Ковалентная полярная химическая связь — что это, определение и ответ
Химическая связь – это взаимодействие атомов, осуществляемое путем обмена электронами.
Различают три случая образования химической связи:
1. Между атомами элементов, электротрицательность которых одинакова.
Таковыми являются молекулы простых веществ-неметаллов, молекулы которых состоят из одинаковых атомов: Cl2, O2 и т.д.)
2. Между атомами элементов, электроотрицательность которых различается незначительно.
3. Между атомами элементов, электроотрицательность которых различается сильно.
Если говорить о ковалентной полярной связи, то нас интересует второй случай. Между атомами, соединенными ковалентной полярной связью, различия в электротрицательности незначительны.
Ковалентная связь – это химическая связь, возникающая в результате образования общих электронных пар.
Если атомы, которые соединены ковалентной связью, незначительно различаются по электроотрицательности, происходит смещение общей электронной пары в сторону более электроотрицательного элемента.
В части молекулы, где находится более электроотрицательный элемент, накапливается избыток отрицательного заряда, а где находится менее электроотрицательный элемент – избыток положительного заряда.
Молекула становится диполем – электрически нейтральной частицей, концы которой противоположно заряжены.
Полярная ковалентная связь – вариант ковалентной связи, при которой общая электронная пара смещена в сторону одного из атомов.
Механизмы образования ковалентной связи:
Обменный.
Заключается в том, что каждый из соединяющихся атомов дает по одному неспаренному электрону на образование общей электронной пары (связи)
Донорно-акцепторный.
Рассмотрим на примере иона NH4+.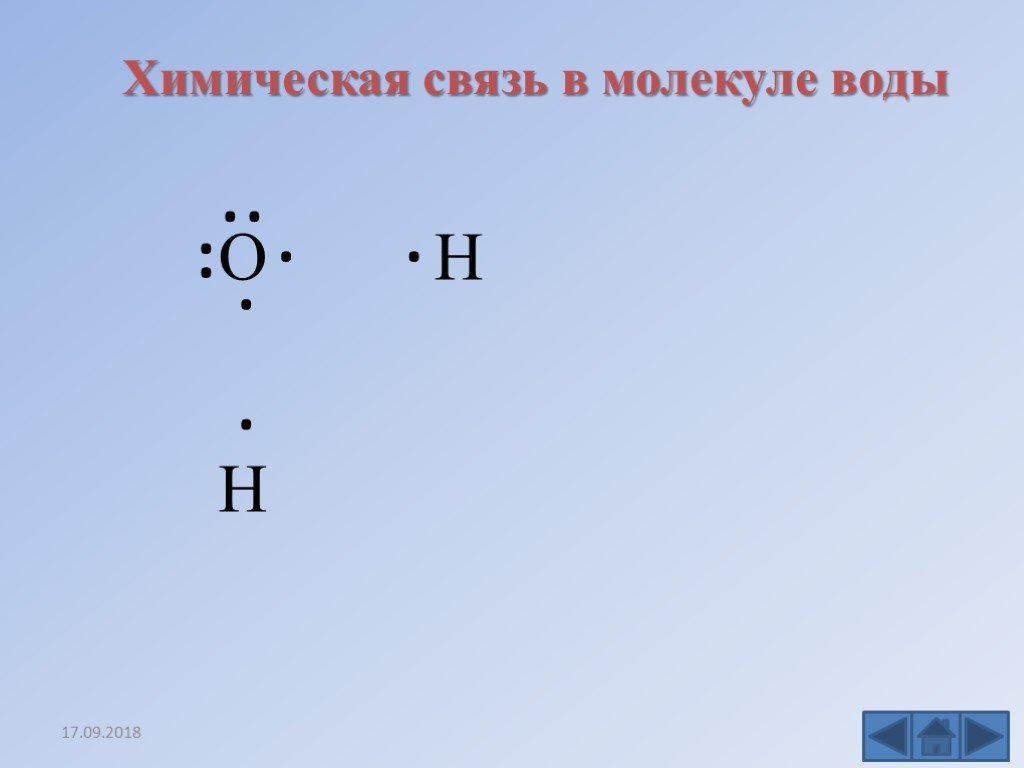 Атом азота содержит на внешнем энергетическом уровне два спаренных и три неспаренных электрона:
Атом азота содержит на внешнем энергетическом уровне два спаренных и три неспаренных электрона:
N 2s22p3
Атом водорода на 1s – подуровне содержит один неспаренный электрон
H 1s1
2р-электроны атома азота образуют три электронные пары с электронами трех атомов водорода по обменному механизму.
На данный момент получилась молекула аммиака – NH3.
У атома азота осталась неподелённая пара электронов на 2s-орбитали.
А ион водорода не содержит электронов на атомной орбитали.
При сближении молекулы аммиака и иона водорода неподеленная пара электронов азота и пустая орбиталь иона водорода взаимодействуют. Они образуют ковалентную полярную связь по донорно-акцепторному механизму. Атом азота является донором электронной пары, а ион водорода – акцептором.
Ковалентная полярная связь по донорно-акцепторному механизму реализуется в таких частицах, как NH4+, BF4—, CO.
Дидактический материал
Тренировочные тесты ЕГЭ по химии
Ковалентная химическая связь, её разновидности и механизмы образования. Характеристика ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь.
1. В аммиаке и хлориде бария химическая связь соответственно 1) ионная и ковалентная полярная 2) ковалентная полярная и ионная 3) ковалентная неполярная и металлическая 4) ковалентная неполярная и ионная 2. Вещества только с ионной связью приведены в ряду: 1) F2, ССl4, КС1 2) NaBr,Na2O,KI 3) SO2.P4.CaF2 4) H2S,Br2,K2S 3. Соединение с ионной связью образуется при взаимодействии 1) СН4 и О2 2) SO3 и Н2О 3) С2Н6 и HNO3 4) NH 4. 1) HCl,NaCl.Cl2 2) O2.H2O.CO2 3) H2O.NH3.CH4 4) NaBr.HBr.CO 5. В каком ряду записаны формулы веществ только с ковалентной полярной 1) С12, NO2, НС1 2) HBr,NO,Br2 3) H2S.H2O.Se 4) HI,H2O,PH3
6. Ковалентная неполярная связь характерна для 1) С12 2) SO3 3) СО 4) SiO2 7. Веществом с ковалентной полярной связью является 1) С12 2) NaBr 3) H2S 4) MgCl2 8. Веществом с ковалентной связью является 1) СаС12 2) MgS 3) H2S 4) NaBr 9. 1) NH3 10. Веществами с неполярной ковалентной связью являются 1) вода и алмаз 2) водород и хлор 3) медь и азот 4) бром и метан 11. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь 1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
12. Ковалентная полярная связь характерна для 1) KC1 2) НВг 3) Р4 4) СаСl2
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь 1)ковалентную полярную 2) ковалентную неполярную 3) ионную 4) металлическую
14. В молекуле какого вещества длина связи между атомами углерода наибольшая? 1} ацетилена 2) этана 3) этена 4) бензола
15. 1) азота 2) сероводорода 3) метана 4) хлора
16. Водородные связи образуются между молекулами 1) диметилового эфира 2) метанола 3) этилена 4) этилацетата
17. Полярность связи наиболее выражена в молекуле 1) HI 2) НС1 3) HF 4) НВг
18. Веществами с неполярной ковалентной связью являются 1) вода и алмаз 2) водород и хлор 3) медь и азот 4) бром и метан
19. Водородная связь не характерна для вещества 1) Н2О 2) СН4 3) NH3 4) СНзОН
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых 1) KI и Н 2) СО2 и К2О 3) H2S и Na2S 4) CS2 и РС15
21. 1) фтора 2) хлора 3} брома 4} иода
22. В молекуле какого вещества длина химической связи наибольшая? 1) фтора 2) хлора 3) брома 4) иода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду: 1) C4H10, NO2, NaCl 2) СО, CuO, CH3Cl 3) BaS,C6H6,H2 4) C6H5NO2, F2, CC14
24. Ковалентную связь имеет каждое из веществ, указанных в ряду: 1) СаО,С3Н6, S8 2) Fe.NaNO3, CO 3) N2, CuCO3, K2S 4) C6H5NO2, SО2, CHC13
25. Ковалентную связь имеет каждое из веществ, указанных в ряду: 1) С3Н4, NO, Na2O 2) СО, СН3С1, PBr3 3) Р2Оз, NaHSO4 4) C6H5NO2, NaF, СС14
26. 1) C3Ha,NO2, NaF 2) КС1, CH3Cl, C6H12О6 3) P2O5, NaHSO4, Ba 4) C2H5NH2, P4, CH3OH
27. Полярность связи наиболее выражена в молекулах
1) сероводорода 3) фосфина 4) хлороводорода
28. В молекуле какого вещества химические связи наиболее прочные?
1)СF4 2)CCl4 3)CBr4 4)CI4
29. Среди веществ NH4Cl, CsCl, NaNO3, PH3, HNO3 — число соединений с ионной связью равно
30.
Ответы: 1-2, 2-2, 3-4, 4-3, 5-4, 6-1, 7-3, 8-3, 9-4, 10-2, 11-3, 12-2, 13-3, 14-2, 15-1, 16-2, 17-3, 18-2, 19-2, 20-4, 21-4, 22-4, 23-4, 24-4, 25-2, 26-4, 27-4, 28-1, 29-3, 30-4
|
вода — ковалентная/водородная связь
спросил
Изменено 4 года, 5 месяцев назад
Просмотрено 111 тысяч раз
При образовании молекулы воды ($\ce{h3O}$) какая связь возникает между элементами? Я сам изучаю эту тему и из одних источников увидел что есть ковалентная связь а другие показали водородную связь, ответственную за неиспарение воды при -9${\circ} \rm{C}$.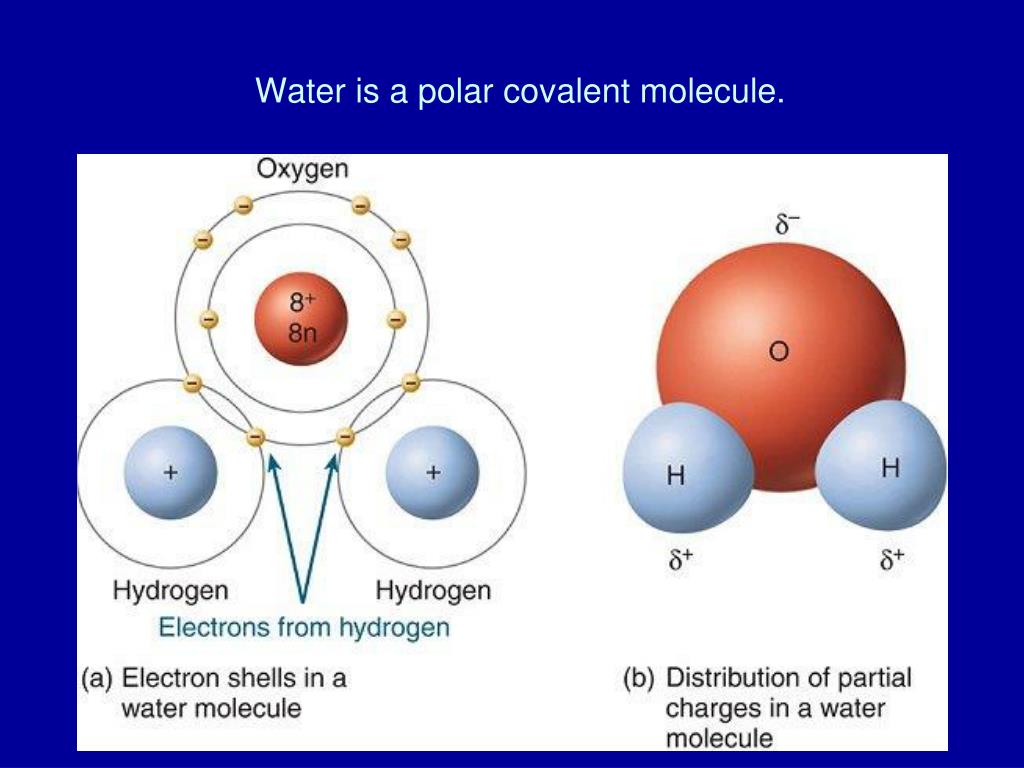 Не могли бы вы, ребята, объяснить мне, как именно ведут себя эти облигации? И то, и другое происходит с молекулами воды?
Не могли бы вы, ребята, объяснить мне, как именно ведут себя эти облигации? И то, и другое происходит с молекулами воды?
- связка
- вода
Ковалентные связи – это связи между атомами одной и той же молекулы воды. Водородные связи — это связи между двумя молекулами воды. Все молекулы имеют ковалентные связи, но только некоторые молекулы имеют водородные связи. Например, в воде есть водородные связи, а в углекислом газе их нет.
Одним из требований к водородной связи является то, что молекула должна быть полярной. Молекулы воды полярны из-за двух эффектов. Во-первых, кислород более электроотрицательный, чем водород, поэтому каждая из связей ОН будет полярной. Электроны, разделяющие каждую из этих связей, будут проводить больше времени рядом с кислородом, чем рядом с водородом. Другой эффект связан с геометрией молекулы: атом кислорода имеет две свободные электронные пары в дополнение к двум связям, поэтому он принимает тетраэдрическое расположение. Связи $\ce{O-H}$ — это два угла этого тетраэдра, а свободные электронные пары — два других угла. Такое расположение означает, что если вы посмотрите только на атомы, молекула имеет изогнутую геометрию. Из-за этого полярность двух связей частично суммируется. Напротив, $\ce{CO2}$ имеет линейную геометрию, и две полярные связи компенсируют друг друга, оставляя молекулу неполярной.
Связи $\ce{O-H}$ — это два угла этого тетраэдра, а свободные электронные пары — два других угла. Такое расположение означает, что если вы посмотрите только на атомы, молекула имеет изогнутую геометрию. Из-за этого полярность двух связей частично суммируется. Напротив, $\ce{CO2}$ имеет линейную геометрию, и две полярные связи компенсируют друг друга, оставляя молекулу неполярной.
Таким образом, молекула воды полярна, с большим количеством избыточного положительного заряда вокруг атомов водорода и большим количеством отрицательного заряда на стороне атома кислорода, удаленной от атомов водорода. Водородная связь — это электростатическое взаимодействие между положительным зарядом атома водорода и отрицательным зарядом атома кислорода соседней молекулы. Ковалентная связь представляет собой электростатическое взаимодействие между двумя атомами одной и той же молекулы. Ковалентные связи намного прочнее водородных: $\ce{O-H}$ имеет прочность 467 кДж/моль, тогда как водородная связь обычно составляет от 4 до 40 кДж/моль.
Просто хочу отметить, что в слове «вода» есть одна тонкость:
Вода может означать молекулу $\ce{h3O}$, и эти связи (между центральными O и H) могут быть ковалентными.
Вода также означает объем воды, много молекул воды. Взаимодействия между двумя или более молекулами определяют объемные свойства жидкости, такие как испарение и замерзание. Здесь мы будем говорить о водородных связях.
Ниже приведено изображение соединения одной конфигурации «воды» в «воде». Это вычислено на основе теории электронной структуры и квантовой теории атомов в молекулах:
$\endgroup$ 1 $\begingroup$В молекуле h3O две молекулы воды связаны водородной связью, но связи между двумя связями H-O внутри молекулы воды ковалентны.
См. эту диаграмму: http://goo.gl/84w9T
Пунктирные линии представляют собой водородную связь, а сплошные линии представляют собой ковалентную связь.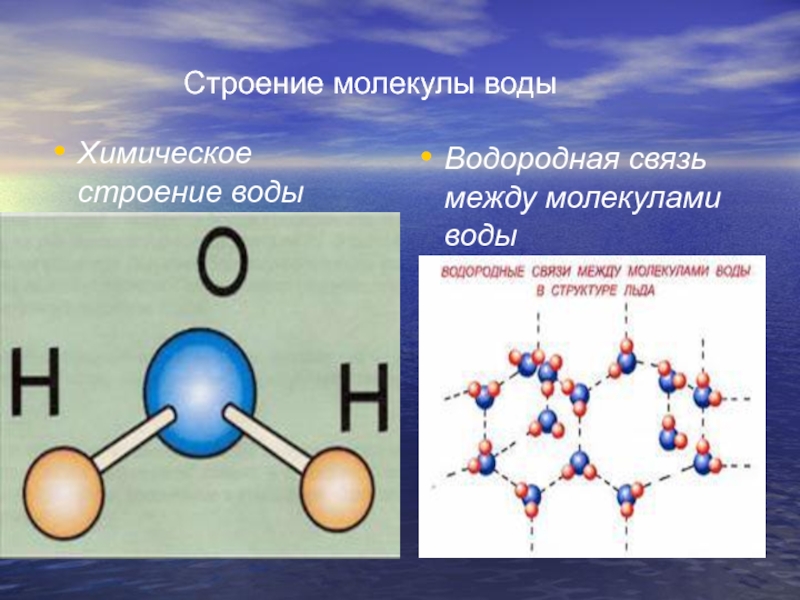
Вода представляет собой полярную ковалентную молекулу. Взгляните на их значения электроотрицательности: водород — 2,20, а кислород — 3,44. Это разница в 1,24 означает, что это полярная ковалентная связь. Ковалентная связь присутствует при разнице 1,7 +/- 0,5. Кроме того, в воде также существует водородная связь, это связано с тем, что водороды будут иметь слегка псотовый заряд, а кислород будет иметь слегка отрицательный заряд, что заставляет водороды в других молекулах воды притягиваться к кислороду. надеюсь это поможет
$\endgroup$Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google Зарегистрироваться через Facebook Зарегистрируйтесь, используя электронную почту и парольОпубликовать как гость
Электронная почтаТребуется, но никогда не отображается
Опубликовать как гость
Электронная почтаТребуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания и подтверждаете, что прочитали и поняли нашу политику конфиденциальности и кодекс поведения.
Химические связи, типы, характеристики, как они возникают…
Химическая связь включает атома, которые объединяются в химические соединения и , придающие устойчивость полученному продукту. В этом процессе атомы могут делиться или отдавать электроны из своих внешних оболочек для связи и создавать новое гомогенное вещество.
При образовании химической связи структура и свойства атомов не изменяются; есть только обмен электронами. Это означает, что когда химическая связь для воды (H 2 О), например, его элементы (кислород и водород) остаются прежними.
Окружающая нас среда является результатом множественных химических связей, которые придают материи свойства, как физические, так и химические. Это продукт силы, создаваемой атомами, когда они объединяются и образуют связи, учитывая, что эти маленькие частицы гораздо более стабильны вместе, чем по отдельности.
Каждый атом состоит из 9Ядро 0093 с положительно заряженными протонами и нейтральными нейтронами , и оно окружено внешним слоем , называемым электронным облаком , которое имеет отрицательный заряд .
Разноименные заряды притягивают как внутри одного атома, так и между атомами. Это притяжение образует химические связи между различными элементами.
Атомы дополняют свои электрические заряды за счет электронных обменов : они могут отдавать, принимать или делиться этими частицами до достичь стабильной электронной конфигурации , что означает более низкое потребление энергии.
Что такое правило октета Льюиса и как оно связано с химическими связями? Американский физик-химик Гилберт Льюис изобрел правило октетов в 1917 году; объясняет, как атомы различных химических элементов объединяются, образуя связи.
Эта теория предполагает, что ионы элементов периодической таблицы заполняют свои последние энергетические уровни 8 электронами . Таким образом, молекулы достигают стабильности на уровне своей электронной структуры .
Таким образом, элемента с высокими электроотрицательными зарядами приобретают электронов до достижения октета, а элементы с низкой электроотрицательностью обычно их теряют для достижения той же цели.
Какие типы химической связи существуют?В зависимости от типа связанных атомов, которые имеют свои особенности и механизмы, химическая связь может быть:
- Ковалентный: возникает, когда неметаллических атома имеют общие электроны . В этом типе связи электрона перемещаются между атомами , образуя полярных ковалентных связей (электроны делятся неравномерно) и неполярных (когда количество электронов распределено равномерно).

Пример: вода (H 2 O) состоит из двух атомов водорода и одного атома кислорода, и в его связи каждый атом водорода имеет общий атом кислорода. - Ионный: это происходит, когда металлических и неметаллических атома связываются и электронный заряд передается от одного к другому. В результате образуются как отрицательно заряженные ионы ( анионы ), так и положительные ( катионы ), и между их противоположными зарядами возникает притяжение.
Пример: в хлориде натрия (NaCl), который объединяет атом хлора и атом натрия, первый имеет семь электронов, а второй — один. При образовании ионной связи натрий отдает свой электрон хлору, выполняя закон октета. - Металлические: эти образуются между атомами металлов, атомные ядра которых собираются и окружены их электронами, как облако. Это сильная связь, которую раскинул как сеть.

Все чистые металлические элементы состоят из металлических связей, например, золота (Au), железа (Fe), алюминия (Al) и т. д.
- Они удерживают вместе атома внутри химических молекул.
- Прочность химической связи определяется разницей электроотрицательностей (чем она выше, тем больше сила притяжения электронов между атомами.)
- Обычно число электронов четно.
- Ковалентные связи могут существовать в виде газа , твердого тела или жидкости .
- Некоторые ковалентные связи растворимы в воде , а другие в органических растворителях .
- Кислотные ковалентные связи проводят электричество в присутствии водного раствора (другие ковалентные связи не являются хорошими проводниками), а ионные связи делают это при растворении в воде или расплавлении.



 В каком ряду все вещества имеют ковалентную полярную связь?
В каком ряду все вещества имеют ковалентную полярную связь? Вещество с ковалентной неполярной связью имеет формулу
Вещество с ковалентной неполярной связью имеет формулу Тремя общими электронными парами образована ковалентная связь в молекуле
Тремя общими электронными парами образована ковалентная связь в молекуле Наименее прочная химическая связь в молекуле
Наименее прочная химическая связь в молекуле Ковалентные связи имеет каждое из веществ, указанных в ряду:
Ковалентные связи имеет каждое из веществ, указанных в ряду: Среди веществ (NH4)2SO4, Na2SO4, CaI2, I2, CO2 — число соединений с ковалентной связью равно
Среди веществ (NH4)2SO4, Na2SO4, CaI2, I2, CO2 — число соединений с ковалентной связью равно

