Строение молекулы воды (h3O), схема и примеры
Общие сведения о строении молекулы воды
Вода – термодинамически устойчивое соединение. Стандартная энергия Гиббса образования жидкой воды при температуре 298 Л рана – 237, 57кДж/моль, водяного пара – 228,94 кДж/моль. В этой связи константа диссоциации водяного пара на водород и кислород очень мала (8,88×10-41).
Агрегатное состояние воды определяется температурой и давлением (рис. 1). Кривая АО соответствует равновесию в системе лед-пар, DO – равновесию в системе переохлажденная вода-пар, кривая OC – равновесию в системе вода-пар, а кривая OB – равновесию в системе лед-вода. В точке О все кривые пересекаются. Эта точка называется тройной точкой и отвечает равновесию в системе лед-вода-пар.
Рис. 1. Диаграмма состояния воды.
Электронное строение молекулы воды
Структурная молекула воды имеет вид H2O. Запишем электронные конфигурации атомов кислорода и водорода в основном состоянии, а затем зарисуем их электронно-графические формулы:
1H 1s1
При образовании молекулы воды электронные облака двух неспаренных 2p-электронов атома кислорода перекрываются с 1s-электронными облаками двух атомов водорода; схема этого перекрывания изображена на рис. 2. Поскольку p-электронные облака атома кислорода ориентированы во взаимно перпендикулярных направлениях, то молекула воды имеет угловое строение, причем можно ожидать, что угол между связями О-Н будет составлять 90o.
Рис. 2. Схема строения молекулы воды.
Однако, на деле валентный угол между атомами кислорода и водорода отличается от 90o, он составляет 104,5o.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Пероксид водорода — Википедия
Перокси́д водоро́да (пе́рекись водорода), H2O2 — простейший представитель пероксидов. Бесцветная жидкость с «металлическим» вкусом, неограниченно растворимая в воде, спирте и эфире. Концентрированные водные растворы взрывоопасны. Пероксид водорода является хорошим растворителем. Из воды выделяется в виде неустойчивого кристаллогидрата H
Молекула пероксида водорода имеет следующее строение:
Структура молекулы пероксида водородаВследствие несимметричности молекула H2O2 сильно полярна (μ = 0,7⋅10−29 Кл·м). Относительно высокая вязкость жидкого пероксида водорода обусловлена развитой системой водородных связей. Поскольку атомы кислорода имеют неподелённые электронные пары, молекула H2O2 также способна образовывать донорно-акцепторные связи.
Оба атома кислорода находятся в промежуточной степени окисления −1, что и обусловливает способность пероксидов выступать в роли как окислителей, так и восстановителей. Наиболее характерны для них окислительные свойства:
- Na2SO3+h3O2→Na2SO4+h3O;{\displaystyle {\mathsf {Na_{2}SO_{3}+H_{2}O_{2}\rightarrow Na_{2}SO_{4}+H_{2}O}};}
- Mn(OH)2+h3O2→MnO(OH)2+h3O.{\displaystyle {\mathsf {Mn(OH)_{2}+H_{2}O_{2}\rightarrow MnO(OH)_{2}+H_{2}O}}.}
При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до атомарного кислорода:
- 2AgNO3+h3O2→2Ag+2O+2HNO3.{\displaystyle {\mathsf {2AgNO_{3}+H_{2}O_{2}\rightarrow 2Ag+2O+2HNO_{3}}}.}
Молекула пероксида водорода сильно полярна, что приводит к возникновению водородных связей между молекулами. Связь O—O непрочна, поэтому H
- 2h3O2→2h3O+O2.{\displaystyle {\mathsf {2H_{2}O_{2}\rightarrow 2H_{2}O+O_{2}}}.}
В присутствии катализаторов разложения в среде кислорода может появляться озон:
- h3O2+O2→h3O+O3↑.{\displaystyle {\mathsf {H_{2}O_{2}+O_{2}\rightarrow H_{2}O+O_{3}\uparrow }}.}
Однако очень чистый пероксид водорода вполне устойчив.
Пероксид водорода проявляет слабые кислотные свойства (К = 1,4⋅10−12), и поэтому диссоциирует по двум ступеням:
- h3O2⇄H++HO2−; HO2−⇄H++O22−.{\displaystyle {\mathsf {H_{2}O_{2}\rightleftarrows H^{+}+HO_{2}^{-};~~~~~~HO_{2}^{-}\rightleftarrows H^{+}+O_{2}^{2-}}}.}
При действии концентрированного раствора Н2O2 на некоторые гидроксиды в ряде случаев можно выделить пероксиды металлов, которые можно рассматривать как соли пероксида водорода (Li2O2, MgO2 и др.):
- h3O2+2NaOH→Na2O2+2h3O;{\displaystyle {\mathsf {H_{2}O_{2}+2NaOH\rightarrow Na_{2}O_{2}+2H_{2}O}};}
- h3O2+Ba(OH)2→BaO2↓+2h3O.{\displaystyle {\mathsf {H_{2}O_{2}+Ba(OH)_{2}\rightarrow BaO_{2}\downarrow +2H_{2}O}}.}
Пероксид водорода может проявлять как окислительные, так и восстановительные свойства. Например, при взаимодействии с оксидом серебра он является восстановителем:
- h3O−12+Ag2O⟶2Ag+O02+h3O.{\displaystyle {\mathsf {H_{2}{\stackrel {-1}{O}}_{2}+Ag_{2}O\longrightarrow 2Ag+{\stackrel {0}{O}}_{2}+H_{2}O}}.}
В реакции с нитритом калия соединение служит окислителем:
- KNO2+h3O−12⟶KNO−23+h3O.{\displaystyle {\mathsf {KNO_{2}+H_{2}{\stackrel {-1}{O}}_{2}\longrightarrow KN{\stackrel {-2}{O}}_{3}+H_{2}O}}.}
Пероксидная группа [—O—O—] входит в состав многих веществ. Такие вещества называют пероксидами, или пероксидными соединениями. К ним относятся пероксиды металлов (Na2O2, BaO2 и др.). Кислоты, содержащие пероксидную группу, называют пероксокислотами, например, пероксомонофосфорная H3PO5, пероксодисерная H2S2O8 и пероксоазотная HNO4 кислоты.
Окислительно-восстановительные свойства[править | править код]
Пероксид водорода обладает окислительными, а также восстановительными свойствами. Он окисляет нитриты в нитраты, выделяет иод из иодидов металлов, расщепляет ненасыщенные соединения по месту двойных связей. Пероксид водорода восстанавливает соли золота и серебра, а также марганец при реакции с водным раствором перманганата калия в кислой среде.
При восстановлении Н2O2 образуется Н2O или ОН-, например:
- h3O2+2KI+h3SO4→I2+K2SO4+2h3O.{\displaystyle {\mathsf {H_{2}O_{2}+2KI+H_{2}SO_{4}\rightarrow I_{2}+K_{2}SO_{4}+2H_{2}O}}.}
При действии сильных окислителей H2O2 проявляет восстановительные свойства, выделяя свободный кислород:
- O22−→O2+2e−,{\displaystyle {\mathsf {O_{2}^{2-}\rightarrow O_{2}+2e^{-}}},}
например:
- 3h3O2+2KMnO4→2MnO2+2KOH+3O2↑+2h3O.{\displaystyle {\mathsf {3H_{2}O_{2}+2KMnO_{4}\rightarrow 2MnO_{2}+2KOH+3O_{2}\uparrow +2H_{2}O}}.}
Реакцию KMnO4 с Н2O2 используют в химическом анализе для определения содержания Н2O2:
- 5h3O2+2KMnO4+3h3SO4→5O2+2MnSO4+K2SO4+8h3O.{\displaystyle {\mathsf {5H_{2}O_{2}+2KMnO_{4}+3H_{2}SO_{4}\rightarrow 5O_{2}+2MnSO_{4}+K_{2}SO_{4}+8H_{2}O}}.}
Окисление органических соединений пероксидом водорода (например, сульфидов и тиолов) целесообразно проводить в среде уксусной кислоты.
Пероксид водорода относится к реактивным формам кислорода и при повышенном образовании в клетке вызывает оксидативный стресс. Некоторые ферменты, например глюкозоксидаза, образуют в ходе окислительно-восстановительной реакции пероксид водорода, который может играть защитную роль в качестве бактерицидного агента. В клетках млекопитающих нет ферментов, которые бы восстанавливали кислород до перекиси водорода. Однако несколько ферментных систем (ксантиноксидаза, НАДФ•H-оксидаза, циклооксигеназа и др.) продуцируют супероксид, который спонтанно или под действием супероксиддисмутазы превращается в пероксид водорода.
Исторически первым промышленным методом синтеза пероксида водорода был электролиз серной кислоты или раствора сульфата аммония в серной кислоте, в ходе которого образуется пероксодисерная кислота, с последующим гидролизом последней до пероксида и серной кислоты:
- h3S2O8+2h3O→h3O2+2h3SO4.{\displaystyle {\mathsf {H_{2}S_{2}O_{8}+2H_{2}O\rightarrow H_{2}O_{2}+2H_{2}SO_{4}}}.}
С середины XX века персульфатный процесс синтеза пероксида водорода был вытеснен антрахиноновым процессом, разработанным компанией BASF в 1930-х[2]. В этом процессе формально идет окисление водорода кислородом воздуха с катализом алкилпроизводными антрахинона:
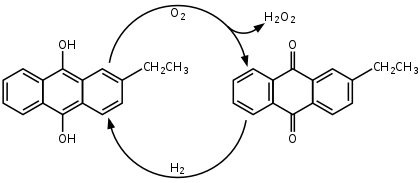
Процесс основан на автоокислении алкилантрагидрохинонов (обычно 2-этил-, 2-трет-бутил- и 2-пентилантрагидрохинонов) кислородом воздуха с образованием антрахинонов и пероксида водорода. Реакция проводится в растворе алкилантрагидрохинонов в бензоле с добавлением вторичных спиртов, по завершении процесса пероксид водорода экстрагируют из органической фазы водой. Для регенерации исходных антрагидрохинонов бензольный раствор антрахинонов восстанавливают водородом в присутствии каталитических количеств палладия[3].
Пероксид водорода также может быть получен каталитическим окислением изопропилового спирта [4]:
- (Ch4)2CHOH+O2→(Ch4)2CO+h3O2,{\displaystyle {\mathsf {(CH_{3})_{2}CHOH+O_{2}\rightarrow (CH_{3})_{2}CO+H_{2}O_{2}}},}
при этом ценным побочным продуктом этой реакции является ацетон, однако в широких масштабах в промышленности этот метод в настоящее время не используется.
В лабораторных условиях для получения пероксида водорода используют реакцию:
- BaO2+h3SO4→BaSO4↓+h3O2.{\displaystyle {\mathsf {BaO_{2}+H_{2}SO_{4}\rightarrow BaSO_{4}\downarrow +H_{2}O_{2}}}.}
Концентрирование и очистку пероксида водорода проводят осторожной перегонкой.
В последнее время (кон. XX в.) удалось синтезировать H2O3 и H2O4. Эти соединения весьма неустойчивы. При обычных температурах (н.у.) они разлагаются за доли секунды, однако при низких температурах порядка −70 °C существуют часами. Спектро-химическое исследование показывает, что их молекулы имеют зигзагообразную цепную структуру (подобную сульфанам): H—O—O—O—H, H—O—O—O—O—H[5].
 3 % раствор перекиси водорода
3 % раствор перекиси водородаБлагодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо, в качестве окислителя или как однокомпонентное (с разложением на катализаторе), в том числе для привода турбонасосных агрегатов.[6] Используется в аналитической химии, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит своё применение в качестве катализатора, гидрирующего агента, как эпоксидирующий агент при эпоксидировании олефинов.
Хотя разбавленные растворы перекиси водорода применяются для небольших поверхностных ран, исследования показали, что этот метод, обеспечивая антисептический эффект и очищение, также продлевает время заживления[7][8]. Обладая хорошими очищающими свойствами, пероксид водорода на самом деле не ускоряет заживление ран. Достаточно высокие концентрации, обеспечивающие антисептический эффект, могут также продлевать время заживления из-за повреждения прилегающих к ране клеток[9]. Более того, пероксид водорода может мешать заживлению и способствовать образованию рубцов из-за разрушения новообразующихся клеток кожи[10].
Однако в качестве средства для очистки глубоких ран сложного профиля, гнойных затёков, флегмон и других гнойных ран, санация которых затруднена, пероксид водорода остаётся предпочтительным препаратом, так как он обладает не только антисептическим эффектом, но и создаёт большое количество пены при взаимодействии с ферментом каталазой. Это в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые будут легко смыты последующим введением в полость раны антисептического раствора. Без предварительной обработки пероксидом водорода антисептический раствор не сможет удалить эти патологические образования, что приведет к значительному увеличению времени заживления раны и ухудшит состояние больного.
Перекись водорода применяют для растворения пробок в слуховых каналах. Раствор вступает в реакцию с ушной серой и растворяет пробку.
Пероксид водорода применяется также для обесцвечивания волос[11] и отбеливания зубов[12], однако эффект в обоих случаях основан на окислении, а следовательно — разрушении тканей. Во время отбеливания зубов, однако, не происходит разрушения тканей. Пигментированные белки дентина начинают раскручиваться до первичной структуры (как если бы белок яйца из варёного стал более сырым), при этом связи не разрушаются, то есть этот процесс обратим. Эмаль сама по себе прозрачна, и эффект отбеливания достигается за счет разницы в отражении света дентином.
В пищевой промышленности растворы пероксида водорода применяются для дезинфекции технологических поверхностей оборудования, непосредственно соприкасающихся с продукцией. Кроме того, на предприятиях по производству молочной продукции и соков, растворы перекиси водорода используются для дезинфекции упаковки (технология «Тетра Пак»). Для технических целей пероксид водорода применяют в производстве электронной техники.
В быту применяется также для выведения пятен MnO2, образовавшихся при взаимодействии перманганата калия («марганцовки») с предметами (ввиду его восстановительных свойств).
3%-ный раствор пероксида водорода используется в аквариумистике для оживления задохнувшейся рыбы, а также для очистки аквариумов и борьбы с нежелательной флорой и фауной в аквариуме
С 90-х годов ХХ века 3%-ный раствор пероксида водорода продвигался целителем И. П. Неумывакиным для приёма внутрь как универсальное средство лечения и оздоровления человека. Научного подтверждения допустимости и эффективности данный метод не имеет.
Перекись водорода используется в известном опыте, демонстрирующем многократное увеличение объёма вещества в результате химической реакции[14].
Выпускается в виде водных растворов, стандартная концентрация 1—6 %, 30, 38, 50, 60, 85, 90 и 98 %[источник не указан 176 дней]. 30 % водный раствор пероксида водорода, стабилизированный добавлением фосфатов натрия, называется пергидролем. Выпускаемый в виде таблеток твёрдого клатрата с мочевиной пероксид водорода называется гидроперитом.
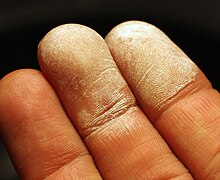 Кожа после попадания на неё концентрированного раствора перекиси водорода.
Кожа после попадания на неё концентрированного раствора перекиси водорода.Несмотря на то, что пероксид водорода нетоксичен, его концентрированные растворы при попадании на кожу, слизистые оболочки и в дыхательные пути вызывают ожоги. В больших концентрациях недостаточно чистый пероксид водорода может быть взрывоопасен.
Опасен при приёме внутрь концентрированных растворов. Вызывает выраженные деструктивные изменения, сходные с действиями щелочей. Летальная доза 30%-го раствора пероксида водорода (пергидроля) — 50—100 мл
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0335.html
- ↑ H. Riedl and G. Pfleiderer, U.S. Patent 2,158,525 (2 October 1936 in USA, and 10 October 1935 in Germany) to I. G. Farbenindustrie, Germany
- ↑ Jose M. Campos-Martin, Gema Blanco-Brieva, Jose L. G. Fierro; Blanco-Brieva; Fierro. Hydrogen Peroxide Synthesis: An Outlook beyond the Anthraquinone Process (англ.) // Angewandte Chemie International Edition : journal. — 2006. — Vol. 45, no. 42. — P. 6962—6984. — DOI:10.1002/anie.200503779. — PMID 17039551.
- ↑ Burgess, A. R.; Cullis, C. F.; Newitt, E. J. 365. The gaseous oxidation of isopropyl alcohol. Part 1. The influence of temperature, pressure, and mixture composition on the formation of hydrogen peroxide and other products (англ.) // Journal of the Chemical Society (англ.)русск. : journal. — Chemical Society, 1961. — 1 January (no. 0). — P. 1884—1893. — ISSN 0368-1769. — DOI:10.1039/JR9610001884.
- ↑ Ахметов Н. С. Общая и неорганическая химия. — 2-е изд. — М.:Высшая школа, 1988. — с. 304.
- ↑ Космонавтика, энциклопедия. М., 1985.
- ↑ O’Connor, Anahd
- ↑ Carroll, Aaron E., Rachel C. Vreeman. Medical myths don’t die easily, CNN (12 июля 2011). Дата обращения 13 июля 2011.
- ↑ Joseph M. Ascenzi, Handbook of Disinfectant and Antiseptics, CRC Press, 1996, ISBN 0824795245, page 161.
- ↑ Wilgus T. A., Bergdall V. K., Dipietro L. A., Oberyszyn T. M. Hydrogen peroxide disrupts scarless fetal wound repair (неопр.) // Wound Repair Regen. — 2005. — Т. 13, № 5. — С. 513—519. — DOI:10.1111/j.1067-1927.2005.00072.x. — PMID 16176460.
- ↑ Средства для осветления волос
- ↑ Способы отбеливания зубов
- ↑ М. Бейли, П. Бергресс. Золотая книга аквариумиста. Полный справочник по уходу за пресноводными тропическими рыбами. — М.: Аквариум ЛТД, 2004.
- ↑ Elephant’s Toothpaste (неопр.). University of Utah Chemistry Demonstrations. University of Utah. Дата обращения 21 марта 2014.
- ↑ Противопоказания к применению перекиси водорода в лечебных целях Архивная копия от 25 августа 2011 на Wayback Machine[неавторитетный источник?]
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994.
Перекись водорода — химическая формула
Автор Антонина На чтение 5 мин. Опубликовано
Перекись водорода (Н2О2) — химическое соединение из группы, включающей пероксиды. Впервые вещество было получено Луи Тенаром в 1818 году путем подкисления раствора перекиси бария азотной кислотой. Это сильный окислитель во многих химических реакциях, таких как окисление ракетного топлива (80%), мощное дезинфицирующее и отбеливающее средство.

Перекись водорода классифицируется как одна из активных форм кислорода. Химическая формула агента состоит из двух атомов водорода и двух атомов кислорода. Благодаря этой структуре молекула под действием органических и неорганических веществ, тепла, света быстро разлагается с выделением атомарного кислорода. Дезинфицирующее действие самой перекиси водорода довольно слабое, но при распаде, оно проявляется быстро и эффективно благодаря свободным атомам кислорода.

Химическая формула перекиси водорода, строение молекулы
Н-О-O-H-связи вокруг атомов кислорода в молекуле h3O2 расположены под углом (аналогично H-O-H-связям в воде), причем атомы H-O-O-H образуют двугранный угол (в твердой фазе около 90°).

Физические свойства пероксида
Чистый пероксид водорода сильно отличается от знакомого всем 3%раствора, который присутствует в каждой в домашней аптечке.
При комнатной температуре он является сиропообразной, бесцветной (концентрированная принимает бледно-голубой цвет), жидкостью с температурой замерзания -0,41 ° С и температурой кипения около 150 ° С. Вязкость у Н2О2 такая же, как и у чуть охлажденной (примерно до 13° С) воды.
Хорошо растворяется в полярных (органических) растворителях и до любой концентрации — в воде. Имеет металлический привкус. Молярная масса 34,01 г/моль.
Химические свойства
Пероксид обладает сильными окислительными свойствами, возникающими в результате образования атомарного кислорода:
h3O2 → h3O + O
Чистая перекись водорода без стабилизаторов — очень нестабильна и подвергается экзотермическому разложению, часто взрывчатому. Это происходит под воздействием воды, кислорода, под воздействием тепла, при контакте с некоторыми металлами (например, марганцем), оксидами металлов и ультрафиолетом.
2h3O2 → 2h3O + O2
Подобное разложение катализируется многими веществами, например, серебром и платиной, оксидом марганца, соединениями йода:
h3O2 + I → h3O + IO
h3O2 + IO → h3O + I+ O2
Эффективным ферментом, который расщепляет перекись водорода, является каталаза.
Благодаря тому, что пергидроль легко реагирует со многими металлами и разлагается при контакте со светом, его следует хранить в герметично закрытой таре, изготовленной из толстостенного полиэтилена или алюминия, не подвергаться воздействию дневного света и источников тепла. Его смесь с карбонатом гидрата натрия (Na2CO3 · 1,5h3O2) является относительно стабильной и безопасной в использовании.

Перекись водорода имеет слабые кислотные свойства. Слабее угольной кислоты. В водных растворах диссоциирует в соответствии с уравнением:
Н2О2 = Н+ +ООН-
В присутствии восстановителей пероксид водорода ведет себя как окислитель (O-I → O-II), например :
2 Nh3OH + 6h3O2 → 2 HNO3 + 8h3O
В присутствии окислителей пероксид показывает восстановительные свойства (O-I → O0), например, в реакции с перманганатом калия в кислых условиях :
2KMnO4 + 5h3O2 + 3h3SO4 → 2MnSO4 + 5O2 + K2SO4 + 8h3O
или с солями серебра (I) в щелочной среде:
2AgNO3 + h3O2 + 2KOH → 2Ag + O2 + 2h3O + 2KNO3
Это агрессивное вещество для живых тканей. При контакте с кожей появляется белый цвет.
Получение — синтез пероксида водорода с использованием метода антрахинона.
В настоящее время hydrogen получают в промышленности методом антрахинона. путем окисления 2-этил-9,10-антрацендиола кислородным газом, прошедшим через раствор этого соединения в смеси подходящих растворителей. Перекись отделяют экстракцией воды и оставляют в растворе.
Этиллантрахинон регенерируют восстановлением газообразным водородом до 2-этил-9,10-антрацендиола, катализируемого палладием на подходящем носителе или соединениях никеля. В методах промышленного производства цикл обеих реакций (окисление и восстановление) осуществляется поочередно.
Разведенный водный раствор перекиси, полученный в этом процессе, концентрируют осторожным выпариванием воды при пониженном давлении, получая таким образом раствор с максимальной концентрацией 70%. Большая концентрация приводит к взрыву. Более концентрированные растворы и полностью чистый пероксид, может быть получен путем быстрого замораживания его из водного концентрированного раствора.
Интересные химические опыты с перекисью водорода — видео:
Водные растворы перекиси водорода и их применение
Перекись водорода в чистом виде не является коммерчески доступным веществом, поскольку законы большинства европейских стран и США запрещают его продажу по соображениям безопасности. В торговле (максимум 70% растворов) это соединение доступно после соблюдения особых условий (правила RID и ADR), а наиболее распространенной коммерческой формой является пергидроль 30% водный раствор и 3-5% растворы для домашнего использования, называемые перекисью водорода.

Перекись в растворе 3-3,5% используется для дезинфекции ран, и такие растворы для непосредственного использования доступны в аптеках. h3O2 оказывает особенно сильное разрушающее действие на анаэробные бактерии (анаэробы).
Дезинфекция раны с использованием перекиси водорода значительно снижает риск попадания бактерий в организм через поврежденный эпидермис. Быстрое уничтожение бактерий во время дезактивации также разрушает клетки крови, вытекающие из раны, а также часть клеток кожи, подвергнутых повреждению.
7-15% растворы обычно используются в качестве так называемых «Активных кислородных отбеливателей» в бытовой химии, 5% водный раствор используется для обесцвечивания волос. Очень разбавленные растворы (прибл. 1%) применяются в народной медицине для перорального применения. До сих пор считаются спорным способом лечения некоторых видов рака.
Свойства молекулы воды | Дистанционные уроки
12-Янв-2014 | Нет комментариев | Лолита Окольнова
Размышления ( не учебный материал !!!) на тему
свойств молекулы воды
Автор статьи — Саид Лутфуллин
Самое распространенное вещество на нашей планете. Без нее не было бы жизни. Все живые структуры, за исключением вирусов, по большей части состоят из воды. На ее примере детям в школе объясняют строение молекул, химические формулы. Свойства, характерные только для воды, используются в живой природе, а так же в хозяйственной жизни человека.
С детства нам знакомое вещество, никогда не вызывавшее каких-то вопросов. Ну вода, и что? А в таком простом, казалось бы, веществе скрыто много загадок.
Общие
Вода — основной природный растворитель. Все реакции в живых организмах так или иначе протекают в водной среде, вещества реагируют в растворенном состоянии.
У воды отличная теплоемкость, но довольно малая теплопроводность. Это позволяет использовать воду как транспорт тепла. На этом принципе основан механизм охлаждения многих организмов. А в атомной энергетике и воду, благодаря этому свойству, используют в качестве теплоносителя.
В воде не только протекают реакции, она сама вступает в реакции. Гидратация, фотолиз и т. д.
Это только некоторые свойства, ни одно вещество не может похвастаться таким наборов свойств. Поистине это вещество уникально.
Ну а теперь ближе к теме.
Всегда, везде, даже в школе на уроках химии ее называют просто «вода».
А вот какое химическое называние и свойства молекулы воды?
На просторах интернета и учебной литературы можно встретить такие называния: оксид водорода, гидроксид водорода, гидроксильная кислота. Это самые наиболее часто встречающиеся.
Так к какому все таки классу неорганических веществ относится вода?
Давайте разберемся в этом вопросе.
Ниже приведена схема:
вода — точно не простое вещество, так как образована атомами разных элементов;
и не соль, так как связь в солях между катионом и анионом должна быть ионной, катионом должен быть металл, а в молекуле воды связи только ковалентные и катион — водород (неметалл).
Для начала разберемся — оксид это или гидроксид. Что с уверенностью можно сказать, так это то, что вода — это точно не оксид.
Хотя, если поверхностно посмотреть, то вода, в принципе, попадает под определение оксида водорода. Образуется в результате реакции полного окисления водорода: 2H2 + O2 → 2H2O, кислород в низшей степени окисления.
Рассмотрим по свойствам :
Свойства основных оксидов:
Взаимодействие с кислотами.
Взаимодействие с кислотными оксидами.
Взаимодействие с амфотерными оксидами.
Молекула воды обладает только одним свойством основного оксида — это взаимодействие с кислотными оксидами.
Свойства кислотных оксидов:
Взаимодействие со щелочами.
Взаимодействие основными оксидами.
Взаимодействие амфотерными оксидами.
Молекула воды так же проявляет только одно свойство: взаимодействие основными оксидами.
По свойствам молекула воды проявляет двойственную природу: реагирует с кислотными и основными оксидами.
Но воду нельзя отнести к амфотерным оксидам, так как амфотерные оксиды образуют металлы, а водород — неметалл.
Выходит, если вода — все таки оксид, значит несолеобразующий.
Но, может это будет сенсацией, ВОДА ОБРАЗУЕТ СОЛИ!
Но об этом немного позже.
Из приведенных выше доказательств следует, что вода — не оксид. Еще один аргумент «против оксида»: ни один оксид не диссоциирует на ионы, а одно из свойств молекулы воды — частичная диссоциация на катион H+ и анион OH—.
Исходя из предыдущего: в воде два «разных» водорода. Один в катионе, другой — в анионе.
И формулу воды следует писать не так как мы привыкли: H2O, а
HOH
Следовательно, вода — это гидроксид.
Эта версия более правдоподобна: гидроксильная группа явно намекает на что-то подобное. Но какой гидроксид? Давайте опять разберем по свойствам гидроксиды:
Свойства основных гидроксидов (оснований):
Для растворимых оснований (щелочей):
Для растворимых оснований (щелочей) характерны реакции ионного обмена.
Взаимодействие растворимых оснований (щелочей) с кислотными основаниями.
Взаимодействие с амфотерными гидроксидами.
Нерастворимые основания разлагаются при нагревании.
Молекула воды не проявляет ни одного свойства, только разве что, при сильном нагревании, она подвергнется разложению, ну а это со всеми веществами так — есть определенный порог температуры, выше которого связи не могут больше существовать и разрушаются.
Так же аргумент, «против» амфотерного и основного гидроксида — основные и амфотерные гидроксиды образуют только металлы.
Теперь подходим к самой интересной части. Выходит, что вода — это
кислотный гидроксид, то есть кислородосодержащая кислота.
Рассмотрим по свойствам.
Для кислотных гидроксидов характерны:
Реакции с металлами.
Реакции с основными и амфотерными оксидами.
Реакции с основаниями и амфотерными гидроксидам.
Реакции с солями.
Для сильных кислот так же реакции ионного обмена.
Вытеснение более слабых, а так же летучих кислот из солей.
Для молекулы воды характерны почти все эти свойства.
Разберем подробно.
- Реакции с металлами. Не все металлы способны реагировать с водой. Вода как кислота — очень слабая, но, тем не менее, это свойство она проявляет:
HOH + Na → NaOH + H2↑ — из воды вытесняется водород — вода ведет себя, как большинство кислот.
- Реакции с основными и амфотерными оксидами. С амфотерными оксидами не реагирует, так как кислотные свойства слабые, но реагирует с основными оксидами (не со всеми правда, это объясняется слабыми кислотными свойствами):
HOH + Na2O → 2NaOH
- Реакции с основаниями и амфотерными гидроксидам. Тут вода не может похвастаться такими реакциями — из-за своей слабости как кислоты.
- Реакции с солями. Некоторые соли подвергаются гидролизу — как раз таки реакции с водой.
Al2S3 + HOH → Al(OH)3↓ + H2S↑
Эта реакция так же иллюстрирует последнее свойство — вытеснение кислоты, у воды получается вытеснить сероводород.
Из определения: «кислота — это сложное вещество, состоящее из водорода и кислотного остатка, при диссоциирующее на катион H+ и катион кислотного остатка«.
Все подходит. И получается, что кислотный остаток — это гидроксильная группа OH.
И, как я и говорил раньше, вода образует соли, выходит, что соли воды-кислоты — это основные и амфотерные гидроксиды: металл, соединенный с кислотным остатком (OH).
И схемы реакций:
кислота + металл → соль + водород (в общем случае)
HOH + Na → NaOH + H2↑
кислота + основный оксид → соль вода
HOH + Na2O → 2NaOH (соль образуется, только воды не образуется, да и с чего бы это вдруг в результате реакции с водой, должна образовываться вода)
соль + кислота → другая кислота + другая соль
Al2S3 + HOH → Al(OH)3↓ + H2S↑
Итак, мы пришли к выводу, что амфотерные и основные гидроксиды — это соли воды — кислоты.
Тогда как их называть?
Весть термин «гидроксид» также применим к кислородосодержащим кислотам. По правилам получается:
название иона + ат = Гидрокс + ат.
Соли воды — гидроксаты.
Вода настолько слабая кислота, что проявляет некоторые амфотерные свойства, например реакции с кислотными оксидами.
И в воде нейтральная среда, а не кислая, как во всех кислотах — это исключение из правила.
Но в конце концов, как говорил замечательный русский химик-органик «Неосуществимых реакций нет, а если реакция не идет, то еще не найден катализатор».
Подведем итог.
Сформулируем основные положения теории «Вода — кислота»:
Молекула воды по свойствам — слабая (очень слабая) кислота.
Вода настолько слабая, что проявляет амфотерные свойства и у нее нейтральная реакция среды.
Вода как кислота образует соли — гидроксаты.
К гидроксатам относятся амфотерные и основные гидроксиды.
Формула воды: HOH.
Правильные названия воды: гидроксид водорода, гидроксильная кислота.
Еще на эту тему:
Обсуждение: «Свойства молекулы воды»
(Правила комментирования)ее состав, строение молекулы, физические свойства. Химические свойства воды
Билет № 15
1. Вода: ее состав, строение молекулы, физические свойства. Химические свойства воды: разложение, отношение к натрию, оксиду кальция, оксиду серы (IV). Основные загрязнители природной воды
Состав воды можно выяснить с помощью реакции разложения электрическим током. Образуется два объема водорода на один объем кислорода (объем газа пропорционален количеству вещества):
2H2O = 2H2↑ + O2↑
Вода состоит из молекул. Каждая молекула содержит два атома водорода, соединенные ковалентными связями с одним атомом кислорода. Угол между связями около 105°:
O — H
|
H
Поскольку кислород является более электроотрицательным элементом (сильным окислителем), общая электронная пара ковалентной связи смещается к атому кислорода, на нем образуется частичный отрицательный заряд δ−, на атомах водорода — частичный положительный δ+. Соседние молекулы притягиваются друг к другу противоположными зарядами — это обуславливает сравнительно высокую температуру кипения воды.
Вода при комнатной температуре — бесцветная прозрачная жидкость. Температура плавления 0º C, температура кипения при атмосферном давлении — 100° С. Чистая вода не проводит электрический ток.
Интересной особенностью воды является то, что она имеет наибольшую плотность 1 г/см3 при температуре около 4° С. При дальнейшем понижении температуры плотность воды снижается. Поэтому с наступлением зимы верхние замерзающие слои воды становятся легче и не погружаются вниз. Лед образуется на поверхности. Промерзания водоема до дна обычно не происходит (к тому же лед тоже имеет плотность меньше воды и плавает на поверхности).
Химические свойства:
- Вода разлагается при пропускании электрического тока* на водород и кислород:
2H2O = 2H2↑ + O2↑ - Вода взаимодействует с натрием и некоторыми другими активными металлами, которые вытесняют из нее водород, образуется щелочь (гидроксид натрия):
2Na + 2HOH = 2NaOH + H2↑ - Оксид кальция (негашеная известь) бурно взаимодействует с водой (гасится) с выделением большого количества тепла, что может быть
даже причиной пожара. Образуется гидроксид кальция (гашеная известь):
CaO + H2O = Ca(OH)2 + Q - Большинство оксидов неметаллов реагируют с водой с образованием кислот. Оксид серы (IV) взаимодействует с водой с образованием серни́стой кислоты:
SO2 + H2O = H2SO3
К основным загрязнителям природной воды относятся сточные воды промышленных предприятий, содержащие соединения ртути, мышьяка и других токсичных элементов. Стоки животноводческих комплексов, городов могут содержать отходы, вызывающие бурное развитие бактерий. Большую опасность для природных водоемов представляет неправильное хранение (не обеспечивающее защиту от атмосферных осадков) или применение удобрений и ядохимикатов, смываемых в водоемы. Транспорт, особенно водный, загрязняет водоемы нефтепродуктами и бытовым мусором, выбрасываемым недобросовестными людьми прямо в воду.
Для охраны вод необходимо вводить замкнутое водоснабжение промышленных предприятий, комплексную переработку сырья и отходов, строительство очистных сооружений, экологическое воспитание населения.
* Для электролиза воды используются растворы солей
2. Опыт. Распознавание соли угольной кислоты среди трех предложенных солей.
Качественной реакцией на карбонаты служит взаимодействие с кислотами, сопровождающееся бурным выделением углекислого газа:
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
или, в ионном виде:
CO32− + 2H+ = H2O + CO2↑
Доказать, что выделяется именно оксид углерода (IV), можно, пропуская его через раствор известковой воды, что вызывает её помутнение:
CO2 + Ca(OH)2 = CaCO3↓ + H2O
Чтобы распознать соль угольной кислоты, добавляем во все три пробирки немного кислоты (чтобы не вылилась через край при «вскипании»). Где будет выделяться бесцветный газ без запаха, там находится карбонат.
автор: Владимир Соколов
Вода
Физические и химические свойства
Физические и химические свойства воды определяются химическим, электронным и пространственным строением молекул Н2O.
Атомы Н и О в молекуле Н20 находятся в своих устойчивых степенях окисления, соответственно +1 и -2; поэтому вода не проявляет ярко выраженных окислительных или восстановительных свойств. Обратите внимание: в гидридах металлов водород находится в степени окисления -1.
Молекула Н2O имеет угловое строение. Связи Н-O очень полярны. На атоме О существует избыточный отрицательный заряд, на атомах Н — избыточные положительные заряды. 8 целом молекула Н2O является полярной, т.е. диполем. Этим объясняется тот факт, что вода является хорошим растворителем для ионных и полярных веществ.
Наличие избыточных зарядов на атомах Н и О, а также неподеленных электронных пар у атомов О обусловливает образование между молекулами воды водородных связей, вследствие чего они объединяются в ассоциаты. Существованием этих ассоциатов объясняются аномально высокие значения т. пл. и т. кип. воды.
Наряду с образованием водородных связей, результатом взаимного влияния молекул Н2O друг на друга является их самоионизация:
в одной молекуле происходит гетеролитический разрыв полярной связи О-Н, и освободившийся протон присоединяется к атому кислорода другой молекулы. Образующийся ион гидроксония Н3О+ по существу является гидратированным ионом водорода Н+ • Н2O, поэтому упрощенно уравнение самоионизации воды записывается так:
Н2O ↔ H+ + OH—
Константа диссоциации воды чрезвычайно мала:
Это свидетельствует о том, что вода очень незначительно диссоциирует на ионы, и поэтому концентрация недиссоциированных молекул Н2O практически постоянна:
В чистой воде [Н+] = [ОН—] = 10-7 моль/л. Это означает, что вода представляет собой очень слабый амфотерный электролит, не проявляющий в заметной степени ни кислотных, ни основных свойств.
Однако вода оказывает сильное ионизирующее действие на растворенные в ней электролиты. Под действием диполей воды полярные ковалентные связи в молекулах растворенных веществ превращаются в ионные, ионы гидратируются, связи между ними ослабляются, в результате чего происходит электролитическая диссоциация. Например:
HCl + Н2O — Н3O+ + Сl—
(сильный электролит)
(или без учета гидратации: HCl → Н+ + Сl—)
CH3COOH + H2O ↔ CH3COO— + H+ (слабый электролит)
(или CH3COOH ↔ CH3COO— + H+)
Согласно теории кислот и оснований Брёнстеда-Лоури, в этих процессах вода проявляет свойства основания (акцептор протонов). По той же теории в роли кислоты (донора протонов) вода выступает в реакциях, например, с аммиаком и аминами:
NH3 + H2O ↔ NH4+ + OH—
CH3NH2 + H2O ↔ CH3NH3+ + OH—
Окислительно-восстановительные реакции с участием воды
Эти реакции возможны только с сильными восстановителями, которые способны восстановить ионы водорода, входящие в состав молекул воды, до свободного водорода.
1) Взаимодействие с металлами
а) При обычных условиях Н2О взаимодействует только со щел. и щел.-зем. металлами:
2Na + 2Н+2О = 2NaOH + H02↑
Ca + 2Н+2О = Ca(OH)2 + H02↑
б) При высокой температуре Н2О вступает в реакции и с некоторыми другими металлами, например:
Mg + 2Н+2О = Mg(OH)2 + H02↑
3Fe + 4Н+2О = Fe2O4 + 4H02↑
в) Al и Zn вытесняют Н2 из воды в присутствии щелочей:
2Al + 6Н+2О + 2NaOH = 2Na[Al(OH)4] + 3H02↑
2) Взаимодействие с неметаллами, имеющими низкую ЭО (реакции происходят в жестких условиях)
C + Н+2О = CO + H02↑ («водяной газ»)
2P + 6Н+2О = 2HPO3 + 5H02↑
В присутствии щелочей кремний вытесняет водород из воды:
Si + Н+2О + 2NaOH = Na2SiO3 + 2H02↑
3) Взаимодействие с гидридами металлов
NaH + Н+2 O = NaOH + H02↑
CaH2 + 2Н+2О = Ca(OH)2 + 2H02↑
4) Взаимодействие с угарным газом и метаном
CO + Н+2O = CO2 + H02
2CH4 + O2 + 2Н+2 O = 2CO2 + 6H02
Реакции используются в промышленности для получения водорода.
ти реакции возможны только с очень сильными окислителями, которые способны окислить кислород СО С. О. -2, входящий в состав воды, до свободного кислорода O2 или до пероксид-анионов [O2]2-. В исключительном случае (в реакции с F2) образуется кислород со c o. +2.
1) Взаимодействие с фтором
2F2 + 2Н2O-2 = O02 + 4HF
или:
2F2 + Н2O-2 = O+2F2 + 2HF
2) Взаимодействие с атомарным кислородом
Н2O-2 + O• = Н2O—2
3) Взаимодействие с хлором
При высокой Т происходит обратимая реакция
2Cl2 + 2Н2O-2 = O02 + 4HCl
Под действием электрического тока или высокой температуры может происходить разложение воды на водород и кислород:
2Н+2O-2 = 2H02↑ + O02↑
Термическое разложение — процесс обратимый; степень термического разложения воды невелика.
I. Гидратация ионов. Ионы, образующиеся при диссоциации электролитов в водных растворах, присоединяют определенное число молекул воды и существуют в виде гидратированных ионов. Некоторые ионы образуют столь прочные связи с молекулами воды, что их гидраты могут существовать не только в растворе, но и в твердом состоянии. Этим объясняется образование кристаллогидратов типа CuSO4 • 5H2O, FeSO4• 7Н2O и др., а также аквакомплексов: [Cr(H2O)6]CI3, [Pt(H2O)4]Br4 и др.
I. Гидролиз солей
Обратимый гидролиз:
а) по катиону соли
Fe3+ + Н2O = FeOH2+ + Н+; (кислая среда. рН
б) по аниону соли
СО32- + Н2O = НСО3— + ОН—; (щелочная среда. рН > 7)
в) по катиону и по аниону соли
NH4+ + СН3СОО— + Н2O = NH4OH + СН3СООН (среда, близкая к нейтральной)
Необратимый гидролиз:
Al2S3 + 6Н2O = 2Аl(ОН)3↓ + 3H2S↑
II. Гидролиз карбидов металлов
Al4C3 + 12Н2O = 4Аl(ОН)3↓ + 3CH4↑ нетан
СаС2 + 2Н2O = Са(ОН)2 + С2Н2↑ ацетилен
III. Гидролиз силицидов, нитридов, фосфидов
Mg2Si + 4Н2O = 2Mg(OH)2↓ + SiH4↑ силан
Ca3N2 + 6Н2O = ЗСа(ОН)2 + 2NH3↑ аммиак
Cu3P2 + 6Н2O = ЗСu(ОН)2 + 2РН3↑ фосфин
IV. Гидролиз галогенов
Cl2 + Н2O = HCl + HClO
Вr2 + Н2O = НВr + НВrО
V. Гидролиз органических соединений
Классы органических веществ | Продукты гидролиза (органические) |
Галогеналканы (алкилгалогениды) | Спирты |
Арилгалогениды | Фенолы |
Дигалогеналканы | Альдегиды или кетоны |
Алкоголяты металлов | Спирты |
Галогенангидриды карбоновых кислот | Карбоновые кислоты |
Ангидриды карбоновых кислот | Карбоновые кислоты |
Сложные зфиры карбоновых кислот | Карбоновые кислоты и спирты |
Жиры | Глицерин и высшие карбоновые кислоты |
Ди- и полисахариды | Моносахариды |
Пептиды и белки | α-Аминокислоты |
Нуклеиновые кислоты | Азотсодержащие гетероциклы, пентозы (рибоза или дезоксирибоза) |
Водородная связь — Википедия
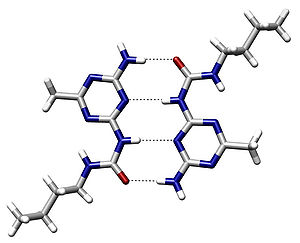 Пример межмолекулярных водородных связей
Пример межмолекулярных водородных связейВодородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.[1]
Часто водородную связь рассматривают как электростатическое взаимодействие, усиленное небольшим размером водорода, которое разрешает близость взаимодействующих диполей. Тогда об этом говорят как о разновидности донорно-акцепторной связи, невалентном взаимодействии между атомом водорода H, ковалентно связанным с атомом A группы A-H молекулы RA-H и электроотрицательным атомом B другой молекулы (или функциональной группы той же молекулы) BR’. Результатом таких взаимодействий являются комплексы RA-H···BR′ различной степени стабильности, в которых атом водорода выступает в роли «моста», связывающего фрагменты RA и BR′.
Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность[2], её распространенность и важность, особенно в органических соединениях[3], а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода.
В настоящее время в рамках теории молекулярных орбиталей водородная связь рассматривается как частный случай ковалентной с делокализацией электронной плотности по цепи атомов и образованием трёхцентровых четырёхэлектронных связей (например, -H···[F-H···F]-).
В книге The Nature of Chemical Bond and the Structure of Molecules and Crystals Лайнуса Полинга, впервые изданной в 1939 году, первое упоминание водородной связи приписывается Муру и Винмиллу. Они использовали водородную связь, чтобы обосновать факт, что гидроксид триметиламмония является более слабым основанием, чем гидроксид тетраметиламмония.[4] Описание водородных связей в воде было сделано в 1920 году Латимером и Родебушем[5].
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак. Связь этого типа, хотя и слабее ионной и ковалентной связей, играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры). Прочность водородной связи (энтальпия образования комплекса) зависит от полярности комплекса и колеблется от ~ 6 кДж/моль для комплексов молекул галогеноводородов с инертными газами до 160 кДж/моль для ион-молекулярных комплексов (AHB)±; так, для комплекса (H2O•H•OH2)+, образованного H2O и H3O+ — 132 кДж/моль в газовой фазе.
Механизм Гротгуса[править | править код]
Аномально высокая теплоёмкость воды, а также теплопроводность многоатомных спиртов обеспечивается многочисленными водородными связями. Одна молекула воды может образовать до четырёх классических водородных связей с соседями (с учётом бифуркатных H-связей до 5—6).
Водородные связи повышают температуру кипения, вязкость и поверхностное натяжение жидкостей. Водородные связи ответственны за многие другие уникальные свойства воды.
Водные кластеры[править | править код]
Водородная связь между молекулами воды обозначена чёрными пунктирными линиями. Жёлтые линии обозначают ковалентную связь, которая удерживает вместе атомы кислорода (красный) и водорода (серый).Согласно современным представлениям, наличие водородных связей между молекулами воды приводит к возникновению так называемых водных кластеров или комплексов. Простейшим примером такого кластера может служить димер воды:
- (h3O)2=h3O⋯HOH{\displaystyle {\mathsf {(H_{2}O)_{2}}}={\mathsf {H_{2}O}}\cdots {\mathsf {HOH}}}
Энергия водородной связи в димере воды составляет 0,2 эВ (≈ 5 ккал/моль), что всего на порядок больше, чем характерная энергия теплового движения при температуре 300 К. В то же время энергия ковалентной связи O-H в 200 раз больше тепловой энергии. Таким образом, водородные связи относительно слабы и неустойчивы: предполагается, что они могут легко возникать и исчезать в результате тепловых флуктуаций. Это, в частности, приводит к тому, что вода должна рассматриваться не как «простая», а как «связанная жидкость»: вода представляется как сеть молекул h3O{\displaystyle {\mathsf {H_{2}O}}}, соединённых водородными связями[6].
Водородная связь в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты. В частности, элементы вторичной структуры (например, α-спирали, β-складки) и третичной структуры в молекулах белков, РНК и ДНК стабилизированы водородными связями. В этих макромолекулах водородные связи сцепляют части той же самой макромолекулы, заставляя её сворачиваться в определенную форму. Например, двойная спиральная структура ДНК определяется в значительной степени наличием водородных связей, сцепляющих пары нуклеотидов, которые связывают одну комплементарную нить с другой.
Многие полимеры усилены водородными связями в их главных цепях. Среди синтетических полимеров самый известный пример — нейлон, где водородные связи играют главную роль в кристаллизации материала. Водородные связи также важны в структуре полученных искусственно полимеров (например, целлюлозы) и в многих различных формах в природе, таких как древесина, хлопок и лён.
- ↑ Определение по IUPAC
- ↑ Энергия связи H···N = 8 кДж/моль, связи H···O — около 21 кДж/моль, связи H···F около 36 кДж/моль [1]. Для сравнения, энергия ковалентной связи — 400—900 кДж/моль [2]
- ↑ Например, водородными связями обусловлена форма молекулы ДНК
- ↑ T. S. Moore and T. F. Winmill. The state of amines in aqueous solution (англ.) // J. Chem. Soc.. — 1912. — Vol. 101. — P. 1635-1676. — DOI:10.1039/CT9120101635.
- ↑ Wendell M. Latimer, Worth H. Rodebush. POLARITY AND IONIZATION FROM THE STANDPOINT OF THE LEWIS THEORY OF VALENCE. (англ.) // J. Am. Chem. Soc.. — 1920. — Vol. 42. — P. 1419–1433. — DOI:10.1021/ja01452a015.
- ↑ Dominik Marx. Proton Transfer 200 Years after von Grotthuss: Insights fromAb Initio Simulations (англ.) // ChemPhysChem. — 2006. — Vol. 7. — P. 1848—1870. — DOI:10.1002/cphc.200600128.
- Химическая Энциклопедия. Советская Энциклопедия. — М., 1988.
- В. В. Москва. Водородная связь в органической химии. Соросовский образовательный журнал, 11999,N 2, с.58-64 [3]
- Пиментел Дж., О. Мак-Клеллан. Водородная связь, пер. с англ.. — М., 1964.
- Эпштейн Л.М, Шубина Е.С. Многоликая водородная связь // «Природа». — 2003. — № 1.
- Водородная связь. Сб. ст.. — М., 1964.
- Pauling L. The chemical bond. — N. Y., 1967.

