ВВЕДЁН В ДЕЙСТВИЕ ГОСТ ISO 14971-2021(ISO 14971-2019)
26 апреля 2022
СЕРТИФИКАЦИЯ В УСЛОВИЯХ САНКЦИОННОЙ ПОЛИТИКИ
Новости наших партнеров: Сертификация в условиях санкционной политики Начиная с 24 февраля 2022 года условия бизнеса в нашей стране изменились кардинально. Мы стали свидетелями предельно жёсткой реакции стран Запада, выразившейся в массовых рестрикциях в различных сферах деятельности, в том числе и в области сертификации. Данная реакция выразилась в массовом уходе органов по сертификации- резидентов 48 недружественных стран из России.
05 марта 2022
С 8 марта!!!
В этот весенний, нежный праздник Желаем счастья и добра, Пусть небо будет светлым, ясным, Пускай горит в глазах искра. Желаем новых впечатлений, Поменьше будет пусть хлопот. Желаем жизни без волнений, Без горя, бед и без забот.
21 февраля 2022
Обязательное обучение руководителей и специалистов до 01.
С 2022 года вступают в силу новые нормативные правовые акты, утвержденные в 2021 году. В связи с этим, каждый работодатель обязан организовать для сотрудников организаций прохождение внеочередной проверки знаний. Организуйте обучение и проверку знаний членов комиссии в учебном центре в объеме знаний новых требований. Только после этого комиссия имеет право проводить внеочередную проверку знаний своих работников. Обучение и проверку знаний нужно провести после опубликования нормативного акта и до его вступления в законную силу, то есть до 1 марта 2022 г.
13 января 2022
ВВЕДЁН В ДЕЙСТВИЕ ГОСТ Р ИСО/МЭК 27001-2021
ВВЕДЁН В ДЕЙСТВИЕ ГОСТ Р ИСО/МЭК 27001-2021
13 января 2022
ВВЕДЁН В ДЕЙСТВИЕ ГОСТ ISO 14971-2021(ISO 14971-2019)
ВВЕДЁН В ДЕЙСТВИЕ ГОСТ ISO 14971-2021(ISO 14971-2019)
28 сентября 2021
Семинар в Санкт-Петербурге! Внутренний аудитор систем менеджмента качества (ISO 9001; ISO 19011) 25 октября 2021 г.
25 октября 2021 г. в г. Санкт-Петербург состоится двухдневный обучающий семинар «Внутренний аудитор систем менеджмента качества (ISO 9001; ISO 19011)».
05 августа 2021
Семинар в Санкт-Петербурге! Внутренний аудитор систем менеджмента качества (ISO 9001; ISO 19011)
Семинар в Санкт-Петербурге! Внутренний аудитор систем менеджмента качества (ISO 9001; ISO 19011)
27 апреля 2021
Получение сертификата ГОСТ ISO 13485-2017 для получения/переоформления лицензии на осуществление деятельности по производству и техническому обслуживанию медицинской техники
Для получения лицензии на осуществление деятельности по производству и техническому обслуживанию медицинской техники лицензиат или соискатель лицензии представляет в лицензирующий орган копии документов, подтверждающих соответствие производства требованиям межгосударственного стандарта ГОСТ ISO 13485-2017 (сертификат).
26 апреля 2021
FSSC 22000 версия 5.
С 01 апреля 2021 г. вступила в силу новая версия FSSC 22000 версия 5.1.
14 апреля 2021
ГОСТ Р ИСО 45001-2020 (ISO 45001:2018)
С 1 апреля 2021 года вступил в силу стандарт ГОСТ Р ИСО 45001-2020 (ISO 45001:2018) «СИСТЕМЫ МЕНЕДЖМЕНТА БЕЗОПАСНОСТИ ТРУДА И ОХРАНЫ ЗДОРОВЬЯ. Требования и руководство по применению» ВЗАМЕН ГОСТ Р 54934-2012/OHSAS 18001:2007.
18 января 2021
Вниманию всех производителей медицинской техники !!!
Вниманию всех производителей медицинской техники !!! Лицензии на осуществление деятельности по производству и техническому обслуживанию медицинской техники подлежат переоформлению с 1 января 2021 г.
19 ноября 2020
Новый СанПиН для общепита с 01.01.2021 г
СанПиН 2.3/2.4.3590-20 «Санитарно-эпидемиологические требования к организации общественного питания населения» вводится в действие, начиная с 01.01.2021 г.
12 октября 2020
Семинар в Санкт-Петербурге! Внутренний аудитор систем менеджмента качества (ISO 9001; ISO 19011)
Семинар в Санкт-Петербурге! Внутренний аудитор систем менеджмента качества (ISO 9001; ISO 19011)
10 апреля 2020
Консалтинг на период самоизоляции!!!
ВНИМАНИЕ!!! В связи с неблагоприятной эпидемиологической обстановкой, вызванной пандемией вируса COVID-19, наша компания имеет возможность оказывать некоторые услуги дистанционно.
15 января 2020
ГОСТ ISO/IEC 17025-2019
С 1 сентября 2019 года вступил в силу межгосударственный стандарт ГОСТ ISO/IEC 17025-2019 «Общие требования к компетентности испытательных и калибровочных лабораторий»
15 января 2020
Новая версия ГОСТ Р ИСО 22000-2019
Новая версия ГОСТ Р ИСО 22000-2019
15 января 2020
Новая версия ISO 19011:2018
Новая версия ISO 19011:2018
27 декабря 2019
С НОВЫМ ГОДОМ!!!
С НОВЫМ ГОДОМ!!!
17 декабря 2019
выездной семинар «Обучение требованиям ГОСТ Р ИСО 15378-2017»
28 ноября 2019
выездной семинар «Основы статистического анализа данных. Использование программного обеспечения MiniTab для статистического анализа данных»
05 ноября 2019
Новая версия ГОСТ Р ИСО 22000-2019 (ISO 22000:2018)
С 27.11.2019 по 29.11.2019 в г. Санкт-Петербург состоится практический семинар «Новая версия ГОСТ Р ИСО 22000-2019 (ISO 22000:2018). Разработка/доработка, внедрение и внутренний аудит системы менеджмента»
Разработка/доработка, внедрение и внутренний аудит системы менеджмента»
22 октября 2019
Утвержден национальный стандарт — ГОСТ Р ИСО 22000-2019
Приказом Росстандарта от 23.07.2019 N 416-ст утвержден национальный стандарт — ГОСТ Р ИСО 22000-2019 «Системы менеджмента безопасности пищевой продукции. Требования к организациям, участвующим в цепи создания пищевой продукции». ГОСТ Р ИСО 22000-2019 вводится в действие с 1 января 2020 года. Национальный стандарт на СМБПП разработан АО «ВНИИС» взамен ГОСТ Р ИСО 22000-2007 и идентичен международному стандарту ISO 22000:2018 «Системы менеджмента безопасности пищевой продукции. Требования к организациям, участвующим в цепи создания пищевой продукции».
02 октября 2019
Семинар Внутренний аудитор систем менеджмента качества (ISO 9001; ISO 19011)
Внутренний аудитор систем менеджмента качества (ISO 9001; ISO 19011)
17 сентября 2019
Курс профессиональной переподготовки «Техносферная безопасность»
Санкт-Петербургский Институт Современного Образования (АНО ДПО «ИСО СПб») предлагает курс профессиональной переподготовки «Техносферная безопасность»
29 августа 2019
Новая версия ISO 22000:2018
С 25.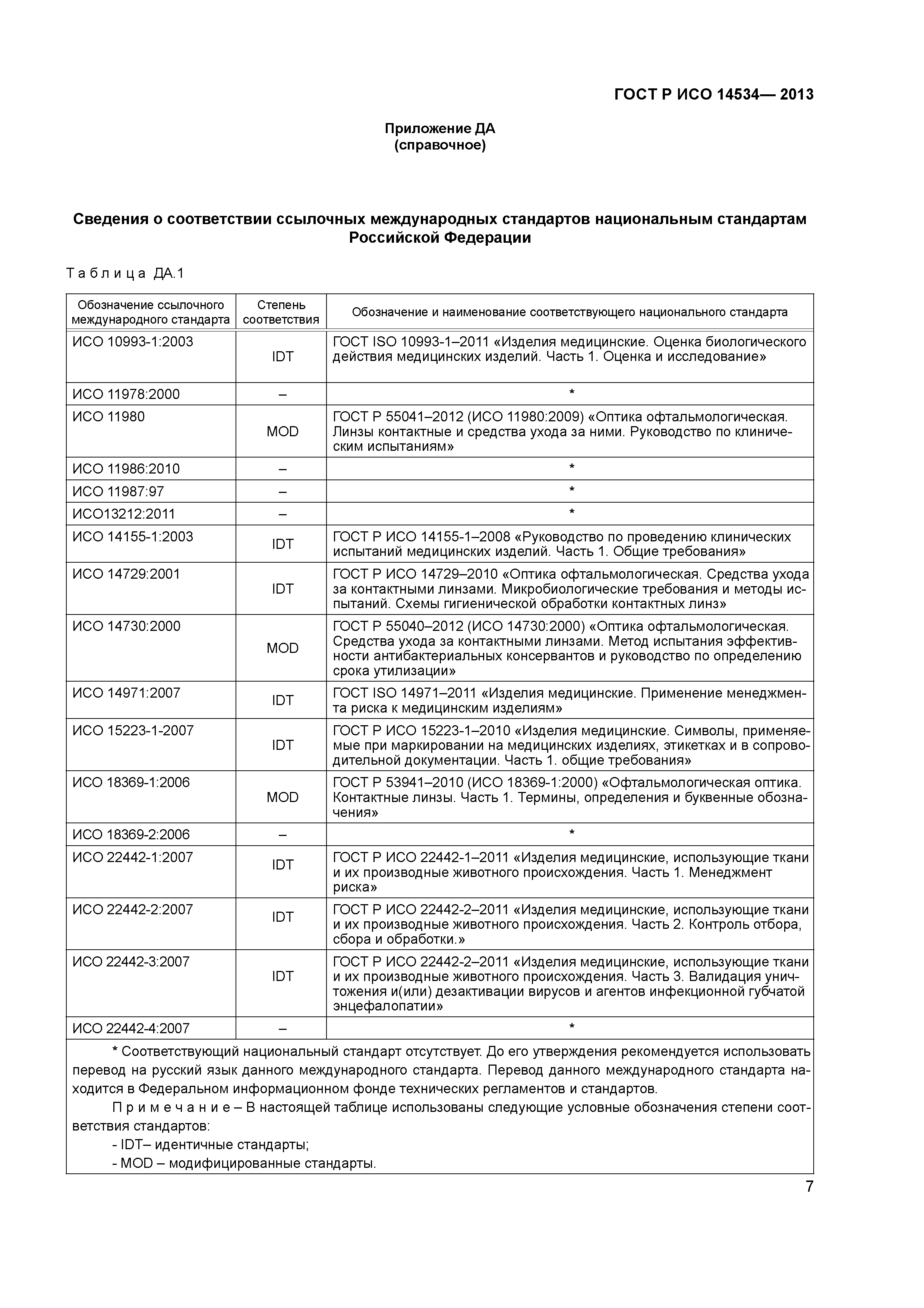 09.2019 по 27.09.2019 в г. Санкт-Петербург состоится практический семинар «Новая версия ISO 22000:2018. Разработка/доработка, внедрение. Внутренний аудит системы менеджмента в соответствии с новой версией ISO 19011:2018»
09.2019 по 27.09.2019 в г. Санкт-Петербург состоится практический семинар «Новая версия ISO 22000:2018. Разработка/доработка, внедрение. Внутренний аудит системы менеджмента в соответствии с новой версией ISO 19011:2018»
29 августа 2019
Новая версия ISO 22000:2018
С 22.08.2019 по 23.08.2019 RSM Group провела семинар: «Новая версия ISO 22000:2018. Разработка/доработка, внедрение и внутренний аудит системы менеджмента»
22 июля 2019
семинар «Новая версия ISO 22000:2018»
С 22.08.2019 по 23.08.2019 в г. Санкт-Петербург состоится практический семинар «Новая версия ISO 22000:2018. Разработка/доработка, внедрение. Внутренний аудит системы менеджмента в соответствии с новой версией ISO 19011:2018».
17 июля 2019
Семинар «Внутренний аудитор систем менеджмента качества (ISO 9001; ISO 19011)»
24 июля 2019 г. в г. Санкт-Петербург состоится трехдневный обучающий семинар»Внутренний аудитор систем менеджмента качества (ISO 9001; ISO 19011)».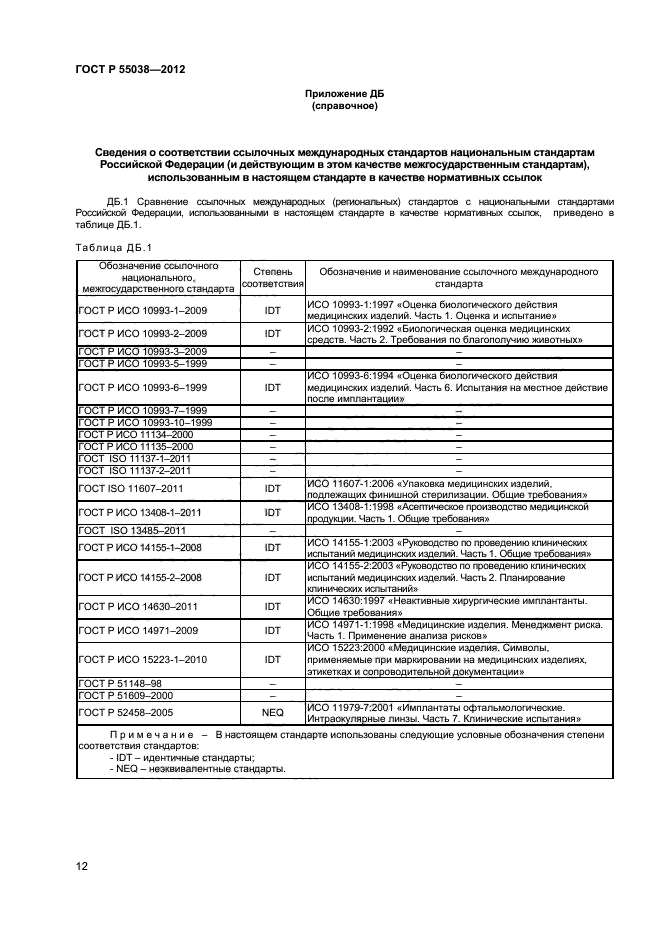
13 июня 2019
Семинар «Разработка, внедрение и внутренний аудит системы менеджмента качества (ISO 9001:2015/ГОСТ Р ИСО 9001-2015)»
Семинар «Разработка, внедрение и внутренний аудит системы менеджмента качества (ISO 9001:2015/ГОСТ Р ИСО 9001-2015)»
13 июня 2019
Выездной семинар для сотрудников АО «Армалит» (г. Санкт-Петербург)
Выездной семинар для сотрудников АО «Армалит» (г. Санкт-Петербург)
13 июня 2019
Вручение Благодарностей Комитета по промышленной политике и инноваций в ФБУ «Тест-С.-Петербург» за вклад в развитие промышленности Санкт-Петербурга
Вручение Благодарностей Комитета по промышленной политике и инноваций в ФБУ «Тест-С.-Петербург» за вклад в развитие промышленности Санкт-Петербурга
04 апреля 2019
Семинар «Внутренний аудитор систем менеджмента качества (ISO 9001; ISO 19011)»
17 апреля 2019 г. в г. Санкт-Петербург состоится обучающий семинар «Внутренний аудитор систем менеджмента качества (ISO 9001; ISO 19011)».
01 апреля 2019
Семинар «Внутренний аудитор систем менеджмента ИТ-услуг (ISO/IEC 20000, ISO 19011)»
28.03 — 29.03.2019 RSM Group провела семинар: «Внутренний аудитор систем менеджмента ИТ-услуг (ISO/IEC 20000, ISO 19011)».
14 марта 2019
Семинар «Внутренний аудитор системы экологического менеджмента (ISO 14001; ISO 19011)»
С 13.03.2019 по 14.03.2019 RSM Group провела семинар: «Внутренний аудитор системы экологического менеджмента (ISO 14001; ISO 19011)»
25 января 2019
Семинар «Разработка, внедрение и внутренний аудит системы менеджмента информационной безопасности с учетом требований международных стандартов серии 27000 и ГОСТ»
С 23.01.2019 по 25.01.2019 RSM Group провела семинар «Разработка, внедрение и внутренний аудит системы менеджмента информационной безопасности с учетом требований международных стандартов серии 27000 и ГОСТ»
20 декабря 2018
Семинар «Разработка, внедрение и внутренний аудит системы менеджмента качества в соответствии со стандартом СТО Газпром 9001-2018»
С 18. 12.2018 по 20.12.2018 RSM Group провела Семинар «Разработка, внедрение и внутренний аудит системы менеджмента качества в соответствии со стандартом СТО Газпром 9001-2018»
12.2018 по 20.12.2018 RSM Group провела Семинар «Разработка, внедрение и внутренний аудит системы менеджмента качества в соответствии со стандартом СТО Газпром 9001-2018»
25 ноября 2018
Выездной семинар для сотрудников АО «Концерн Калашников»
В ноябре 2018 года RSM Group провела выездной корпоративный семинар: «Требования к системе менеджмента качества на предприятиях оборонной промышленности (ГОСТ РВ 0015-002-2012; ISO 19011)» в АО «Концерн Калашников» (г. Ижевск).
01 ноября 2018
Выездной семинар для сотрудников ОАО «Хлебопек»
В октябре 2018 года RSM Group провела выездной корпоративный семинар: «Внутренний аудитор системы ХАССП (ГОСТ Р 51705.1, ГОСТ Р ИСО 19011)» в ОАО «Хлебопек».
21 сентября 2018
Семинар!!! Новая версия ISO 22000:2018
С 19.09.2018 по 21.09.2018 RSM Group провела семинар: «Новая версия ISO 22000:2018. Разработка/доработка, внедрение и внутренний аудит системы менеджмента»
29 января 2018
Обучение внутренних аудиторов СМК в ОАО «Мценский литейный завод»
С «17» по «19» января 2018 года группа компаний «RSM Group» провелf выездной корпоративный семинар: «Внутренний аудитор СМК в соответствии с требованиями международных стандартов» (ISO 9001:2015, ISO 19011:2011)» в ОАО «Мценский литейный завод».
13 сентября 2017
Межрегиональная практическая конференция: «Аспекты безопасности и качества рыбы и рыбной продукции. Государственный надзор и контроль рыбной отрасли в России»
1 ноября 2017 года! Межрегиональная практическая конференция: «Аспекты безопасности и качества рыбы и рыбной продукции. Государственный надзор и контроль рыбной отрасли в России»
02 ноября 2016
«Метрологическое обеспечение испытательных лабораторий» (требования к лабораториям в соответствии с требованиями Федеральной службы по аккредитации (Росаккредитации)».
02 ноября 2016
Практический семинар «Основы статистического анализа данных. Использование программного обеспечения MiniTab для статистического анализа данных»
27 октября 2016
«Специалист по техническому контролю качества продукции». Курс профессиональной переподготовки!
«Специалист по техническому контролю качества продукции». Курс профессиональной переподготовки для руководителей и специалистов. Дистанционно либо очно-заочно (2 дня), с выдачей сертификата, либо удостоверения о повышении квалификации (72 ч.) , либо диплома о проф. переподготовке (256 ч.)
Дистанционно либо очно-заочно (2 дня), с выдачей сертификата, либо удостоверения о повышении квалификации (72 ч.) , либо диплома о проф. переподготовке (256 ч.)
27 января 2016
Внедрение инструментов Бережливого Производства: максимальная эффективность при минимальных затратах
Уважаемые руководители и специалисты предприятий! Сегодня, без уверенного и правильного применения знаний в области Бережливого Производства нельзя успешно и прибыльно развиваться, стать поставщиком или партнёром современных российских, зарубежных и совместных компаний.
27 января 2016
Внутренний аудитор системы менеджмента экологической безопасности ISO 14001, ISO 19011 в соответствии с новыми стандартами, введенными в действие в 2015 г. Курс подготовки внутренних аудиторов!
Курс аккредитован в системе добровольной сертификации персонала (СДС) «РСМ-Персонал» № РОСС RU.3810.04ФАР0, сертифицирован Регистром систем менеджмента № РОСС RU.3722.04РСМ0. По окончании обучения слушатели получают сертификат компетентности, утвержденного образца Федеральным агентством по техническому регулированию и метрологии!
По окончании обучения слушатели получают сертификат компетентности, утвержденного образца Федеральным агентством по техническому регулированию и метрологии!
26 января 2016
Внутренний аудитор систем менеджмента качества ISO 9001, ISO 19011 в соответствии с новыми стандартами, введенными в действие в 2015 г. Курс подготовки внутренних аудиторов!
Курс аккредитован в системе добровольной сертификации персонала (СДС) «РСМ-Персонал» № РОСС RU.3810.04ФАР0, сертифицирован Регистром систем менеджмента № РОСС RU.3722.04РСМ0. По окончании обучения слушатели получают сертификат компетентности, утвержденного образца Федеральным агентством по техническому регулированию и метрологии!
20 января 2016
Внутренний аудитор систем менеджмента безопасности труда и охраны здоровья OHSAS 18001, ISO 19011. Курс подготовки внутренних аудиторов!
Курс аккредитован в системе добровольной сертификации персонала (СДС) «РСМ-Персонал» № РОСС RU.3810.04ФАР0, сертифицирован Регистром систем менеджмента № РОСС RU. 3722.04РСМ0. По окончании обучения слушатели получают сертификат компетентности, утвержденного образца Федеральным агентством по техническому регулированию и метрологии!
3722.04РСМ0. По окончании обучения слушатели получают сертификат компетентности, утвержденного образца Федеральным агентством по техническому регулированию и метрологии!
19 января 2016
Внутренний аудитор систем менеджмента безопасности пищевой продукции ISO 22000, HACCP, ISO 19011. Курс подготовки внутренних аудиторов!
Курс аккредитован в системе добровольной сертификации персонала (СДС) «РСМ-Персонал» № РОСС RU.3810.04ФАР0, сертифицирован Регистром систем менеджмента № РОСС RU.3722.04РСМ0. По окончании обучения слушатели получают сертификат компетентности, утвержденного образца Федеральным агентством по техническому регулированию и метрологии!
ГОСТ ISO 14971-2011. Изделия медицинские. Применение менеджмента риска к медицинским изделиям
| Вид документа | ГОСТ |
| Статус | Действует |
| Документ принят организацией | Межгосударственный Совет по стандартизации метрологии и сертификации |
| Документ внесен организацией | Федеральное агентство по техническому регулированию и метрологии |
| Разработчик документа | Федеральное государственное унитарное предприятие «Всероссийский научно-исследовательский институт стандартизации и сертификации в машиностроении» (ВНИИНМАШ) |
| Дата принятия в МГС | 2011-11-29 |
| Дата начала действия | 2013-01-01 |
| Дата последней редакции | 2013-10-24 |
| Страны действия | Республика Беларусь;Республика Казахстан;Кыргызская Республика;Российская Федерация |
| Где применяется | Настоящий стандарт устанавливает для изготовителя процесс определения опасностей, связанных с медицинскими изделиями, включая изделия для диагностики in vitro, и процедуры определения, оценивания, управления рисками и мониторинга результативности данного управления. Требования настоящего стандарта применимы ко всем стадиям жизненного цикла медицинских изделий. Настоящий стандарт не может быть использован для принятия клинических решений. Настоящий стандарт не устанавливает уровни допустимого риска. Настоящий стандарт не требует наличия у изготовителя системы менеджмента качества, однако менеджмент риска может быть составной частью системы менеджмента качества Требования настоящего стандарта применимы ко всем стадиям жизненного цикла медицинских изделий. Настоящий стандарт не может быть использован для принятия клинических решений. Настоящий стандарт не устанавливает уровни допустимого риска. Настоящий стандарт не требует наличия у изготовителя системы менеджмента качества, однако менеджмент риска может быть составной частью системы менеджмента качества |
| Код ОСК | 11.040.01 |
ГОСТы которые могут вас заинтересовать
Список ГОСТов
628-2013. Государственная система обеспечения единства измерений. Изделия медицинские электрические. Мониторы прикроватные. Методика поверки»>ГОСТ 8.628-2013. Государственная система обеспечен…2028.00р.
ГОСТ 30324.0.4-2002 (МЭК 60601-1-4:1996). Изделия …
2598.00р.
ГОСТ 30324.30-2002 (МЭК 60601-2-30:1995). Изделия …
2598. 00р.
00р.
ГОСТ 30324.31-2002 (МЭК 60601-2-31:1994). Изделия …
2598.00р.
ГОСТ 31214-2016. Изделия медицинские. Требования к…
2028.00р.
ГОСТ 34243-2017.
 Системы телемедицинские. Общие тр…
Системы телемедицинские. Общие тр…2028.00р.
ГОСТ 34244-2017. Системы телемедицинские. Общие тр…
2028.00р.
ГОСТ Р 15.013-2016. Система разработки и постановк…
2028.00р.
ISO 14971:2019 — Медицинские изделия. Применение управления рисками к медицинским изделиям
ISO 14971:2019 — Медицинские изделия. Применение управления рисками к медицинским изделиям Перейти к основному содержанию ИСО 14971:2019стр
ИСО 14971:2019
72704
Резюме
Предварительный просмотр Этот документ определяет терминологию, принципы и процесс для управления рисками медицинских устройств , включая программное обеспечение в виде медицинских изделий и диагностики in vitro медицинских изделий . Процесс , описанный в этом документе, призван помочь производителям медицинских устройств идентифицировать опасностей , связанных с медицинским устройством , оценить и оценить связанные риски , контролировать эти риски 900 15 , и следить за эффективностью средств контроля.
Процесс , описанный в этом документе, призван помочь производителям медицинских устройств идентифицировать опасностей , связанных с медицинским устройством , оценить и оценить связанные риски , контролировать эти риски 900 15 , и следить за эффективностью средств контроля.
Требования настоящего документа применимы ко всем фазам жизненного цикла медицинского изделия . Процесс , описанный в этом документе, применяется к рискам , связанным с медицинским устройством , таким как риски , связанные с биосовместимостью, безопасностью данных и систем, электричеством, движущимися частями, излучением и удобством использования.
Процесс , описанный в этом документе, также может применяться к продуктам, которые не обязательно являются медицинские устройства в некоторых юрисдикциях, а также могут использоваться другими лицами, участвующими в жизненном цикле медицинских устройств .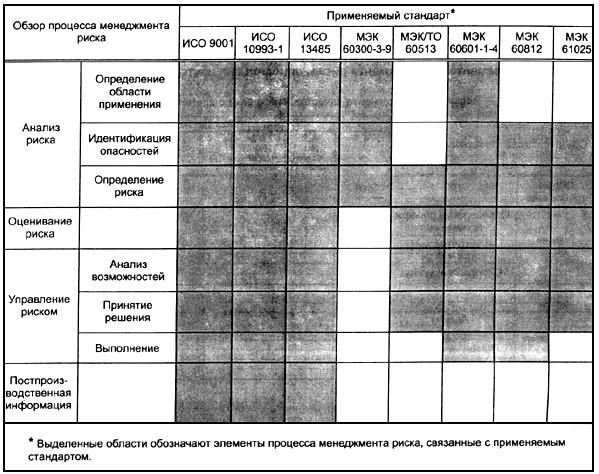
Настоящий документ не распространяется на:
— решения об использовании медицинского устройства в контексте какой-либо конкретной клинической процедуры ; или
— бизнес управление рисками .
Этот документ требует, чтобы производителей установили объективные критерии для риск приемлемость, но не определяет приемлемые уровни риска .
Управление рисками может быть неотъемлемой частью системы управления качеством. Однако этот документ не требует от производителя наличия системы управления качеством.
ПРИМЕЧАНИЕ Руководство по применению этого документа можно найти в ISO/TR 24971 [ 9 ] .
Общая информация
Купить этот стандарт
ru
| Формат | Язык | |
|---|---|---|
станд. 1
166 1
166 | PDF + ePub | Английский Французский Испанский |
| станд. 2 199 | PDF + ePub + Редлайн | Английский французский |
| станд. 3 166 | Бумага | Английский Французский испанский |
- 166 швейцарских франков
Люди также покупали
ISO 14155:2020
Клинические исследования медицинских изделий на людях
Надлежащая клиническая практика
ISO 15223-1:2 016 [Изъят]
Медицинские изделия
Символы, которые необходимо используется с этикетками медицинских изделий, маркировкой и информацией, которая должна быть предоставлена
Часть 1: Общие требования
ISO 13485:2016
Изделия медицинские
Системы управления качеством
Требования для целей регулирования
Жизненный цикл
Ранее
Отозван
ISO 14971:2007
Сейчас
Опубликовано
ИСО 14971:2019
Стадия: 60,60- 00
Предварительный
- 10
Предложение
- 20
Подготовительный
- 30
Комитет
- 40
Запрос
- 50
Одобрение
- 60
Публикация
- 90
Обзор
- 95
Снятие
- 00
Есть вопрос?
Ознакомьтесь с нашими часто задаваемыми вопросами
Будьте в курсе ISO
Подпишитесь на нашу рассылку, чтобы получать последние новости, обзоры и информацию о продуктах.
Подписаться
Нормативные требования
Вернуться к началу
Стационарное лечение
Правовая основа в области управления качеством: Формальная структура руководства по IMS основана на рекомендациях международных стандартов DIN EN ISO 9001:2008 и DIN EN ISO 13485. С точки зрения содержания и информативности процессов в соответствии с требованиями DIN EN ISO 9001 и DIN EN ISO 13485 Руководство «Интегрированные системы менеджмента» следует следующим законам и стандартам:
- DIN EN ISO 9001Системы менеджмента качества – требования представления QM при проектировании, разработке, производстве, монтаже и обслуживании
- DIN EN ISO 13485 Системы обеспечения качества – медицинские устройства
- DIN EN ISO 14971 Медицинские устройства. Применение управления рисками к медицинским устройствам
- ISO/IEC 27001 «Информационные технологии. Методы обеспечения безопасности. Системы управления информационной безопасностью.
 Требования»
Требования» - DIN ISO 45001 Системы управления охраной труда и техникой безопасности. Требования с руководством по применению
- DIN EN ISO 50001 Системы управления энергопотреблением. Требования с руководством по применению
- Регламент (ЕС) 2017/745 Совета по медицинским устройствам, вносящий поправки в Директиву 2001/83/ЕС, Регламент (ЕС) № 178/2002 и Регламент (ЕС) № 1223/2009 и отменяющий Директивы Совета 90/385/ЕЕС и 93/42/EEC
- Регламент 1935/2004/EC Совета о материалах и изделиях, предназначенных для контакта с пищевыми продуктами, и отменяющий Директивы 80/590/EEC и 89/109/EEC
- Регламент 1223/2009/EC Совета по косметическим продуктам
- Регламент о регистрации, оценке, разрешении и ограничении использования химических веществ (REACH), учреждающий Европейское агентство по химическим веществам (ECHA)
- Европейская фармакопея (Ph.Eur.)
- Европейское агентство по лекарственным средствам (EMA) Рабочие группы
- Регламент 1935/2004/EC Совета о материалах и изделиях, предназначенных для контакта с пищевыми продуктами, и отменяющий Директивы 80/590/EEC и 89/109/EEC
- Регламент 528/2012/EC Совета о размещении на рынке и использовании биоцидных продуктов
- Регламент 1272/2008/EC Совета о классификации, маркировке и упаковке веществ и смесей , изменяя и отменяя Директивы 67/548/ЕЭС и 1999/45/ЕС и вносящий поправки в Регламент (ЕС) № 1907/2006
- Директива 93/42/EWG Совета по медицинским изделиям
- Директива 2014/30/ЕС о сближении законов государств-членов, касающихся Электромагнитная совместимость
- Директива 2001/83/ЕС Европейского парламента и Совета от 6 ноября 2001 г.
 о коде сообщества для лекарственных средств для человека
о коде сообщества для лекарственных средств для человека - Директива 2001/82/ЕС Европейского парламента и Совета 6 Ноябрь 2001 г. о кодексе сообщества, касающемся ветеринарных лекарственных средств
- Директива 2012/19/ЕС Совета об отходах электрического и электронного оборудования
- Директива 2011/65/ЕС Совета об ограничении использования некоторых опасных веществ в электрическом и электронном оборудовании
- Директива 89/ 686/EEC Совета по средствам индивидуальной защиты
- Директива 2013/C 68/01 Совета по надлежащей практике распространения лекарственных средств для человека
- Закон об осуществлении закона о медицинских устройствах (MPDG — Medizinprodukterecht Durchführungsgesetz)
- Закон о наркотиках (AMG)
- Закон о наркотиках (BtMG)
- Закон о фармацевтической рекламе (HWG)
- Закон об обращении с отходами замкнутого цикла (KrWG)
- Закон о пищевых продуктах и кормах (LFGB) 90 151
- Электрическое и электронное оборудование Закон (ElektroG)
- Закон о защите от опасных веществ (ChemG)
- Предписания для фармацевтических предприятий (насколько они применимы) (AMWHV)
- Предписания для фармацевтических оптовых компаний (AM-HandelsV)
- Постановление о косметике (KosmetikV)
- Постановление об упаковке (VerpackV)
- Постановление о потребительских товарах (BedGgstV)
- Свод законов о социальном обеспечении (SGBV)
- Постановление BSI-Kritis (BSI-Kritis V)
- Единая программа аудита медицинских изделий ( MDSAP)
- 21 Свод федеральных правил (CFR) 820 (Федеральный закон США) (США)
- 21 Свод федеральных правил (CFR) 803, Отчетность по медицинским устройствам (США)
- 21 Свод федеральных правил (CFR) 806 , Отчеты об исправлениях и удалениях (США)
- 21 Свод федеральных правил (CFR) 807, Регистрация предприятий и список устройств (США)
- 21 Свод федеральных правил (CFR) 821, Отслеживание устройств (США)
- Канадские правила медицинского оборудования (CMDR)
- Закон Японии по обеспечению качества, эффективности и безопасности фармацевтических препаратов, медицинских устройств, продуктов регенеративной и клеточной терапии, продуктов генной терапии и косметики (Закон о PMD)
- MHLW MO169 (Япония)
- Положения о терапевтических товарах (медицинских устройствах) 2002 г.
 (Австралия)
(Австралия) - RDC ANVISA №. 16/2013 – Надлежащая производственная практика (Бразилия)
- RDC ANVISA n. 23/2012 (отчет о действиях на местах) (Бразилия)
- RDC ANVISA n. 67/2009 – Бдительность (Бразилия)
- Федеральный закон №. 6360/76 (Бразилия)
- RDC ANVISA №. 56/2001 – Основные требования безопасности и эффективности (Бразилия)
- 21 Свод федеральных правил (CFR) 210 (Федеральный закон США) Текущая надлежащая производственная практика производства, обработки, упаковки или хранения лекарственных средств, общая (США)
- 21 Свод федеральных правил (CFR) 211 (Федеральный закон США) Текущая надлежащая практика производства готовых лекарственных средств (США)
- Фармакопея США (USP), текущая версия
- Фармакопея Бразилии, текущая версия 1
- RDC 17/ 2010 г. (GMP для лекарственных средств) (Бразилия)
- Тайваньский закон о фармацевтике (Pal)
- 2014 г. № 650 Положения о надзоре и управлении медицинскими устройствами (Китай)
- 2014 г.
 № 64 Китай GMP регламент
№ 64 Китай GMP регламент - Регламент регистрации лекарственных средств (Приказ SFDA 28; 2007 г.) (Китай)
- Надлежащая производственная практика для фармацевтических продуктов (пересмотрен в 2010 г.) Постановление № 79 Министерства здравоохранения (Китай)
- Фармакопея Китайской Народной Республики ( Текущая редакция)
- 2013 N 913 – Правила надлежащей производственной практики
- Федеральный закон N 323-ФЗ – «Об охране здоровья населения в Российской Федерации»
- Приказ № 737н – Утверждение Административного регламента регистрации медицинских изделий РЗН (Россия)
- Постановление № 906 – Изменения в перечень всей продукции, подлежащей процедуре соответствия в России
- № 184-ФЗ Федеральный закон «О техническом регламенте» (Россия)
- Постановление № 1416 – Нормативно-правовая база для изделий медицинского назначения (Россия)
- № 214 10/2 – Правила технических, токсикологических и клинических испытаний (Россия)
- РС-002 Правила испытаний (Россия)
- Приказ МЗ РФ N 4нУтверждение Номенклатурной номенклатуры изделий медицинского назначения и IVD (Россия)
- Приказ 174н – Мониторинг безопасности, качества и эффективности медицинских изделий (Россия)
- Приказ 175н – Об утверждении Методики мониторинга безопасности медицинских изделий (Россия)
- Приказ 12н – Отчетность о нежелательных явлениях (Россия)
- ГОСТ Р 51609- 2000 г.
 – Классификация только медицинских изделий по классам риска (Россия)
– Классификация только медицинских изделий по классам риска (Россия) - МЗ № 89 – Правила испытаний медицинских изделий с функцией измерения (Россия)
- Закон Кореи о медицинских изделиях
- Положение о надлежащей производственной практике (GMP) для лекарственных средств , Уведомление Министерства безопасности пищевых продуктов и лекарственных средств № 2019-52, частично изменено 28 июня 2019 г. и введено в действие 29 июня 2020 г. (Корея)
- PIC-Руководство по надлежащей производственной практике для лекарственных средств
- Руководство по надлежащей лабораторной практике
- Руководство по надлежащей клинической практике
- Руководство ICH
- Руководство VICH
- Приложение 2 Надлежащая производственная практика ВОЗ для фармацевтических продуктов: основные принципы
- EudraLex – Том 4 – Руководство по надлежащей производственной практике (GMP)
Каждый из законов и стандартов учитывается в его актуальной версии.
Связи с соответствующими законами и постановлениями по охране окружающей среды: Применительно к местным производственным площадкам термин «Промышленная охрана окружающей среды» описывает все действия, предпринимаемые в связи с экологически безопасным производством, которые направлены на поддержание чистоты воздуха , защита почвы и воды, предотвращение образования отходов, -сокращение, -переработка и -удаление, а также утилизация продуктов. Он соответствует следующим стандартам:
- DIN EN ISO 14001: Система управления окружающей средой-Спецификация с инструкциями для применения
- EMA (в зависимости от местного раза)
Управление водными ресурсами, а также утилизация отходов и управление отходами должны соблюдаться каждым производственным предприятием в той мере, в какой это применимо в соответствии с национальным законодательством. Защита от иммиссии может регулировать установку и эксплуатацию установок и машин, оказывающих воздействие на окружающую среду, как с требованием официального разрешения, так и без него.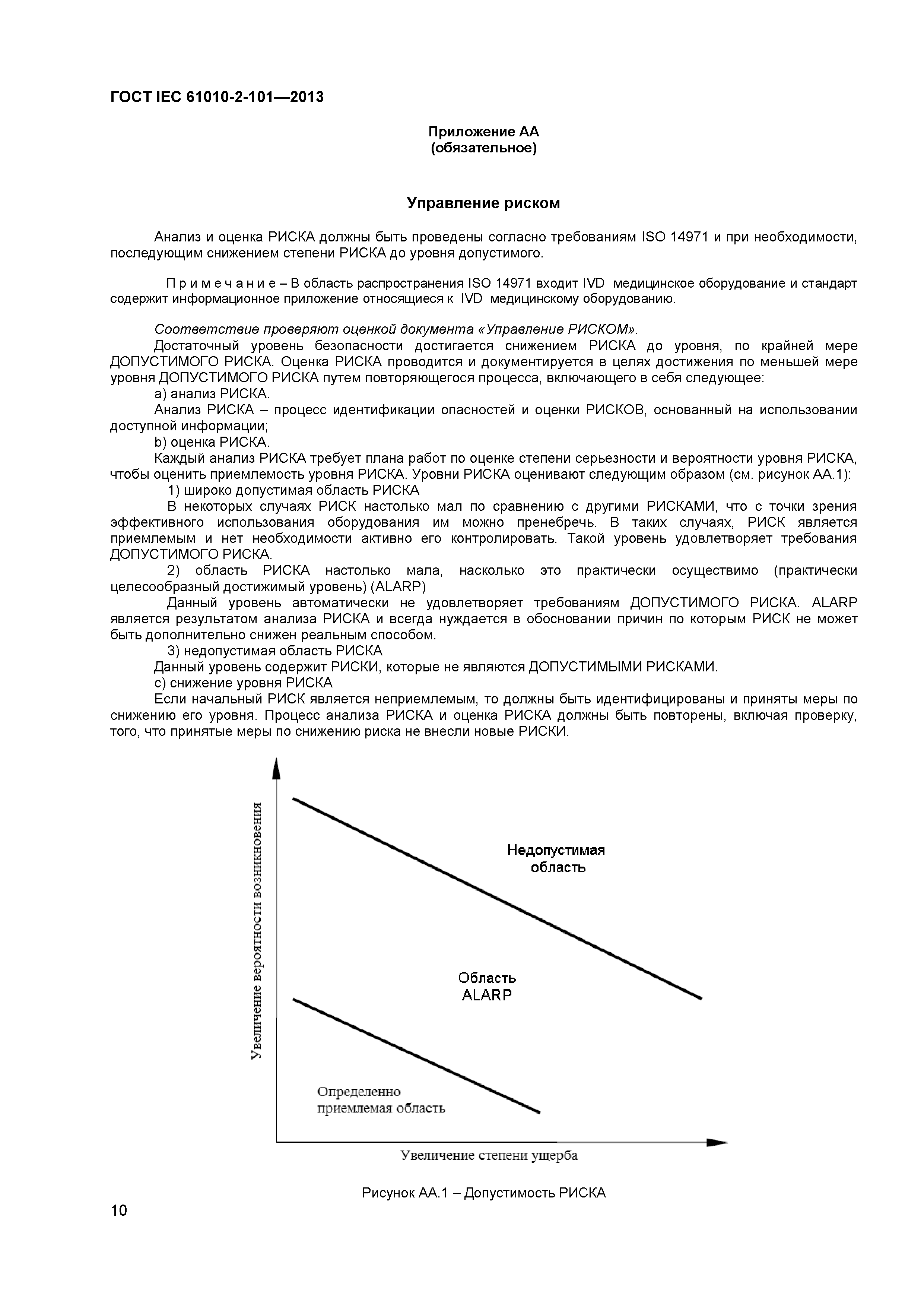 Установленным ориентиром при эксплуатации таких установок и машин является их соответствие нормам современной техники. Поэтому уже при покупке новых установок и машин необходимо учитывать будущие разработки.
Установленным ориентиром при эксплуатации таких установок и машин является их соответствие нормам современной техники. Поэтому уже при покупке новых установок и машин необходимо учитывать будущие разработки.
Управление водного хозяйства может регулировать обязанности по очистке сточных вод и защите подземных вод. Поэтому вводятся и применяются технические стандарты безопасности, а также методы очистки или директивы по предотвращению попадания сточных вод в общественную канализационную систему. Он может регулировать защиту почвы и грунтовых вод при обращении с загрязняющими воду веществами.
Правила, касающиеся отходов, могут регулировать надлежащее недопущение, переработку и утилизацию отходов от их производства до их окончательного удаления (например, захоронение отходов).
Условия, установленные органами в области охраны окружающей среды: Эксплуатация установок и машин с требованием официального разрешения и осуществление природоохранной деятельности могут подлежать проверке со стороны официальных органов. Эти условия фиксируются для каждой производственной площадки в табличной форме в Заявлении об охране окружающей среды для конкретной площадки, насколько это применимо. Руководящий персонал станции обеспечивает соблюдение этих условий.
Эти условия фиксируются для каждой производственной площадки в табличной форме в Заявлении об охране окружающей среды для конкретной площадки, насколько это применимо. Руководящий персонал станции обеспечивает соблюдение этих условий.
Вернуться к началу
Aesculap AG
Основные стандарты:
- EN ISO 9001:2015 Система менеджмента качества
- EN ISO 13485:2016 Медицинские изделия. Системы управления качеством Требования для целей регулирования
- EN ISO 14971:2019 Управление рисками
- EN ISO 14001:2015 Управление окружающей средой
- BS OHSAS 18001:2018 Охрана труда и управление здравоохранением
- DIN ISO 45001:2018 Системы управления охраной труда и техникой безопасности. Требования с руководством по применению
- EN ISO 50001:2018 Энергетический менеджмент
Нормативно-правовые акты:
- AIMD 90/385/EEC (20 07/47/EC) Активные имплантируемые медицинские устройства
- AMG Закон о наркотиках
- AM -HandelsV Операционные правила для оптовых торговцев фармацевтическими препаратами
- ASiG Закон о безопасности труда
- BGV’s Положение о социальном страховании от несчастных случаев на производстве
- CGMP Китайский GMP для медицинских устройств
- CMDR (SOR/98-282) Канадские правила медицинского оборудования
- EMAS (EG 1221/2009) Схема аудита управления ECO
- Регламент EnEV по энергосбережению
- EnEG Закон о снижении потребления энергии в зданиях
- Закон EnWG об энергетике
- MDA Закон о медицинских устройствах, включая KGMP (Корейская надлежащая производственная практика)
- MDD 93/42/EEC (2007/47/EC) Директива о медицинских устройствах
- MDR 2017/745 Регламент о медицинских устройствах
- MPG Закон Германии о медицинских устройствах (заменено)
- MPEUAnpG Medizinprodukte-EU-Anpassungsgesetz
- MPDG Das Medizinprodukterecht-Durchführungsgesetz
- MPAMIV Medizinprodukte-Anwendermelde- und Informationsverordnung
- PAA Закон о фармацевтике Тайвань
- Закон о PMD, Миссури.
 169 Закон о фармацевтических и медицинских устройствах Япония
169 Закон о фармацевтических и медицинских устройствах Япония - RDC 16:2013 Резолюция Бразилия
- Правила TGA (TG(MD)R) Правила Австралии в отношении медицинских устройств
- 21 CFR QSR 820 Правила системы качества FDA
Вернуться к началу
Avitum
Основные стандарты:
- EN ISO 13485:2016 Медицинские изделия. Системы управления качеством Требования для целей регулирования
- EN ISO 14971:2019 Управление рисками
- EN ISO 14001 :2015 Управление окружающей средой
- DIN ISO 45001:2018 Системы управления охраной труда и техникой безопасности. Требования с руководством по применению
- EN ISO 50001:2018 Управление энергопотреблением
Нормативно-правовые акты:
- CGMP Китайские правила GMP для медицинских устройств
- CMDR (SOR/98-282) Канадские правила медицинского оборудования
- Закон о медицинском оборудовании MDA, включая KGMP (Корейская надлежащая производственная практика)
- Европейская директива 93/42/EEC (2007/47/EC) Директива по медицинским устройствам (MDD)
- Европейский регламент (ЕС) 2017/745 Регламент по медицинским устройствам (MDR)
- MPEUAnpG Medizinprodukte-EU-Anpassungsgesetz
- MPDG Medizinprodukterecht-Durchführungsgesetz
- MPAMIV Medizinprodukte-Anwendermelde- und Informationsverordnung
- RDC 16:2013 Бразильская резолюция GMP для медицинских устройств
- Регламент TGA (TG(MD) )R) Австралийские правила медицинского оборудования
- 21 CFR Part 820 Система качества Регламенты FDA
- Европейские директивы 2001/83/EC и 2008/29/EC о своде правил, касающиеся лекарственных средств для человека
- Европейская директива 2003/94/ЕС о принципах и руководящих принципах надлежащей производственной практики в отношении лекарственных средств для человека и исследуемых лекарственных средств для человека
- Европейский регламент (ЕС) 726/2004 по выдаче разрешений и надзору за лекарственными средствами для человека и ветеринарии
- Европейский регламент (ЕС) 658/2014 по проведению мероприятий по фармаконадзору
- Европейская директива 2001/20/EC по GCP и клиническим испытаниям, Изменения в области фармаконадзора в 12-й поправке к Закону о лекарственных средствах Германии
- Европейская директива о фальсифицированных лекарственных средствах (2011/62/ЕС)
- Европейское руководство 2013/C343/01 о надлежащей практике распространения лекарственных средств для человека (ЕС-ВВП)
- Европейская фармакопея (Ph.



 Требования»
Требования» о коде сообщества для лекарственных средств для человека
о коде сообщества для лекарственных средств для человека (Австралия)
(Австралия)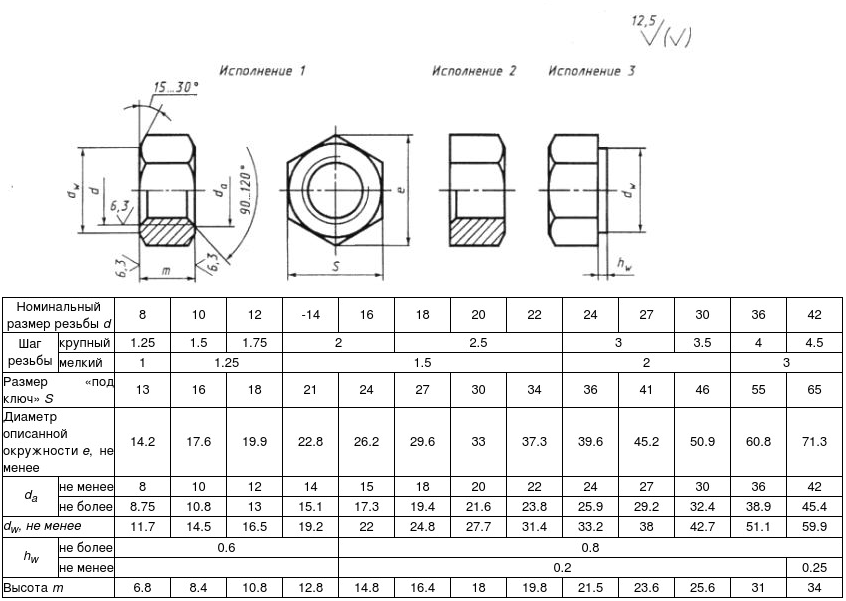 № 64 Китай GMP регламент
№ 64 Китай GMP регламент – Классификация только медицинских изделий по классам риска (Россия)
– Классификация только медицинских изделий по классам риска (Россия)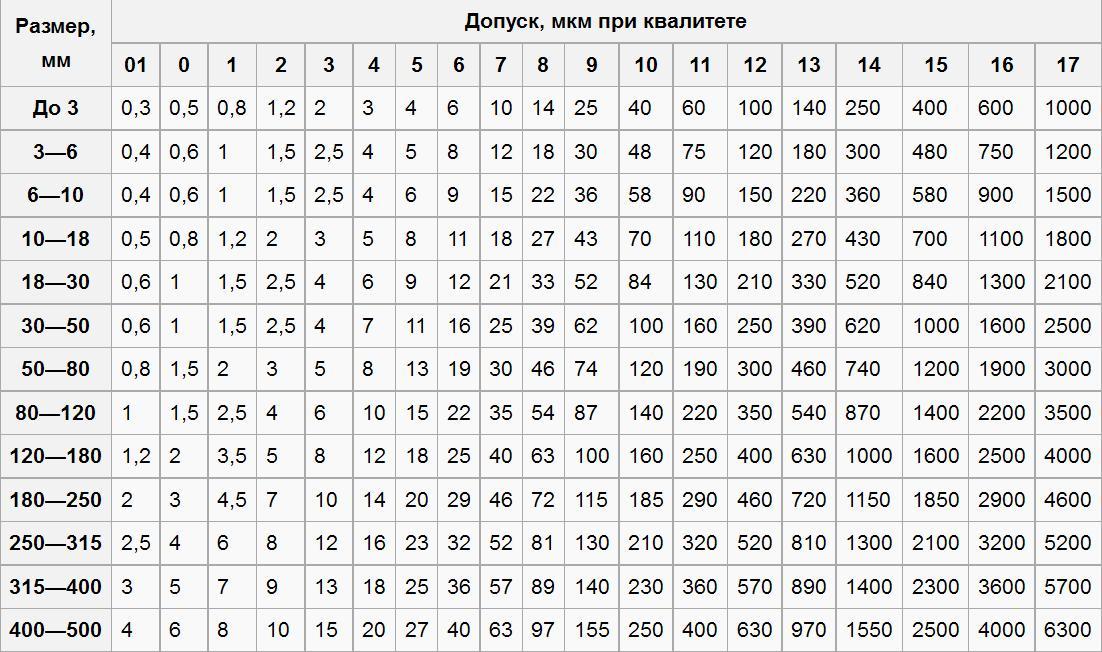 169 Закон о фармацевтических и медицинских устройствах Япония
169 Закон о фармацевтических и медицинских устройствах Япония