Ученые Сколтеха уточнили формулу воды
https://ria.ru/20200709/1574132897.html
Ученые Сколтеха уточнили формулу воды
Ученые Сколтеха уточнили формулу воды — РИА Новости, 09.07.2020
Ученые Сколтеха уточнили формулу воды
Российские ученые в сотрудничестве с немецкими коллегами выяснили, что вода содержит большое количество короткоживущих ионов. Это коренным образом меняет… РИА Новости, 09.07.2020
2020-07-09T19:18
2020-07-09T19:18
2020-07-09T19:18
наука
открытия — риа наука
сколковский институт науки и технологий
химия
физика
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/149988/43/1499884311_0:283:5442:3344_1920x0_80_0_0_eecf326339221d319655c6d154e47306.jpg
МОСКВА, 9 июл — РИА Новости. Российские ученые в сотрудничестве с немецкими коллегами выяснили, что вода содержит большое количество короткоживущих ионов. Это коренным образом меняет понимание динамической структуры воды и подходы к оценке кислотности. Результаты исследования опубликованы в журнале Scientific Reports.Природная вода представляет собой многокомпонентную смесь изотопологов —комбинаций различных изотопов кислорода и водорода, двух элементов, из которых состоит вода.Ученые из Сколтеха и Штутгартского университета изучили ионно-молекулярный состав трех изотопологов воды — обычной (h3O), тяжелой (D2O) и полутяжелой (HDO) — и выяснили, что на очень коротких, субпикосекундных временных интервалах чистая жидкая вода содержит большие концентрации короткоживущих ионов h4O+ и OH- — намного выше, чем учитывается при оценке pH. До нескольких процентов молекул h3O были временно ионизированы.Ионные виды жидкой воды играют важную роль в окислительно-восстановительных процессах, каталитических реакциях и электрохимических системах. Ранее предполагалось, что слабобарьерное туннелирование атома водорода между молекулами h3O, вызванное ядерными квантовыми эффектами, может приводить к возникновению кратковременных избыточных протонных состояний, но до настоящего времени не было ни экспериментального подтверждения таких состояний, ни информации о концентрации избыточных протонов в чистой воде.
Это коренным образом меняет понимание динамической структуры воды и подходы к оценке кислотности. Результаты исследования опубликованы в журнале Scientific Reports.Природная вода представляет собой многокомпонентную смесь изотопологов —комбинаций различных изотопов кислорода и водорода, двух элементов, из которых состоит вода.Ученые из Сколтеха и Штутгартского университета изучили ионно-молекулярный состав трех изотопологов воды — обычной (h3O), тяжелой (D2O) и полутяжелой (HDO) — и выяснили, что на очень коротких, субпикосекундных временных интервалах чистая жидкая вода содержит большие концентрации короткоживущих ионов h4O+ и OH- — намного выше, чем учитывается при оценке pH. До нескольких процентов молекул h3O были временно ионизированы.Ионные виды жидкой воды играют важную роль в окислительно-восстановительных процессах, каталитических реакциях и электрохимических системах. Ранее предполагалось, что слабобарьерное туннелирование атома водорода между молекулами h3O, вызванное ядерными квантовыми эффектами, может приводить к возникновению кратковременных избыточных протонных состояний, но до настоящего времени не было ни экспериментального подтверждения таких состояний, ни информации о концентрации избыточных протонов в чистой воде. «Мы использовали различные изотопологи воды, чтобы идентифицировать избыточные протонные состояния, — приводятся в пресс-релизе слова одного из авторов исследования Хенни Уердана (Henni Ouerdane), профессора Центра энергетических наук и технологий Сколтеха (CEST). — Постепенно заменяя атомы водорода (H) дейтерием (D), мы изменили относительную концентрации частиц, связанных с избытком протонов, таких как HD2O+, Dh3O+, h4O+ и D3O+, и определили их вклад в кумулятивное инфракрасное поглощение».На инфракрасных спектрах авторы увидели максимумы, которые существующие модели не могли объяснить.»Мы обнаружили концентрационно-зависимые спектральные особенности вблизи молекулярных изгибных мод полутяжелых водных спектров. Мы считаем, что эти особенности связаны с избытком протонов, которые существуют в пикосекундном масштабе времени», — говорит Уердан.»В то время как предыдущие исследования структуры воды были основаны на кристаллографических экспериментах и не отражали динамику воды, наше исследование дает новое представление о сложной структуре воды в ультракоротком масштабе времени», — отмечает ведущий автор статьи, старший научный сотрудник CEST Василий Артемов.
«Мы использовали различные изотопологи воды, чтобы идентифицировать избыточные протонные состояния, — приводятся в пресс-релизе слова одного из авторов исследования Хенни Уердана (Henni Ouerdane), профессора Центра энергетических наук и технологий Сколтеха (CEST). — Постепенно заменяя атомы водорода (H) дейтерием (D), мы изменили относительную концентрации частиц, связанных с избытком протонов, таких как HD2O+, Dh3O+, h4O+ и D3O+, и определили их вклад в кумулятивное инфракрасное поглощение».На инфракрасных спектрах авторы увидели максимумы, которые существующие модели не могли объяснить.»Мы обнаружили концентрационно-зависимые спектральные особенности вблизи молекулярных изгибных мод полутяжелых водных спектров. Мы считаем, что эти особенности связаны с избытком протонов, которые существуют в пикосекундном масштабе времени», — говорит Уердан.»В то время как предыдущие исследования структуры воды были основаны на кристаллографических экспериментах и не отражали динамику воды, наше исследование дает новое представление о сложной структуре воды в ультракоротком масштабе времени», — отмечает ведущий автор статьи, старший научный сотрудник CEST Василий Артемов. Ученые считают, что учет ионных частиц в ультракоротком временном масштабе улучшит и значительно упростит модели физико-химических и электрохимических систем, в которых жидкая вода играет важную роль, а также поможет в будущих исследованиях аномальных свойств воды, например, при ее взаимодействии с электрическим полем.
Ученые считают, что учет ионных частиц в ультракоротком временном масштабе улучшит и значительно упростит модели физико-химических и электрохимических систем, в которых жидкая вода играет важную роль, а также поможет в будущих исследованиях аномальных свойств воды, например, при ее взаимодействии с электрическим полем.
https://ria.ru/20191017/1559912207.html
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
1920
1080
true
1920
1440
true
https://cdnn21.img.ria.ru/images/149988/43/1499884311_302:0:5138:3627_1920x0_80_0_0_eb2fdf9a55c853b629cfddd01a67bae3.jpg
1920
1920
true
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
1
5
4.7
96
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
открытия — риа наука, сколковский институт науки и технологий, химия, физика
Наука, Открытия — РИА Наука, Сколковский институт науки и технологий, Химия, Физика
МОСКВА, 9 июл — РИА Новости. Российские ученые в сотрудничестве с немецкими коллегами выяснили, что вода содержит большое количество короткоживущих ионов. Это коренным образом меняет понимание динамической структуры воды и подходы к оценке кислотности. Результаты исследования опубликованы в журнале Scientific Reports.
Это коренным образом меняет понимание динамической структуры воды и подходы к оценке кислотности. Результаты исследования опубликованы в журнале Scientific Reports.
Природная вода представляет собой многокомпонентную смесь изотопологов —комбинаций различных изотопов кислорода и водорода, двух элементов, из которых состоит вода.
Ученые из Сколтеха и Штутгартского университета изучили ионно-молекулярный состав трех изотопологов воды — обычной (H2O), тяжелой (D2O) и полутяжелой (HDO) — и выяснили, что на очень коротких, субпикосекундных временных интервалах чистая жидкая вода содержит большие концентрации короткоживущих ионов H3O+ и OH— — намного выше, чем учитывается при оценке pH. До нескольких процентов молекул h3O были временно ионизированы.
Ионные виды жидкой воды играют важную роль в окислительно-восстановительных процессах, каталитических реакциях и электрохимических системах. Ранее предполагалось, что слабобарьерное туннелирование атома водорода между молекулами h3O, вызванное ядерными квантовыми эффектами, может приводить к возникновению кратковременных избыточных протонных состояний, но до настоящего времени не было ни экспериментального подтверждения таких состояний, ни информации о концентрации избыточных протонов в чистой воде.
«Мы использовали различные изотопологи воды, чтобы идентифицировать избыточные протонные состояния, — приводятся в пресс-релизе слова одного из авторов исследования Хенни Уердана (Henni Ouerdane), профессора Центра энергетических наук и технологий Сколтеха (CEST). — Постепенно заменяя атомы водорода (H) дейтерием (D), мы изменили относительную концентрации частиц, связанных с избытком протонов, таких как HD2O+, DH2O+, H3O+ и D3O+, и определили их вклад в кумулятивное инфракрасное поглощение».
© SkoltechИнфракрасные спектры легкой (красный), тяжелой (синий) и полутяжелой (серый) воды и ионных частиц, которые были идентифицированы в настоящем исследовании. Красные, белые и черные кружки изображают атомы кислорода, водорода и дейтерия соответственно
© Skoltech
Инфракрасные спектры легкой (красный), тяжелой (синий) и полутяжелой (серый) воды и ионных частиц, которые были идентифицированы в настоящем исследовании. Красные, белые и черные кружки изображают атомы кислорода, водорода и дейтерия соответственно
Красные, белые и черные кружки изображают атомы кислорода, водорода и дейтерия соответственно
На инфракрасных спектрах авторы увидели максимумы, которые существующие модели не могли объяснить.
«Мы обнаружили концентрационно-зависимые спектральные особенности вблизи молекулярных изгибных мод полутяжелых водных спектров. Мы считаем, что эти особенности связаны с избытком протонов, которые существуют в пикосекундном масштабе времени», — говорит Уердан.
«В то время как предыдущие исследования структуры воды были основаны на кристаллографических экспериментах и не отражали динамику воды, наше исследование дает новое представление о сложной структуре воды в ультракоротком масштабе времени», — отмечает ведущий автор статьи, старший научный сотрудник CEST Василий Артемов.
Ученые считают, что учет ионных частиц в ультракоротком временном масштабе улучшит и значительно упростит модели физико-химических и электрохимических систем, в которых жидкая вода играет важную роль, а также поможет в будущих исследованиях аномальных свойств воды, например, при ее взаимодействии с электрическим полем.
17 октября 2019, 19:33Наука
Ученые усовершенствовали способ получения чистого топлива из воды
Официальный сайт школы №1 города Коммунара.Школьные работы.Аномальные свойства воды при замерзани.
Цель: Изучение причин изменения плотности воды при снижении температуры.
Вода — одно из самых уникальных и загадочных веществ на Земле. Известно, что за незатейливой химической формулой Н2О скрывается вещество, обладающее уникальной структурой и не менее уникальными свойствами. Исследователи, пытавшиеся на протяжении двух с лишним столетий раскрыть секреты воды, часто заходили в тупик. Да и сейчас ученые понимают, что вода остается трудным объектом для исследований, ее свойства до сих пор не всегда до конца прогнозируемы.
Наличием водородных связей обусловлены уникальные свойства воды. Трехатомная молекула Н2О образует четыре водородные связи. В их образовании принимают участие оба атома водорода, а атом кислорода, имеющий две неподеленные электронные пары, образует две водородные связи с атомами водорода соседних молекул воды.
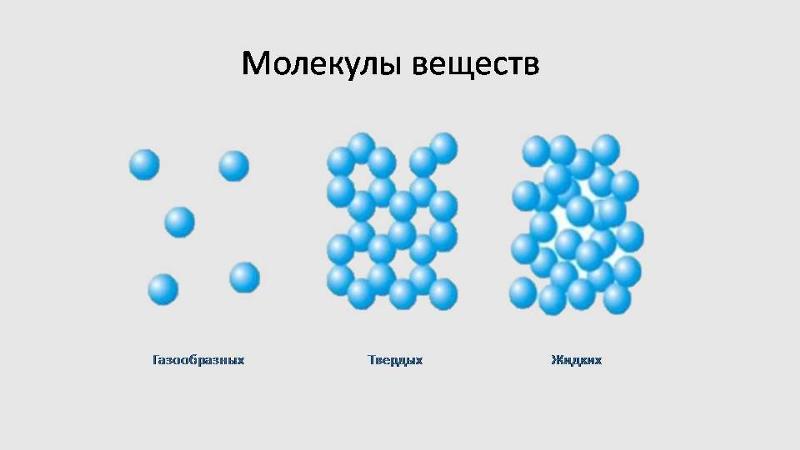
Хаотичное сообщество газообразных молекул воды при конденсации, формирует жидкое вещество удивительной сложности. Молекулы воды объединяются в кластеры (группы) (Н2О)x. В жидкой воде они связаны между собой лишь в отдельные агрегаты из нескольких молекул. Эти агрегаты могут свободно двигаться рядом друг с другом, образуя подвижную жидкость. Но при понижении температуры упорядоченность становится все больше и больше, а агрегаты – все крупнее. Наконец, образуется лед, который имеет упорядоченную структуру.
В кристалле льда между молекулами остаются пустоты. Объем этих пустот больше, чем размер отдельной молекулы Н2О. Поэтому лед имеет меньшую плотность, чем жидкая вода и плавает на поверхности воды. Большинство же других веществ при замерзании увеличивает свою плотность.
Объект исследования: Дистиллированая вода.
Направления исследования:
1. Наблюдения за изменением плотности воды при снижении температуры через каждые 5 мин.
2. Расчет объема пустоты между молекулами воды в кристаллической решетке льда.
3. Вычисление среднего количества молекул жидкой воды в кластере при различных температурах.
Результаты исследования:
1. От 100оС до 40оС плотность воды увеличивается. Скорость снижения плотности уменьшается с понижением температуры. От 40оС до 4 oС плотность меняется незначительно, нестабильно, скачкообразно. Наибольшее значение (1,00 г/мл) она имеет при температуре 4 oС. Замерзание воды сопровождается скачкообразным уменьшением плотности.
3.При температуре 4оС общая формула кластера Н14О7 , а при комнатной температуре среднее между Н8О4.
Выводы: Образование кластеров и пустот в них объясняет расширение воды при замерзании.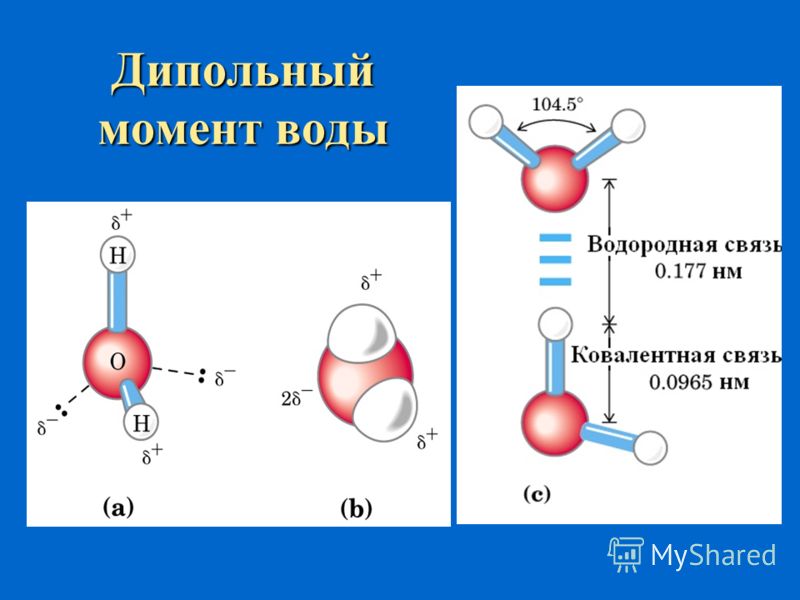
Заключение: Результаты исследования могут быть полезны в расшифровке структуры воды. Особенности образования кластеров и кристаллической решетки льда, вытеснять все растворенные в ней вещества могут быть применимы в разработке установок по очистке воды путем неполного замораживания.
Автор: Захаренкова Наталья
Руководитель: Петролай Валентина Сафроновна
Более подробно узнать об аномальных свойствах воды при замерзании можно изучив исследовательскую работу Натальи и её презентацию. Тезисы её доклада размещены в сборнике «XXXIII Всероссийская научно-практическая конференция школьников по химии» — СПбГУ: 2009.
Моделирование образования воды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 49950
- Эд Витц, Джон В.

- Цифровая библиотека химического образования (ChemEd DL)
Мы смоделировали составляющие воды, но как модели двух газов (элементов водорода и кислорода) помогают понять, как вода является основой жизни? Третий постулат Дальтона утверждает, что атомы являются единицами химических изменений. Когда газы водород и кислород смешиваются и смесь воспламеняется, образуется водяной пар (позже он сконденсируется в жидкую воду, когда огонь утихнет). В результате реакции выделяется много тепла, как вы можете видеть на этом фото взрыва «Гинденбурга»:
Рисунок \(\PageIndex{1}\) Водород в Гинденбурге вступает в реакцию с кислородом воздуха. Zeppelin LZ 129 Hindenburg загорелся 6 мая 1937 года на военно-морской авиабазе Лейкхерст в Нью-Джерси. (Общественное достояние; Creidt Gus Pasquerella). В Интернете или на YouTube есть много видео взрыва водорода, а также видео Гинденбурга и катастрофы. Эти впечатляющие видеоролики показывают свидетельство химического изменения: более слабые связи H-H и O-O разрываются (вот почему нам нужно добавить энергию или поджечь смесь), но затем образование очень прочных связей H-O в воде, H-O-H высвобождает много энергии.
Взрыв огромного водородно-кислородного шара
Вскоре после смешивания двух газов и добавления энергии начинается перегруппировка атомов. Общее изменение можно увидеть на этой анимации, но «механизм» реакции сложен, как мы увидим позже, когда будем изучать кинетику.
Конечным результатом является то, что два атома водорода каждой молекулы H 2 разделяются и вместо этого соединяются с атомами кислорода (атомы водорода могут атаковать молекулы кислорода, разрушая их). Когда химическая реакция завершена, все, что остается, — это набор молекул воды, каждая из которых содержит один атом кислорода и два атома водорода. Обратите внимание, что после реакции остается столько же атомов кислорода, сколько и до реакции. То же самое относится и к атомам водорода. Атомы не создавались, не разрушались, не делились на части и не превращались в другие виды атомов в ходе химической реакции.
Вид воды — наш первый микроскопический пример соединения . Модель предполагает то, что мы уже знаем: свойства молекул воды сильно отличаются от свойств водорода или кислорода; в частности, они имеют тенденцию слипаться, образуя жидкость. Каждая молекула соединения состоит из двух (или более) различных
Формула соединения включает как минимум два химических символа — по одному для каждого присутствующего элемента. В случае воды каждая молекула содержит один атом кислорода и два атома водорода, поэтому формула имеет вид H 2 O. И рисунок, и формула говорят вам, что любой образец чистой воды содержит в два раза больше атомов водорода, чем атомов кислорода. . Это соотношение 2:1 согласуется с четвертым постулатом Дальтона о том, что атомы соединяются в соотношении малых целых чисел.
Хотя Джон Дальтон изначально использовал круглые символы, подобные приведенным на рисунке, для обозначения атомов в химических реакциях, современный химик будет использовать химические символы и химическое уравнение, подобное 9.0032
\[ \underbrace{2 H_2 + O_2}_{\text{Реагент(ы)}} \rightarrow \underbrace{2 H_2O}_{\text{Продукт(ы)}} \label{1}\]
Это уравнение можно интерпретировать с микроскопической точки зрения как означающее, что 2 молекулы водорода и 1 молекула кислорода реагируют с образованием 2 молекул воды. Следует также напомнить о макроскопических изменениях, показанных на фотографиях. Эта макроскопическая интерпретация часто усиливается указанием физических состояний реагентов и продуктов:
\[2 H_{2(g)} + O_{2(g)} \rightarrow 2 H_2O_{(l)} \label{2}\]
Таким образом, газообразный водород и газообразный кислород реагируют с образованием жидкой воды. [Если реагент или продукт является твердым, можно было бы использовать такой символ, как H 2 O( s ). Иногда ( c ) может использоваться вместо ( s ) для обозначения кристаллического твердого вещества.] Химическая реакция, такая как уравнение \(\ref{1}\) и \(\ref{2}\), обобщает большое информацию как на макроскопическом, так и на микроскопическом уровнях, для тех, кто умеет их интерпретировать.
Иногда ( c ) может использоваться вместо ( s ) для обозначения кристаллического твердого вещества.] Химическая реакция, такая как уравнение \(\ref{1}\) и \(\ref{2}\), обобщает большое информацию как на макроскопическом, так и на микроскопическом уровнях, для тех, кто умеет их интерпретировать.
Из ChemPRIME: 2.3: Макроскопический и микроскопический взгляд на химическую реакцию
Ссылки
- ↑ www.umass.edu/microbio/chime/…er10/index.htm
Авторы и авторство
Эд Витц (Университет Куцтауна), Джон У. Мур (UW-Мэдисон), Джастин Шорб (Колледж Хоуп), Ксавьер Прат-Ресина (Университет Миннесоты в Рочестере), Тим Вендорф и Адам Хан .
Эта страница под названием «Моделирование образования воды» распространяется по незаявленной лицензии, авторами, ремиксами и/или кураторами являются Эд Витц, Джон У. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан. .
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Теги
- Образец
Плотность воды | Глава 3: Плотность
- Скачать
- Электронная почта
- Печать
- Добавить в закладки или поделиться
Тебе это нравится? Не нравится ? Пожалуйста, найдите время, чтобы поделиться с нами своими отзывами. Спасибо!
Спасибо!
Урок 3.3
Ключевые понятия
- Жидкости, как и твердые тела, также имеют собственную плотность.
- Объем жидкости можно измерить непосредственно мерным цилиндром.
- Молекулы разных жидкостей имеют разный размер и массу.
- Масса и размер молекул в жидкости, а также то, насколько плотно они упакованы вместе, определяют плотность жидкости.
- Как и твердое тело, плотность жидкости равна массе жидкости, деленной на ее объем; Д = м/об.
- Плотность воды 1 грамм на кубический сантиметр.
- Плотность вещества одинакова независимо от размера образца.
Резюме
Учащиеся измеряют объем и массу воды, чтобы определить ее плотность. Затем они измеряют массу различных объемов воды и обнаруживают, что плотность всегда одинакова. Учащиеся строят график зависимости объема и массы воды.
Цель
Учащиеся смогут измерить объем и массу воды и вычислить ее плотность. Учащиеся смогут объяснить, что, поскольку любой объем воды всегда имеет одинаковую плотность при данной температуре, эта плотность является характерным свойством воды.
Оценка
Загрузите лист с заданиями учащегося и раздайте по одному учащемуся, если это указано в задании. Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и ваши ученики носите подходящие защитные очки.
Материалы для каждой группы
- Градуированный цилиндр, 100 мл
- Вода
- Весы в граммах (могут измерять более 100 г)
- Пипетка
Демонстрационные материалы
- Вода
- Два одинаковых ведра или больших контейнера
Проведите демонстрацию, чтобы представить идею плотности воды.
Материалы
- Вода
- Два одинаковых ведра или больших контейнера
Подготовка учителя
Наполните одно ведро наполовину, а в другое добавьте примерно 1 стакан воды.

Процедура
- Выберите ученика, который поднимет оба ведра с водой.
- Спросите у студента-добровольца, какое ведро имеет большую массу.
Ожидаемые результаты
Ведро, в котором больше воды, имеет большую массу.
Спросите студентов:
- В уроках 3.1 — Что такое плотность? и 3.2 — Метод вытеснения воды, вы нашли плотность твердых тел, измерив их массу и объем. Как вы думаете, может ли жидкость, например вода, иметь плотность?
- Учащиеся должны понять, что вода имеет объем и массу. Поскольку D=m/v, вода также должна иметь плотность.
- Как вы думаете, можно найти плотность жидкости, такой как вода?
- Не ожидается, что учащиеся смогут полностью ответить на этот вопрос на данном этапе. Он задуман как повод к расследованию. Но учащиеся могут понять, что сначала им нужно каким-то образом найти массу и объем воды.
- Могут ли маленькое и большое количество воды, поднятые вашим одноклассником, иметь одинаковую плотность?
- Учащиеся могут указать, что ведро с большим количеством воды имеет большую массу, но больший объем.
 Ведро с меньшей массой имеет меньший объем. Поэтому возможно, что разное количество воды может иметь одинаковую плотность.
Ведро с меньшей массой имеет меньший объем. Поэтому возможно, что разное количество воды может иметь одинаковую плотность.
Раздайте каждому учащемуся лист с заданиями.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания. Разделы «Объясните это с помощью атомов и молекул» и «Воспримите это» в листе с заданиями будут выполняться в классе, в группах или индивидуально в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
Обсудите с учащимися, как найти объем и массу воды.
Сообщите учащимся, что они попытаются определить плотность воды.
Спросите студентов:
- Какие две вещи нужно знать, чтобы найти плотность воды?
- Учащиеся должны понимать, что им нужны как объем, так и масса образца воды, чтобы найти ее плотность.
- Как можно измерить объем воды?
- Предложите учащимся использовать мерный цилиндр для измерения объема в миллилитрах.
 Напомните учащимся, что каждый миллилитр равен 1 см 3 .
Напомните учащимся, что каждый миллилитр равен 1 см 3 . - Как можно измерить массу воды?
- Предложите учащимся использовать весы для измерения массы в граммах. Скажите учащимся, что они могут найти массу, взвесив воду. Однако, поскольку вода является жидкостью, она должна находиться в каком-то контейнере. Таким образом, чтобы взвесить воду, они также должны взвесить контейнер. Объясните учащимся, что им придется вычесть массу пустого мерного цилиндра из массы цилиндра и воды, чтобы получить массу только воды.
Предложите учащимся найти массу различных объемов воды, чтобы показать, что плотность воды не зависит от размера образца.
Вопрос для расследования
Имеют ли разное количество воды одинаковую плотность?
Материалы для каждой группы
- Градуированный цилиндр, 100 мл
- Вода
- Весы в граммах (могут измерять более 100 г)
- Пипетка
Процедура
- Найдите массу пустого мерного цилиндра.
 Запишите массу в граммах в таблице на рабочем листе.
Запишите массу в граммах в таблице на рабочем листе. Налейте 100 мл воды в мерный цилиндр. Постарайтесь быть максимально точным, убедившись, что мениск находится прямо на отметке 100 мл. Используйте пипетку, чтобы добавить или удалить небольшое количество воды.
- Взвесьте мерный цилиндр с водой. Запишите массу в граммах.
- Найдите массу только воды, вычитая массу пустого градуированного цилиндра. Запишите массу 100 мл воды в таблицу.
- Используйте массу и объем воды для расчета плотности. Запишите плотность в г/см 3 в таблицу.
- Сливайте воду, пока в мерном цилиндре не будет 50 мл воды. Если вы случайно вылили слишком много, добавляйте воду, пока не дойдете до 50 мл.
Найдите массу 50 мл воды. Запишите массу в лист активности. Рассчитайте и запишите плотность.
- Затем слейте воду, пока в мерном цилиндре не будет 25 мл воды. Найдите массу 25 мл воды и запишите ее в таблицу. Рассчитайте и запишите плотность.

Таблица 1. Нахождение плотности различных объемов воды. Объем воды 100 миллилитров 50 миллилитров 25 миллилитров Масса мерного цилиндра + вода (г) Масса пустого мерного цилиндра (г) Масса воды (г) Плотность воды (г/см 3 ) Ожидаемые результаты
Плотность воды должна быть близка к 1 г/см 3 . Это верно для 100, 50 или 25 мл.
Спросите студентов:
- Посмотрите значения плотности на диаграмме.
 Одинакова ли плотность различных объемов воды?
Одинакова ли плотность различных объемов воды? - Помогите учащимся увидеть, что большинство различных значений плотности близки к 1 г/см 3 . Они могут удивиться, почему не все их значения точно равны 1 г/см 3 . Одной из причин может быть неточность измерения. Другая причина заключается в том, что плотность воды меняется в зависимости от температуры. Вода имеет наибольшую плотность при 4 °C и при этой температуре имеет плотность 1 г/см 3 . При комнатной температуре, около 20–25 °C, плотность составляет около 0,99 г/см 3 .
- Какова плотность воды в г/см3?
- Ответы учащихся могут различаться, но в основном их значения должны быть около 1 г/см 3 .
Предложите учащимся начертить свои результаты.
Помогите учащимся построить график данных на листе с заданиями. По оси x должен быть объем, а по оси y масса.
Когда учащиеся наносят свои данные на график, должна быть прямая линия, показывающая, что при увеличении объема масса увеличивается на ту же величину.

Обсудите наблюдения учащихся, данные и графики.
Спросите студентов:
- Используйте свой график, чтобы найти массу 40 мл воды. Какова плотность этого объема воды?
- Масса 40 мл воды составляет 40 грамм. Поскольку D = m/v и mL = см 3 , плотность воды составляет 1 г/см 3 .
- Выберите объем от 1 до 100 мл. Используйте свой график, чтобы найти массу. Какова плотность этого объема воды?
- Независимо от того, весят ли ученики 100, 50, 25 мл или любое другое количество, плотность воды всегда будет равна 1 г/см 3 .
Скажите учащимся, что плотность – это характерное свойство вещества. Это означает, что плотность вещества одинакова независимо от размера образца.
Спросите студентов:
- Является ли плотность характерным свойством воды? Откуда вы знаете?
- Плотность является характеристическим свойством воды, поскольку плотность любой пробы воды (при одной и той же температуре) всегда одинакова.
 Плотность 1 г/см 3 .
Плотность 1 г/см 3 .
Объясните, почему плотность пробы воды любого размера всегда одинакова.
Спроецируйте изображение Плотность воды.
Молекулы воды имеют одинаковую массу и размер. Молекулы воды также упакованы довольно близко друг к другу. Они упакованы одинаково во всей пробе воды. Итак, если объем воды имеет определенную массу, удвоенный объем будет иметь удвоенную массу, трехкратный объем будет иметь трехкратную массу и т. д. Независимо от того, какой размер пробы воды вы измеряете, соотношение между массой и объемом всегда будет одинаковым. Поскольку D=m/v, плотность одинакова для любого количества воды.
Спроектируйте анимацию «Жидкая вода».
Молекулы воды всегда в движении. Но в среднем они упакованы везде одинаково. Следовательно, соотношение между массой и объемом одинаково, что делает плотность одинаковой. Это верно независимо от размера выборки или места, откуда вы ее выбираете.
Предложите учащимся подумать, равна ли плотность большого куска твердого вещества плотности меньшего куска.

Дайте учащимся время рассчитать плотность каждого из трех образцов, нарисованных на листе с заданиями, и ответить на соответствующие вопросы.
Спросите студентов:
- Плотность жидкости одинакова независимо от размера образца. Может ли это быть верно и для твердых тел? Рассчитайте плотность каждого из трех образцов, чтобы выяснить это.
- Да. Плотность твердого вещества одинакова независимо от размера образца.
- Образец А имеет массу 200 г. Какова плотность образца А?
- Д = м/об
- D = 200 г/100 см 3
- D = 2 г/см 3
- Если вы разрежете образец A пополам и посмотрите только на одну половину, вы получите образец B. Какова плотность образца B?
- Если учащиеся не знают, что такое масса, скажите им, что это половина массы образца A. Поскольку образец A весит 200 г, образец B составляет половину объема и, следовательно, половину массы (100 г).




 Ведро с меньшей массой имеет меньший объем. Поэтому возможно, что разное количество воды может иметь одинаковую плотность.
Ведро с меньшей массой имеет меньший объем. Поэтому возможно, что разное количество воды может иметь одинаковую плотность.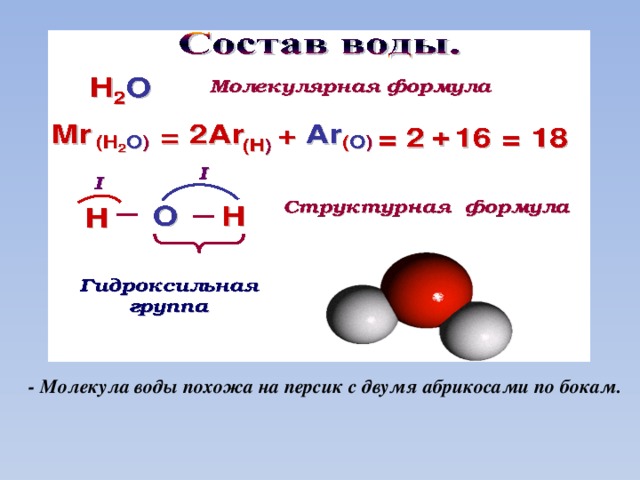 Напомните учащимся, что каждый миллилитр равен 1 см 3 .
Напомните учащимся, что каждый миллилитр равен 1 см 3 .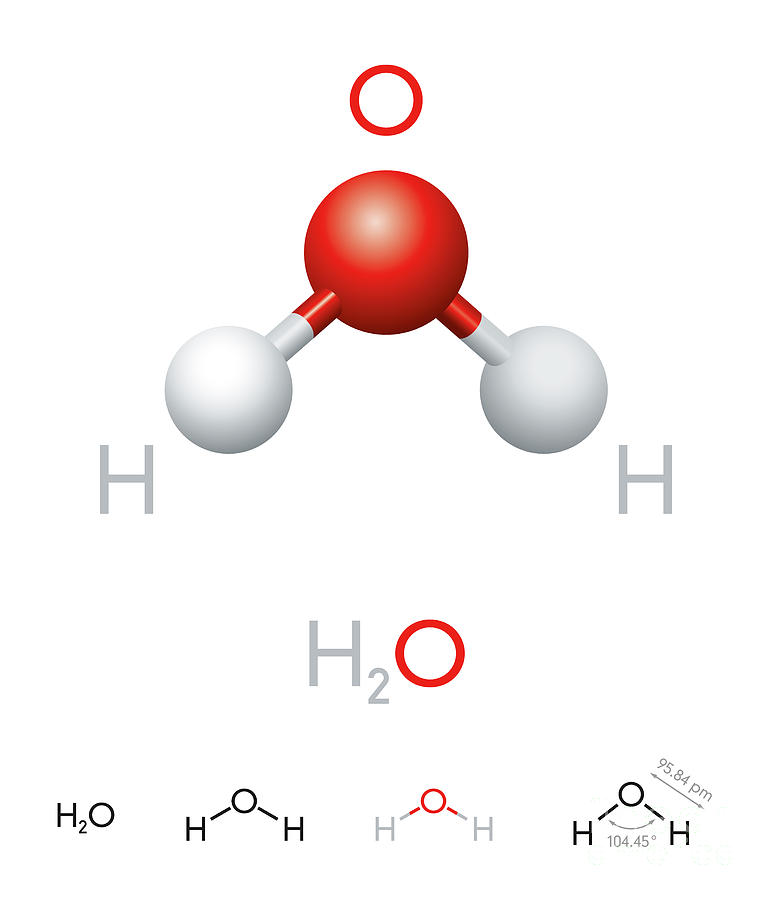 Запишите массу в граммах в таблице на рабочем листе.
Запишите массу в граммах в таблице на рабочем листе.
 Одинакова ли плотность различных объемов воды?
Одинакова ли плотность различных объемов воды?
 Плотность 1 г/см 3 .
Плотность 1 г/см 3 .