Формула воды
Формула воды.
Поделиться в:
Простейшая и истинная (молекулярная) формула воды H2O. Рациональная формула воды Н-(ОН).
Формула воды
Химические формулы изотопных модификаций воды
Вода, её роль в природе
Формула воды:
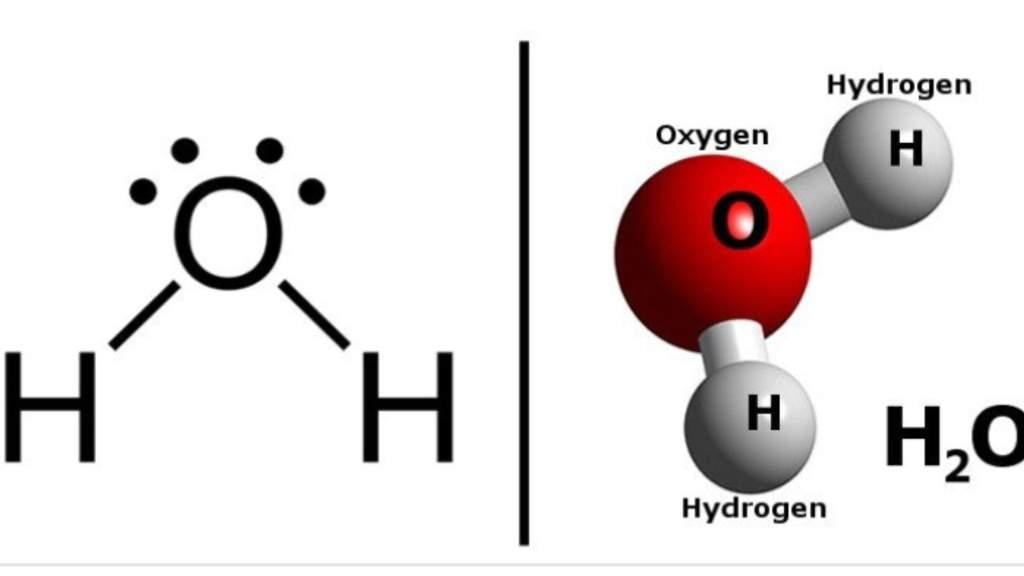
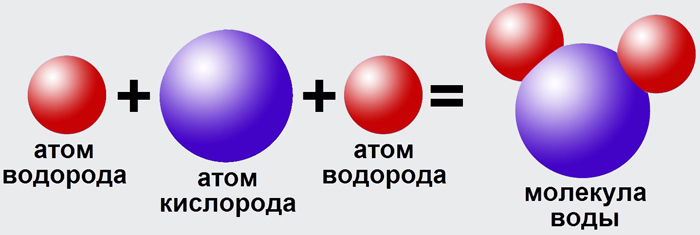
Вода (оксид водорода, гидроксид водорода, химическая формула – H2O) – бинарное неорганическое соединение, молекула которого состоит из двух атомов водорода и одного – кислорода, которые соединены между собой ковалентной связью.
Для условного обозначения химического состава и структуры веществ и соединений с помощью символов химических элементов, числовых и вспомогательных знаков (скобок, тире и т. п.) служит химическая формула.
Различают следующие виды химических формул:
– простейшая формула – это химическая формула с простейшим положительным целочисленным соотношением атомов, присутствующих в веществе или соединении. В простейшей формуле атомы обозначаются знаками химических элементов, а относительное их количество – числами в формате нижних индексов. Простейшая формула не показывает структуру, расположение и количестве атомов в веществе, она лишь показывает их соотношение друг относительно друга. Простейшая формула воды H2O.
В простейшей формуле атомы обозначаются знаками химических элементов, а относительное их количество – числами в формате нижних индексов. Простейшая формула не показывает структуру, расположение и количестве атомов в веществе, она лишь показывает их соотношение друг относительно друга. Простейшая формула воды H2O.
– истинная формула (брутто‐формула, молекулярная формула) – это химическая формула, показывающая точное количество атомов каждого элемента в одной молекуле вещества или соединения, но не ее структуру. Истинная формула показывает точный химический состав молекулы вещества (соединения). В истинной формуле атомы обозначаются знаками химических элементов, а их количество в молекуле вещества или соединения – числами в формате нижних индексов. Истинная (молекулярная) формула воды H2O совпадает с простейшей формулой воды.
– рациональная формула – это химическая формула, в которой выделяются группы атомов, характерные для классов химических соединений (например, гидроксильной группы –ОН). Рациональная формула также как и истинная формула показывает точный химический состав молекулы вещества (соединения). При записи рациональной формулы такие группы атомов заключаются в круглые скобки (). Количество повторяющихся групп обозначаются числами в формате нижних индексов, которые ставятся сразу за закрывающей скобкой. Квадратные скобки [] применяются для отражения структуры комплексных соединений. Рациональная формула воды Н-(ОН).
Рациональная формула также как и истинная формула показывает точный химический состав молекулы вещества (соединения). При записи рациональной формулы такие группы атомов заключаются в круглые скобки (). Количество повторяющихся групп обозначаются числами в формате нижних индексов, которые ставятся сразу за закрывающей скобкой. Квадратные скобки [] применяются для отражения структуры комплексных соединений. Рациональная формула воды Н-(ОН).
– структурная формула – это химическая формула, графически показывающая взаимное расположение и порядок связи атомов в соединении или веществе, выраженное на плоскости (2D-формулы) или в трёхмерном пространстве (3D-формулы). Химические связи между атомами обозначаются линиями (чёрточками).
2D-формулы воды
3D-формулы воды
Химические формулы изотопных модификаций воды
В зависимости от типа изотопов водорода, входящих в состав молекулы, выделяют несколько изотопных модификаций воды.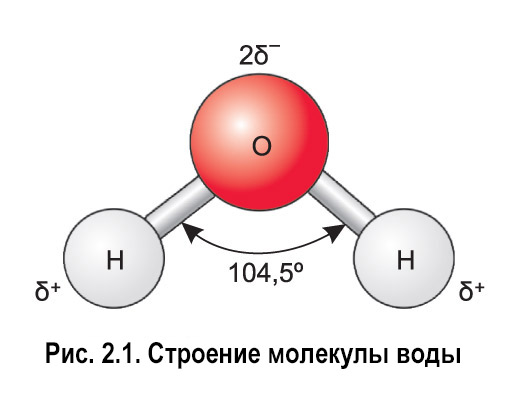 В таблице напротив изотопной модификации воды приводится соответствующая ей истинная (молекулярная) формула:
В таблице напротив изотопной модификации воды приводится соответствующая ей истинная (молекулярная) формула:
| Название | Истинная (молекулярная) формула |
|---|---|
| Легкая (обычная) вода (основной компонент природной воды) | H2O |
| Тяжёлая вода (дейтериевая) | D2O |
| T2O | |
| Дейтерий-протиевая вода | DHO |
| Тритий-протиевая вода | THO |
| Тритий-дейтериевая вода | TDO |
Коэффициент востребованности 28
химическая формула, почему не отличается от воды, строение молекулы, какие формулы используются в химии для расчетов, связанных с водяным паром?
Содержание
- Химическая формула
- Почему не отличается от воды?
- Строение молекулы
- Какие используются формулы для расчетов, связанных с водяным паром?
- Заключение
Химическая формула
Химическая формула водяного пара не отличается от формулы воды h3O.
Она состоит из 2 атомов водорода и одного атома кислорода, которые между собой соединены при помощи ковалентных связей и образуют равносторонний треугольник.
При этом молекула пара представляет собой одиночную молекулу. В воде эти молекулы образуют целую структуру из связанных между собой частиц.
Почему не отличается от воды?
Отсутствие отличия заключается в исходной формуле. Молекула воды не теряет ковалентных связей при фазовом переходе.
Теряется только водородная связь между молекулами, что определяет скорость парообразования. Также остается неизменной и молярная масса воды, которая составляет 18 г/моль.
Строение молекулы
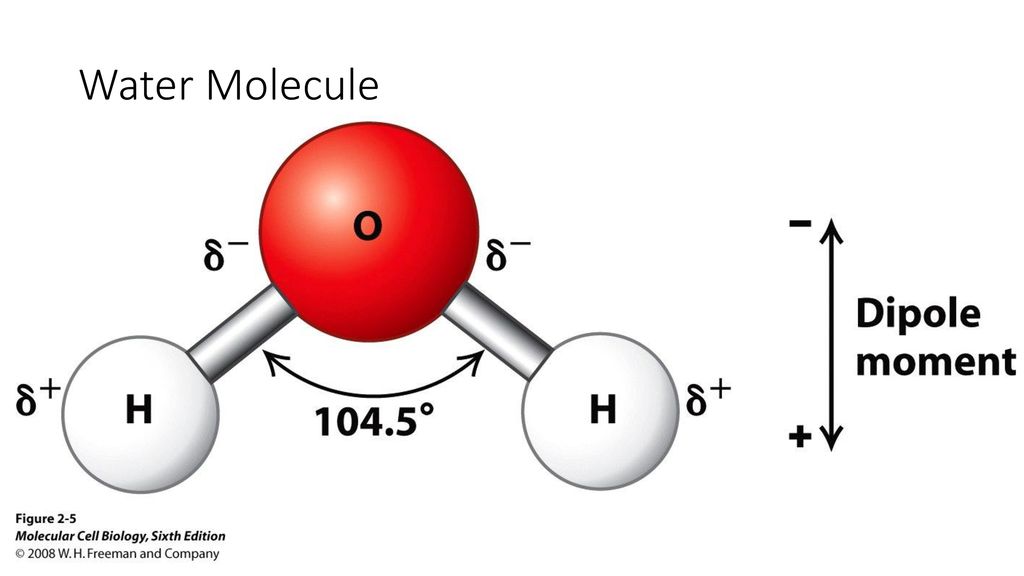
Молекула водяного пара состоит из одного атома кислорода и двух атомов водорода. В классическом написании формула выглядит как h3O, но наглядно ее можно представить в виде H-O-H.
Молекуле воды свойственно:
- Атомы водорода и кислорода образуют равнобедренный треугольник.

- Атомы связаны ковалентной связью.
- Угол связи составляет 104,31 градуса.
- Расстояние между О-Н 0,99°А, что примерно равно 10-8 см.
- Расстояние между Н-Н составляет 1,5°А.
- За счет плотного расположения всех атомов, относительно друг друга, молекула представляет собой сферу, радиусом 1,38 °А.
- Молекулы воды между собой соединены водородной связью. Именно она разрывается при переходе из жидкого состояния в газообразное с последующим вытеснением молекул воды с поверхности жидкости.
Именно тесное соединение между атомами водорода и кислорода определяет температуру кипения и парообразования, которые составляют 100 градусов при атмосферном давлении 101 кПа. При этих параметрах воздействия разрывается связь между молекулами, так как они получают достаточную кинетическую энергию для разрыва связи и выхода с поверхности.
Какие используются формулы для расчетов, связанных с водяным паром?
Для расчета различных параметров водяного пара используются следующие формулы:
Удельная теплота парообразования при обращении воды в пар: L=Q/m или Q=Lm, где:
- Q – количество теплоты;
- L – удельная теплота парообразования;
- M — масса.

Энтальпия пара: h=u+pv, где:
- H – энтальпия;
- U – внутренняя энергия;
- P — давление;
- V — объем.
Плотность: P=PM/Rt, где:
- p — плотность;
- P – плотность насыщенного пара;
- M – молярная масса;
- R – газовая постоянная;
- T — температура.
Влажность: φ= p/po*100%, где:
- φ — влажность;
- p-po — абсолютное и относительное давление;
- 100% — влажность.
Давление насыщенного пара: po=nkt, где:
- po – давление;
- n – концентрация молекул;
- K – постоянная Больцмана;
- T – температура.
Абсолютная влажность: P=m/v=Mp/Rt, где:
- P – абсолютная влажность;
- m – молярная масса;
- V – объем;
- M – масса;
- P – давление;
- R – газовая постоянная;
- T – температура.
Это основные формулы для расчета различных параметров водяного пара, которые используются в физике, промышленных и инженерных расчетах.
Заключение
Вода – это структура, состоящая из молекул, связанных между собой водородной связью. При нагревании, водородная связь разрывается, и молекулы воды покидают структуру. При этом собственная структура молекулы не разрушается.
При конденсации пара, отдельные молекулы воды снова выстраивают структуру. Иными словами, при парообразовании меняется только структура воды, а не ее отдельные молекулы.
А какова Ваша оценка данной статье?
Загрузка…
Определениев кембриджском словаре английского языка
Переводы h3O
на китайский (традиционный)
水的分子式,水…
Подробнее
на китайском (упрощенном)
水的分子式,水…
Узнать больше
Нужен переводчик?
Получите быстрый бесплатный перевод!
Как произносится h3O ?
Обзор
гироскоп
извилина
Ч, ч
водородная бомба
Н3О
га
ха-ха
ха’порт
хаар
Проверьте свой словарный запас с помощью наших веселых викторин по картинкам
- {{randomImageQuizHook.

- {{randomImageQuizHook.copyright2}}
Авторы изображений
Пройди тест сейчас
Слово дня
появляться
Великобритания
Ваш браузер не поддерживает аудио HTML5
/ ɪˈmɜːdʒ /
НАС
/ ɪˈmɝːdʒ /
появляться, выходя из чего-либо или из-за чего-либо
Об этом
Блог
Высматривать! К слову об осторожности.
Подробнее
зеленая комета
Больше новых слов
добавлено в список
Наверх
Содержание
EnglishПереводы
Свойства материи | manoa.hawaii.edu/ExploringOurFluidEarth
Title
Properties of Matter
NGSS Performance Expectations
MS-PS1-2 Анализ и интерпретация данных о свойствах веществ до и после взаимодействия веществ, чтобы определить, произошла ли химическая реакция .
Тело
Вода повсюду
Люди ежедневно используют воду для обезвоживания, очистки себя и одежды и приготовления пищи. Поскольку люди так часто используют воду, легко забыть, насколько она важна и уникальна.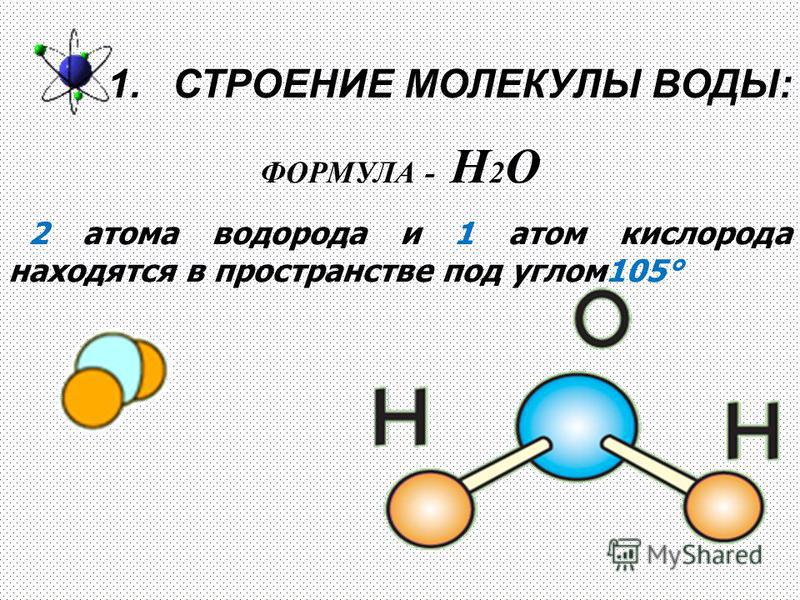 Вода настолько распространена, что является отличным примером для изучения свойств материи.
Вода настолько распространена, что является отличным примером для изучения свойств материи.
Определение воды
Изображение
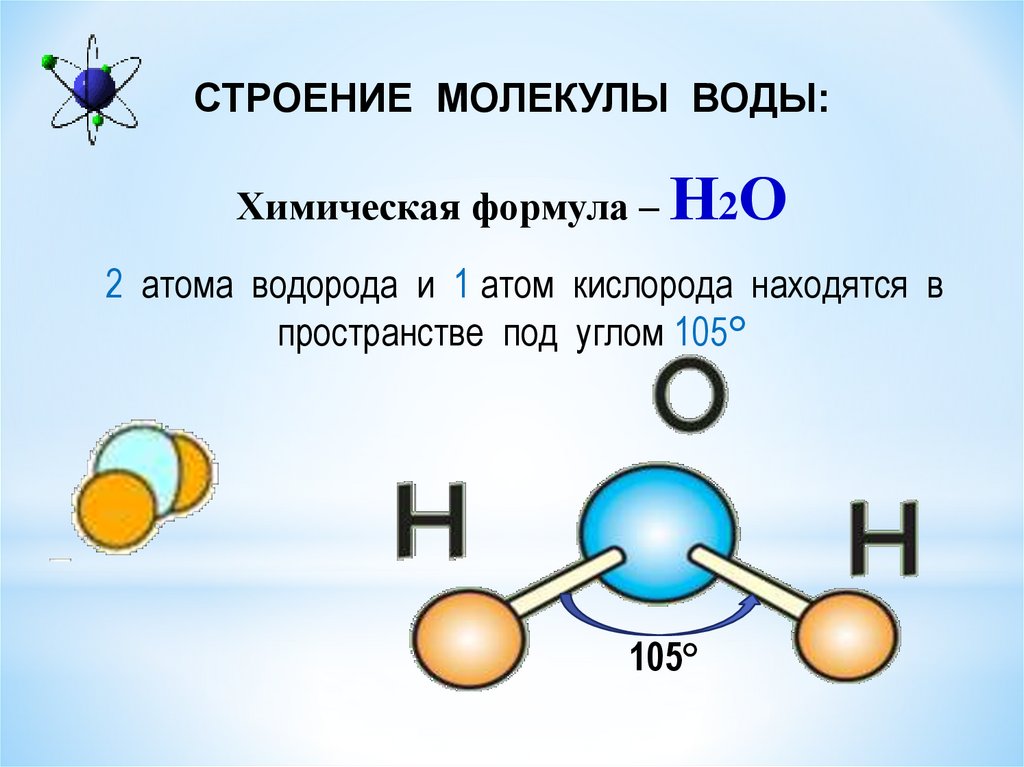
Рис. 1.4. Схема молекулы воды. Круги представляют собой атомы элементов.
Изображение Байрона Иноуэ
Вода представляет собой соединение, состоящее из атомов двух элементов, водорода и кислорода, связанных вместе. Молекула воды состоит из двух атомов водорода (Н) и одного атома кислорода (О). Эта взаимосвязь выражается в химической формуле воды H
Практика науки
Странная наука
Деятельность
Вода — самое распространенное вещество на Земле, необходимое для жизни.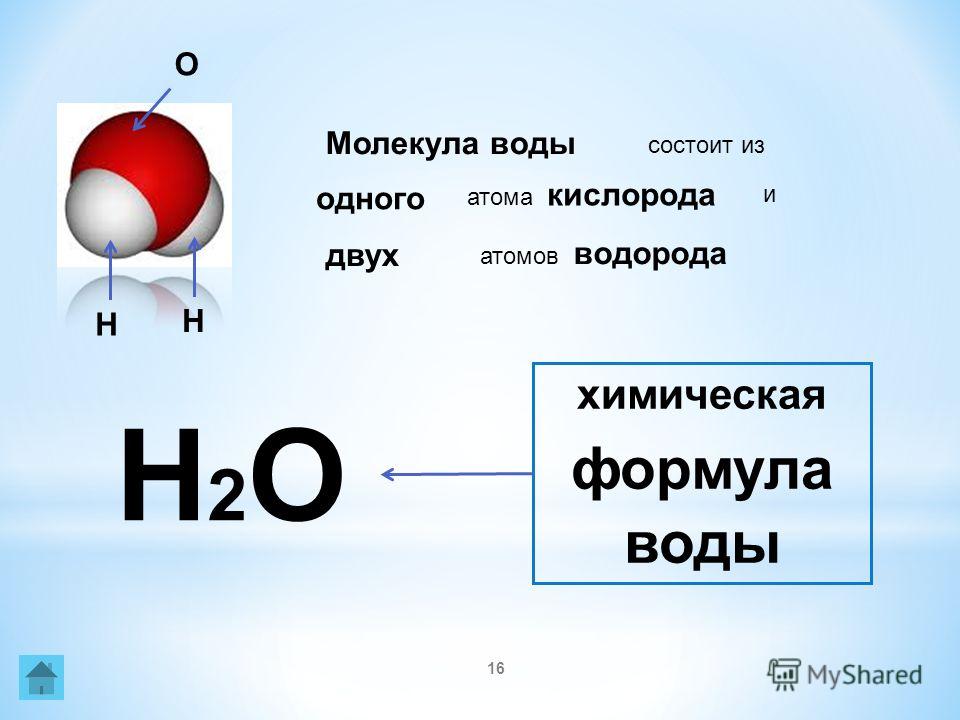 Определите, где находится вода, проверив ее наличие.
Определите, где находится вода, проверив ее наличие.
Практика науки
Странная наука
Состояния материи
Существует четыре основных состояния материи: твердое, жидкое, газообразное и плазменное. На Земле наиболее распространены твердые, жидкие и газообразные состояния вещества. Вода является не только самым распространенным веществом на Земле, но и единственным веществом, которое обычно встречается в твердом, жидком и газообразном состояниях в пределах нормального диапазона земных температур. Это делает воду хорошей моделью для обсуждения твердого, жидкого и газообразного состояний материи.
На Земле вода существует в трех состояниях:
- Как жидкость , вода течет и принимает форму океана, озер и речных бассейнов. В жидкости молекулы воды расположены относительно близко друг к другу и могут свободно перемещаться друг вокруг друга (рис. 1.5 А).
Как твердое тело , вода принимает определенную форму, такую как снежинка, кубик льда или ледник.
 В твердом теле молекулы воды расположены относительно близко друг к другу, но имеют различную форму. Вода — уникальное вещество, потому что ее молекулы
В твердом теле молекулы воды расположены относительно близко друг к другу, но имеют различную форму. Вода — уникальное вещество, потому что ее молекулына самом деле дальше друг от друга в твердом состоянии, чем в жидком состоянии. В большинстве других веществ молекулы твердого тела расположены ближе друг к другу, чем молекулы жидкости (рис. 1.5 Б).
- В качестве газа водяной пар может свободно перемещаться в атмосфере на большие расстояния. В газе молекулы воды относительно далеко друг от друга и могут свободно двигаться с высокой скоростью. Трудно сфотографировать воду в газообразном состоянии. Многие люди думают, что пар или облака — это водяной пар, но на самом деле это крошечные капельки жидкой воды, а не газообразной воды.
Рис. 1.5 ( A ) Вода в жидком состоянии.
Изображение Алиссы Гундерсен
Рис.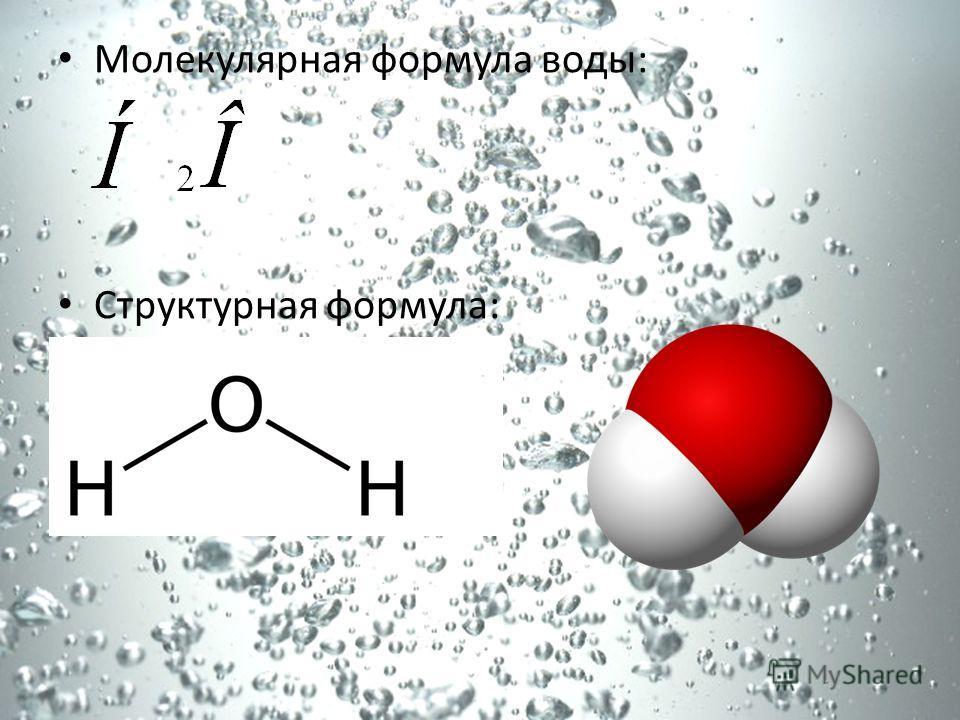 1.5 ( B ) Вода в твердом состоянии.
1.5 ( B ) Вода в твердом состоянии.
Изображение Алиссы Гундерсен
Плазма представляет собой газ, обладающий электрическим зарядом. Плазма очень распространена во Вселенной, из нее состоят звезды и пространство между планетами в нашей Солнечной системе. Плазму также можно найти на Земле в таких вещах, как флуоресцентные лампы и молнии. Однако плазма не является состоянием материи, которое является обычным или постоянным в естественном мире на Земле.
Физические и химические изменения
 В каждом из состояний химическая формула воды H 2 О, остается прежним. Другими примерами физических изменений являются фильтрация, резка, плавление и окрашивание поверхности чего-либо краской, мелками или фломастерами. Примеры физического изменения показаны на рис. 1.6 А и Б.
В каждом из состояний химическая формула воды H 2 О, остается прежним. Другими примерами физических изменений являются фильтрация, резка, плавление и окрашивание поверхности чего-либо краской, мелками или фломастерами. Примеры физического изменения показаны на рис. 1.6 А и Б.Рис. 1.6. ( B ) Удаление помидоров из салата является примером физического изменения.
Изображение Канесы Серафин
Рис. 1.6. ( A ) Окраска является примером физического изменения.
Изображение Алиссы Гундерсен
При химическом изменении конечный продукт химически отличается от исходного вещества, и изменяется химическая формула. Когда растение сахарного тростника биологически преобразует углекислый газ (CO 2 ), воду (H 2 O) и газообразный кислород (O 2 ) в глюкозу (C 6 H 12 O 6 ), это химическое изменение.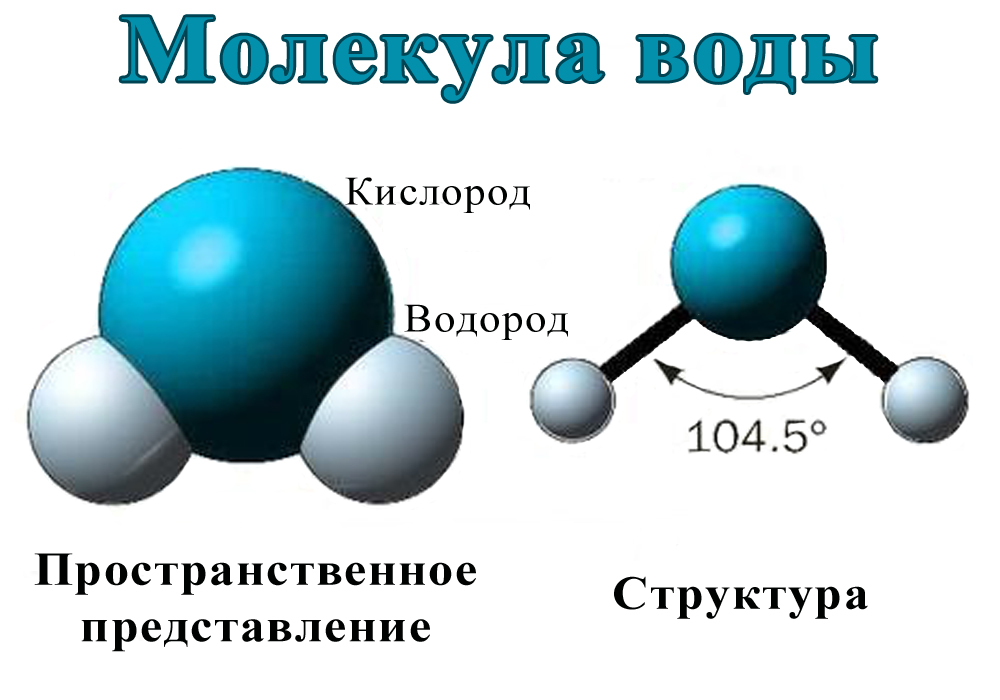 Поскольку химические изменения производят новые вещества, их нельзя легко обратить вспять. Глюкоза может быть снова расщеплена на компоненты только в результате другого химического превращения, такого как сжигание. Другими распространенными типами химических изменений являются приготовление пищи, ржавление и созревание. Примеры химических изменений показаны на рис. 1.6 С и D.
Поскольку химические изменения производят новые вещества, их нельзя легко обратить вспять. Глюкоза может быть снова расщеплена на компоненты только в результате другого химического превращения, такого как сжигание. Другими распространенными типами химических изменений являются приготовление пищи, ржавление и созревание. Примеры химических изменений показаны на рис. 1.6 С и D.
Рис. 1.6. ( D ) Ржавление является примером химического изменения.
Изображение Алиссы Гундерсен
Рис. 1.6. ( C ) Производство сахара из сахарного тростника является примером химического изменения.
Изображение предоставлено Мариордо
Химические изменения часто сопровождаются физическими изменениями, такими как изменение цвета. Это может затруднить различие между физическим изменением, которое является чисто физическим, и физическим изменением, вызванным химическим изменением. При чисто физическом изменении субстанции после изменения остаются теми же субстанциями, которыми они были до изменения. При раскрашивании листа бумаги карандашом мелок был нанесен поверх бумаги, но субстанциями по-прежнему являются воск для карандашей и бумага. Вещества можно разделить, соскребая воск с бумаги. При химическом изменении, таком как ржавление, вещества после изменения химически отличаются от веществ, существовавших до изменения. Когда кусок металла ржавеет, его цвет меняется, потому что железо химически соединяется с кислородом воздуха, образуя новое вещество — ржавчину. Не существует физического способа разделить ржавчину обратно на железо и газообразный кислород.
Это может затруднить различие между физическим изменением, которое является чисто физическим, и физическим изменением, вызванным химическим изменением. При чисто физическом изменении субстанции после изменения остаются теми же субстанциями, которыми они были до изменения. При раскрашивании листа бумаги карандашом мелок был нанесен поверх бумаги, но субстанциями по-прежнему являются воск для карандашей и бумага. Вещества можно разделить, соскребая воск с бумаги. При химическом изменении, таком как ржавление, вещества после изменения химически отличаются от веществ, существовавших до изменения. Когда кусок металла ржавеет, его цвет меняется, потому что железо химически соединяется с кислородом воздуха, образуя новое вещество — ржавчину. Не существует физического способа разделить ржавчину обратно на железо и газообразный кислород.
Понятия физических и химических изменений можно использовать для понимания различий между смесями и соединениями. В смеси два или более вещества, элемента или соединения физически соединяются.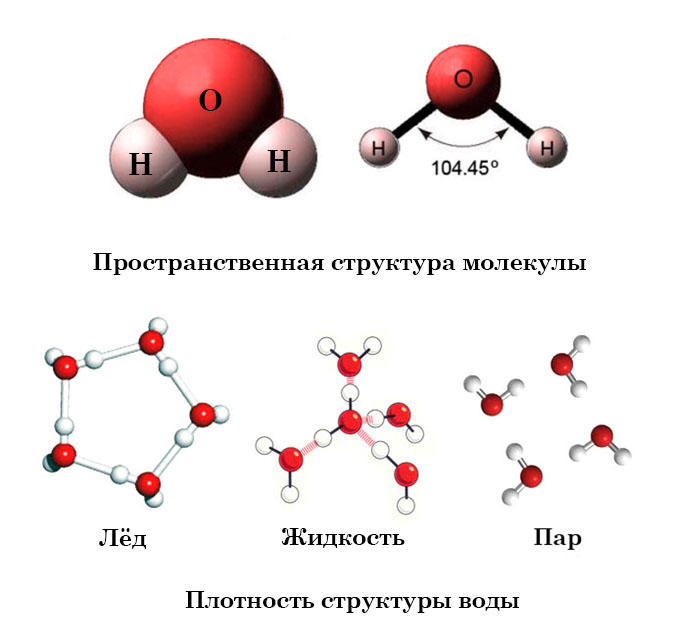 Свойства смеси обычно отражают свойства отдельных веществ. Например, если смешать соль с водой, получится соленая вода. Много раз смесь можно разделить на отдельные вещества путем физического превращения. Например, смесь помидоров, листьев салата, сухариков, моркови и изюма в салате можно разделить на отдельные составляющие.
Свойства смеси обычно отражают свойства отдельных веществ. Например, если смешать соль с водой, получится соленая вода. Много раз смесь можно разделить на отдельные вещества путем физического превращения. Например, смесь помидоров, листьев салата, сухариков, моркови и изюма в салате можно разделить на отдельные составляющие.
Рис. 1.7. ( А ) глюкоза
Изображение взято из Википедии, предоставлено Умберто Сальвагнином
Рис. 1.7. ( B ) уголь
Изображение взято из Википедии, предоставлено Нострификатором
Рис. 1.7. ( К ) графит
Изображение Джордана Вана
Рис. 1.7. ( D ) алмаз
1.7. ( D ) алмаз
Изображение Алиссы Гундерсен
В соединении два или более элемента соединены химически. Свойства соединения часто сильно отличаются от свойств отдельных элементов. Например, сахар в злаках, скорее всего, представляет собой глюкозу, C 6 Н 12 О 6 . Глюкоза — сладкий белый кристалл (рис. 1.7 А), сильно отличающийся от углерода, водорода или кислорода, составляющих его элементов. Углерод (C) существует в природе либо в виде хрупкого черного твердого вещества (уголь), либо в виде мягкого серого твердого вещества (графит), либо в виде твердого прозрачного твердого вещества (алмаз), как показано на рис. 1.7 B, C и D. Водород (H 2 ) и кислород (O 2 ) существуют в природе в виде бесцветных газов без запаха. Невозможно разделить соединение физическими методами. Соединения могут быть разложены на составляющие их элементы только в процессе химического превращения.



 В твердом теле молекулы воды расположены относительно близко друг к другу, но имеют различную форму. Вода — уникальное вещество, потому что ее молекулы
В твердом теле молекулы воды расположены относительно близко друг к другу, но имеют различную форму. Вода — уникальное вещество, потому что ее молекулы