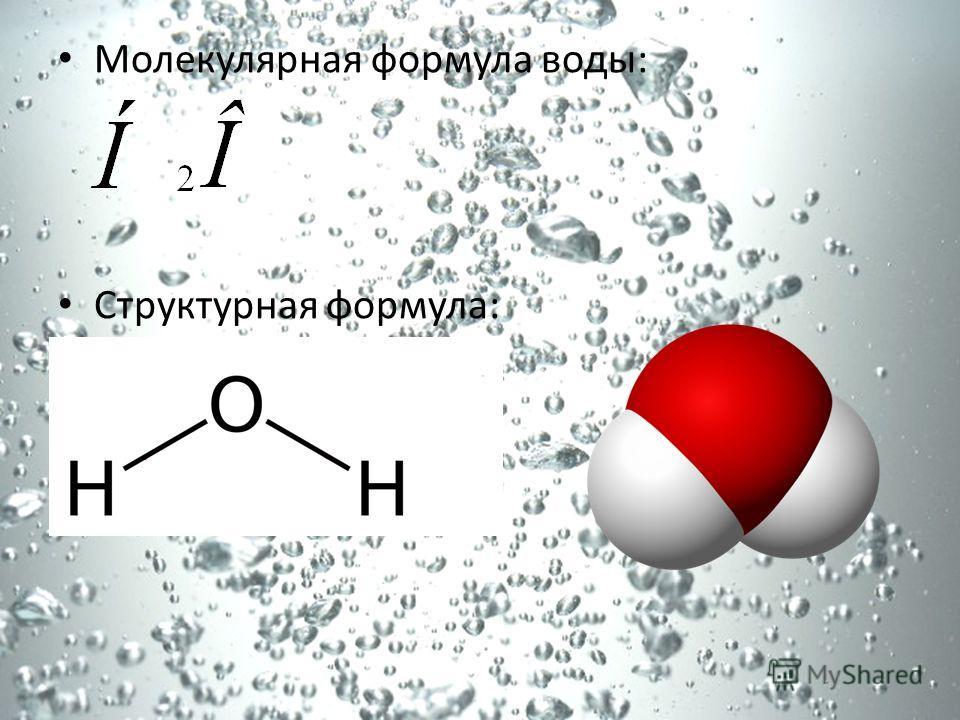
Вода — что это?
Вообще гораздо правильнее было бы называть нашу планету не Земля, а Вода. Почти 75% ее поверхности занято океанами и морями, 20% покрыто снегом и льдом. Вода морей и океанов днём нагревается, поглощая огромное количество солнечного тепла, а остывая ночью, отдает его атмосфере. От космического холода атмосферу защищает содержащийся в ней пар. Всем известен тот факт, что в пустынях, особенно крупных, где воздух очень сухой перепад между дневной и ночной температурами может достигать 50° С. Таким образом, от воды целиком и полностью зависит климат планеты, а значит и возможность жизни на ней.
Воду (Н2О) можно рассматривать и как оксид водорода, и как гидрид кислорода. Но её свойства не похожи ни на свойства оксидов, ни на свойства гидридов. Все дело в том, что молекула воды построена в виде тупоугольного треугольника: угол между двумя связями кислород-водород равен около 104°. Но поскольку оба водородных атома расположены по одну сторону от атома кислорода, электрические заряды в ней «разбегаются в стороны».
Вода постоянно движется в гигантском круговороте — газообразная, твердая, жидкая, пресная и соленая, свободная и связанная, кроме того, во время вулканических извержений вода образуется непосредственно из водорода и кислорода, выделяющихся из магмы. Такая вода называется «ювенильной» и выливается проливными дождями из облаков вокруг извергающегося вулкана. Ученые считают, что вся вода образовалась в свое время как продукт «дыхания» недр планеты.
Еще одно необычное свойство воды: это единственное на земле вещество, которое при переходе из твердого состояния в жидкое (плавлении) сначала сжимается, а уже потом начинает расширяться,1 грамм твердой воды (льда) занимает объем 1,0905 см³, а 1 грамм жидкой воды при температуре +1. ..+3 °С — всего 1, 0001 см³. Только на рубеже +4 °С плотность жидкой воды уменьшается. Оттого и не промерзают насквозь водоемы, а лишь покрываются ледяным покровом. При высоких давлениях обычный лед можно превратить в более тяжелые и плотные кристаллические формы. Самая плотная форма — лед-VII. Он плавится при температуре +190 °С.
..+3 °С — всего 1, 0001 см³. Только на рубеже +4 °С плотность жидкой воды уменьшается. Оттого и не промерзают насквозь водоемы, а лишь покрываются ледяным покровом. При высоких давлениях обычный лед можно превратить в более тяжелые и плотные кристаллические формы. Самая плотная форма — лед-VII. Он плавится при температуре +190 °С.
Именно из-за полярности молекул вода — главный и универсальный растворитель. Лучшего растворителя, чем вода, в мире просто не существует. Она растворяет в себе если не все, то хотя бы малую часть того, с чем входит в соприкосновение — горные породы, металлы, продукты человеческой жизнедеятельности… Проливаясь дождем она поглощает находящиеся в воздухе газы, частицы копоти и пыли, превращаясь порой в слабоконцентрированные кислоты. Например, серную Н2SО4 (в результате растворения газов, образующихся при сжигании угля в крупных городах) и угольную Н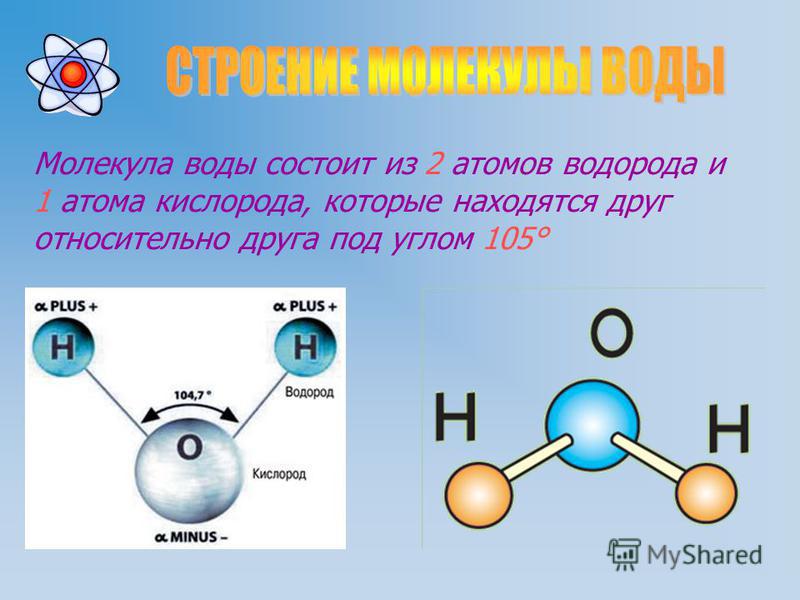 Свойства растворять в себе вещества позволяют воде выполнять свои очищающие функции и после того, как она достигает поверхности земли. Определенное количество воды, выпадающей в качестве осадков, превращается в так называемый смыв. В процессе смыва вода увлекает своим потоком твердые минеральные вещества, глину, мелкозем, ил, а также продукты жизнедеятельности животных и растений, бактерии и споры различных микроорганизмов.
Свойства растворять в себе вещества позволяют воде выполнять свои очищающие функции и после того, как она достигает поверхности земли. Определенное количество воды, выпадающей в качестве осадков, превращается в так называемый смыв. В процессе смыва вода увлекает своим потоком твердые минеральные вещества, глину, мелкозем, ил, а также продукты жизнедеятельности животных и растений, бактерии и споры различных микроорганизмов.
Большая часть выпавших осадков быстро возвращается в атмосферу. Только около 30% просачивается в землю или становится частью океанов, рек и озер. Просачиваясь в подземные слои, вода отфильтровывается от глины, ила, разлагающейся материи животного и растительного происхождения, обедняется кислородом, но обогащается минеральными веществами.
Воды на нашей земле очень много, но 97,5% всей воды — это соленые воды морей и океанов, а для промышленности, хозяйственного потребления и питья нужна пресная. Около 75% пресной воды заморожено в горных ледниках и полярных «шапках», еще более 24% находится под землей в виде грунтовых вод. Так что на долю наиболее доступных и дешевых источников воды — пресных рек и водоемов приходится менее 1% мировых запасов воды. Потребности человечества уже сегодня сравнимы с этой цифрой. Те объемы воды, что природа опресняет и очищает самостоятельно, мы успеваем загрязнить продуктами своей жизнедеятельности, поэтому чистой пресной воды на Земле очень мало.
Так что на долю наиболее доступных и дешевых источников воды — пресных рек и водоемов приходится менее 1% мировых запасов воды. Потребности человечества уже сегодня сравнимы с этой цифрой. Те объемы воды, что природа опресняет и очищает самостоятельно, мы успеваем загрязнить продуктами своей жизнедеятельности, поэтому чистой пресной воды на Земле очень мало.
Формула воды — интернет энциклопедия для студентов
ОПРЕДЕЛЕНИЕ
Вода (оксид водорода) представляет собой бинарное неорганическое соединение.
Химическая и структурная формула воды
Структурная формула:
Химическая и структурная формула воды
Молярная масса: 18,01528 г / моль.
Альтернативные названия: оксид водорода, гидроокись водорода, гидроксикислота, двуокись водорода, оксидан, оксид дигидромона.
Атом кислорода в молекуле воды находится в состоянии sp3-гибридизации, поскольку в образовании гибридных орбиталей участвует не только валентные электроны, но и одиночные электронные пары.
Из-за большой разницы в электроотрицательности кислорода и водорода связи в молекуле сильно поляризованы, а электронная плотность сдвигается к кислороду. Молекула воды имеет большой дипольный момент, поскольку полярные связи асимметричны.
Образование водородных связей между молекулами воды связано с сильной поляризацией O-H-связи. Каждая молекула воды может образовывать до четырех водородных связей — два из них образуют атом кислорода, а еще два — атомы водорода:
Образование водородных связей определяет более высокую температуру кипения, вязкость и поверхностное натяжение воды по сравнению с гидридами аналогов (селен и серу теллура).
Изотопная модификация воды
В зависимости от типа изотопов водорода, которые составляют молекулу, выделяются следующие изотопные модификации воды:
\(\ \begin{array}{|c|c|} \hline Название&Формула\\ \hline Легкая вода (основной компонент природной воды)& \mathrm{H}_{2} \mathrm{O}\\ \hline Тяжёлая вода (дейтериевая)& \mathrm{D}_{2} \mathrm{O}\\ \hline Сверхтяжёлая вода (тритиевая)& \mathrm{T}_{2} \mathrm{O}\\ \hline Тритий-дейтериевая вода&\mathrm{TDO}\\ \hline Тритий-протиевая вода&\mathrm{THO}\\ \hline Дейтерий-протиевая вода&\mathrm{DHO}\\ \hline \end{array} \)
Учитывая тот факт, что кислород имеет три стабильных изотопа \(\
^{16} \mathrm{O},^{17} \mathrm{O} и n^{18} \mathrm{O}
\) , можно сделать 18 формул молекул воды, отличающихся изотопным составом. Как правило, природная вода содержит все эти типы молекул.
Как правило, природная вода содержит все эти типы молекул.
Примеры решения проблем по «водной формуле»
ПРИМЕР 1
9 литров воды выливали в радиатор автомобиля и добавляли 2 литра метилового спирта с плотностью 0,8 г / мл. При какой минимальной температуре вы можете оставить автомобиль на открытом воздухе, не опасаясь, что вода в радиаторе замерзнет (криоскопическая постоянная воды составляет 1,86 K • кг / моль)?
Согласно закону Рауля понижение температуры кристаллизации разбавленных растворов неэлектролитов равно:
\(\
\Delta t_{c r}=K_{c r} \cdot C_{m}=\frac{K_{c r} \cdot m_{B} \cdot 1000}{m_{A} \cdot M_{B}}
\) где: \(\
\Delta t_{c r}
\) — понижение температуры замерзания раствора; \(\
\mathrm{KCR}
\) — константа криоскопического растворителя; \(\
\mathrm{Cm}
\) — мольная концентрация раствора; \(\
\mathrm{mB}
\) — масса растворенного вещества; \(\
mA
\) — масса растворителя; МБ — это молярная масса растворенного вещества. {\circ} C
\)
{\circ} C
\)
\(\ Tzam=0-\Delta t=-10,3 \)
Автомобиль можно оставить на улице при температуре выше -10,3 ° C
ПРИМЕР 2
Сколько грамм \(\ \mathrm{Na} 2 \mathrm{SO} 4 \) • \(\ 10 \mathrm{H} 20 \) следует растворить в 250 г воды, чтобы получить раствор, содержащий 5% безводную соль?
Молярная масса \(\ \mathrm{Na} 2504 \) равна:
\(\ M\left(N a_{2} S O_{4}\right)=142 \) г / моль
Молярная кристаллическая гидратная масса:
\(\ M\left(N a_{2} S O_{4} \cdot 10 H_{2} O\right)=322 \) г / моль
Обозначим количество (моль) растворенной соли в виде х.
Тогда масса решения будет равна:
\(\ m(p-p a)=m\left(N a_{2} S O_{4} \cdot 10 H_{2} O\right)+m\left(H_{2} O\right)=x \cdot 322+250 \)
Масса безводной соли в готовом растворе будет равна:
\(\ m\left(N a_{2} S O_{4}\right)=x \cdot 142 \)
Массовая доля сульфата натрия в растворе:
\(\ \omega=\frac{m\left(N a_{2} S O_{4}\right)}{m(\mathrm{p}-\mathrm{pa})}=\frac{142 \cdot \mathrm{x}}{322 \cdot \mathrm{x}+250} \cdot 100=5 \)
Отсюда \(\ \mathbf{x} \) будет равен:
\(\ 14200 x=5 \cdot(322 x+250) \)
\(\ 12590 x=1250 \)
\(\ x=0,0993 \) моль
Масса кристаллического гидрата будет равна:
\(\
m\left(N a_{2} S O_{4} \cdot 10 H_{2} O\right)=0,0993 \cdot 322=31,97=31.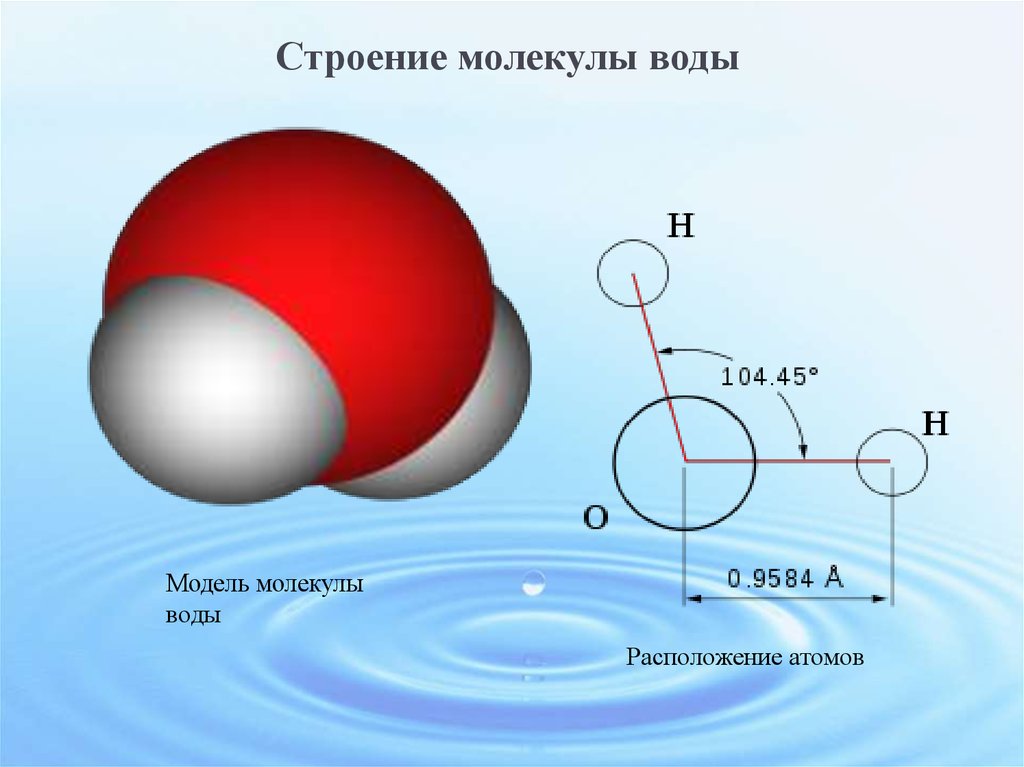 97 г.
\)
97 г.
\)
Масса \(\ \mathrm{Na}_{2} \mathrm{SO}_{4} \cdot 10 \mathrm{H}_{2} \mathrm{O} \) будет равна 31,97 г.
Физика
166
Реклама и PR
31
Педагогика
80
Психология
72
Социология
7
Астрономия
9
Биология
30
Культурология
86
Экология
8
Право и юриспруденция
36
Политология
13
Экономика
49
Финансы
9
История
16
Философия
8
Информатика
20
Право
35
Информационные технологии
6
Экономическая теория
7
Менеджент
719
Математика
338
Химия
20
Микро- и макроэкономика
1
Медицина
5
Государственное и муниципальное управление
2
География
542
Информационная безопасность
2
Аудит
11
Безопасность жизнедеятельности
3
Архитектура и строительство
1
Банковское дело
1
Рынок ценных бумаг
6
Менеджмент организации
2
Маркетинг
238
Кредит
3
Инвестиции
2
Журналистика
1
Конфликтология
15
Этика
9
Хлорирование метана Формула алканов Формула соляной кислоты Макс Боденштейн, немецкий химик
Узнать цену работы
Узнай цену
своей работы
Имя
Выбрать тип работыЧасть дипломаДипломнаяКурсоваяКонтрольнаяРешение задачРефератНаучно — исследовательскаяОтчет по практикеОтветы на билетыТест/экзамен onlineМонографияЭссеДокладКомпьютерный набор текстаКомпьютерный чертежРецензияПереводРепетиторБизнес-планКонспектыПроверка качестваЭкзамен на сайтеАспирантский рефератМагистерскаяНаучная статьяНаучный трудТехническая редакция текстаЧертеж от рукиДиаграммы, таблицыПрезентация к защитеТезисный планРечь к дипломуДоработка заказа клиентаОтзыв на дипломПубликация в ВАКПубликация в ScopusДиплом MBAПовышение оригинальностиКопирайтингДругоеПринимаю Политику конфиденциальности
Подпишись на рассылку, чтобы не пропустить информацию об акциях
Его химическая формула проста, но вода (H3O) является одним из самых поразительных веществ в известной Вселенной.
 , нюансированный, изменяющий форму состав.
, нюансированный, изменяющий форму состав.Это что-то вроде загадки: соединение, состоящее всего из двух химических элементов, один из которых является самым простым в известной вселенной. Пара атомов водорода, крепко держащаяся за один атом кислорода, создает обманчиво минималистское устройство, которое противоречит его огромной универсальности и важности.
Ценность воды как ресурса общеизвестна. Без постоянного снабжения цивилизация, какой мы ее знаем, не существовала бы.
Но как вещество — как молекула — вода ускользает от чувства удивления большинства людей. Что очень плохо, на самом деле, потому что это весьма примечательно.
Формованные и связанные
Основная молекулярная формула воды, H₂O, предполагает простую структуру из трех атомов на прямой линии. Но физические свойства трех атомов требуют другого расположения — V-образной формы с кислородом в конце. Эта нелинейная форма превращает воду в замечательную субстанцию с поразительными способностями.
Форма «V» возникает из-за расположения электронов в молекуле, которое вызывает дисбаланс электрического заряда, при этом кислородная точка «V» немного более отрицательна, чем противоположный конец возле атомов водорода. Это небольшое разделение означает, что молекулы воды поляризованы — один полюс положительный, а другой отрицательный.
Полярность электрического заряда лежит в основе удивительных свойств воды. Слегка отрицательный конец одной молекулы воды притягивает слегка положительный конец другой и наоборот, что ученые называют водородной связью.
Водородные связи между молекулами воды исключительно прочны, что придает им склонность цепляться друг за друга, что чаще всего проявляется в виде поверхностного натяжения. Например, вода в наполненном до краев сосуде выглядит выпуклой, если смотреть сбоку из-за поверхностного натяжения. А некоторые существа, такие как водомерки, могут использовать поверхностное натяжение, чтобы скользить по поверхности прудов.
Водородные связи также позволяют воде прилипать к посторонним веществам.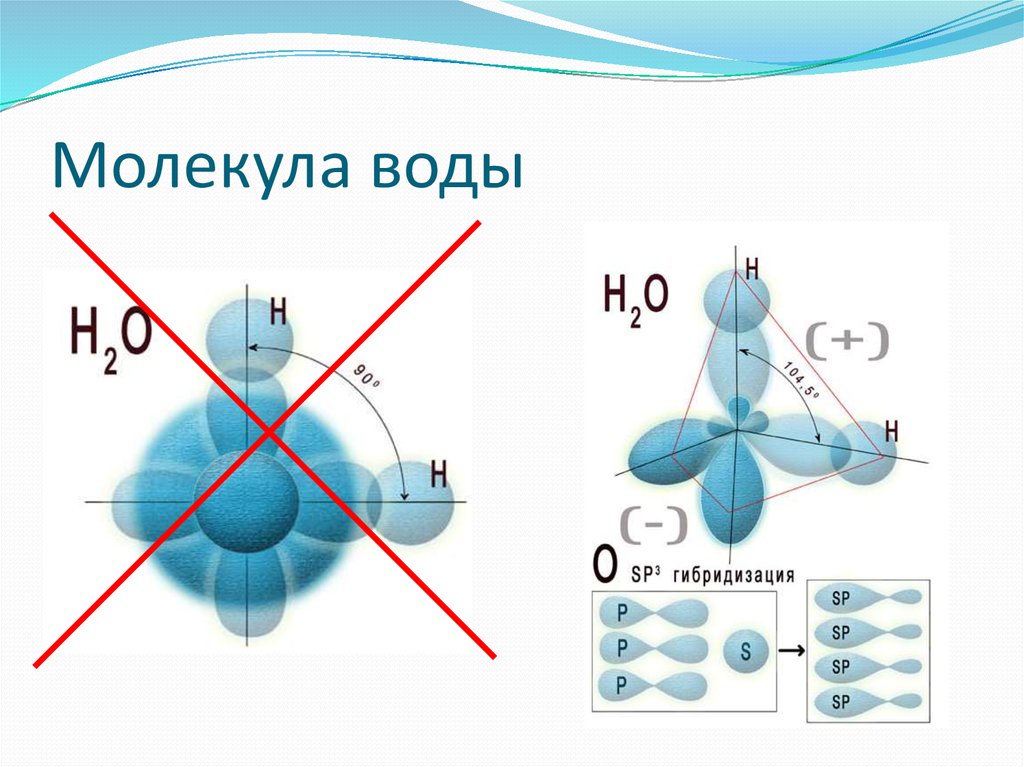 Это клейкое свойство позволяет растениям вытягивать воду из земли через корни и до кончиков листьев, игнорируя притяжение.
Это клейкое свойство позволяет растениям вытягивать воду из земли через корни и до кончиков листьев, игнорируя притяжение.
Полярная природа воды и ее форма делают ее легче в твердом состоянии, чем в жидком. Это потому, что молекулярные V образуют воздушные кристаллические структуры при замерзании, делая лед менее плотным, чем его жидкая форма. Таким образом, лед плавает по рекам и озерам, образуя щит против холодного воздуха сверху и удерживая воду внизу от замерзания, что позволяет рыбам и другим водным видам выживать в более холодных краях.
Водородные связи воды также приводят к еще одной важной характеристике — более высокой, чем ожидалось, температуре кипения, объясняет Джессика Парр, профессор (преподавание) химии. Парр получила докторскую степень по химии в USC Dornsife в 2007 году и с тех пор преподает общую химию студентам. Ее диссертационное исследование было сосредоточено на понимании того, как водородные связи реагируют на воздействие интенсивного света.
«Если бы вода не была способна образовывать такие прочные водородные связи, она кипела бы при минус 200 градусах Цельсия, — объясняет Парр, — намного ниже ее фактической точки замерзания 0 градусов Цельсия.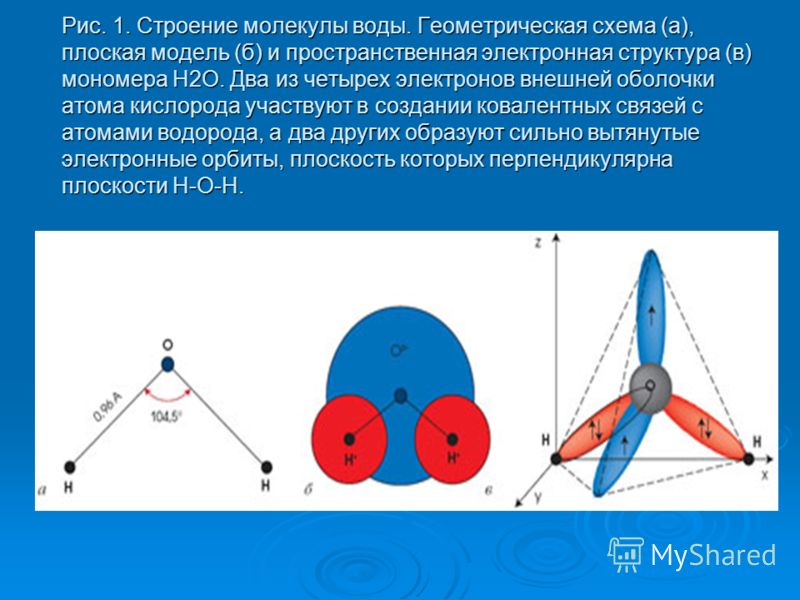 Это означает, что он будет существовать на Земле в основном в виде газа, что сделает жизнь в том виде, в каком мы ее знаем, невозможной. Вместо этого наша планета залита водой, всего около 366 миллионов миллиардов галлонов.
Это означает, что он будет существовать на Земле в основном в виде газа, что сделает жизнь в том виде, в каком мы ее знаем, невозможной. Вместо этого наша планета залита водой, всего около 366 миллионов миллиардов галлонов.
Универсальный растворитель
Полярная природа воды также делает ее исключительным растворителем, способным растворять самые разные вещества.
«Мы называем его «универсальным растворителем», потому что он может растворять не все, а очень многое», — говорит Парр. «Многие другие молекулы разборчивы в том, с чем они взаимодействуют и как они работают вместе, но вода будет взаимодействовать практически со всем».
Например, его положительные и отрицательные центры притягивают и легко разводят заряженные атомы, называемые ионами, из которых состоят такие соли, как хлорид натрия, обычно используемый в кулинарии. Положительно заряженные атомы натрия и отрицательно заряженные хлориды находят удобный дом среди поляризованных молекул воды.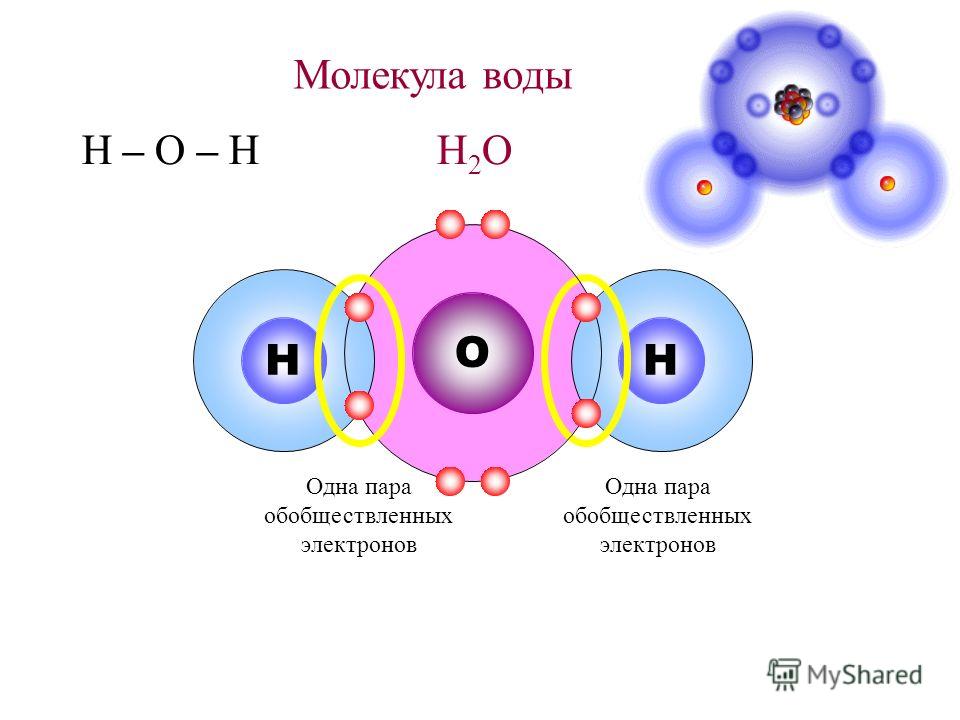
Но вода также может растворять вещества, не состоящие из ионов, например сахара. Однако вместо того, чтобы разделять отдельные атомы молекулы сахара, молекулы воды прокладывают себе путь между каждой молекулой сахара, находя слабозаряженные части для водородной связи. Это ослабляет связи между молекулами сахара, отталкивая их друг от друга и в конечном итоге превращая в раствор.
«Пока присутствует один атом, который заставляет другую молекулу взаимодействовать с водой, вода будет это делать», — говорит Парр.
Становится странно
Вода не всегда ведет себя так, как ожидалось. Хотя он чаще всего переходит из твердого состояния (льда) в жидкое, а затем в газообразное (пар или пар) и наоборот, когда его температура поднимается и падает, он может совершить прыжок прямо из льда в пар при правильных условиях.
«Если вы когда-нибудь замечали, что ваши кубики льда со временем становятся меньше, то это потому, что они сублимируются в морозильной камере — лед сразу превращается в газ», — объясняет Парр. Эта сублимация происходит из-за низкой влажности внутри морозильной камеры, что позволяет нескольким молекулам воды выходить из льда в воздух без предварительного таяния.
Эта сублимация происходит из-за низкой влажности внутри морозильной камеры, что позволяет нескольким молекулам воды выходить из льда в воздух без предварительного таяния.
В обратном процессе, называемом отложением, газообразная вода внезапно замерзает, так и не превратившись в жидкость. Так образуется снег. И когда условия подходящие, снег может пропустить стадию таяния и сублимировать обратно в атмосферу, что является особой проблемой для подверженных засухе районов, таких как Калифорния, которые полагаются на таяние снежного покрова в качестве источника воды.
Но вода может быть еще более странной.
«Лед имеет множество различных кристаллических форм, но он также может существовать в форме, напоминающей стекло — аморфное твердое вещество, которое находится где-то между жидкостью и твердым телом и все еще может течь», — говорит Парр. По словам Парра, когда молекулы воды сливаются при очень низких температурах и давлениях — представьте себе космическое пространство — образующийся лед также может вести себя как стекло.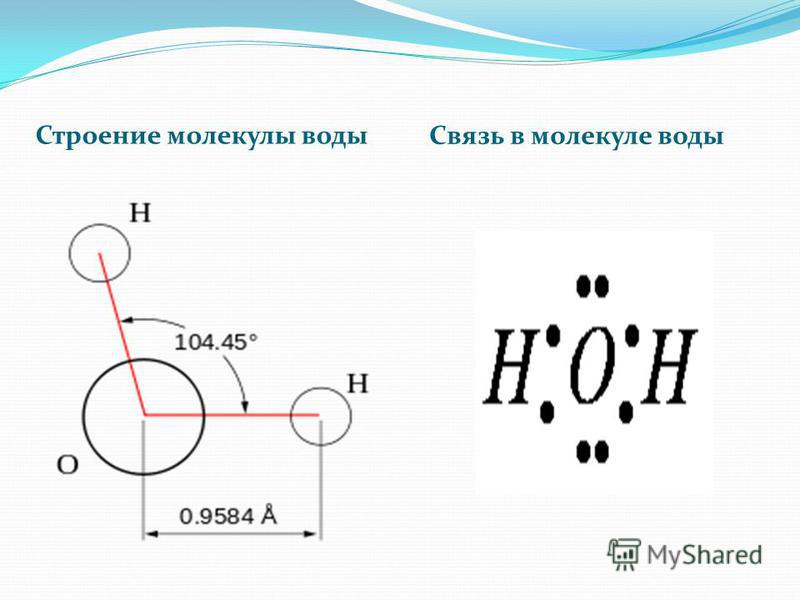 Ученые подозревают, что это может быть одна из самых распространенных форм воды во Вселенной.
Ученые подозревают, что это может быть одна из самых распространенных форм воды во Вселенной.
Тайны и чудеса продолжаются
Несмотря на широкое распространение во Вселенной и на Земле, а также на давнее знакомство людей с водой, вода продолжает удивлять.
Ученые недавно обнаружили форму под названием «суперионный лед». Существуя при чрезвычайно высоком давлении, например, в ядре планет, он, по-видимому, играет роль в поддержании магнитных полей Земли.
И хотя вода в чистом виде не является электрическим проводником, она ведет себя неожиданно при воздействии электрического поля. Александр Бендерский из USC Dornsife, адъюнкт-профессор химии, и Стивен Кронин из инженерной школы USC Viterbi недавно обнаружили, что молекулы воды вблизи электрода выстраиваются иначе, чем те, что дальше.
«Мы смогли увидеть, как молекулы взаимодействуют с электрическим полем так, как никто раньше не понимал», — сказал Бендерский. Открытие может изменить то, как химики контролируют реакции, в том числе процессы изготовления лекарств и очистки воды для питья.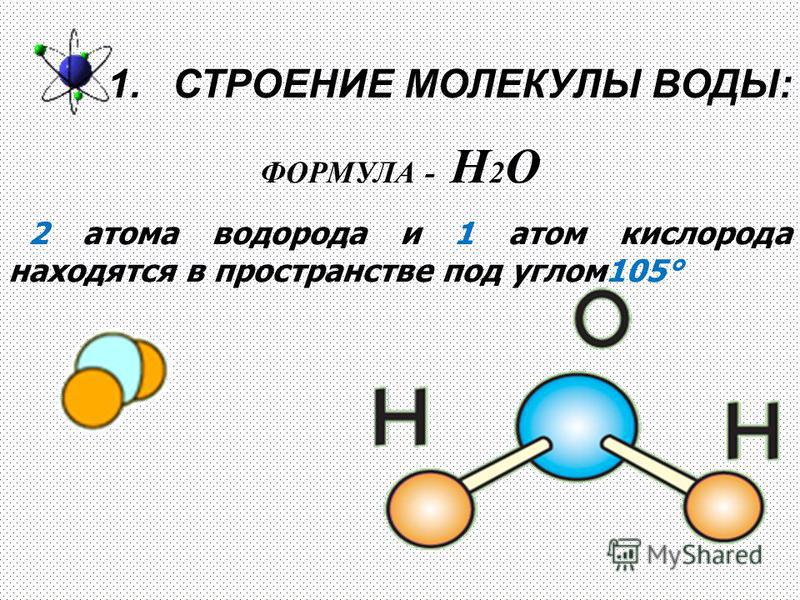
По мере того, как исследователи продолжают исследовать это универсальное, неожиданное вещество, потенциально раскрывая более странные свойства, вода может оказаться самой сложной простой молекулой во Вселенной.
Количество молекул воды — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 50700
- Эд Витц, Джон В. Мур, Джастин Шорб, Ксавье Прат-Ресина, Тим Вендорф и Адам Хан
- Электронная библиотека химического образования (ChemEd DL)
Согласно атомной теории, атомы являются единицами химических реакций. Формула H 2 O указывает на то, что каждая молекула этого вещества содержит один атом кислорода и два атома водорода.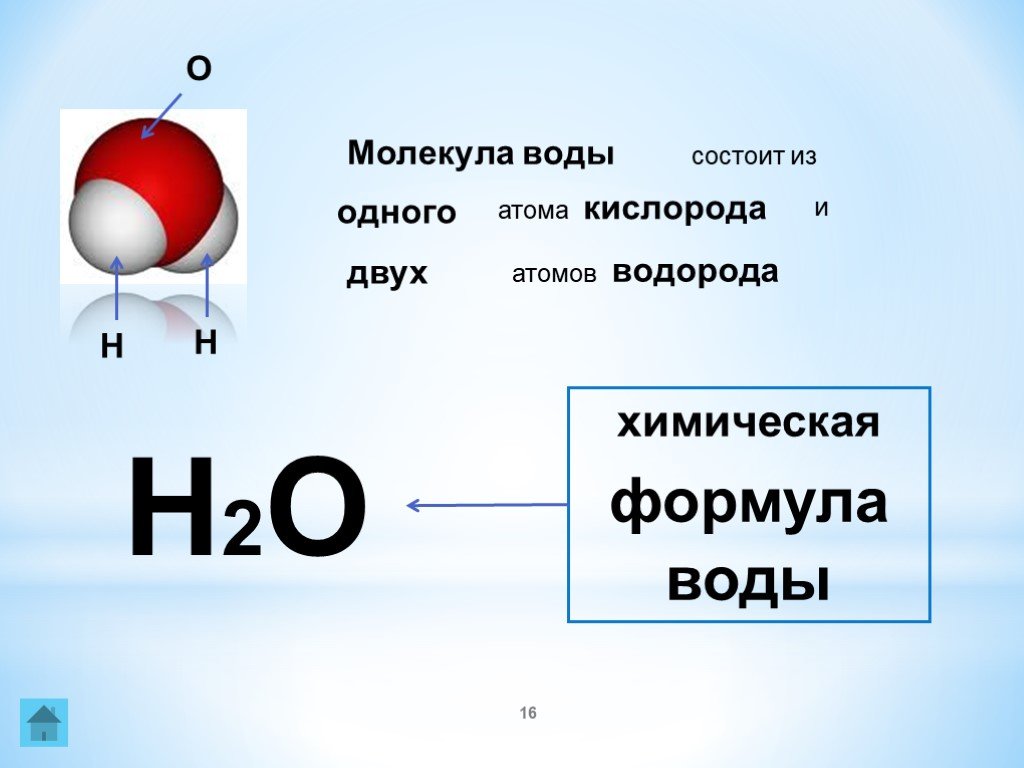 Следовательно, если мы спросим, сколько водорода требуется для получения данного количества воды, ответ будет таков: два атома водорода на каждый атом кислорода или два атома водорода на молекулу. Другими словами, то, сколько вещества у нас есть, очень важным образом зависит от того, сколько атомов или молекул присутствует.
Следовательно, если мы спросим, сколько водорода требуется для получения данного количества воды, ответ будет таков: два атома водорода на каждый атом кислорода или два атома водорода на молекулу. Другими словами, то, сколько вещества у нас есть, очень важным образом зависит от того, сколько атомов или молекул присутствует.
До сих пор мы имели дело с массовыми отношениями. Есть ли способ преобразовать массы атомов в число атомов, чтобы легко увидеть, сколько одного элемента будет реагировать с другим, просто взглянув на необходимое количество атомов?
«Сколько?» в указанном выше смысле количество присутствующих атомов или молекул не то же самое, что их количество в терминах объема или массы. Для реакции с 2,016 г водорода требуется 15,994 г кислорода. Однако в атомном смысле всего 2,016 г водорода содержат вдвое больше атомов водорода, чем атомов кислорода содержится в 15,994 г кислорода, и вдвое больше количество водорода в виде кислорода.