Электролиз воды – схема процесса, реакция
4.4
Средняя оценка: 4.4
Всего получено оценок: 225.
4.4
Средняя оценка: 4.4
Всего получено оценок: 225.
Процесс электролиза – это окислительно-восстановительная реакция, возможная только под действием электричества. Электролиз протекает в расплавах и растворах. В лабораториях для получения чистых газов – водорода и кислорода – проводят электролиз воды.
Что такое электролиз
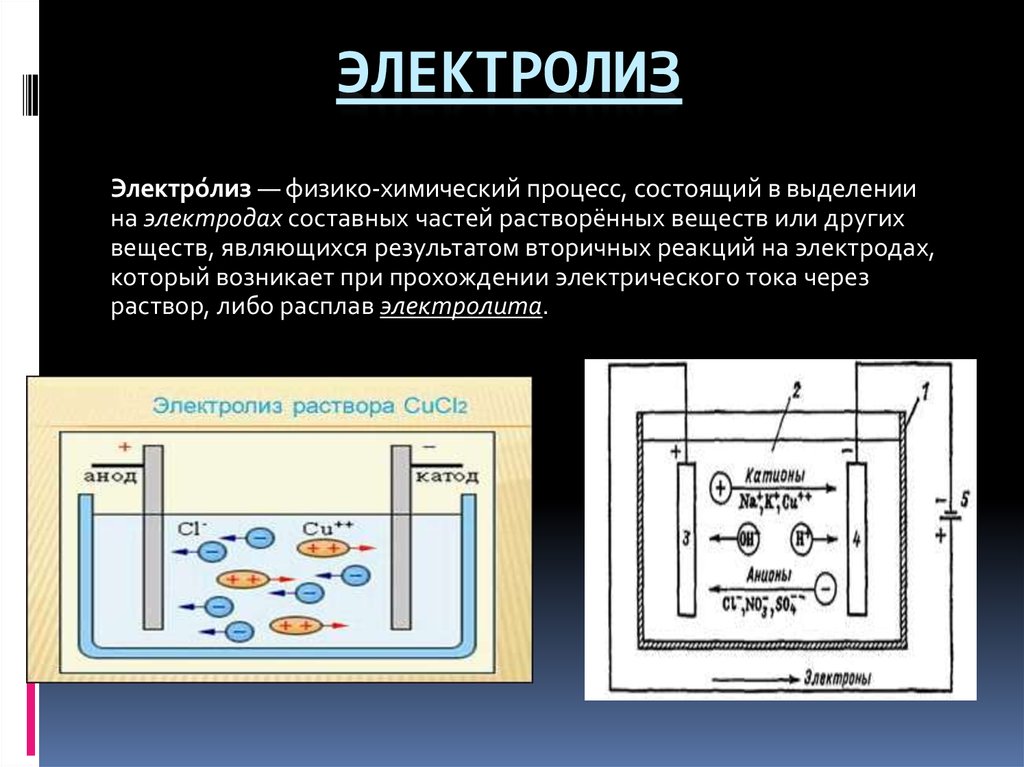
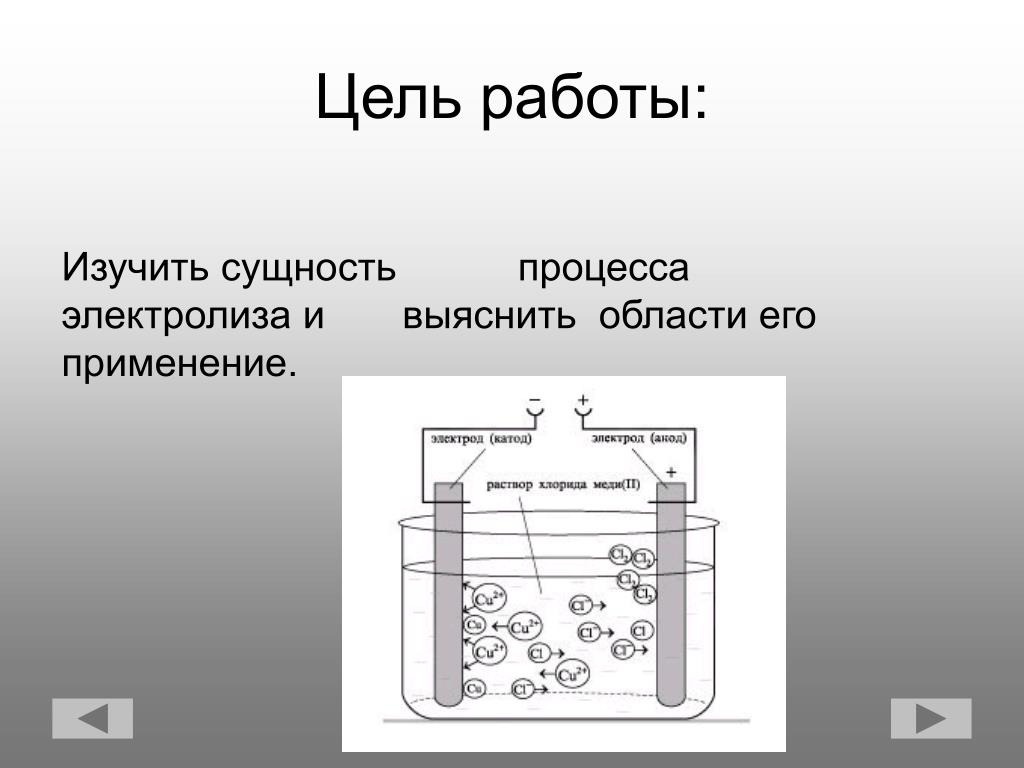
Для осуществления процесса электролиза в раствор или в расплав помещают два электрода, подключённых к противоположным полюсам источника тока. В качестве электродов чаще всего используется металл или графит, так как эти материалы пропускают электрический ток.
Рис. 1. Электролиты в растворе.Под действием электричества электрод, подключенный к отрицательному полюсу, становится катодом, а электрод, соединённый с положительным полюсом, превращается в анод. Катод и анод притягивают противоположные ионы: к катоду направляются положительно заряженные катионы, к аноду – отрицательно заряженные анионы.
Катод является окислителем, на нём происходит процесс восстановления катионов. На аноде протекает процесс окисления: анод восстанавливает анионы и окисляется.
Процесс электролиза можно разделить на два этапа. Сначала происходит диссоциация – распад электролита (раствора или расплава) на ионы. Затем протекают реакции на электродах.
Электролиз воды
Если пропустить через воду электрический ток, жидкость начнёт диссоциироваться на составляющие молекулу воды атомы. В результате процесса электролиза воды получают кислород и водород. Однако в зависимости от природы электродов можно получить озон и перекись водорода.
Схема электролиза воды:
Или:
- анод:
3H2O → O3 + 6e– + 6H+;
- катод:
O2 + 2H2O + 2e– → H2O2 + 2OH–.
Общее уравнение:
2H2O → 2H2 + O2.
Вода – слабый электролит, поэтому электролиз чистой, дистиллированной воды протекает медленно или не идёт вовсе. Для ускорения процесса в воду добавляют сильный электролит, увеличивающий проводимость электрического тока.
Электролит выбирается так, чтобы исключить конкуренцию между катионами электролита и катионами воды (H
- Li+;
- Rb+;
- K+;
- Cs+;
- Ba2+;
- Sr2+;
- Ca2+;
- Na+;
- Mg2+.
Для исключения конкуренции анионов, наоборот, подбирают электролит с анионами большего электродного потенциала, чем анион OH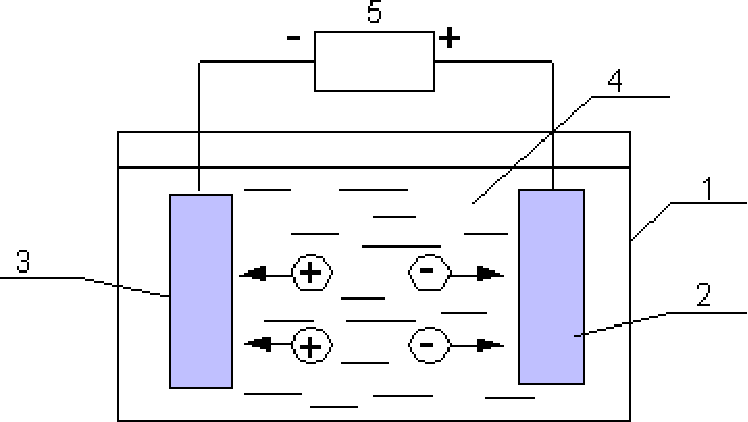 В качестве такого электролита применяется щелочь для образования гидроксильного иона OH–.
В качестве такого электролита применяется щелочь для образования гидроксильного иона OH–.
Для электролиза воды используются сильные щелочи: гидроксид калия (KOH) или натрия (NaOH). В некоторых случаях применяется сильная кислота, например, H2SO4.
Что мы узнали?
Электролиз – процесс образования и оседания на электродах ионов вещества под действием электрического тока. Вода разделяется на катионы водорода и анионы кислорода. Положительные катионы движутся к катоду, отрицательные анионы – к аноду. В некоторых случаях вода диссоциируется на озон и перекись водорода. Из-за низкой способности к диссоциации в воду добавляется сильный электролит, не мешающий образованию водорода и кислорода. Чаще всего добавляется щёлочь или сильная кислота.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Ирина Лысых
5/5
Олег Гаврюшкин
5/5
Induction System
5/5
Оценка доклада
4. 4
4
Средняя оценка: 4.4
Всего получено оценок: 225.
А какая ваша оценка?
Химические явления внутри и вокруг нас
Ручаюсь, вы не раз замечали что-нибудь вроде того, как мамино серебряное кольцо со временем темнеет. Или как ржавеет гвоздь. Или как сгорают до золы деревянные поленья. Ну ладно, если мама не любит серебро, а в походы вы не никогда не ходили, уж как заваривается чайный пакетик в чашке видели точно.
Что общего у всех этих примеров? А то, что все они относятся к химическим явлениям.
Химическое явление происходит тогда, когда одни вещества превращаются в другие: у новых веществ другой состав и новые свойства. Если припомнить еще и физику, то запомните, что химические явления происходят на молекулярном и атомарном уровне, но не затрагивают состав ядер атомов.
С точки же зрения химии это не что иное, как химическая реакция. А для каждой химической реакции обязательно возможно выделить характерные признаки:
- в ходе реакции может выпасть осадок;
- может измениться цвет вещества;
- следствием протекания реакции может стать выделение газа;
- может быть выделена либо поглощена теплота;
- также реакция может сопровождаться выделением света.

Мы дальше рассмотрим примеры различных химических явлений, так что этот момент станет понятнее.
Также давно определен список необходимых для протекания химической реакции условий:
- контакт: чтобы реагировать, вещества должны соприкасаться.
- измельчение: для успешного протекания реакции, вступающие в нее вещества должны быть как можно мельче измельчены, идеальный вариант – растворены;
- температура: очень многие реакции напрямую зависят от температуры веществ (чаще всего их требуется нагреть, но некоторые наоборот – охладить до определенной температуры).
Записывая буквами и цифрами уравнение химической реакции, вы тем самым описываете суть химического явления. А закон сохранения массы – одно и самых главных правил при составлении таких описаний.
Химические явления в природе
Вы, конечно, понимаете, что химия происходит не только в пробирках в школьной лаборатории. Самые впечатляющие химические явления вы можете наблюдать в природе. И значение их так велико, что не было бы никакой жизни на земле, если бы не некоторые из природных химических явлений.
И значение их так велико, что не было бы никакой жизни на земле, если бы не некоторые из природных химических явлений.
Итак, первым делом поговорим про фотосинтез. Это процесс, во время которого растения поглощают углекислый газ из атмосферы и под воздействием солнечного света вырабатывают кислород. Этим кислородом мы и дышим.
Вообще фотосинтез протекает в две фазы, и освещение нужно только для одной. Ученые проводили различные опыты и выяснили, что фотосинтез протекает даже при слабом освещении. Но с увеличением количества света процесс значительно ускоряется. Также было замечено, что если одновременно увеличивать освещенность растения и повышать температуру, скорость фотосинтеза увеличивается еще больше. Происходит это до известного предела, по достижении которого дальнейшее увеличение освещенности перестает ускорять фотосинтез.
В процессе фотосинтеза задействованы фотоны, которые излучает солнце, и специальные пигментные молекулы растений – хлорофилл. В клетках растений он содержится в хлоропластах, именно благодаря которым листья зеленые.
В клетках растений он содержится в хлоропластах, именно благодаря которым листья зеленые.
С точки зрения химии при фотосинтезе происходит цепочка преобразований, результатом которой является кислород, вода и углеводы в качестве запаса энергии.
Первоначально считалось, что кислород образуется в результате расщепления углекислого газа. Однако позже Корнелиус Ван Ниль выяснил, что кислород образуется в результате фотолиза воды. Позднейшие исследования подтвердили эту гипотезу.
Описать суть фотосинтеза можно с помощью вот такого уравнения: 6СО2 + 12Н2О + свет = С6Н12О6 + 6О2 + 6Н2О.
Дыхание, наше с вами в том числе, – это тоже химическое явление. Мы вдыхаем выработанный растениями кислород, а выдыхаем углекислый газ.
Но не только углекислый газ образуется в результате дыхания. Главное в этом процессе то, что благодаря дыханию выделяется большое количество энергии, и этот способ ее получения очень эффективен.
Кроме того, промежуточным итогом разных этапов дыхания является большое число различных соединений. А те в свою очередь служат основой для синтеза аминокислот, белков, витаминов, жиров и жирных кислот.
Процесс дыхания сложный и разбит на несколько этапов. На каждом из которых в ход идет большое количество ферментов, выполняющих роль катализаторов. Схема химических реакций дыхания практически одинаковая у животных, растений и даже бактерий.
С точки зрения химии дыхание – это процесс окисления углеводов (как вариант: белков, жиров) с помощью кислорода, в результате реакции получаются вода, углекислый газ и энергия, которую клетки запасают в АТФ: С6Н12О6 + 6О2 = СО2 + 6Н2О + 2,87 * 106 Дж.
Кстати, мы говорили выше, что химические реакции могут сопровождаться излучением света. В случае с дыханием и сопутствующими ему химическими реакциями это тоже верно. Светиться (люминесцировать) могут некоторые микроорганизмы. Хотя при этом энергетическая эффективность дыхания снижается.
Светиться (люминесцировать) могут некоторые микроорганизмы. Хотя при этом энергетическая эффективность дыхания снижается.
Горение тоже происходит при участии кислорода. В результате древесина (и другое твердое топливо) превращается в золу, а это вещество с совершенно другим составом и свойствами. Кроме того, в процессе горения выделяется большое количество теплоты и света, а также газа.
Горят, конечно, не только твердые вещества, просто с их помощью было удобнее привести пример в данном случае.
С химической точки зрения горение – это окислительная реакция, которая протекает с очень большой скоростью. А при очень-очень высокой скорости реакции может произойти взрыв.
Схематически реакцию можно записать так: вещество + О2 → оксиды + энергия.
Как природное химическое явление рассматриваем мы и гниение.
По сути, это тот же процесс, что и горение, только протекает он гораздо медленней.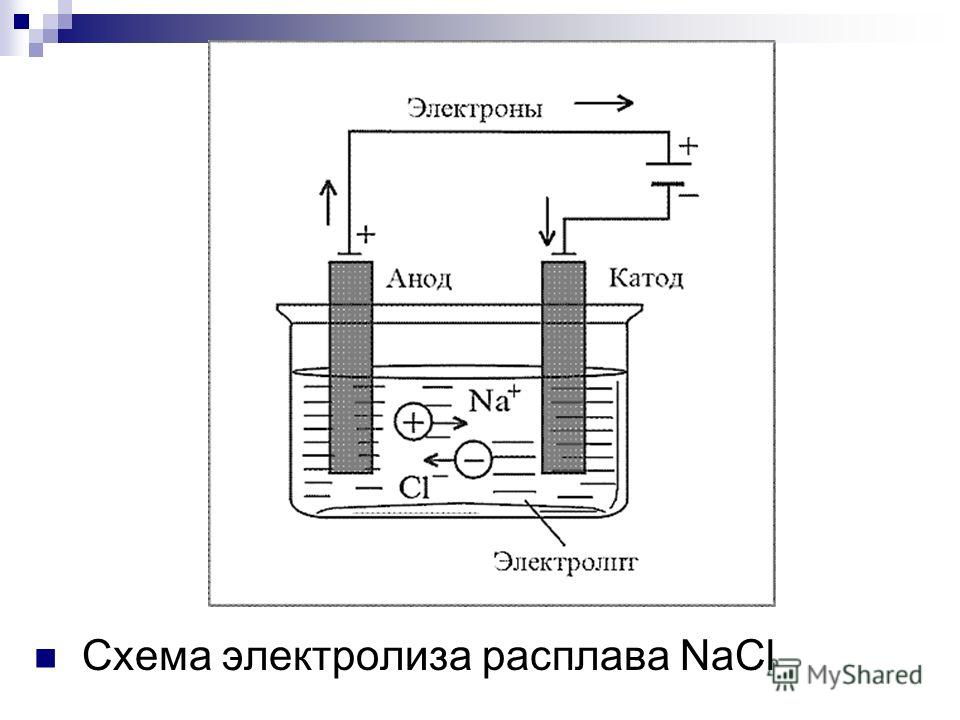 Гниение представляет собой взаимодействие сложных азотосодержащих веществ с кислородом при участии микроорганизмов. Наличие влаги является одним из факторов, способствующих возникновению гниения.
Гниение представляет собой взаимодействие сложных азотосодержащих веществ с кислородом при участии микроорганизмов. Наличие влаги является одним из факторов, способствующих возникновению гниения.
В результате химических реакций из белка образуется аммиак, жирные летучие кислоты, углекислота, оксикислоты, спирты, амины, скатол, индол, сероводород, меркаптаны. Часть из образованных в результате гниения азотосодержащих соединений ядовито.
Если снова обратимся к нашему списку признаков химической реакции, то многие из них обнаружим и в этом случае. В частности, имеется исходное вещество, реагент, продукты реакции. Из характерных признаков отметим выделение теплоты, газов (сильнопахнущих), изменение цвета.
Для круговорота веществ в природе гниение имеет очень большое значение: позволяет перерабатывать белки погибших организмов в соединения, пригодные к усвоению растениями. И круг начинается сначала.
Уверена, вы замечали, как летом легко дышится после грозы.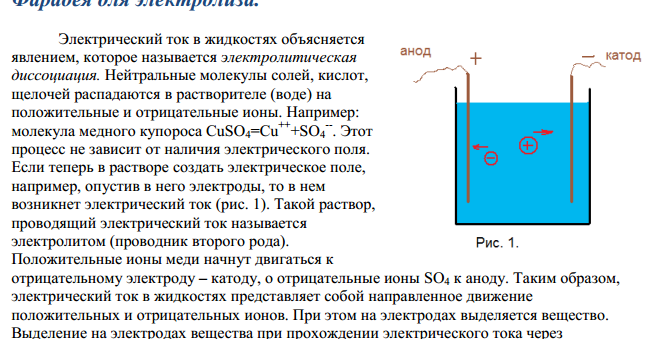 И воздух тоже становится особенно свежим и приобретает характерный запах. Каждый раз после летней грозы вы можете наблюдать еще одно распространенное в природе химическое явление – образование озона.
И воздух тоже становится особенно свежим и приобретает характерный запах. Каждый раз после летней грозы вы можете наблюдать еще одно распространенное в природе химическое явление – образование озона.
Озон (О3) в чистом виде представляет собой газ синего цвета. В природе наибольшая концентрация озона – в верхних слоях атмосферы. Там он выполняет роль щита нашей планеты. Который защищает ее от солнечной радиации из космоса и не дает Земле остывать, поскольку поглощает и ее инфракрасное излучение.
В природе озон в большинстве своем образуется благодаря облучению воздуха ультрафиолетовыми лучами Солнца (3О2 + УФ свет → 2О3). А также при электрических разрядах молний во время грозы.
В грозу под воздействием молний часть молекул кислорода распадается на атомы, молекулярный и атомарный кислород соединяются, и образуется О3.
Вот почему мы ощущаем особую свежесть после грозы, нам легче дышится, воздух кажется более прозрачным. Дело в том, что озон гораздо более сильный окислитель, чем кислород. И в небольшой концентрации (как после грозы) безопасен. И даже полезен, поскольку разлагает вредные вещества в воздухе. По сути, дезинфицирует его.
Дело в том, что озон гораздо более сильный окислитель, чем кислород. И в небольшой концентрации (как после грозы) безопасен. И даже полезен, поскольку разлагает вредные вещества в воздухе. По сути, дезинфицирует его.
Однако в больших дозах озон очень опасен для людей, животных и даже растений, для них он ядовит.
Кстати, дезинфицирующие свойства полученного лабораторным путем озона широко используются для озонирования воды, предохранения продуктов от порчи, в медицине и косметологии.
Разумеется, это далеко не полный список удивительных химических явлений в природе, которые делают жизнь на планете такой разнообразной и прекрасной. Вы сможете узнать о них больше, если будете внимательно смотреть по сторонам и держать уши открытыми. Вокруг полно удивительных явлений, которые только и ждут, чтобы вы ими заинтересовались.
Химические явления в быту
К ним относятся те, что можно наблюдать в повседневной жизни современного человека. Некоторые из них совсем простые и очевидные, любой может наблюдать их на своей кухне: например, заваривание чая. Нагретые кипятком чаинки меняют свои свойства, в результате меняется и состав воды: она приобретает другой цвет, вкус и свойства. То есть получается новое вещество.
Нагретые кипятком чаинки меняют свои свойства, в результате меняется и состав воды: она приобретает другой цвет, вкус и свойства. То есть получается новое вещество.
Если в этот же чай насыпать сахар, в результате химической реакции получится раствор, который снова будет обладать набором новых характеристик. В первую очередь, новым, сладким, вкусом.
На примере крепкой (концентрированной) чайной заварки можете самостоятельно провести и еще один опыт: осветлить чай при помощи дольки лимона. Из-за кислот, содержащихся в лимонном соке, жидкость еще раз изменит свой состав.
Какие еще явления вы можете наблюдать в быту? Например, к химическим явлениям относится процесс сгорания топлива в двигателе.
Если упростить, реакцию сгорания топлива в двигателе можно описать так: кислород + топливо = вода + углекислый газ.
Вообще в камере двигателя внутреннего сгорания происходит несколько реакций, в которых задействованы топливо (углеводороды), воздух и искра зажигания. А точнее, не просто топливо – топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается.
А точнее, не просто топливо – топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается.
Сгорание смеси происходит в доли секунды, в итоге связь между атомами водорода и углерода разрушается. Благодаря этому высвобождается большое количество энергии, которая приводит в движение поршень, а тот – коленчатый вал.
В дальнейшем атомы водорода и углерода соединяются с атомами кислорода, образуется вода и углекислый газ.
В идеале реакция полного сгорания топлива должна выглядеть так: CnH2n+2 + (1,5n+0,5)O2 = nCO2 + (n+1)H2O. В реальности же двигатели внутреннего сгорания не настолько эффективны. Предположим, если кислорода при реакции не хватает незначительно, в результате реакции образуется СО. А при большей нехватке кислорода образуется сажа (С).
Образование налета на металлах в результате окисления (ржавчина на железе, патина на меди, потемнение серебра) – тоже из категории бытовых химических явлений.
Возьмем железо для примера. Ржавление (окисление) происходит под воздействием влаги (влажность воздуха, прямой контакт с водой). Результатом этого процесса становится гидроксид железа Fe2O3 (точнее, Fe2O3 * H2O). Вы можете увидеть его в виде рыхлого, шероховатого, оранжевого или красно- коричневого налета на поверхности металлических изделий.
Другим примером может послужить зеленый налет (патина) на поверхности изделий из меди и бронзы. Он образуется со временем под воздействием атмосферного кислорода и влажности: 2Cu + O2 + H2O + CO2 = Cu2CO5H2 (или CuCO3 * Cu(OH)2). Полученный в итоге основной карбонат меди встречается и в природе – в виде минерала малахита.
И еще один пример медленной окислительной реакции металла в бытовых условиях – это образование темного налета сульфида серебра Ag2S на поверхности серебряных изделий: украшений, столовых приборов и т.п.
«Ответственность» за его возникновение несут частички серы, которые в виде сероводорода присутствуют в воздухе, которым мы с вами дышим. Потемнеть серебро может и при контакте с серосодержащими пищевыми продуктами (яйцами, например). Реакция же выглядит так: 4Ag + 2H2S + O2 = 2Ag2S + 2H2O.
Вернемся на кухню. Здесь можно рассмотреть еще несколько любопытных химических явлений: образование накипи в чайнике одно из них.
В бытовых условиях нет химически чистой воды, в ней всегда в различной концентрации растворены соли металлов и другие вещества. Если вода насыщена солями кальция и магния (гидрокарбонатами), ее называют жесткой. Чем выше концентрация солей, тем более жесткой является вода.
Когда такая вода нагревается, эти соли подвергаются разложению на углекислый газ и нерастворимый осадок (СаСО3 и MgСО3). Эти твердые отложения вы и можете наблюдать, заглянув в чайник (а также взглянув на нагревательные элементы стиральных и посудомоечных машинок, утюгов).
Кроме кальция и магния (из которых получается карбонатная накипь), в воде также часто присутствует железо. В ходе химических реакций гидролиза и окисления из него образуются гидроксиды.
Кстати, собравшись избавиться от накипи в чайнике, вы можете наблюдать еще один пример занимательной химии в быту: с отложениями хорошо справляются обычный столовый уксус и лимонная кислота. Чайник с раствором уксуса/лимонной кислоты и воды кипятят, после чего накипь исчезает.
А без другого химического явления не было бы вкусных маминых пирогов и булочек: речь о гашении соды уксусом.
Когда мама гасит соду в ложке уксусом, происходит вот такая реакция: NaHCO3 + CH3COOH = CH3COONa + H2O + CO2. Полученный в ее результате углекислый газ стремится покинуть тесто – и тем самым изменяет его структуру, делает пористым и рыхлым.
Полученный в ее результате углекислый газ стремится покинуть тесто – и тем самым изменяет его структуру, делает пористым и рыхлым.
Кстати, можете рассказать маме, что гасить соду вовсе не обязательно – она и так прореагирует, когда тесто попадет в духовку. Реакция, правда, будет проходить немного хуже, чем при гашении соды. Но при температуре от 60 градусов (а лучше 200) происходит разложение соды на карбонат натрия, воду и все тот же углекислый газ. Правда, вкус готовых пирогов и булочек может оказаться хуже.
Список бытовых химических явлений не менее впечатляющий, чем список таких явлений в природе. Благодаря им у нас есть дороги (изготовление асфальта – это химические явление), дома (обжиг кирпича), красивые ткани для одежды (окрашивание). Если задуматься об этом, становится отчетливо ясно, насколько многогранная и интересная наука химия. И сколько пользы можно извлечь из понимания ее законов.
Интересные химические явления
Среди многих и многих придуманных природой и человеком явлений есть особенные, которые сложно описать и объяснить. К ним относится и горение воды. Как такое, может быть, спросите вы, ведь вода не горит, ею тушат огонь? Как она может гореть? А дело вот в чем.
К ним относится и горение воды. Как такое, может быть, спросите вы, ведь вода не горит, ею тушат огонь? Как она может гореть? А дело вот в чем.
Горение воды – это химическое явление, при котором в воде с примесью солей под воздействием радиоволн разрываются кислородно-водородные связи. В результате образуется кислород и водород. И горит, конечно, не сама вода, а именно водород.
При этом он достигает очень высокой температуры горения (больше полутора тысяч градусов), плюс в ходе реакции снова образуется вода.
Это явление давно интересует ученых, мечтающих научиться использовать воду в качестве топлива. Например, для автомобилей. Пока это нечто из области фантастики, но кто знает, что ученые сумеют изобрести совсем скоро. Одна из главных загвоздок в том, чтобы при горении воды энергии выделялось больше, чем затрачивается на проведение реакции.
Кстати, нечто подобное можно наблюдать и в природе. Согласно одной из теорий, большие волны-одиночки, появляющиеся словно бы из ниоткуда, на самом деле являются следствием водородного взрыва. Электролиз воды, который к нему приводит, осуществляется благодаря попаданию электрических разрядов (молний) на поверхность соленой воды морей и океанов.
Электролиз воды, который к нему приводит, осуществляется благодаря попаданию электрических разрядов (молний) на поверхность соленой воды морей и океанов.
Но не только в воде, но и на суше можно наблюдать поражающие воображение химические явления. Если бы вам довелось побывать в природной пещере, наверняка вы смогли бы увидеть там причудливые, красивые природные «сосульки», свисающие с потолка – сталактиты. То, как и почему они появляются, объясняется еще одним интересным химическим явлением.
Химик, глядя на сталактит, видит, конечно, не сосульку, а карбонат кальция СаСО3. Основой для его образования служат сточные воды, природный известняк, а сам сталактит выстраивается благодаря осаждению карбоната кальция (рост вниз) и силе сцепления атомов в кристаллической решетке (рост вширь).
К слову, аналогичные образования могут подниматься от пола к потолку – их называют сталагмиты. А если сталактиты и сталагмиты встречаются и срастаются в цельные колонны, они получают название сталагнаты.
Заключение
В мире ежедневно происходит множество удивительных, прекрасных, а также опасных и пугающих химических явлений. Из многих человек научился извлекать пользу: создает строительные материалы, готовит пищу, заставляет транспорт перемещаться на огромные расстояния и многое другое.
Без многих химических явлений не было бы возможным существование жизни на земле: без озонового слоя люди, животные, растения не выжили бы из-за ультрафиолетовых лучей. Без фотосинтеза растений животным и людям нечем было бы дышать, а без химических реакций дыхания этот вопрос вообще не был бы актуальным.
Брожение позволяет готовить продукты питания, а сходное с ним химическое явление гниения разлагает белки на более простые соединения и возвращает те в круговорот веществ в природе.
Образование оксида при нагревании меди, сопровождающееся ярким свечением горение магния, плавление сахара и др. тоже считают химическими явлениями. И находят им полезное применение.
Будет здорово, если в комментариях вы расскажете нам, какие еще химические явления вы могли сами наблюдать в природе или у себя дома. И будет очень хорошо, если расскажете про эту статью своим друзьям – многие из них тоже могут захотеть поделиться своими наблюдениями.
И будет очень хорошо, если расскажете про эту статью своим друзьям – многие из них тоже могут захотеть поделиться своими наблюдениями.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Явления электролиза при электрофорезе — PubMed
. 2020 апр;41(7-8):536-544.
doi: 10.1002/elps.2011. Epub 2020 8 января.
Томаш Новотны 1 , Богуслав Гаш 1
принадлежность
- 1 Карлов университет, факультет естественных наук, кафедра физической и макромолекулярной химии, Прага, Чехия.
- PMID: 31883353
- DOI:
10.
 1002/элпс.2011
1002/элпс.2011
Томаш Новотны и др. Электрофорез. 2020 9 апр.0003
. 2020 апр;41(7-8):536-544.
doi: 10.1002/elps.2011. Epub 2020 8 января.
Авторы
Томаш Новотны 1 , Богуслав Гаш 1
принадлежность
- 1 Карлов университет, факультет естественных наук, кафедра физической и макромолекулярной химии, Прага, Чехия.
- PMID: 31883353
- DOI:
10.
 1002/элпс.2011
1002/элпс.2011
Абстрактный
Представлен новый теоретический подход к расчету изменения физико-химических свойств БГЭ для измерений методом КЗЭ в результате электролиза в электродных ампулах (сосудах). Электролиз — неизбежное явление при любом измерении в CZE. Электролиз воды, который происходит в большинстве измерений, может значительно изменить состав БГЭ в электродных ампулах и в разделительном капилляре и отрицательно повлиять на надежность и качество разделения. Возможность прогнозировать изменения в составе BGE важна для оценки пригодности BGE для повторения электрофоретических циклов. Мы сравнили теоретически рассчитанные изменения физико-химических свойств (рН, электропроводность) с таковыми, измеренными с помощью рН-микроэлектрода и бесконтактного определения электропроводности БГЭ после электрофоретического прогона. Мы подтвердили правильность нашего теоретического подхода с помощью обычного БГЭ, состоящего из кислотно-основной пары, где один компонент полностью диссоциирован, а второй диссоциирован только наполовину, и с помощью буфера Гуда. Как и предсказывал теоретический подход, изменения физико-химических свойств буфера Гуда после проведения электрофореза были в несколько раз ниже, чем в случае обычного БГЭ, состоящего из пары слабая кислота — сильное основание.
Как и предсказывал теоретический подход, изменения физико-химических свойств буфера Гуда после проведения электрофореза были в несколько раз ниже, чем в случае обычного БГЭ, состоящего из пары слабая кислота — сильное основание.
Ключевые слова: фоновый электролит; Капиллярный зональный электрофорез; Бесконтактное определение проводимости; Электролиз.
© 2019 WILEY-VCH Verlag GmbH & Co. KGaA, Вайнхайм.
Похожие статьи
Амфолиты как фоновые электролиты в капиллярном зонном электрофорезе: смысл или бессмыслица? Гистидин как модельный амфолит.
Беккерс Дж.Л. Беккерс Дж.Л. Электрофорез. 2003 Январь; 24 (3): 548-56. doi: 10.1002/elps.2003
. Электрофорез. 2003. PMID: 12569544
Определение аминокислот в образцах табака методом капиллярного электрофореза/непрямого определения поглощения с выделением отсека для электролиза и п-аминобензойной кислоты в качестве фонового электролита.

Fu GN, He YZ, Wang L, Wang XK. Фу Г.Н. и др. Анальная наука. 2006 июнь; 22 (6): 883-7. doi: 10.2116/analsci.22.883. Анальная наука. 2006. PMID: 16772690
Собственные подвижности в фоновых электролитах для зонного капиллярного электрофореза: III. Линейная теория электромиграции.
Stĕdrý M, Jaros M, Hruska V, Gas B. Stĕdrý M, et al. Электрофорез. 25 октября 2004 г. (18-19): 3071-9. doi: 10.1002/elps.200405981. Электрофорез. 2004. PMID: 15472980
Приготовление фоновых электролитов при капиллярном зонном электрофорезе: золотые правила и подводные камни.
Беккерс Дж.Л., Бочек П. Беккерс Дж.Л. и соавт. Электрофорез. 2003 Январь; 24 (3): 518-35. doi: 10.1002/elps.2003
.
 Электрофорез. 2003.
PMID: 12569542
Обзор.
Электрофорез. 2003.
PMID: 12569542
Обзор.Системные зоны в капиллярно-зональном электрофорезе.
Газ Б., Кендлер Э. Газ Б и др. Электрофорез. 2004 Декабрь; 25 (23-24): 3901-12. doi: 10.1002/elps.200406159. Электрофорез. 2004. PMID: 15597426 Обзор.
Посмотреть все похожие статьи
Цитируется
Динамическое компьютерное моделирование электрофореза: 2010-2020 гг.
Торманн В., Мошер Р.А. Торманн В. и соавт. Электрофорез. 2022 Январь; 43 (1-2): 10-36. doi: 10.1002/elps.202100191. Epub 2021 2 августа. Электрофорез. 2022. PMID: 34287996 Бесплатная статья ЧВК. Обзор.
использованная литература
6 Каталожные номера
- Бейтман, К.
 П., Дж. Ам. соц. Масс-спектр. 1999, 10, 309-317.
П., Дж. Ам. соц. Масс-спектр. 1999, 10, 309-317.
- Бейтман, К.
- Timperman, A., Tracht, S.E., Sweedler, J.V., Anal. хим. 1996, 68, 2693-2698.
- Erlandsson, P.G., Robinson, N.D., Electrophoresis 2011, 32, 784-790.
- Eigeldinger, J., Vogt, H., Electrochim. Acta 2000, 45, 4449-4456.
- Gabrielli, C., Huet, F., Keddam, M., J. Appl. Электрохим. 1989, 19, 617-629.
Типы публикаций
термины MeSH
вещества
Грантовая поддержка
- 18-11776S/Чешский научный фонд/Международный
- № 4135/Фонд Agilent/Международный
Что является примером физического и химического изменения?
Главная > Химия > Примеры физических и химических изменений
Физическое изменение — это изменение, которое происходит, когда вещество претерпевает изменения, но не изменяет химический состав. Никакое новое вещество не образуется при физических изменениях, а меняется только внешний вид вещества. Это обратимое и только временное изменение.
Никакое новое вещество не образуется при физических изменениях, а меняется только внешний вид вещества. Это обратимое и только временное изменение.
Примеры физических изменений –
- Таяние льда в воду
- Смешивание соли и песка
- Замораживание воды
- Наливание воды в стакан
- Перец молотый
- Рубка дров
- Разбивание яйца
- Расплавленный воск для свечей
Химическое изменение — это изменение, которое изменяет химический состав вещества, в результате чего образуется новое вещество с особыми свойствами. В основном это необратимые изменения, т.е. исходное вещество не может быть получено простыми физическими средствами. Химическое изменение влияет как на физические, так и на химические свойства вещества.
Примеры химических изменений –
- Сжигание дров в камине
- Переваривание хот-дога
- Сквашивание молока
- Жарка яйца
- Реакция фотосинтеза
- Ржавление железа
- Сжигание бумаги
- Разложение отходов
- Гниение пищевых продуктов
- Кислотно-основные реакции
- Взрывы фейерверков
| Физические изменения по сравнению с химическими изменениями | |
| При физическом изменении не происходит химической реакции и химический состав остается прежним | При химическом изменении происходит химическая реакция и изменяется химический состав |
| Новое вещество не образуется при физическом изменении | Новое вещество образуется при химическом изменении |
| носит временный и обратимый характер | Это необратимо и изменения в основном необратимы |
| Изменяет только внешний вид веществ | Изменяет как физические, так и химические свойства вещества |
| Включает очень мало или вообще не поглощает энергию | Происходит поглощение и выделение энергии |
Примеры физических изменений – Измельчение овощей, Разбивание стекла, Сублимация сухого льда, Таяние льда, Разрезание ткани и т. д. д. | Примеры химических изменений – Созревание фруктов, Сжигание дров, Фейерверки, Метаболизм, Гальваника и т. д. |
Давайте разберемся в «физических изменениях против химических изменений» с помощью различных примеров и объяснений.
Q.1 Что из следующего является примером химического изменения?(а). Горение свечи
(б). Приготовление пищи
(c). Замерзание воды
(г). Ржавление железа
(д). Переваривание пищи
(f). Рост растения
(г). Смешивание железного наполнителя и песка
Ответ = Варианты (а), (б), (г), (д), (е)
Горение свечи, Приготовление пищи, Ржавление железа, Переваривание пищи , Рост растений являются примерами химических изменений, а Замерзание воды, Смешивание железного наполнителя с песком являются примерами физических изменений в приведенном выше списке вопросов.
Объяснение:-
(а). Почему горение свечи является химическим изменением?
Почему горение свечи является химическим изменением?
Когда свеча горит, атмосферный воздух вступает в реакцию с водородом и углеродом воска свечи, в результате чего образуется CO 2 (новое вещество). Во время этого процесса большая часть воска свечи сгорает, и мы не можем обратить его вспять. Следовательно, горение свечи — это химическое изменение.
(б). Почему приготовление пищи является химическим изменением?
При приготовлении пищи при повышенной температуре внутренний состав пищи разрушается, что приводит к образованию нового вещества. Как мы знаем, сырые овощи нельзя вернуть обратно после приготовления, следовательно, приготовление пищи — это химическое явление.
(с). Почему замерзание воды является физическим изменением?
Когда вода замерзает, она превращается в затвердевший лед, но мы можем снова превратить этот затвердевший лед в воду, нагрев ее, следовательно, замерзание воды — это физическое изменение.
(г). Почему ржавление железа является химическим явлением?
Во время коррозии железа Fe подвергается процессу окисления и превращается в новое вещество, называемое оксидом железа (Fe 2 O 3 ), этот процесс нельзя обратить вспять, следовательно, ржавление железа является химическим изменением.
(д). Почему переваривание пищи является химическим явлением?
Более крупные макромолекулы, присутствующие в пище, расщепляются на более простые молекулы с помощью ферментов, присутствующих в желудке в процессе переваривания пищи, и в этом процессе образуется новое химическое вещество, следовательно, это химическое явление.
(ф). Почему рост растений является химическим явлением?
«Рост растений — это химическое изменение, потому что оно включает реакцию фотосинтеза, а также многие другие химические реакции». Когда растение начинает расти, его форма и размер также увеличиваются, что не может быть возвращено обратно.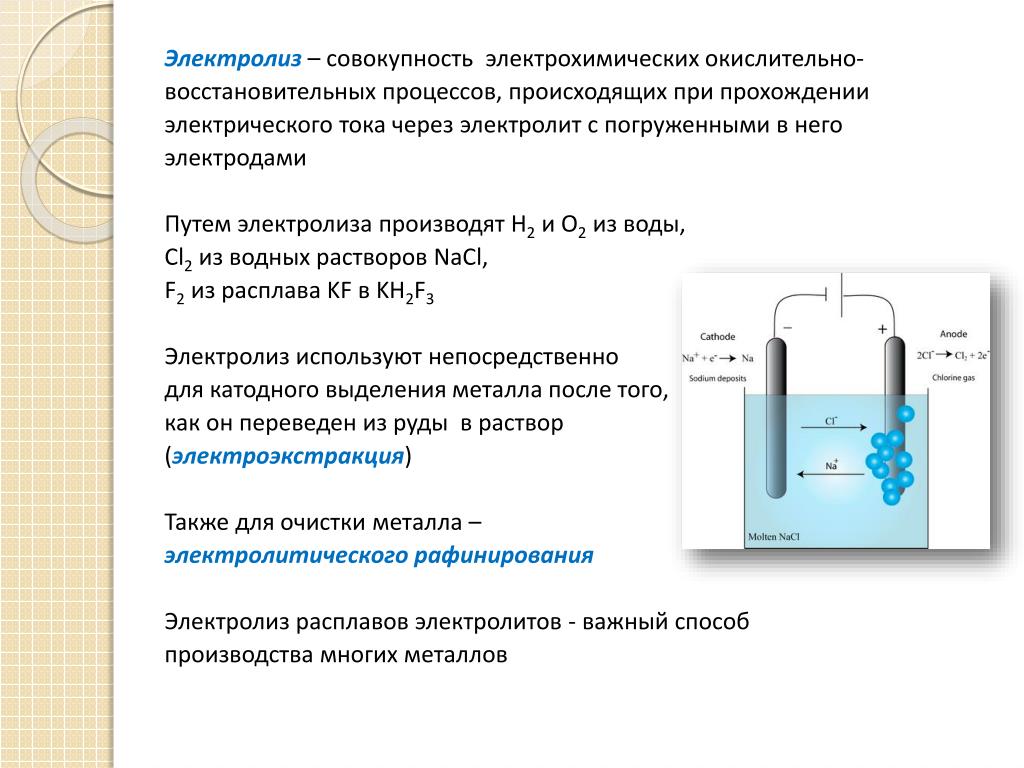
(г). Почему смешивание железного наполнителя и песка является физическим изменением?
Это связано с тем, что при смешивании железного наполнителя и песка их можно легко разделить с помощью магнита, следовательно, смешивание железного наполнителя и песка может вернуться к своей первоначальной форме, следовательно, это физическое изменение.
Q.2 Что из следующего не является физическим изменением?(а). Сжигание древесины
(b). Преобразование воды в пар
(c). Разбивание кирпича
(г). Таяние льда
(д). Кипячение воды
Ответ = Вариант (а)
Сжигание древесины является химическим изменением, тогда как все другие варианты (б, в, г, д) являются физическими изменениями.
Объяснение:-
(а). Почему сжигание древесины — это химический процесс?
Когда древесина сгорает, она превращается в новое вещество, такое как зола, тепло, газ CO 2 и т.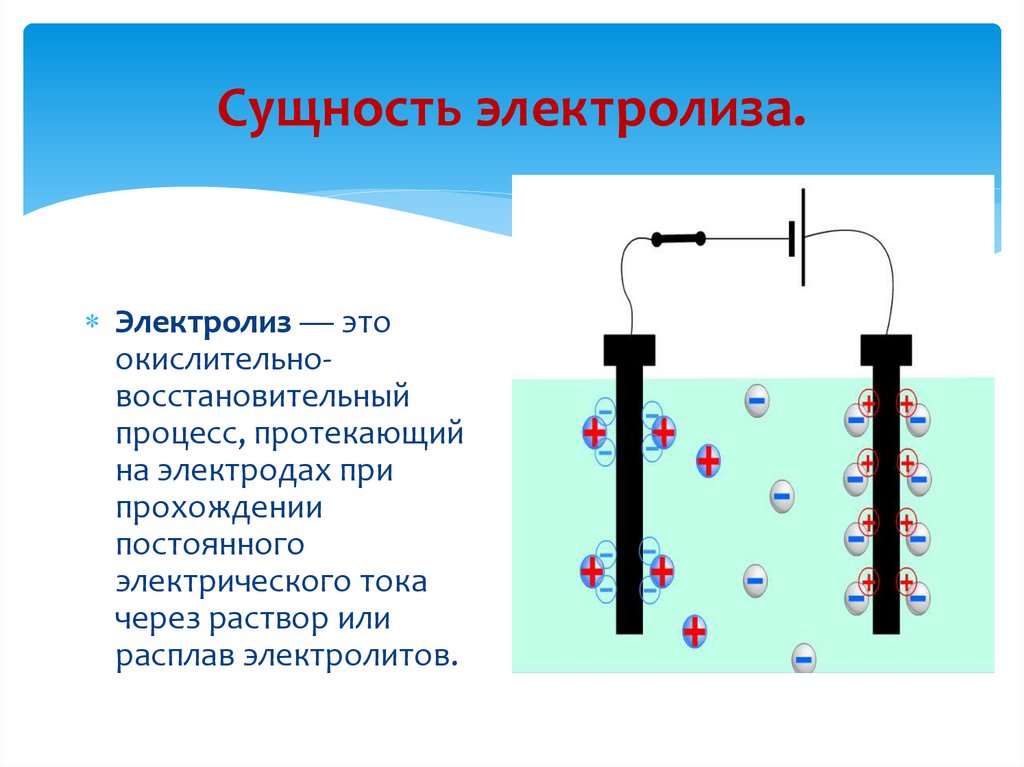 д., которое невозможно вернуть обратно, следовательно, горение древесины является химическим явлением.
д., которое невозможно вернуть обратно, следовательно, горение древесины является химическим явлением.
(б). Почему превращение воды в пар является физическим изменением?
Химический состав пара и воды остается прежним, следовательно, это физическое явление.
(с). Почему разрушение кирпича является физическим изменением?
Когда кирпич разбивается, он не превращается в новое вещество, так как это не влияет на его внутреннюю структуру, следовательно, это физическое изменение.
(д). Почему таяние льда является физическим изменением?
Когда лед тает, он превращается в воду (жидкость). И лед, и вода состоят из атомов водорода и кислорода, следовательно, молекулярный состав воды и льда все тот же, а значит, они взаимосвязаны с физическим явлением.
(д). Почему кипение воды является физическим изменением?
При кипячении вода превращается в водяной пар. Молекулярная структура или химический состав водяного пара и жидкой воды одинаковы, следовательно, новое вещество не образуется.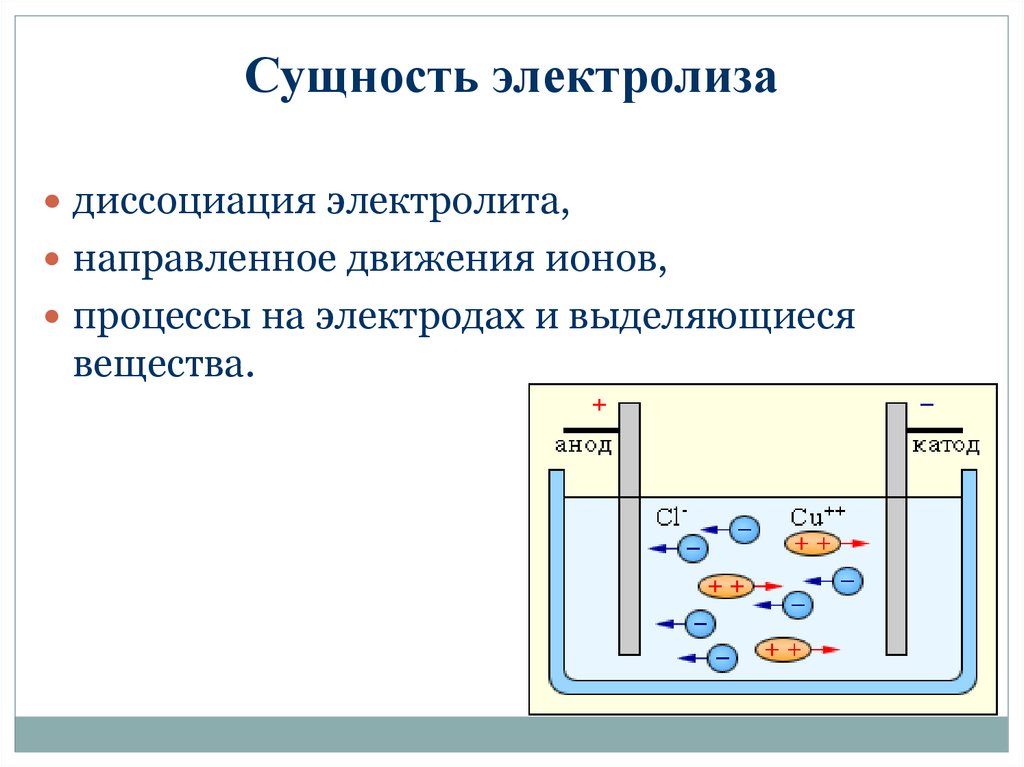
(а). Испарение жидкости
(б). Перемещение колеса
(c). Конденсация пара
(г). Взрыв динамита
Ответ = Вариант (d)
Взрыв динамита — это химическое изменение, тогда как все другие варианты (a, b, c) — физические изменения.
Объяснение:-
(а). Почему испарение воды является физическим изменением?
Когда вода в жидком состоянии испаряется, она превращается в водяной пар (газообразное состояние), тем не менее, это вода, меняется только внешний вид.
(б). Почему движение колеса является физическим изменением?
Движение колеса не вызывает образования нового вещества, следовательно, это физическое явление.
(с). Почему конденсация пара является физическим изменением?
Конденсация пара представляет собой физический процесс, так как не образуется новое вещество, а молекулярный или химический состав пара остается прежним.
(д). Почему взрыв динамита является химическим явлением?
Взрыв динамита связан с высвобождением большого количества энергии и образованием новых веществ, таких как двуокись углерода и окись углерода, следовательно, это химическое изменение.
Q.4 Что из следующего является примером химического изменения?(а). Сжигание метана
(б). Возгонка камфоры или йода
(c). Выпаривание морской воды для получения соли
(г). Плавление натрия в ядерном реакторе
Ответ = Вариант (а)
Сжигание метана представляет собой химическое изменение, тогда как все другие варианты (б, в, г) являются физическими изменениями.
Объяснение:-
(а). Почему горение метана является химическим явлением?
При сгорании метана образуется CO 2 , вода и энергия (новые вещества), следовательно, горение метана является химическим явлением.
(б). Почему сублимация камфоры или йода является физическим изменением?
Процесс сублимации включает изменение состояния, которое является физическим явлением.
(с). Почему испарение морской воды для получения соли является физическим изменением?
Испарение морской воды для получения соли — это всего лишь изменение физического состояния воды из жидкого в газообразное.
(г). Почему плавление натрия в ядерном реакторе является физическим изменением?
Это связано с тем, что плавление не является явлением химической реакции, в процессе плавления происходят изменения только свойств веществ.
Q.5 Что из следующего является физическим изменением?(а). Переваривание пищи
(б). Растворение сахара в воде
(c). Сжигание угля
(г). Фотосинтез
Ответ = Вариант (b)
Растворение сахара в воде является физическим изменением, тогда как сжигание угля, фотосинтез и переваривание пищи являются примерами химических изменений.
Объяснение:-
(а). Почему переваривание пищи является химическим изменением?
Когда мы перевариваем пищу, наш организм начинает расщеплять макромолекулы на более простые молекулы с помощью ферментов. Этот процесс изменяет химическую структуру пищи, и мы получаем новое вещество, которое невозможно обратить, следовательно, переваривание пищи является химическим явлением.
(б). Почему растворение сахара в воде является физическим изменением?
Очевидно, что при растворении сахара в воде не образуется никакого нового вещества, а образуется только смесь, которую легко разделить испарением с последующей конденсацией и кристаллизацией.
Таким образом, химический состав не меняется, и это легко обратимо, что делает растворение сахара в воде физическим изменением.
(с). Почему сжигание угля является химическим изменением?
«Уголь состоит из углерода и углеводородов, которые содержат энергию, которая может выделяться при сгорании». При сжигании угля углерод превращается в CO 2 и водород в воду. Отсюда образуются новые вещества, которые невозможно обратить, поэтому горение угля — это химическое превращение.
При сжигании угля углерод превращается в CO 2 и водород в воду. Отсюда образуются новые вещества, которые невозможно обратить, поэтому горение угля — это химическое превращение.
(г). Почему фотосинтез — это химическое изменение?
В процессе фотосинтеза участвует химическая реакция (вода + CO 2 → глюкоза + O 2 ). Образование новых химических соединений и участие в эндотермических реакциях делают фотосинтез химическим явлением.
Q.6 Что из следующего является физическими изменениями?(а). Волочение проволоки из железа металлического
(б). Плавка металлического железа
(c). Изгиб железного стержня
(г). Ржавление железа
Ответ = Варианты (а), (б), (в)
Волочение проволоки из металлического железа, Плавление металлического железа и Изгиб железного стержня являются примерами физических изменений. тогда как ржавление железа является примером химического изменения.
Объяснение:-
(а). Почему волочение проволоки из железного металла, а не химическое изменение?
Волочение проволоки из металлического железа означает преобразование металлического железа в тонкую проволоку, следовательно, изменяется только физический вид металлического железа, следовательно, это физическое явление.
(б). Почему плавление металлического железа не является химическим превращением?
Плавление металлического железа является физическим явлением, поскольку плавление связано с переходом вещества из твердого состояния в жидкое и не влияет на химический состав или свойства.
(с). Почему изгибание железного стержня является физическим процессом?
Теперь, это здравый смысл, когда мы сгибаем железный стержень, меняется только физический вид железного стержня с прямого на круглый или другой формы. Но химический состав остается прежним.
(г). Почему ржавление железа является химическим изменением?
Почему ржавление железа является химическим изменением?
При ржавлении железа Fe подвергается процессу окисления и превращается в новое вещество, называемое оксидом железа (Fe 2 O 3 ), этот процесс нельзя обратить вспять, следовательно, ржавление железа представляет собой химическое изменение.
Q.7 Что из следующего не является примером химического изменения?(а). Приготовление пищи
(b). Свертывание молока
(c). Горение свечи
(г). Намагничивание железа
Ответ = Вариант (d)
Намагничивание железа является примером физических изменений, а все остальное — химическими изменениями.
Объяснение:-
(а). Почему приготовление пищи является химическим изменением?
Как мы знаем, сырые овощи нельзя вернуть обратно после приготовления, следовательно, приготовление пищи — это химическое явление.
(б).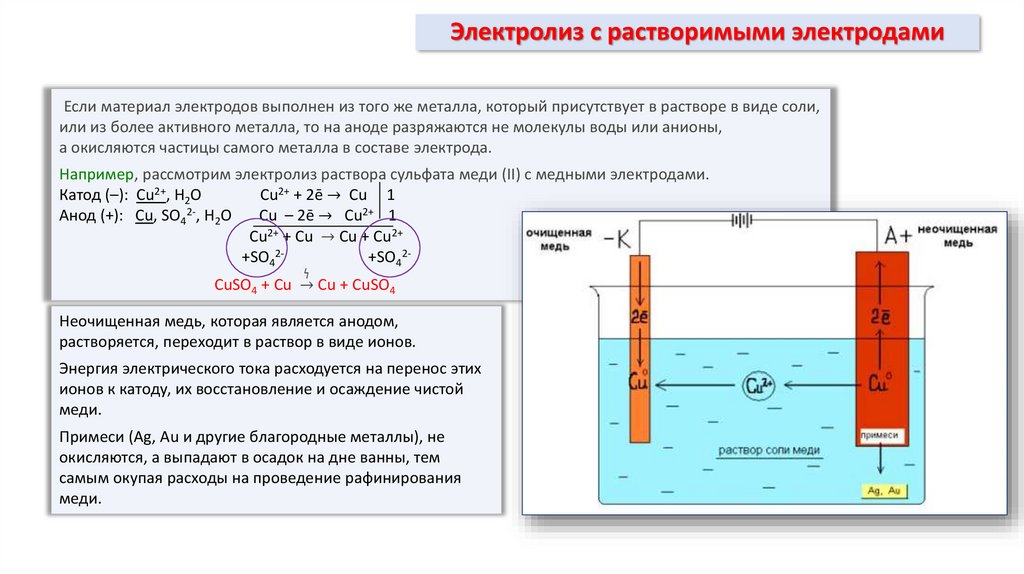 Почему свертывание молока является химическим явлением?
Почему свертывание молока является химическим явлением?
Когда молоко превращается в творог, это изменение носит постоянный характер, так как молоко теряет свои химические свойства и деформируется внутренняя структура. Следовательно, свертывание молока является химическим изменением.
(с). Почему горение свечи является химическим явлением?
Когда свеча горит, атмосферный воздух вступает в реакцию с водородом и углеродом воска свечи, в результате чего образуется CO 2 (новое вещество). Во время этого процесса большая часть воска свечи сгорает, и мы не можем обратить его вспять. Следовательно, горение свечи — это химическое изменение.
(г). Почему намагничивание железа является физическим изменением?
В процессе намагничивания железа нет никакого химического процесса или реакции, кроме того, когда железо размагничивается, оно теряет всю магнитную силу, следовательно, возможен обратимый процесс, следовательно, это делает намагничивание железа физическим процесс.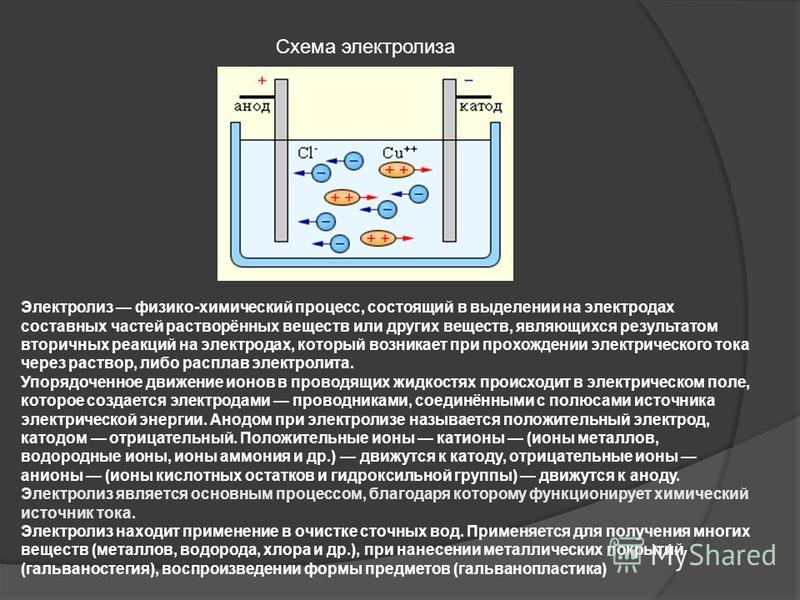
(а). Горючее масло
(б). Потускнение столового серебра
(c). Электролиз воды до газообразного водорода и газообразного кислорода
(d). Кипящая вода
Ответ = Вариант (d)
Кипящая вода представляет собой физическое изменение, тогда как все другие варианты (a, b, c) являются химическими изменениями.
Объяснение:-
(а). Почему горение масла является химическим явлением?
В процессе горения масла происходит реакция горения, которая изменяет его внутренний состав и образуется новое вещество, следовательно, это химическое изменение.
(б). Почему потускнение столового серебра является химическим изменением?
Потускнение серебра превращает серебро в сульфид серебра, следовательно, изменяется химический состав или свойства, которые невозможно восстановить простыми физическими средствами.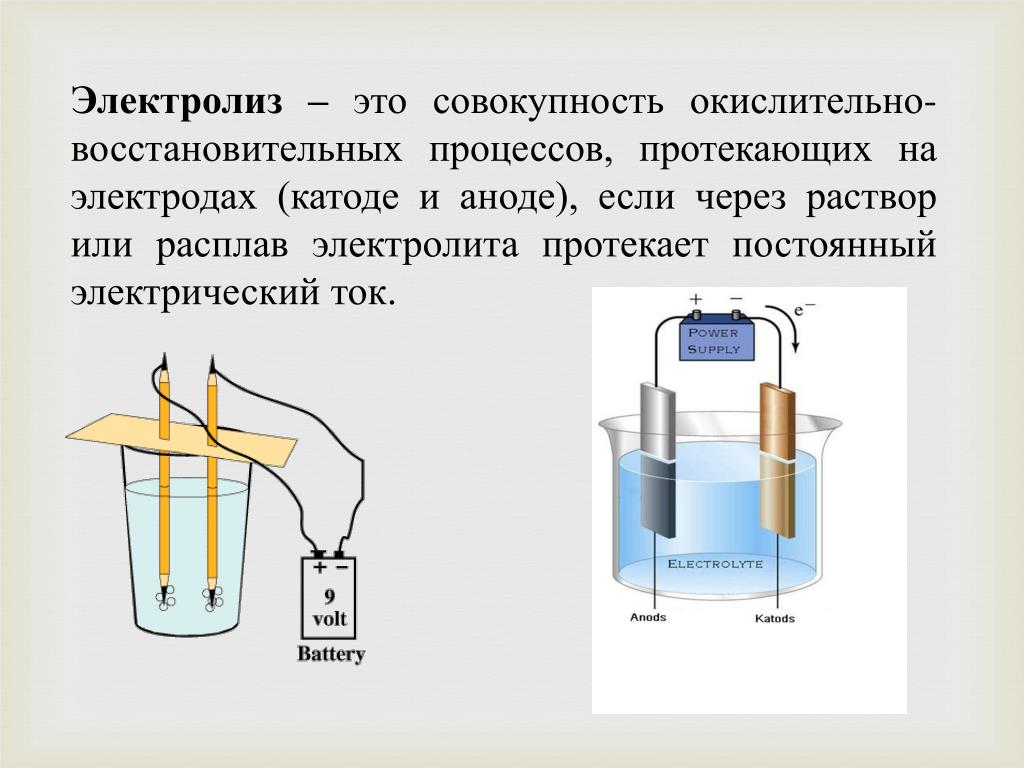
(с). Почему электролиз воды до газообразного водорода и кислорода является химическим изменением?
Химические свойства H 2 O изменяются после процесса электролиза и образуется новое вещество (газообразный водород и кислород), следовательно, это химическое явление.
(г). Почему кипячение воды является физическим изменением?
При кипячении вода превращается в водяной пар. Молекулярная структура водяного пара и жидкой воды одинакова, новое вещество не образуется. Следовательно, кипение воды — это физический процесс.
Часто задаваемые вопросы| Чем химическое изменение отличается от физического изменения? |
Химические изменения изменяют химический состав вещества и образуют новое вещество с другими свойствами, тогда как физические изменения не влияют на химический состав или химические свойства вещества. Физическое изменение влияет только на физические свойства, такие как форма, размер, цвет, температура плавления, температура кипения и т. д. Физическое изменение влияет только на физические свойства, такие как форма, размер, цвет, температура плавления, температура кипения и т. д. |
| Является ли ферментация примером химического или физического изменения? |
«Ферментация — это химический процесс, при котором такие молекулы, как глюкоза, расщепляются анаэробно». При сбраживании молока образуется новое вещество — творог. Следовательно, творог не может быть возвращен в исходную форму (молоко). Таким образом, процесс ферментации является примером химического изменения. |
| Что из перечисленного является химическим изменением «Кипячение яйца» или кипячение воды? |
Варка яйца является примером химического изменения, тогда как кипячение воды является примером физического изменения. При варке яйца при повышенной температуре происходит искажение внутренней структуры яйца, вызывающее изменение его молекулярной структуры. При кипячении вода превращается в водяной пар. Молекулярная структура водяного пара и жидкой воды одинакова, следовательно, новое вещество не образуется. |
| Является ли скисание молока примером физического или химического изменения? |
| Нет, скисание молока является примером химического изменения. |
| Что из перечисленного является примером физического изменения «Горение дров в камине» или «Колка дров для костра»? |
Сжигание дров в камине является примером химических изменений, так как при горении дров присутствие тепла и кислорода превращает их в золу, воду, CO2 и пары, следовательно, образуется новое вещество. Принимая во внимание, что рубка дров для костра является примером физического изменения, так как когда древесина рубится на более мелкие части, ее химический состав остается неизменным, меняется только физический вид древесины. |



 1002/элпс.2011
1002/элпс.2011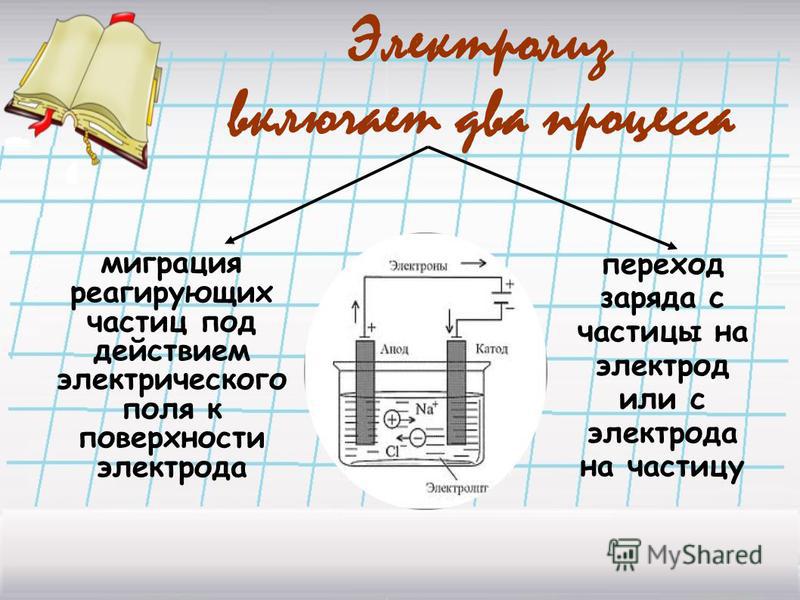 1002/элпс.2011
1002/элпс.2011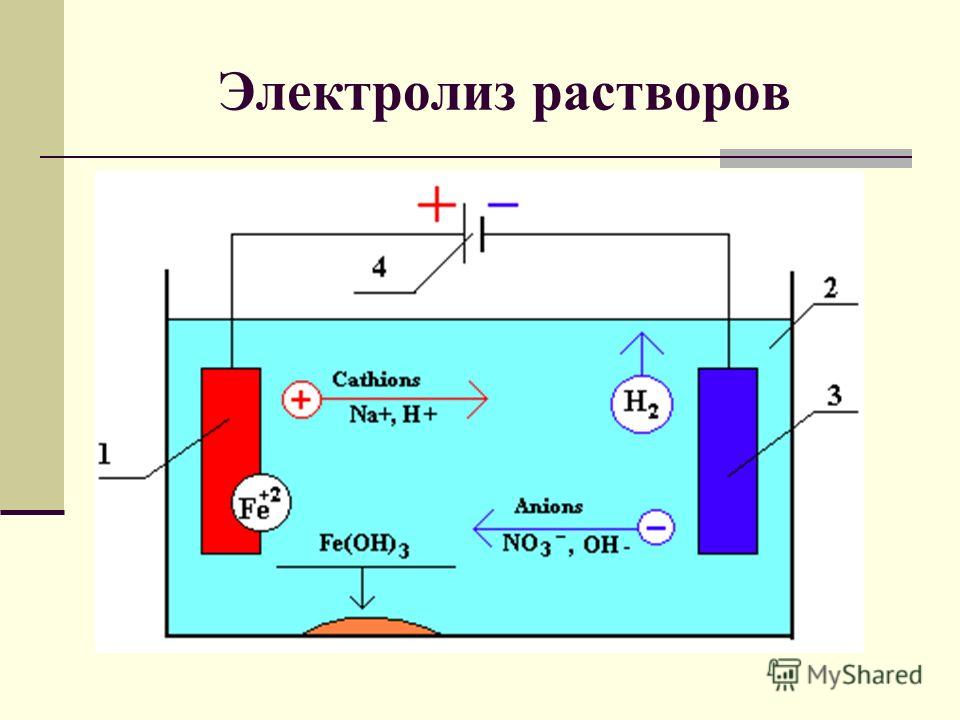
 Электрофорез. 2003.
PMID: 12569542
Обзор.
Электрофорез. 2003.
PMID: 12569542
Обзор. П., Дж. Ам. соц. Масс-спектр. 1999, 10, 309-317.
П., Дж. Ам. соц. Масс-спектр. 1999, 10, 309-317.