Электролизуем воду… а зачем?! — заказ воды для дома и офиса
Физико-электрохимическим термином «электролиз воды» каждый из нас познакомился еще в 8 классе средней школы. Принцип электролиза прост: под действием постоянного электрического тока вода разлагается на кислород и водород: 2Н2О = 2Н2↑ + О2↑.
Сейчас в науке и технике электролиз воды нашел положительное применение. Например, в связи с глобальным энергетическим кризисом в прессе часто упоминают электролиз воды как альтернативу нефтепродуктам и основу водородной энергетики. Французы создали стиральную машину, в основу работы которой положен принцип очистки белья ионами H+ и OH-, генерируемыми в её недрах при электролизе воды, причем ионы H+ стерилизуют одежду, а OH- занимаются удалением грязи. Электролиз уже используется в некоторых странах для обеззараживания питьевых и сточных вод.
Но, к сожалению, электролиз воды имеет отношение и к некоторым популистским «водным» теориям. И в связи с периодически подогреваемым к этим теориям интересом давайте обратимся к двум наиболее популярным.
Уже несколько десятков лет, не столько в науке, сколько в среде потребителей, с переменной интенсивностью обсуждается вопрос активированной воды, она же «живая», щелочная (pH – 8,0-10,5), или католит, и «мертвая», кислотная (pH – 2,5-5,5), или анолит, получаемая с помощью электролиза. Разработаны и продаются многочисленные приборы для получения такой воды в домашних и промышленных масштабах. Сторонниками теории «живой» и «мертвой» воды утверждается, что католит стимулирует биологические процессы, обладает повышенной растворяющей и экстрагирующей способностью, более абсорбционно-химически активен. А анолиту присущи выраженные угнетающие свойства, поэтому он замедляет биопроцессы и потому, якобы, является мощным антисептиком и консервантом, что позволяет рекомендовать его для борьбы с микроорганизмами. Утверждается, что, регулируя процесс электролиза (время, сила тока, исходный состав воды, исходное значение концентрации водородных ионов — рН) можно получить воду желаемых свойств, даже близкую по свойствам к крови и лимфе – основным жидкостям человеческого организма, а потому такая вода – якобы, панацея от всех болезней.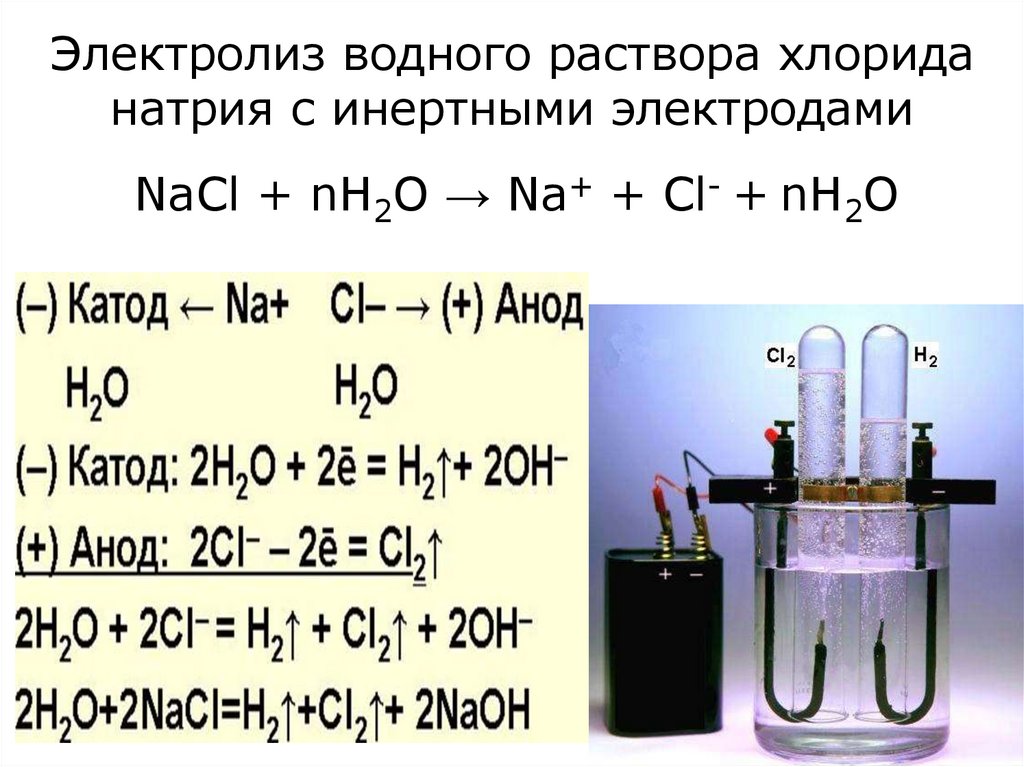
Сегодня также достаточно популярна другая теория — антиоксидантная — о необходимости защиты здоровой ткани от разрушительного окисления активным кислородом, постоянно производимым человеческим организмом. Вещества, предотвращающие окисление, называют антиоксидантами. Одним из таких веществ, по мнению сторонников этой теории, является ионизированная вода — водопроводная вода, преобразованная умеренным электролизом, в результате которого в ней образуется огромное количество электронов, которые могут быть доставлены активному кислороду в организме, чтобы прекратить нежелательное окисление нормальных клеток. И ведется безудержная реклама, и предлагаются приборы для производства такой воды…
Но о пользе различных теорий и изобретений для здоровья человека, имеют право рассуждать, утверждать в уважаемых научных и официальных изданиях, в серьезных рубриках только медики на основе длительных медицинских наблюдений, исследований, клинических испытаний на добровольцах и пр. Вот, например, статистически достоверная новость: ученые Копенгагенского университета в 2006 году, используя методику, которую разработала ведущая международная группа Cochrane Collaboration, специализирующаяся на анализе эффективности применяемых в медицине средств, пришли к выводу, что антиоксиданты в таблетках, известные и употребляемые уже не одно десятилетие, причинили принимающим их людям больше вреда, чем пользы. Что тогда говорить о «новоявленном» антиоксиданте – обработанной электролизом воде?!
Что тогда говорить о «новоявленном» антиоксиданте – обработанной электролизом воде?!
Кроме того, нет однозначной физиологической оценки результатов электролиза, при котором уменьшается количество солей (растворенных и нерастворенных) в питьевой воде, в том числе и необходимых для человека, поскольку эффект электролиза воды сродни процессу дистилляции: в обоих случаях умягчается вода. Но Всемирная Организация Здравоохранения — законодатель для всех экономически развитых стран в разработке требований к питьевой воде, — рекомендует очень осторожно умягчать воду. Известно, что излишне мягкая вода «вымоет» из организма без разбору и «шлаки», и нужные минералы, в результате чего начнутся сбои в работе сердечно-сосудистой системы и других систем организма из-за невозможности синтеза полноценных ферментов, гормонов, секретов и пр.
Доказано также, что затрудняется утилизация организмом некоторых компонентов воды при изменении их физико-электро-химического состояния из-за электролиза.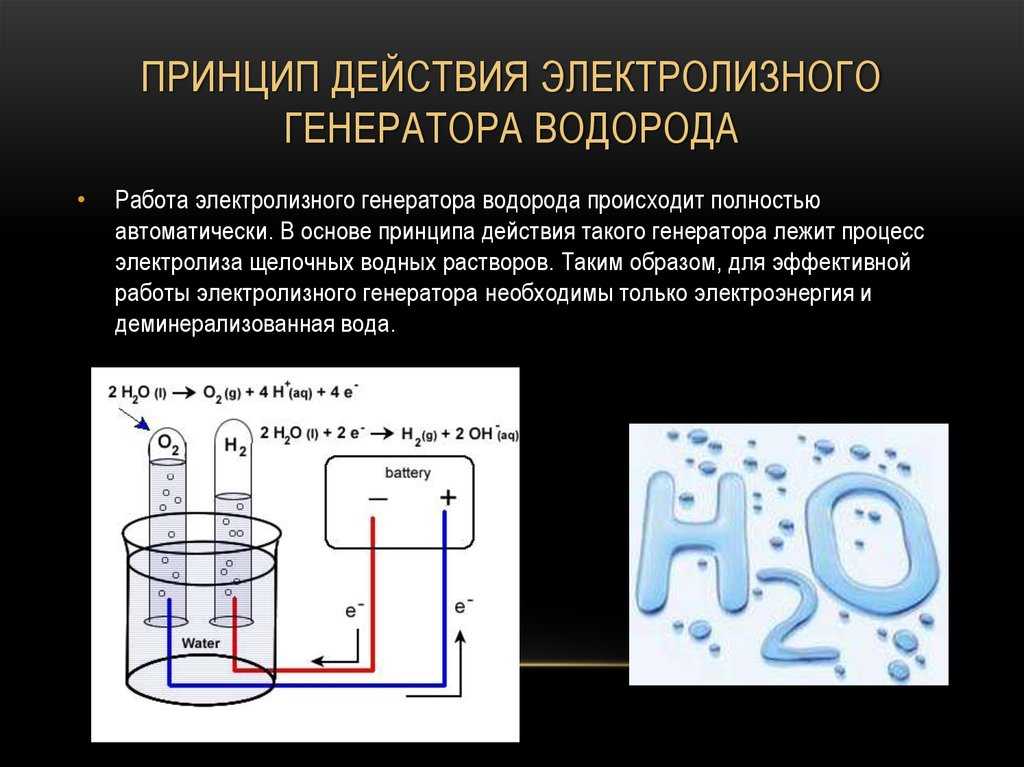
Далее, доказано, что обычная (протиевая) вода содержит наряду с обычными молекулами воды (Н2О) незначительное количество молекул тяжелой (дейтериевой) воды (D2O), в состав которой входит тяжелый изотоп водорода. При электролизе такой воды разложению подвергаются преимущественно обычные молекулы, а остаток постепенно обогащается молекулами дейтерия, небезопасного для человека. Зафиксированы даже случаи тяжелых отравлений дейтериевой водой.
Существует жесткое, но справедливое правило: в производстве питьевой воды только государством могут быть признаны и рекомендованы к употреблению и использованию методы, приборы, аппараты…
Теперь о некоторых рекламных трюках. Понятно, что процесс электролиза воды будет длиться до разложения последней ее молекулы. Поэтому, когда, например, не совсем компетентные или честные продавцы так называемых фильтров — приборов для доочистки воды — в емкость с дистиллированной водой вставляют электроды, то начинается электролиз, и вода меняет цвет (если добавлен индикатор, реагирующий на смену рН) или прозрачность. Но это значит, что нам всего лишь показывают фокус, основанный на изменении концентрации водородных ионов, а вовсе не демонстрируют огромные «очистные» возможности предлагаемого метода или фильтра. И тем более не убеждают нас в необходимости покупки и использования прибора, как правило, достаточно дорогого.
Но это значит, что нам всего лишь показывают фокус, основанный на изменении концентрации водородных ионов, а вовсе не демонстрируют огромные «очистные» возможности предлагаемого метода или фильтра. И тем более не убеждают нас в необходимости покупки и использования прибора, как правило, достаточно дорогого.
Существует жесткое, но справедливое правило: в производстве питьевой воды только государством могут быть признаны и рекомендованы к употреблению и использованию методы, приборы, аппараты и пр., прошедшие полноценную, длительную, разностороннюю проверку. А пока в Украине нет упоминаний о вышеназванных методах ни в одном официальном документе.
Поэтому берегите здоровье, взвешивайте все «за» и «против», прежде чем приобретать рекламируемый товар или продукт, безопасность употребления которого не гарантирует Министерство здравоохранения.
электролиз воды
МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное
учреждение высшего образования
Нижегородский
государственный технический университет
им. Р.Е. Алексеева
Р.Е. Алексеева
(НГТУ)
Институт физико-химических технологий и материаловедения (ИФХТиМ)
Кафедра «Технология электрохимических производств
и химии органических веществ (ТЭПиХОВ)»
Дисциплина «Электрохимические технологии»
ДОКЛАД
по теме
«Электролиз воды»
Выполнила: Студентка гр. ____________ |
Принял: |
_________________________________________ |
Электролиз
воды –физико-химический процесс, при котором
под действием постоянного электрического
тока вода разлагается на кислород и
водород. Постоянное напряжение для
ячейки получается, как правило,
выпрямлением трехфазного переменного
тока. В электролитической ячейке
дистиллированная вода подвергается
электролизу, при этом химическая реакция
идет по следующей известной схеме:
Постоянное напряжение для
ячейки получается, как правило,
выпрямлением трехфазного переменного
тока. В электролитической ячейке
дистиллированная вода подвергается
электролизу, при этом химическая реакция
идет по следующей известной схеме:
Для раздельного получения газов используют электролизеры с диафрагмами или мембранами, разделяющими катодное и анодное пространство. Использование специальных электродов позволяет производить из воды озон и перекись водорода.
На аноде производится озон: 3H2O → O3 + 6e− + 6H+ (вода подкисляется).
На
катоде – перекись
водорода: O2 +
2H2O
+ 2e− → H2O2 +
2OH− (вода
подщелачивается).
Удельная проводимость
очищенной воды незначительна: при 18°С
она составляет 4,41·10-6 Ом-1·м-1. Поэтому
электролитическое разложение воды
проводят в присутствии фонового
электролита.
Раствор электролита, используемый в установках для электролиза воды, содержит 16-20% NaOH или 25-30% КОН.
Побочные
реакции: Естественная
пресная (не дистиллированная) вода
всегда содержит минеральные соли –
сульфаты, карбонаты, хлориды. В целях
получения хлора для пролонгированного
эффекта обеззараживания воды интересны
только хлориды. В воде они представлены
в основном хлоридом натрия (NaCl), хлоридом
кальция (CaCl) и хлоридом калия (KCl).
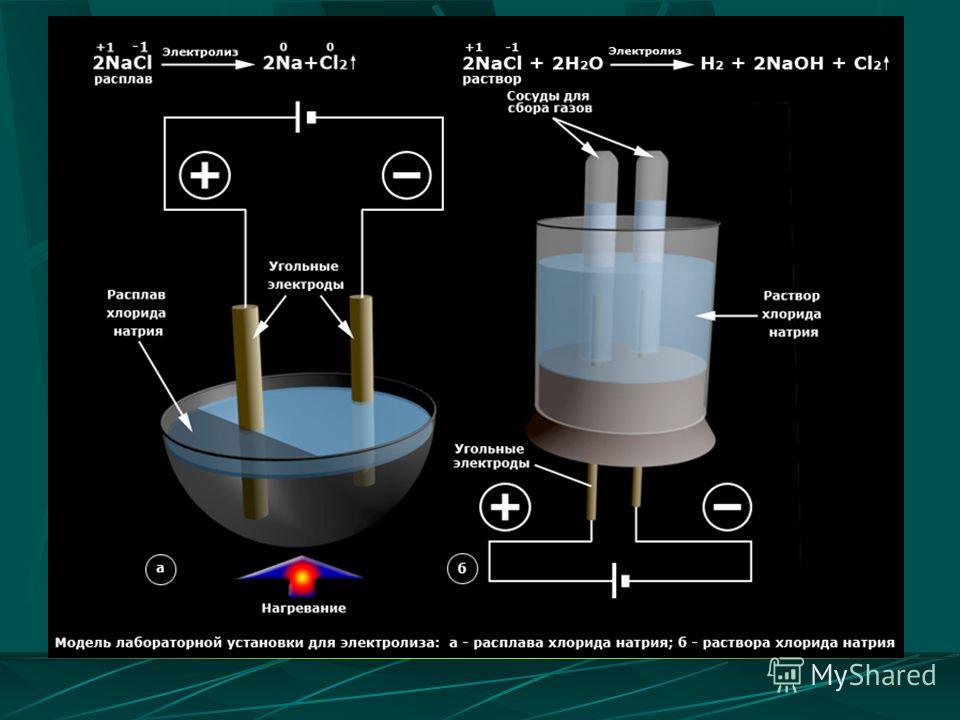
На примере с хлоридом натрия реакция образования хлора электролизом будет следующей.
Соль, растворенная в воде: 2NaCl + H2O → 2Na+ +2Cl– + 2H2O
Во время электролиза на аноде формируется хлор: 2Cl– → Cl2+2e– (вода подкисляется).
А у катода образуется гидроокись натрия: Na+ + OH– → NaOH (вода подщелачивается).
Эта реакция является недолгой, поскольку любой хлор, произведенный у анода, быстро потребляется для формирования гипохлорита натрия: Cl2 + 2NaOH → H2 + 2NaOCl.
Подобные реакции электролиза происходят и с хлоридами кальция и калия.
Материал электродов:
Для электролиза воды применяют нержавеющую сталь, часто покрытую никелем, с целью уменьшения перенапряжения водорода.
Конструкции электролизеров
Промышленные электролизеры для производства водорода бывают двух типов:
— монополярные — электроды питаются параллельно в одной и той же емкости;
— биполярные
— электроды питаются последовательно
(электрод с одной стороны поверхности
является анодом, а с другой — катодом) и
образуют укладку ячейки.
При монополярном включении электродов все электроды одного знака присоединены к шине, идущей от соответствующего полюса источника постоянного тока. При биполярном включении электродов ток подводится только к крайним электродам 1 и 2, которые являются монополярными электродами. Все остальные электроды подвода тока не имеют и работают биполярно.
Соотношение между током и напряжением в электролизерах
Чем
ниже напряжение на ячейке электролизера,
тем меньшую он потребляет мощность. С
ростом температуры электролита напряжение
электролизера снижается поэтому
энергетически выгодно было бы
эксплуатировать электролизеры при
повышенных температурах (при работе
под давлением — с температурой 100°С и
даже выше). Однако с ростом температуры
электролита усиливаются коррозионные
процессы и значительно ускоряется
старение прокладочного материала
паронита. Поэтому для небольших
электролизных установок на электростанциях
основное значение имеет надежность
оборудования и длительность работы
между ремонтами, температуру электролита
следует поддерживать 60-75°С, а в тех
случаях, когда не требуется работа
электролизера с полной нагрузкой,
желательно поддерживать 40-50°С.
Для того чтобы ток проходил через электролизер с биполярным включением электродов, напряжение на электролизере (U) должно быть равно:
U= U1
где, U1 — напряжение на одной ячейке;
n — количество ячеек.
Напряжение на монополярном электролизере равно напряжению между парой электродов (на одной ячейке U= U1).
Ток (I), подводимый к монополярному электролизеру, разветвляется на все электроды в соответствии с законами параллельного соединения. Поэтому ток, идущий через пару электродов I1=I/n.
В биполярном электролизере ток, идущий через каждую пару электродов, равен току через весь электролизер (I1=I) — закон последовательного соединения.
Таким
образом, при одинаковой токовой нагрузке
на монополярный и биполярный электролизеры
количество полученного вещества в
биполярном электролизере в n раз больше.
Iэкв=I·n.
Монополярные электролизеры не создаются на токовые нагрузки выше 200 — 300 кА, биполярные электролизеры работают при эквивалентной токовой нагрузке до 2000 кА. Следовательно, биполярные электролизеры более мощные и более производительные.
Другим достоинством биполярных электролизеров является снижение падения напряжения в ошиновке электролизера и в контактах за счет уменьшения их количества
Кроме того, уровень автоматизации биполярных электролизеров выше, чем монополярных, что уменьшает затраты рабочей силы на их обслуживание.
Все современные конструкции электролизеров для электролиза воды относятся к фильтр-прессному типу с биполярным включением электродов.
Схема фильтр-прессного электролизера
Увлажняющий
элемент (1) сборочного узла содержит
электролитную полость (2) и пористую
мембрану (3), пропускающую через себя
пары воды и не пропускающую жидкость. Пористая мембрана (3) отделяет увлажняющий
элемент (1) от электролизной ячейки (4),
которая включает в себя кислородную
(5) и паро-водородную (6) полости, пористый
катод (7), пористый анод (8) и пористую
электролитосодержащую матрицу (9).
Пористая мембрана (3) отделяет увлажняющий
элемент (1) от электролизной ячейки (4),
которая включает в себя кислородную
(5) и паро-водородную (6) полости, пористый
катод (7), пористый анод (8) и пористую
электролитосодержащую матрицу (9).
Схема биполярного фильтр-прессного электролизера
Как видно из фиг.1, электролизер состоит из блока дистанцированных друг от друга электродов 2 и охватывающего блок диэлектрического стакана 3, погруженных в электролит 4 в корпусе 5. Ток к концевым электродам блока 2 подведен изолированными снаружи проводниками 6, пропущенными в электролит 4 через гермовводы 7. Через патрубок 8 из корпуса 5 выходит водородно-кислородная смесь, а через патрубок 1 корпус пополняют электролитом.
Список литературы:
Якименко Л.Н. Получение водорода, кислорода, хлора и щелочей. — М.: Химия, 1981;
Фиошин М.Я., Павлов В. Н., Электролиз в неорганической химии, М., 1976;
Мазанко А.Ф., Камарьян Г.
 М., Помашин О.П., Промышленный
мембранный электролиз, М., 1989;
М., Помашин О.П., Промышленный
мембранный электролиз, М., 1989;А.И. Левин, Теоретические основы электрохимии, Гос. Научно-техн. Издат., Москва, 1963;
Л.М. Якименко и др., Электролиз воды, изд. «химия», Москва, 1970.
Электролиз воды Эксперимент — разделение воды
Электролиз — это процесс, при котором электрический ток проходит через вещество, чтобы вызвать химическое изменение. Химическое изменение происходит, когда вещество теряет электроны (окисление) или приобретает их (восстановление). В двух экспериментах, перечисленных ниже, первым реактивным веществом является вода, а вторым — раствор сульфата меди.
Электролиз используется для удаления волос, расщепления соединений, а также в производственном процессе для украшения, укрепления и повышения устойчивости металлических поверхностей к ржавчине.
>>Посмотрите это видео, чтобы увидеть гальваническое покрытие медного ключа>>
Электролиз: расщепление воды Для этого эксперимента вы можете собрать свои собственные материалы или купить полный набор для электролиза воды.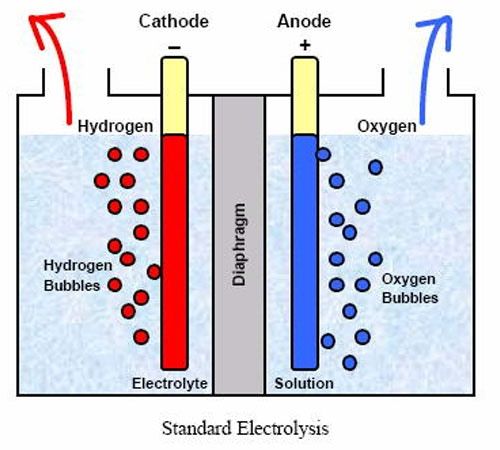
Требуется наблюдение взрослых.
Что вам нужно:
- 6-вольтовая или 9-вольтовая батарея
- Два провода с зажимом типа «крокодил» или изолированный провод
- Стакан или стакан
- Кусок тонкого картона или картона
- Два карандаша #2
Что нужно сделать:
1. Наполните химический стакан или стакан теплой водой.
2. Осторожно снимите ластики и металлические гильзы, чтобы можно было заточить оба конца каждого карандаша. Эти карандаши — ваши электроды . Графит в них будет проводить электричество, но не растворится в воде.
3. Отрежьте кусок картона, чтобы надеть стакан, затем проделайте два отверстия в центре картона на расстоянии около дюйма друг от друга. Протолкните карандаши через отверстия и поместите их в стакан. Они должны уходить в воду, но не касаться дна стакана. Картон удержит их на месте.
4. Подсоедините каждый карандаш к батарее с помощью зажима типа «крокодил», прикрепленного к открытому графиту (грифель карандаша). Если у вас нет проводов с зажимом типа «крокодил», используйте два отрезка провода и снимите изоляцию на дюйм с каждого конца. Оберните проволоку вокруг графита каждого карандаша и подключите провода к батарейке. Возможно, вам понадобится скотч, чтобы удерживать провода на месте.
Если у вас нет проводов с зажимом типа «крокодил», используйте два отрезка провода и снимите изоляцию на дюйм с каждого конца. Оберните проволоку вокруг графита каждого карандаша и подключите провода к батарейке. Возможно, вам понадобится скотч, чтобы удерживать провода на месте.
Что произошло:
Как только вы подключите провода к аккумулятору, вы увидите, как вокруг каждого кончика карандаша в воде появляются пузырьки, которые всплывают вверх. Эти пузырьки представляют собой компоненты воды — газообразные водород и кислород — которые были разделены электричеством, когда оно проходит через воду от одного карандаша к другому. Карандаш, присоединенный к отрицательной клемме батареи, собирает газообразный водород, а карандаш, подключенный к положительной клемме, собирает кислород. Собирает ли один карандаш больше пузырьков, чем другой? Который из? Как вы думаете, почему это так?
(Подсказка: химическое название воды H 2 O, поскольку на каждый атом кислорода приходится два атома водорода.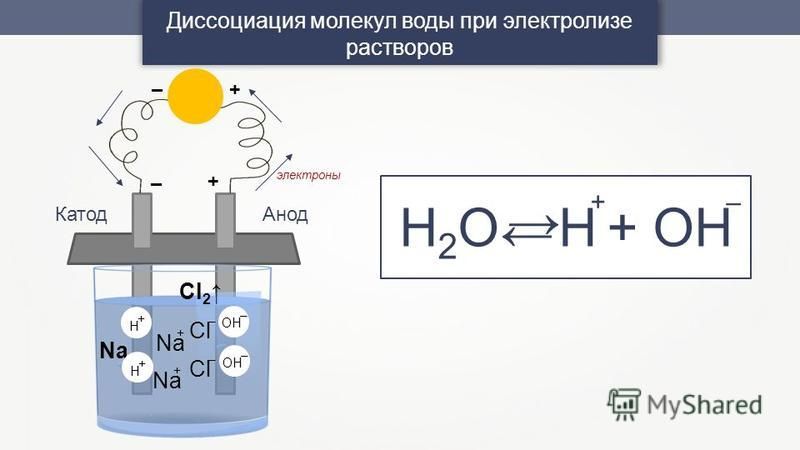 )
)
Дальнейшие эксперименты:
- Попробуйте добавить электролит в воду в стакане. Вода сама по себе не так хорошо проводит электричество, но любой эксперимент по электролизу воды можно ускорить, добавив в воду поваренную соль. Когда это будет сделано, вы должны увидеть изменение скорости образования пузырьков.
Примечание по технике безопасности : при использовании соли может выделяться небольшое количество газообразного хлора, аналогичное количеству, присутствующему при использовании отбеливателя.
- Попробуйте разные типы батарей. Можете ли вы сделать электролиз с помощью 1,5-вольтовой батареи? А если добавить электролит?
- С помощью настоящего электролизного оборудования вы можете собрать два газа в пробирки, чтобы измерить их различное количество и проверить их различную реакцию на пламя.
- Чтобы электролиз работал как настоящая возобновляемая энергия, вам нужно использовать чистый источник энергии для запуска реакции.
 Проведите этот эксперимент по электролизу еще раз, используя солнечные элементы вместо батареи.
Проведите этот эксперимент по электролизу еще раз, используя солнечные элементы вместо батареи.
Гальваника использует форму электролиза, при которой электроды (проводники, обычно металлические) погружают в раствор электролита и держат отдельно друг от друга. Затем, используя в качестве источника питания постоянный ток, один из электродов покрывается металлом другого. Ювелиры и производители посуды используют гальваническое покрытие. Профессиональное гальванопокрытие требует специальных химикатов и оборудования для получения высококачественного покрытия, но в этом эксперименте по электролизу вы можете попробовать свои силы в простой процедуре переноса меди на латунный ключ.
Требуется наблюдение взрослых и оборудование для химической безопасности.
>> Посмотрите видео нашего проекта, чтобы увидеть этот проект в действии!
Что вам нужно:
- Аккумулятор D 1,5 В с держателем аккумулятора
- Два провода с зажимом типа «крокодил» или изолированный провод
- Стакан или стакан
- Сульфат меди
- Медный электрод (или катушка медной проволоки)
- Латунный ключ
- Оборудование для обеспечения безопасности
Что вы делаете:
1. Подготовьте ключ к меднению, очистив его зубной пастой или водой с мылом. Высушите его на бумажном полотенце.
Подготовьте ключ к меднению, очистив его зубной пастой или водой с мылом. Высушите его на бумажном полотенце.
2. Размешайте сульфат меди в стакане с небольшим количеством горячей воды, пока он не перестанет растворяться. Ваш раствор должен быть темно-синим. Дать остыть.
3. Используйте один зажим типа «крокодил», чтобы прикрепить медный электрод к положительной клемме батареи (теперь это анод ), а другой — чтобы прикрепить ключ к отрицательной клемме (теперь называемой ).катод ).
4. Частично подвесьте ключ в растворе, свободно обернув проволочный стержень вокруг карандаша и поместив карандаш на горловину стакана. Зажим «крокодил» не должен касаться раствора.
5. Поместите медную полоску в раствор, убедившись, что она не касается клавиши, а уровень раствора ниже зажима типа «крокодил». Электрическая цепь образовалась, и по ней течет ток.
6. Оставьте цепь включенной на 20–30 минут или до тех пор, пока вас не устроит количество меди на ключе.
Что произошло:
Раствор сульфата меди — это электролит, проводящий электричество от одного электрода к другому. Когда течет ток, окисление (потеря электронов) происходит на медном аноде, добавляя ионы меди в раствор. Эти ионы перемещаются с электрическим током к катоду, где происходит восстановление (присоединение электронов), покрывая ключ ионами меди. Ионы меди уже присутствовали в растворе сульфата меди до того, как вы начали, но реакция окисления на аноде продолжала замещать их в растворе по мере того, как они наносились на ключ, поддерживая реакцию.
В этом проекте много переменных, в том числе чистота и гладкость ключа, сила раствора медного купороса и сила тока. Если на ключе начинает образовываться черное копоть, ваш раствор недостаточно силен для тока. Выньте электроды и добавьте еще сульфата меди. Когда вы вставите их обратно, убедитесь, что анод и катод находятся как можно дальше друг от друга.
С гальванопокрытием можно реализовать множество проектов! Одна забавная идея состоит в том, чтобы использовать плоский кусок латуни в качестве катода и нарисовать на нем рисунок маркером на масляной основе. Медь не склеится там, где находится маркер. После того, как вы закончите покрытие, вы можете использовать ацетон (или жидкость для снятия лака), чтобы стереть маркер, оставив рисунок латуни, просвечивающий сквозь медь. Вы можете использовать немного металлического полироля, чтобы сделать медь блестящей, если хотите.
Медь не склеится там, где находится маркер. После того, как вы закончите покрытие, вы можете использовать ацетон (или жидкость для снятия лака), чтобы стереть маркер, оставив рисунок латуни, просвечивающий сквозь медь. Вы можете использовать немного металлического полироля, чтобы сделать медь блестящей, если хотите.
Вы можете попробовать этот простой эксперимент с меднением, в котором не используется электролиз и требуются только бытовые материалы.
Проекты в области возобновляемых источников энергии:- Ветряная турбина
- Сделать водяное колесо
- Построить солнечную печь
- Дизайн и сборка автомобиля на солнечной энергии
23.9: Электролиз воды — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53976
Поскольку ископаемое топливо становится все более дорогим и менее доступным, ученые ищут другие источники энергии.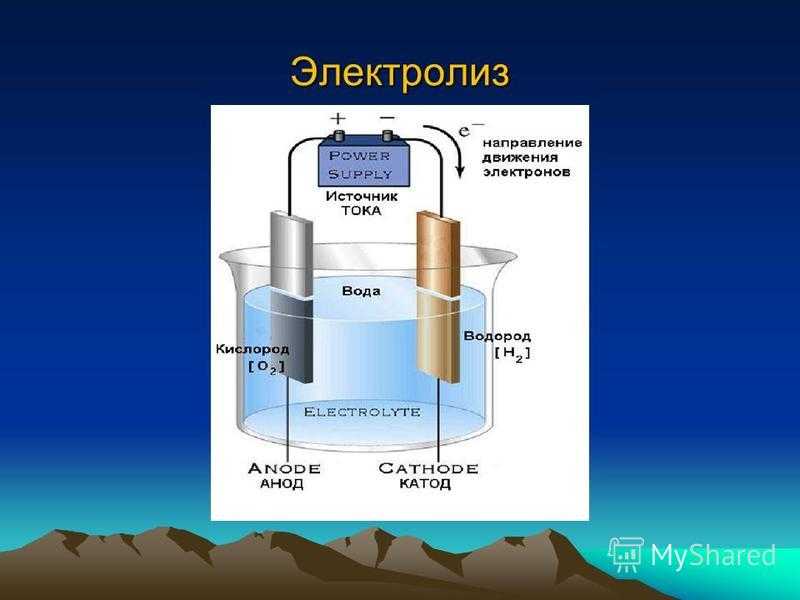 Водород долгое время считался идеальным источником, поскольку при горении он не загрязняет воздух. Проблема заключалась в том, чтобы найти способы экономичного производства водорода. Один из новых подходов, который изучается, — это фотоэлектролиз — производство электричества с использованием фотогальванических элементов для расщепления молекул воды. Этот метод все еще находится на стадии исследований, но, похоже, в будущем он станет очень многообещающим источником энергии.
Водород долгое время считался идеальным источником, поскольку при горении он не загрязняет воздух. Проблема заключалась в том, чтобы найти способы экономичного производства водорода. Один из новых подходов, который изучается, — это фотоэлектролиз — производство электричества с использованием фотогальванических элементов для расщепления молекул воды. Этот метод все еще находится на стадии исследований, но, похоже, в будущем он станет очень многообещающим источником энергии.
Электролиз воды
При электролизе воды образуются газообразные водород и кислород. Электролитическая ячейка состоит из пары платиновых электродов, погруженных в воду, к которым добавлено небольшое количество электролита, такого как \(\ce{H_2SO_4}\). Электролит необходим, потому что чистая вода не несет достаточного заряда из-за отсутствия ионов. На аноде вода окисляется до газообразного кислорода и ионов водорода. На катоде вода восстанавливается до газообразного водорода и ионов гидроксида. 90_\text{ячейка} = -2,06 \: \text{V} \end{array}\nonumber \]
Чтобы получить общую реакцию, полуреакция восстановления была умножена на два, чтобы уравнять электроны.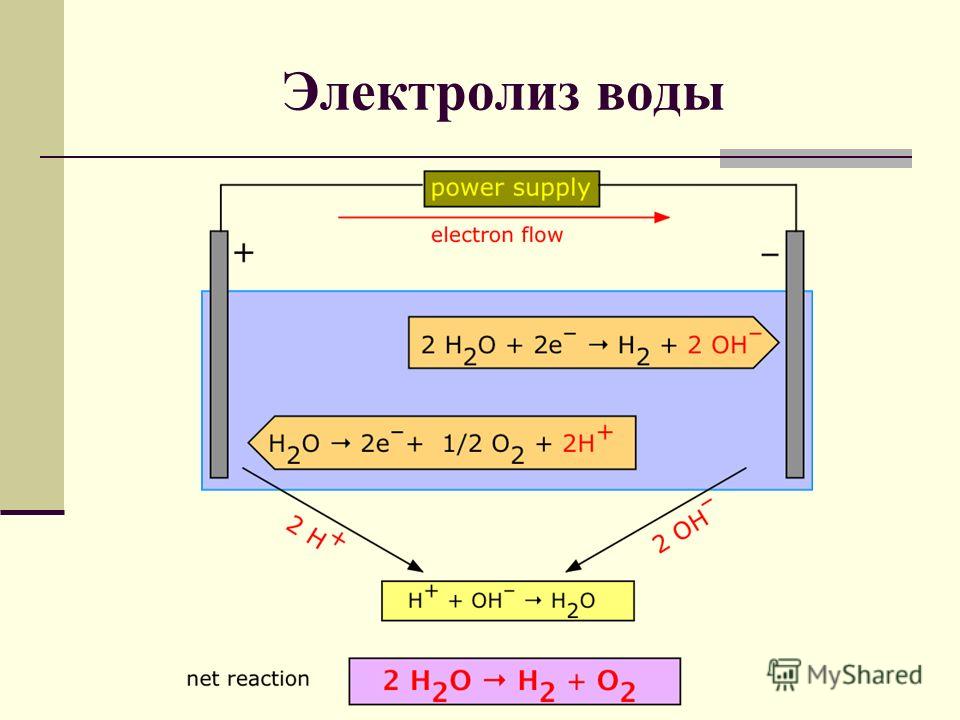


 М., Помашин О.П., Промышленный
мембранный электролиз, М., 1989;
М., Помашин О.П., Промышленный
мембранный электролиз, М., 1989;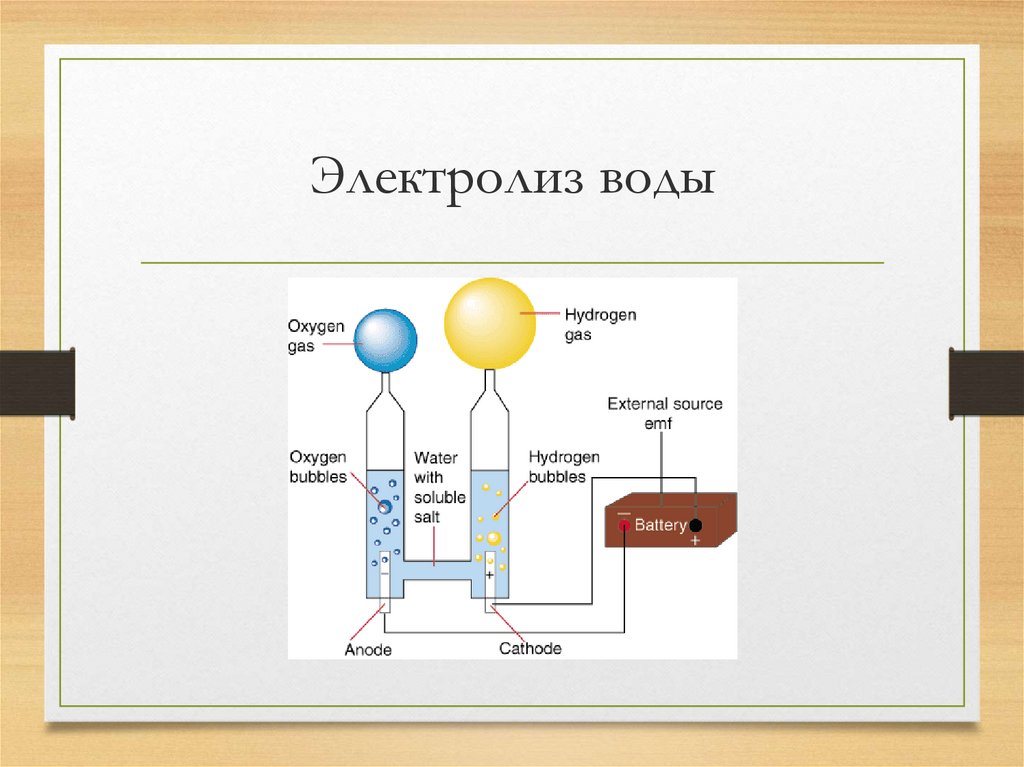 Проведите этот эксперимент по электролизу еще раз, используя солнечные элементы вместо батареи.
Проведите этот эксперимент по электролизу еще раз, используя солнечные элементы вместо батареи.