Электродвижущая сила (эдс) гальванического элемента
Причиной возникновения электрического тока в гальваническом элементе является разность электродных потенциалов двух окислительно-восстановительных систем. Эту разность обозначают символом ∆Е и называют электродвижущей силой (ЭДС) гальванического элемента. Поскольку ЭДС — величина положительная, её находят кАк разность между большим (катод) и меньшим (анод) значениями электродных потенциалов:
∆Е = Е(катода) – Е(анода).
Таблица стандартных окислительно-восстановительных потенциалов
Чаще всего в таких таблицах полуреакции восстановления приводятся не в порядке увеличения значений Ео, а группируются по признаку содержания в них определённых элементов, например, соединения азота, марганца, хрома и т.д. Обратите внимание на следующее. В таблице, в соответствии с рекомендациями ИЮПАК,
Используя значения электродных или окислительно-восстановительных потенциалов полуреакций, можно выполнить следующие операции:
1. Оценить окислительно-восстановительные свойства веществ.
Из нескольких веществ более сильными восстановительными свойствами обладает то вещество, которому соответствует полуреакция с более низким значением потенциала. И наоборот: более сильными окислительными свойствами обладает то вещество, которому соответствует полуреакция с
2. Предсказать принципиальную возможность осуществления реакции в
указанном направлении.
Протекание окислительно-восстановительной реакции в данном направлении возможно лишь тогда, когда потенциал полуреакции с участием используемого окислителя будет больше потенциала полуреакции с участием используемого восстановителя.
3. Определить направление протекания реакции.
Любая ОВР всегда протекает в том направлении, в котором осуществляется полуреакциия с более высоким значением потенциала. Этому направлению соответствует положительное значение ЭДС реакции. Однако необходимо помнить, что в данном направлении реакция протекает практически необратимо при ЭДС,
4. Выбрать наиболее вероятную реакцию из нескольких возможных.
Из всех возможных ОВР наиболее вероятной будет та реакция, которой соответствует максимальное значение (ЭДС).
3. Окислительно-восстановительные процессы с участием электрического тока. Электролиз расплавов и водных растворов электролитов. Электролиз с инертными и активными электродами. Схемы процессов на электродах. Получение неорганических веществ и их очистка при помощи электрического тока. Химические источники тока.
1. с. 155-159; 2. с. 285-295; 3. с. 350-358; 4. с. 236; 6. с. 285-287.
Э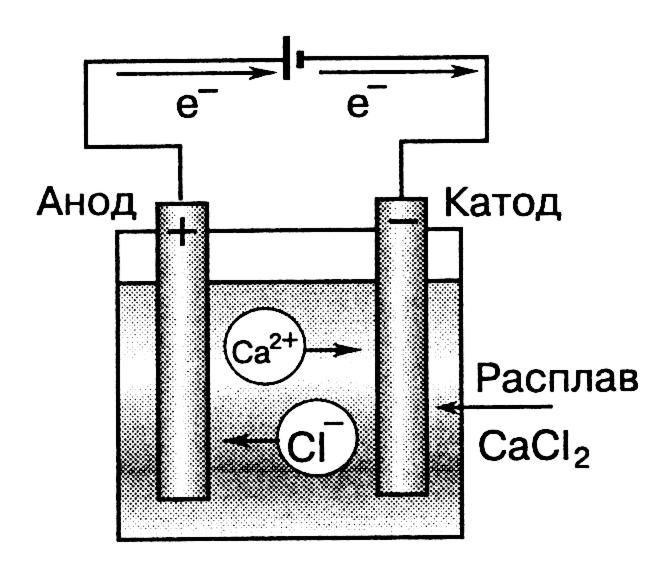 лектролиз – электрохимический
окислительно-восстановительный процесс,
протекающий на электродах при прохождении
постоянного электрического тока через
расплавы или растворы электролитов.
лектролиз – электрохимический
окислительно-восстановительный процесс,
протекающий на электродах при прохождении
постоянного электрического тока через
расплавы или растворы электролитов.
При электролизе энергия электрического тока превращается в химическую энергию и при этом осуществляется процесс, обратный происходящему в гальваническом элементе.
О
Схема процесса электролиза расплава хлорида кальция
братите внимание, что заряды электродов при электролизе противоположны зарядам электродов в гальваническом элементе. Поэтому:Катод – отрицательно заряженный электрод, соединённый с отрицательным полюсом источника тока. Катод при электролизе является восстановителем. На его поверхности протекают процессы катодного восстановления. Катод всегда изготавливается из инертных материалов (графит, платина, золото, иридий и др.)
Анод – положительно заряженный электрод, который при электролизе является окислителем. На его поверхности всегда протекают процессы анодного окисления. Анод может быть изготовлен как из инертных материалов («инертный» или «нерастворимый» анод), так и из металлов, способных в ходе электролиза переходить в раствор («растворимый анод»).
При пропускании электрического тока через расплав или раствор электролита содержащиеся в нём ионы принимают направленное движение: положительно заряженные катионы направляются к отрицательно заряженному катоду, а отрицательно заряженные анионы – к положительно заряженному катоду (Рис. 6).
Процессы на катоде.
В расплавах электролитов на катоде всегда происходит восстановление катионов металлов по схеме: Меn+
В водных растворах электролитов характер процессов на катоде определяется природой катионов:
а) катионы H+ : 2Н+ + 2е— = Н2.
б) катионы [Li+ – Al3+ ] и катионы NH4+: 2Н2О + 2е— = Н2 + 2ОН—.
в) катионы [Bi3+ – Au3+]: Меn+
г) катионы [Mn2+ – Pb2+]: одновременно восстанавливаются катионы металлов и молекулы воды.
Процессы на инертном аноде.
В расплавах электролитов.
а) анионы ОН—: 4ОН— — 4е— = О2 + 2Н2О;
б) галогенид-анионы: 2Гал— -2е— = Гал20;
в) сульфид- и селенид-анионы:
В водных растворах электролитов.
а) анионы ОН—: 4ОН— — 4е— = О2 + 2Н2О;
б) анионы Гал— кроме F—: 2Гал— -2е— = Гал20;
в) сульфид- и селенид-анионы: Э2- — 2е— = Э0;
г) анионы кислородсодержащих неорганических кислот и анионы F—:
2H2O – 4e— = O2 + 4H+
д) анионы карбоновых кислот: 2RCOO— -2e— = R2 + 2CO2.
При электролизе с растворимым анодом происходит его окисление по схеме:
Ме0 – ne— = Men+.
Образующиеся при этом катионы переходят в раствор и восстанавливаются на катоде. Таким образом, электролиз с растворимым анодом заключается в переносе металла с анода на катод.
Пример.
С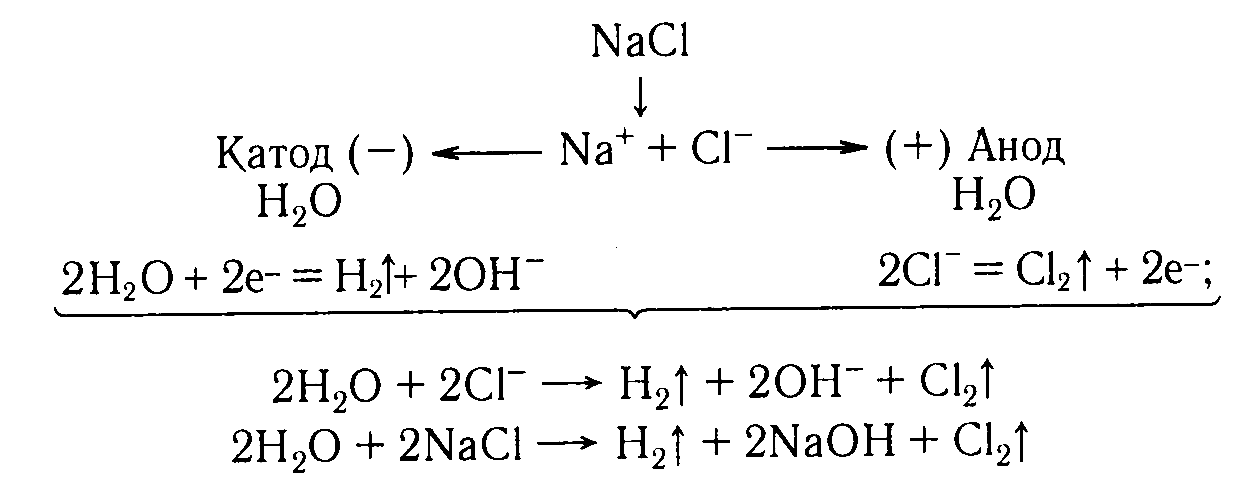 оставим
схемы процессов, протекающих на электродах
при электролизе раствора хлорида натрия
и общее уравнение процесса.
оставим
схемы процессов, протекающих на электродах
при электролизе раствора хлорида натрия
и общее уравнение процесса.
П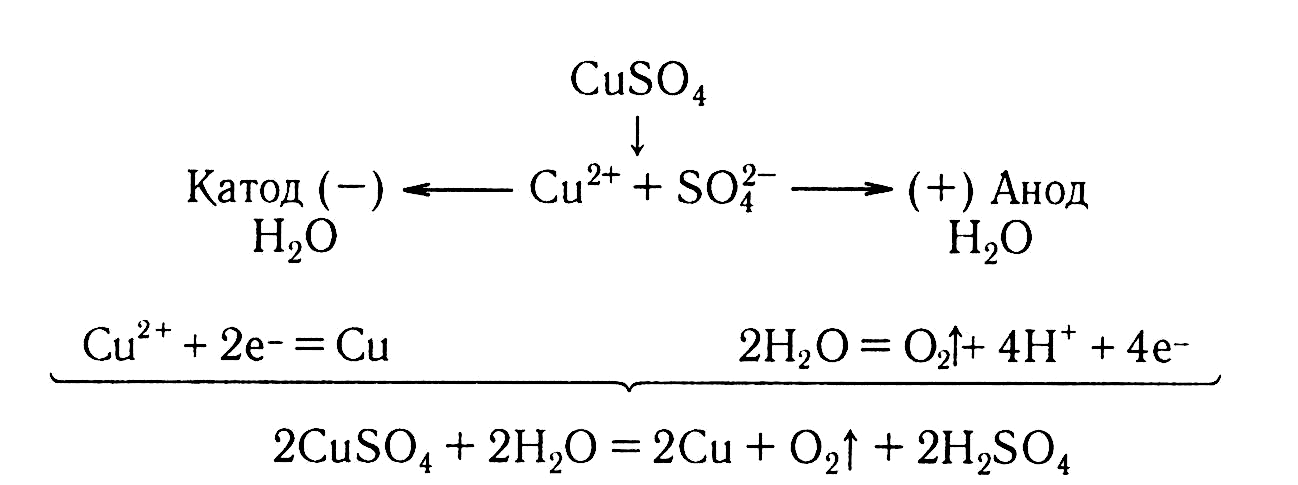 ример.
Составим схемы процессов, протекающих
на электродах при электролизе раствора
сульфата меди(II) и общее уравнение
процесса.
ример.
Составим схемы процессов, протекающих
на электродах при электролизе раствора
сульфата меди(II) и общее уравнение
процесса.
Пример. Составим схемы процессов, протекающих на электродах при электролизе раствора сульфата калия и общее уравнение процесса.
Электродвижущая сила ЭДС — Справочник химика 21
На поверхности контакта двух проводящих фаз электрохимической системы (различной химической природы, агрегатного состояния и типа проводимости) наблюдаются скачки потенциала. Сумма скачков потенциала на всех границах раздела фаз равновесной электрохимической системы называется электродвижущей силой (ЭДС) элемента или цепи. Она может быть непосредственно измерена как разность потенциалов фаз, находящихся на концах цепи. Для электрохимических систем характерны три основные типа скачков потенциала скачки потенциала металл — раствор, раствор — раствор и металл — металл. [c.280]Основная характеристика гальванического элемента — электродвижущая сила (эдс) равна разности его электродных потенциалов [c.135]
Стандартные потенциалы металлов, расположенные в порядке возрастания их алгебраической величины, образуют так называемый ряд напряжений металлов, или ряд стандартных электродных потенциалов. Для определения электродвижущей силы (ЭДС) гальванического элемента следует из стандартного потенциала с большей алгебраической величиной вычесть стандартный потенциал с меньшей алгебраической величиной. Так, ЭДС медно-цинкового гальванического элемента составляет (см. приложение V) [c.126]
Электродвижущая сила (ЭДС) химического источника тока равна разности электродных потенциалов катода, и анода. Существует большое количество гальванических элементов, важнейшие из которых приведены в табл. 96. [c.155]
ЭНЕРГЕТИКА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ И СОЗДАНИЕ ЭЛЕКТРОДВИЖУЩЕЙ СИЛЫ (ЭДС) [c.227]
Таким образом, разность потенциалов на концах равновесной электрохимической цепи однозначно связана с изменением свободной энергии Гиббса в ходе соответствующей химической реакции. Величина Е, т. е. разность потенциалов на концах равновесной электрохимической цепи, называется ее электродвижущей, силой (ЭДС). Если же на отдельных фазовых границах (хотя бы на одной) равновесие не устанавливается, то разность потенциалов на концах цепи не равна ЭДС и уравнение (VI.19) оказывается неприменимым. Величина пРЕ характеризует максимальную электрическую работу, которую можно получить при помощи электрохимической цепи. Уравнение (VI.19) служит основой для расчета АО различных химических реакций. Часто электрохимический метод определения изобарного потенциала имеет существенные преимущества перед термохимическим методом. [c.118]
Основной характеристикой электрохимической системы является электродвижущая сила (ЭДС) — разность потенциалов между двумя металлическими электродами, измеряемая при протекании обратимых процессов в системе. [c.314]
Разность потенциалов электродов гальванического элемента называется его электродвижущей силой ЭДС( ). При расчете значения Е принято из значения потенциала фз электрода, записанного в обозначении состава гальванического элемента справа, вычесть значение потенциала ф1 электрода, записанного в обозначении состава слева, в начале записи Е = = Ф2—Ф1- [c.188]
Разность электродных потенциалов — это электродвижущая сила (ЭДС) гальванического элемента. Так как водородный электрод служит электродом сравнения, для которого о=ОВ, то измеряемая ЭДС рассматриваемого элемента — это потенциал медного электрода по отношению к водородному. Ниже значения электродных потенциалов будем обозначать символом Е (иногда пользуются символом ф), как и ЭДС электродных реакций. Таким образом, потенциалы металлов можно сравнивать по ЭДС гальванической цепи с водородным электродом. [c.326]
Потенциометрические методы основаны на измерении потенциалов различных электродов или, точнее, электродвижущих сил (ЭДС) различных цепей, поскольку экспериментально измеряется именно ЭДС, являющаяся разностью потенциалов. [c.240]
Электрохимическая цепь находится в равновесии, если на всех межфазных границах достигнуто равновесие и исключен диффузионный потенциал. В этом случае разность потенциалов между концами проводников первого рода, присоединенных к электродам, называется электродвижущей силой (ЭДС) гальванического элемента. [c.218]
Если в цепи 1 > Уз, то ток всегда течет от к Уд для того чтобы цепь была замкнутой, ток внутри электрической батареи — источника тока — должен течь в обратную сторону, т. е. от отрицательного электрода к положительному. Это осуществляется за счет так называемой электродвижущей силы (ЭДС), уравновешивающей разность потенциалов во внешней цепи и падение потенциала на внутреннем сопротивлении Ло батареи [c.185]
Разность электродных потенциалов Е — это электродвижущая сила (эдс) гальванического элемента. Так как водородный электрод служит электродом сравнения, для которого °н /н2 = = 0, то измеряемая эдс рассматриваемого элемента — это потенциал медного электрода по отношению к водородному. [c.261]
Определение энергии Гиббса процесса. Подобно энтальпии ЛЯ и энтропии 5 величину ЬС физико-химических процессов можно определить экспериментально. Один из широко применяемых методов определения ДС окислительно-восстановительных реакций заключается в проведении их в гальваническом элементе и измерении его электродвижущей силы (эдс). Рассмотрим этот метод определения ДС7 на примере реакции вытеснения цинком меди из раствора сульфата меди [c.203]
Электродвижущая сила (ЭДС) этой цепи при протекании какой-либо химической реакции в стандартных условиях (температура 25°С, давление 1 атм, концентрации всех веществ в ячейках- [c.163]
По табл. 93 находим, что для С1 — -С1 о= 1,359 В, а для SOi S05 o = = 0,17 В. Разность стандартных потенциалов ионов, участвующих в реакции, называется электродвижущей силой (ЭДС) реакции. Чем больше ЭДС, тем энергичнее протекает реакция. Для реакции окисления сульфит-иона ЭДС равна [c.150]
Вертикальные черточки здесь обозначают поверхности раздела фаз. В случае положительной электродвижущей силы (ЭДС) слева располагают отрицательный электрод, справа — положительный. Для того чтобы учесть соединение меди и цинка (непосредственное или с помощью промежуточных металлов), про- [c.232]
Соединение электродов металлическим проводником приводит к возникновению электрического тока. Следовательно, в этой системе возникает электродвижущая сила — ЭДС элемента. 3)та ЭДС способна совершать работу по переносу электрона по металлическому проводнику (а следовательно, и любые виды работы, в которые можно преобр
Калькулятор ЭДС гальванического элемента | Новости науки
Калькулятор ЭДС гальванического элемента — это простой инструмент, который предоставляет вам значение электродвижущей силы (EMF) для любой гальванической ячейки с заданным потенциалом электродов. Если вы немного запутались со всеми этими терминами, не волнуйтесь!
В статье ниже вы найдете краткое описание того, что такое ЭДС, как рассчитать ЭДС и примеры источников электродвижущей силы. Более того, мы подготовили объяснение окислительно-восстановительной реакции и гальванического элемента. Краткое пошаговое руководство демонстрирует использование калькулятора.
Что такое ЭДС?
ЭДС — это сокращение от электродвижущей силы. По определению, ЭДС — это сила или электрическое давление, которое генерирует ток в цепи. Единицы измерения ЭДС в вольтах [В].
Чтобы лучше понять это определение, рассмотрим типичную гальваническую ячейку, состоящую из двух электродов. Электродвижущая сила — это разность потенциалов между ними.
Кроме того, электродвижущая сила гальванического элемента определяет способность электрохимического элемента вызывать поток электронов через электрическую цепь.
Уравнение ЭДС
Электродвижущая сила электрохимической ячейки может быть рассчитана с использованием уравнения:
EMFcell [V] = Ecathode [V] — Eanode [V]
где Ecathode — это потенциал катода (в вольтах), а Eanode — это потенциал анода (в вольтах). Помните, что в ячейке потенциал катода выше, чем потенциал анода.
Электропотенциал анода и катода
Если вы хотите найти потенциал металлического электрода, один из способов — проверить гальванический ряд и найти конкретный металл в таблице. Второй способ — рассчитать его, используя уравнение Нерста, также известное как уравнение потенциала ячейки. Эта формула позволяет рассчитать восстановительный потенциал полуклеточной или полной клеточной реакции.
В таблице ниже вы можете найти электропотенциал металлов:
Электрод E⁰ [V]
Li / Li⁺ -3.04
Ca / Ca²⁺ -2,86
Mg / Mg²⁺ -2,36
Al / Al³⁺ -1,69
Mn / Mn²⁺ -1,18
Zn / Zn²⁺ -0,76
Cr / Cr³⁺ -0,74
Fe / Fe²⁺ -0,44
Cd / Cd²⁺ -0,40
Co / Co²⁺ -0,28
Ni / Ni²⁺ -0,26
Sn / Sn²⁺ -0,14
Pb / Pb²⁺ -0,14
Fe / Fe³⁺ -0.04
H₂ / 2H⁺ 0,00
Bi / Bi³⁺ +0.32
Cu / Cu²⁺ +0,34
Ag / Ag⁺ +0,80
Hg / Hg²⁺ +0,85
Au / Au³⁺ +1,52
Как рассчитать ЭДС?
Взгляните на пример расчета ЭДС ниже.
Давайте рассмотрим ячейку Даниэля — простую электрохимическую ячейку, изобретенную в 1836 году Джоном Фредериком Даниэлем (британский химик и метеоролог). В этой ячейке медь погружается в раствор сульфата меди (II), а цинк — в раствор сульфата цинка.
Схема ячейки: (-) Zn | Zn2 + || Cu2 + | Cu (+)
Проверьте потенциал металла: электродный потенциал цинка составляет -0,76 В, а меди — +0,34 В ⇒ из-за более низкого потенциала цинк является анодом, а медь — катодом. Введите эти значения в наш калькулятор.
Рассчитайте значение ЭДС электрохимической ячейки, используя уравнение:
EMFcell = +0,34 В — (-0,76 В) = 1,10 В
Электродвижущая сила ячейки Даниэля равна 1,10 вольт.
Источники электродвижущей силы
Ниже вы можете найти несколько примеров источников ЭМП:
- батареи
генераторы переменного тока
гальванические элементы
солнечные батареи
топливные элементы
термопары
некоторые живые организмы (например, электрический угорь)
Каждый из перечисленных выше источников ЭДС содержит источник энергии, который вызывает поток электрических зарядов. Этими источниками могут быть химические процессы (в батареях, топливе и гальванических элементах), механические силы (в генераторах), электромагнитное излучение, излучаемое Солнцем (в солнечных элементах) и разность температур (в термопарах).
Типы электрохимических ячеек
Электрохимическая ячейка является одним из видов источников энергии. Его можно создать, поместив металлические электроды в электролит, где химическая реакция генерирует или использует электрический ток.
Электрохимические элементы, которые генерируют электрический ток, называются гальваническими элементами (названными в честь их изобретателя, итальянского физика Алессандро Вольта) или гальваническими элементами (названными в честь итальянского физика и врача Луиджи Гальвани).
Обычные батареи состоят из одного или нескольких таких элементов. В других электрохимических элементах электрический ток, подаваемый извне, используется для запуска химической реакции (которая не должна происходить самопроизвольно).
Окислительно-восстановительная реакция
Процессы восстановления и окисления происходят только вместе (невозможно, чтобы эти реакции происходили отдельно). Вот почему окислительно-восстановительные реакции могут быть описаны как две полуреакции, одна представляет процесс окисления, а другая — процесс восстановления. Давайте посмотрим на это на примере ячейки Даниэля.
В ячейке Даниэля медь погружается в раствор сульфата меди (II), а цинк — в раствор сульфата цинка. В этой ячейке цинк действует как анод (из-за более низкого электрического потенциала), а медь действует как катод (из-за более высокого электропотенциала):
E⁰ цинкового электрода = -0,76 В
E⁰ медного электрода = +0,34 В
Общая химическая реакция клетки Даниэля: Zn (s) + Cu2⁺ (aq) → Zn²⁺ (aq) + Cu (s)
Окисление (на аноде): Zn (s) → Zn²⁺ (aq) + 2e⁻
Восстановление (на катоде): Cu2⁺ (aq) + 2e⁻ → Cu (s)
Количество электронов, потерянных восстановителем, равно числу электронов, полученных окислителем (для любой окислительно-восстановительной реакции).
Химический источник тока — Википедия
Хими́ческий исто́чник то́ка (аббр. ХИТ) — источник ЭДС, в котором энергия протекающих в нём химических реакций непосредственно превращается в электрическую энергию.
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был «элемент Вольта» — сосуд с серной кислотой с опущенными в него цинковой и медной пластинками, с проволочными токовыводами. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа «вольтовым столбом». Это изобретение впоследствии использовали другие учёные в своих исследованиях. Так, например, в 1802 году русский академик В. В. Петров сконструировал вольтов столб из 2100 элементов для получения электрической дуги. В 1836 году английский химик Джон Даниель усовершенствовал элемент Вольта, поместив цинковый и медный электроды в раствор серной кислоты. Эта конструкция стала называться «элементом Даниеля».
В 1859 году французский физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор, поместив скрученную в рулон тонкую свинцовую пластину в серную кислоту. Этот тип элемента и по сей день используется в автомобильных аккумуляторах.
В 1865 году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 в качестве деполяризатора с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств.
В 1890 году в Нью-Йорке Конрад Хьюберт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в 1896 году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Самый старый, поныне работающий гальванический элемент — серебряно-цинковая батарея, изготовленная в Лондоне в 1840 году. Подключенный к двум таким последовательно соединенным батареям звонок работает и по сей день в Кларендонской лаборатории Оксфорда[1].
Основу химических источников тока составляют два электрода (положительно заряженный анод, содержащий восстановитель, и отрицательно заряженный катод, содержащий окислитель), контактирующие с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода (отрицательного полюса химического источника тока) к положительному. Это соответствует протеканию электрического тока в направлении от положительного полюса к отрицательному, так как направление тока совпадает с направлением движения положительных зарядов в проводнике.
В современных химических источниках тока используются:
По возможности или невозможности повторного использования химические источники тока делятся на:
- гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций невозможно перезарядить;
- электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
- топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно, пока обеспечивается подача реагентов.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
По типу используемого электролита химические источники тока делятся на кислотные (например свинцово-кислотный аккумулятор, свинцово-плавиковый элемент), щелочные (например ртутно-цинковый элемент, ртутно-кадмиевый элемент, никель-цинковый аккумулятор, никель-кадмиевый аккумулятор) и солевые (например, марганцево-магниевый элемент, цинк-хлорный аккумулятор).
Некоторые виды химических источников тока[править | править код]
Гальванические элементы[править | править код]
Гальванический элемент — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока.
- См. также Категория: Гальванические элементы.
| Тип | Катод | Электролит | Анод | Напряжение, В |
|---|---|---|---|---|
| Литий-железо-дисульфидный элемент | FeS2 | Li | 1,50 | |
| Марганцево-цинковый элемент | MnO2 | KOH | Zn | 1,56 |
| Марганцево-оловянный элемент | MnO2 | KOH | Sn | 1,65 |
| Марганцево-магниевый элемент | MnO2 | MgBr2 | Mg | 2,00 |
| Свинцово-цинковый элемент | PbO2 | H2SO4 | Zn | 2,55 |
| Свинцово-кадмиевый элемент | PbO2 | H2SO4 | Cd | 2,42 |
| Свинцово-хлорный элемент | PbO2 | HClO4 | Pb | 1,92 |
| Ртутно-цинковый элемент | HgO | KOH | Zn | 1,36 |
| Ртутно-кадмиевый элемент | HgO2 | KOH | Cd | 1,92 |
| Окисно-ртутно-оловянный элемент | HgO2 | KOH | Sn | 1,30 |
| Хром-цинковый элемент | K2Cr2O7 | H2SO4 | Zn | 1,8—1,9 |
Другие типы:
Электрические аккумуляторы[править | править код]
Электрический аккумулятор — химический источник тока многоразового действия (то есть в отличие от гальванического элемента химические реакции, непосредственно превращаемые в электрическую энергию, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
- См. также Категория: Аккумуляторы.
Топливные элементы[править | править код]
Топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.
- См. также Категория: Топливные элементы.
- ↑ Exhibit 1 — The Clarendon Dry Pile». Oxford Physics Teaching, History Archive. Retrieved 18 January 2008
- ↑ В демонстрационных экспериментах зачастую используют мякоть плодов апельсина, яблоки и пр.
- Дасоян М. А. Химические источники тока. — 2-е изд. — Л., 1969.
- Романов В. В., Хашев Ю. М. Химические источники тока. — М., 1968.
- Орлов В. А. Малогабаритные источники тока. — 2-е изд. — М., 1970.
- Вайнел Д. В. Аккумуляторные батареи. — пер. с англ., 4-е изд. — М. — Л., 1960.
- The Primary Battery / ed. G. W. Heise, N. C. Cahoon. — N. Y. — L., 1971. — Т. v. 1.
| |||
3.2.2. Уравнение Нернста для эдс гальванического элемента.
Электрической характеристикой электрода является потенциал, а гальванического элемента (электрохимической цепи) ‑ электродвижущая сила (ЭДС), равная алгебраической сумме скачков потенциала, возникающих на границе раздела фаз, входящих в состав цепи. ЭДС электрохимической цепи соответствует разности потенциалов правого (положительного) и левого (отрицательного) электродов и всегда положительна.
ЭДС гальванического элемента (I) равна:
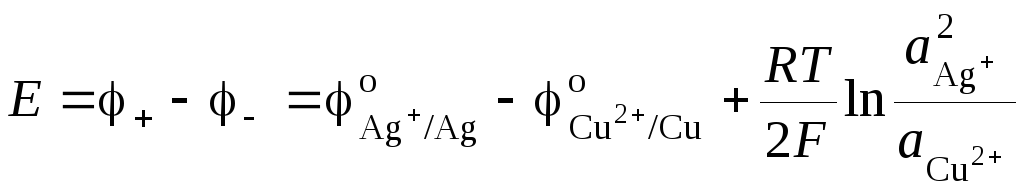 (3.8)
(3.8)
где 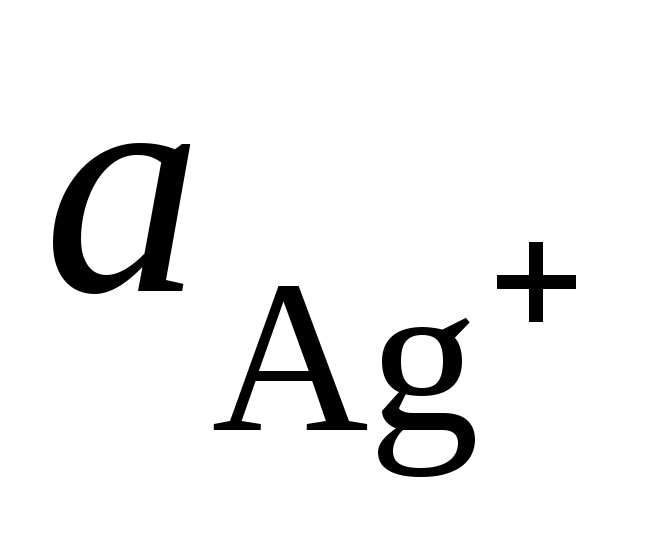 и
и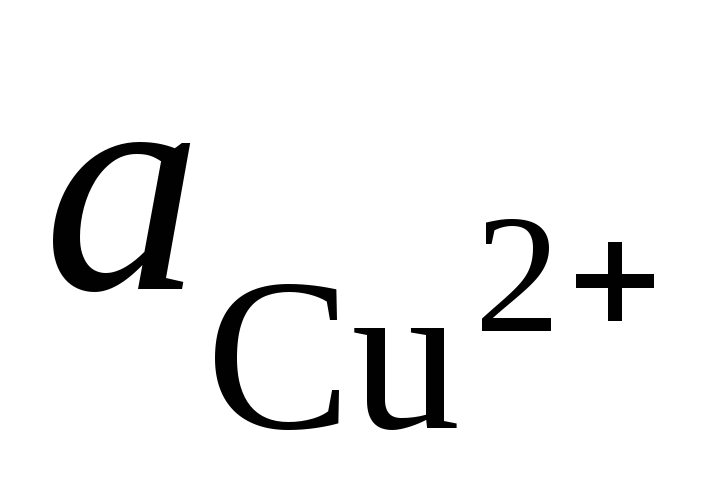 – активности ионов Ag+ и Cu2+ в растворах их солей. Обозначим
– активности ионов Ag+ и Cu2+ в растворах их солей. Обозначим
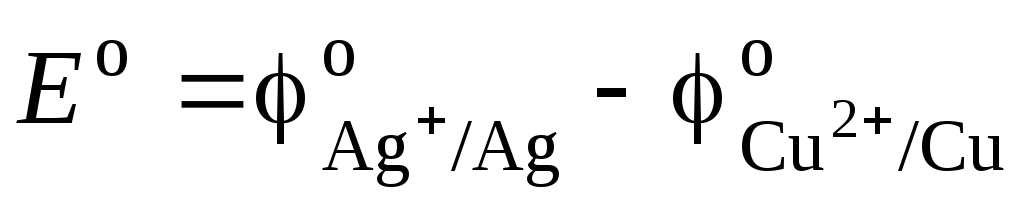 , (3.9)
, (3.9)
где Ео – стандартная ЭДС гальванического элемента. Тогда
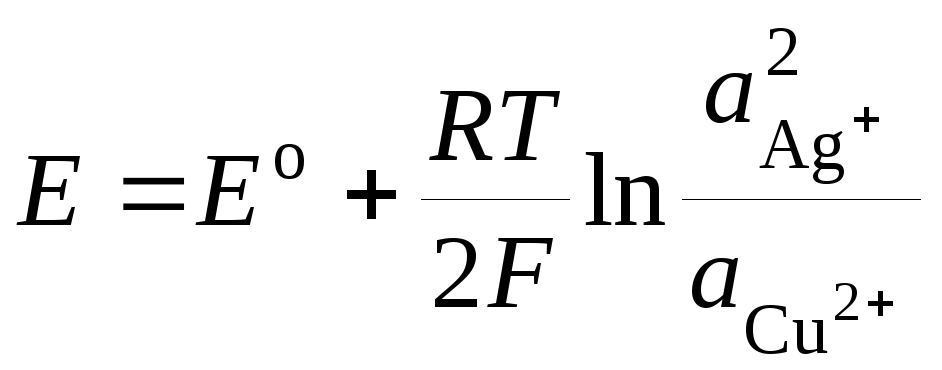 . (3.10)
. (3.10)
Следует помнить, что активность чистого твердого вещества принимается равной единице. Уравнение (3.8) носит название уравнения Нернста для ЭДС гальванического элемента.
Пусть в гальваническом элементе протекает обратимая химическая реакция
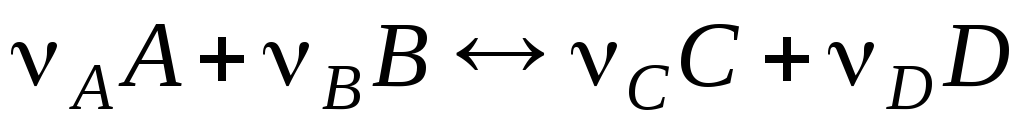 .
.
Максимальная полезная работа гальванического элемента при стандартных условиях равна
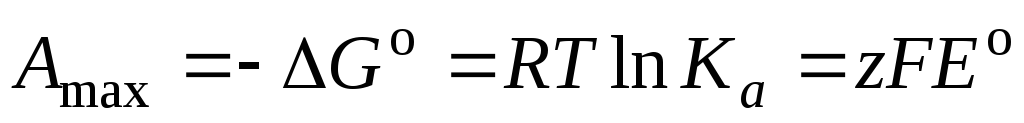 , (3.11)
, (3.11)
где z – число электронов, участвующих в элетродных реакциях (одинаковое для обоих электродов), F – постоянная Фарадея.
По уравнению изотермы Вант-Гоффа
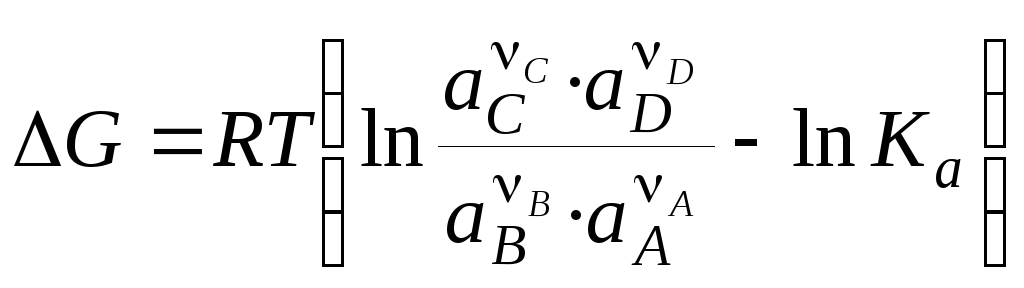 , (3.12)
, (3.12)
или
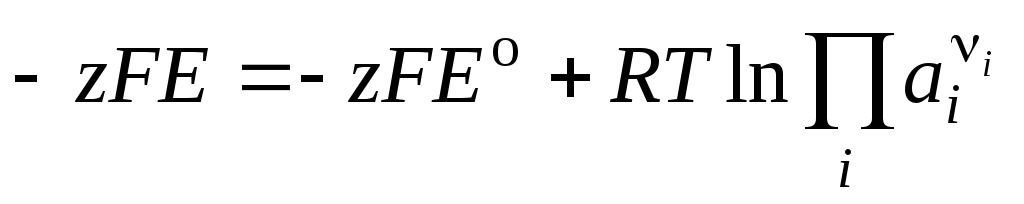 . (3.13)
. (3.13)
Следовательно,
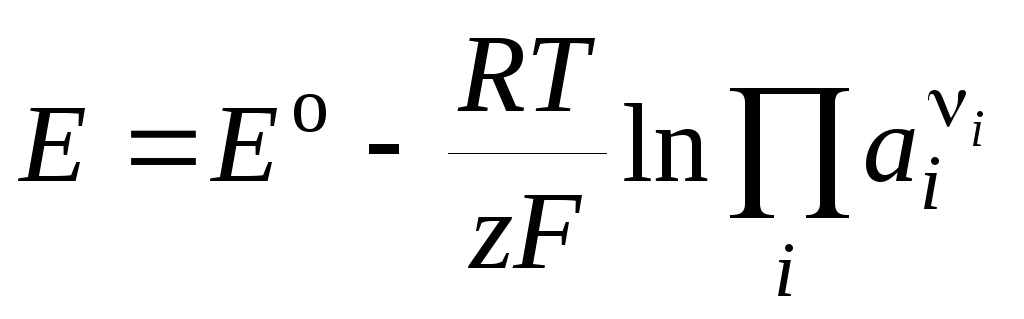 . (3.14)
. (3.14)
Уравнение Нернста в форме (3.14) применимо для расчета ЭДС любого гальванического элемента (по суммарной химической реакции) и потенциала любого электрода (по электродной реакции
3.3. Стандартный водородный электрод.
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ.
Можно с высокой точностью измерить ЭДС цепи, составленной из двух электродов. Однако нельзя ни измерить, ни вычислить абсолютную разность потенциалов φ на границе металл–раствор. Для практических целей достаточно иметь условные величины, характеризующие потенциалы различных электродов, отнесенные к потенциалу некоторого электрода, выбранного за стандартный.
В качестве условно-нулевого потенциала выбран потенциал стандартного водородного электрода:
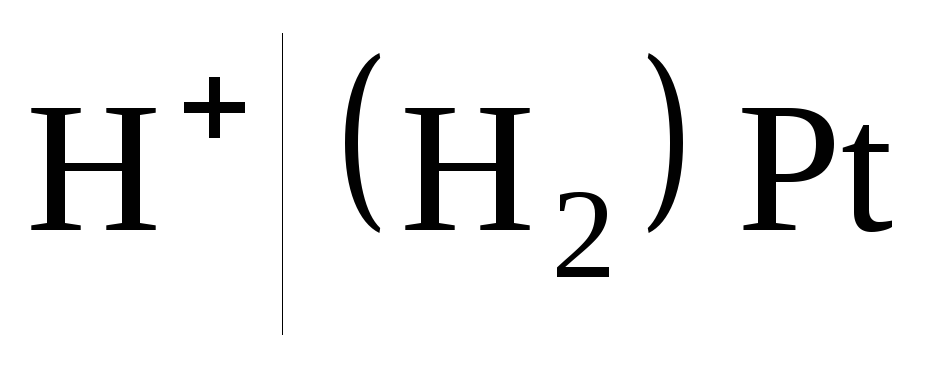 ,
,
в котором давление продуваемого водорода равно 1 атм, а активность ионов водорода в растворе равна 1 (рис. 7).
Электродная реакция
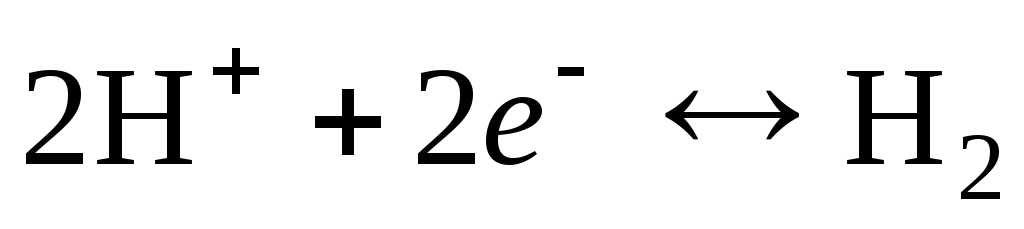 .
.
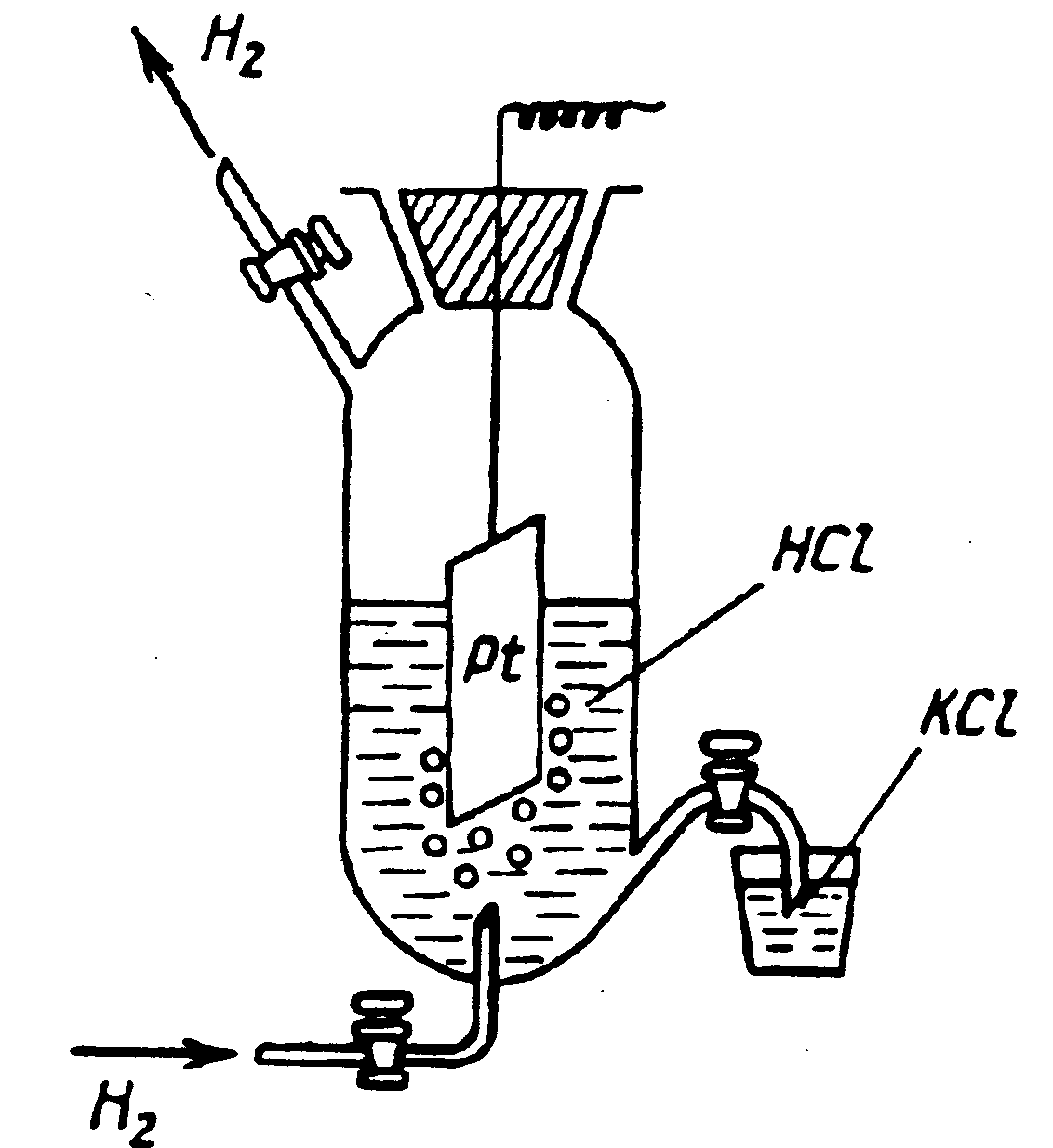
Рис. 7. Общий вид водородного электрода.
Потенциал стандартного водородного электрода равен
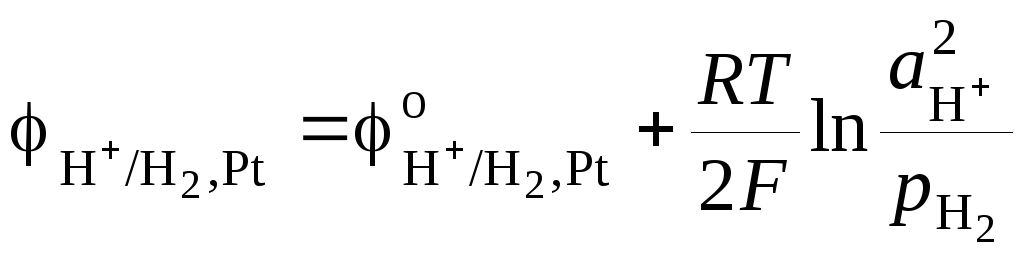 ,
,
С учетом
того, что 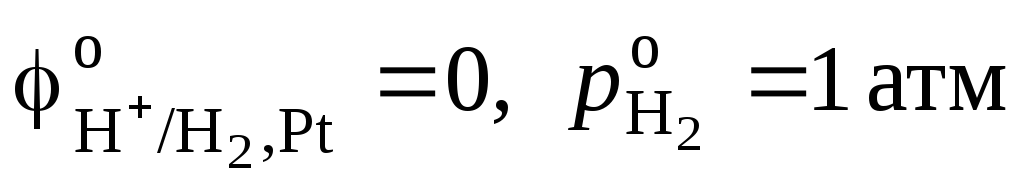 , R = 8.314 Дж·моль-1·К-1, F = 96485 Кл·моль-экв-1,и
заменяя натуральный логарифм десятичным,
получаем
, R = 8.314 Дж·моль-1·К-1, F = 96485 Кл·моль-экв-1,и
заменяя натуральный логарифм десятичным,
получаем
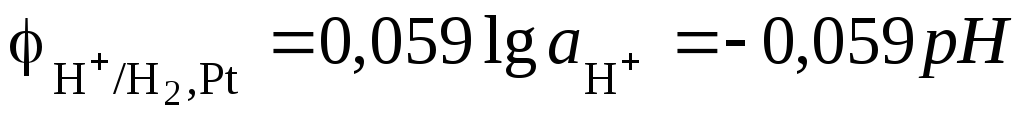 .
.
Электродным потенциалом любого другого электрода называют его потенциал по отношению к стандартному водородному. Другими словами, за электродный потенциал принимают ЭДС цепи, составленной из рассматриваемого электрода и стандартного водородного электрода. При этом справа в цепи расположен рассматриваемый электрод, а слева – стандартный водородный электрод. ЭДС положительна (электродный потенциал положителен), если электрический ток внутри цепи течёт слева направо, и отрицательна – если наоборот.
Пример 3.1.
1) Составим гальванический элемент из платинового и медного электродов:
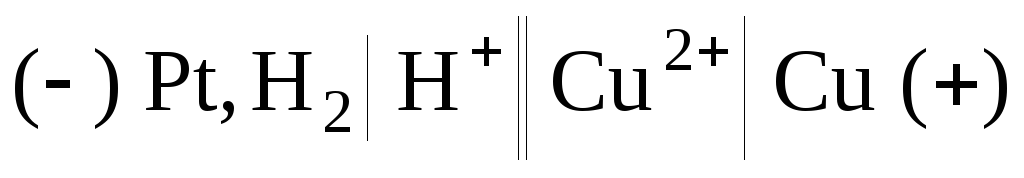 .
.
Суммарная
токообразующая реакция: 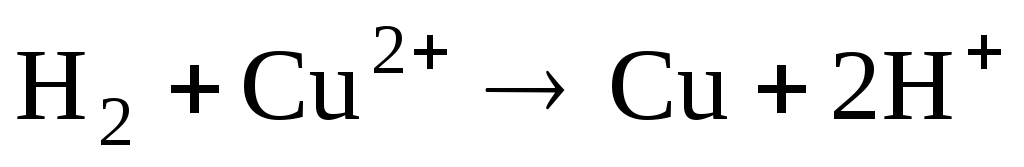 ,
т.е. перенос электронов в цепи происходит
слева направо (от левого электрода к
правому). При стандартных условиях (
,
т.е. перенос электронов в цепи происходит
слева направо (от левого электрода к
правому). При стандартных условиях (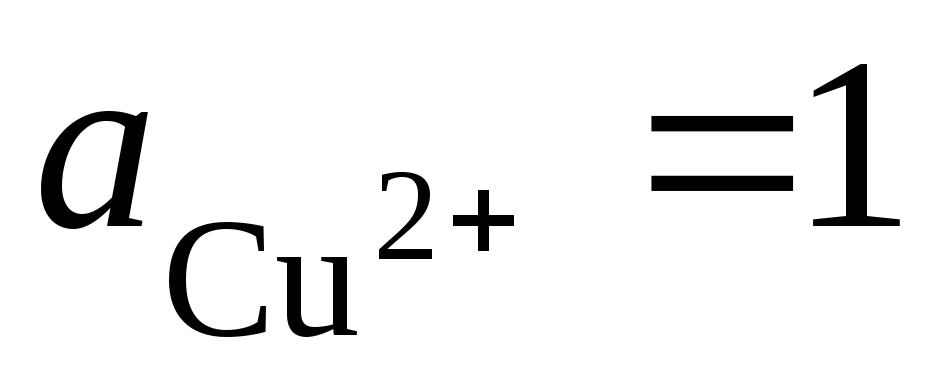 )
)  .
.
2) Составим гальванический элемент из платинового и цинкового эдектродов:
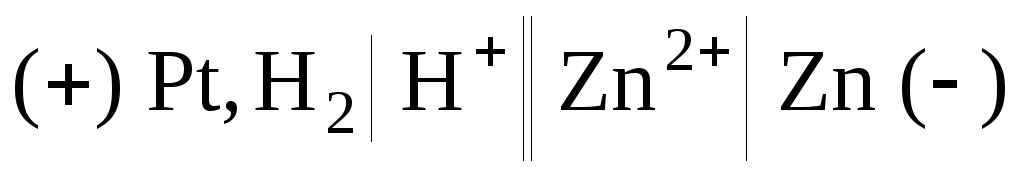 .
.
Суммарная
реакция: 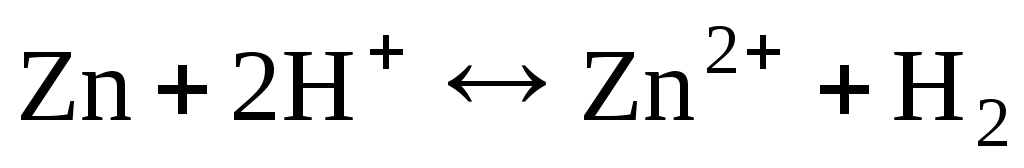 ,
т.е. перенос электронов в цепи происходит
справа налево. При стандартных условиях
(
,
т.е. перенос электронов в цепи происходит
справа налево. При стандартных условиях
(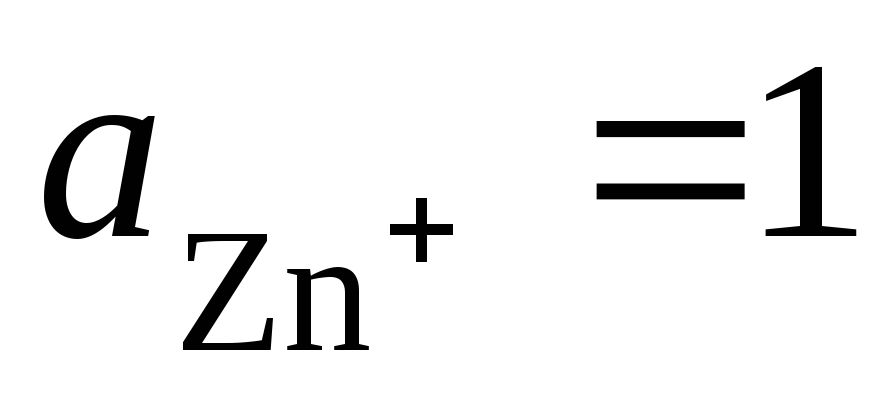 )
) 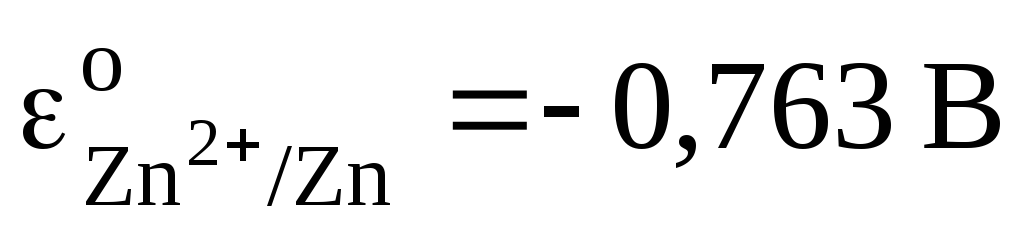 .
.
Следует помнить, что ЭДС цепи всегда положительна, поэтому рассматриваемый гальванический элемент следует записать в следующем виде:
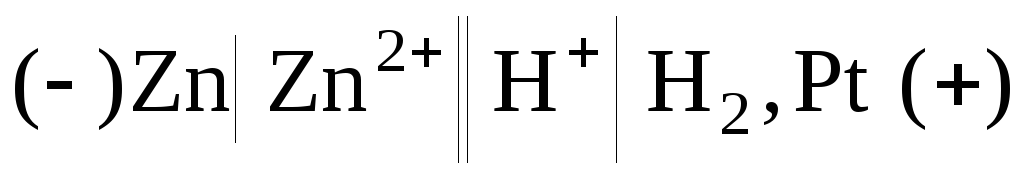 ,
,
при
стандартных условиях 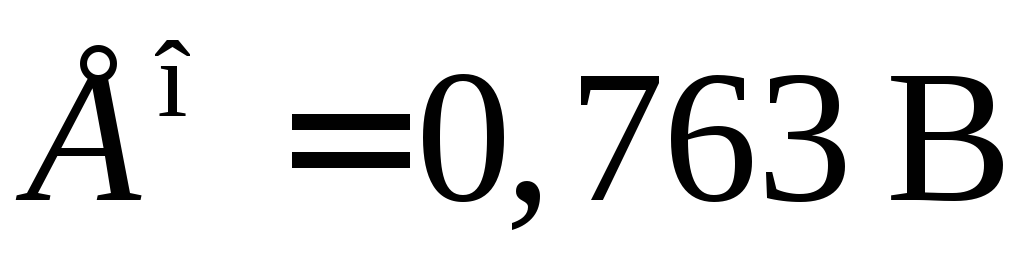 .
.
3.4. ТЕРМОДИНАМИКА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА.
Гальванический элемент при работе в условиях тепловой изоляции нагревается или охлаждается. Поэтому можно предположить, что источником совершаемой электрической работы являются тепловой эффект химической реакции и энергия окружающей среды.
Рассмотрим уравнение Гиббса-Гельмгольца в следующей форме:
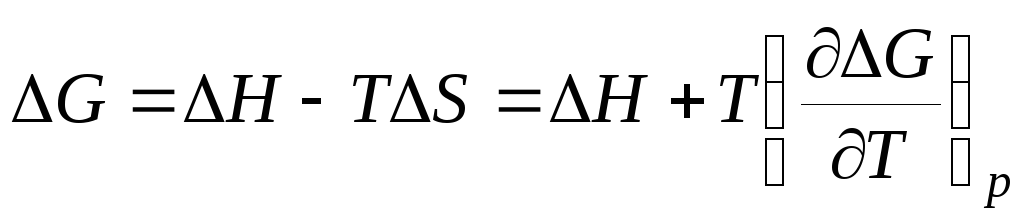 , (3.15)
, (3.15)
где ΔН и ΔS – тепловой эффект и энтропия химической реакции, протекающей в гальваническом элементе. Максимальная полезная работа электрохимической цепи равна убыли энергии Гиббса:
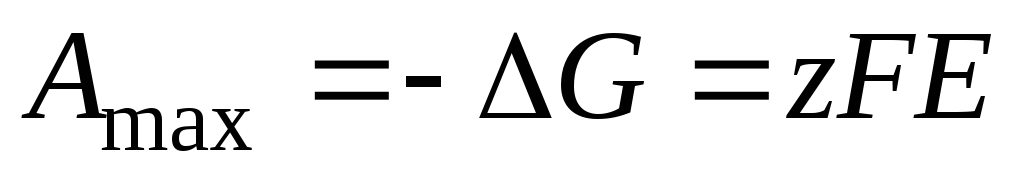 , (3.16)
, (3.16)
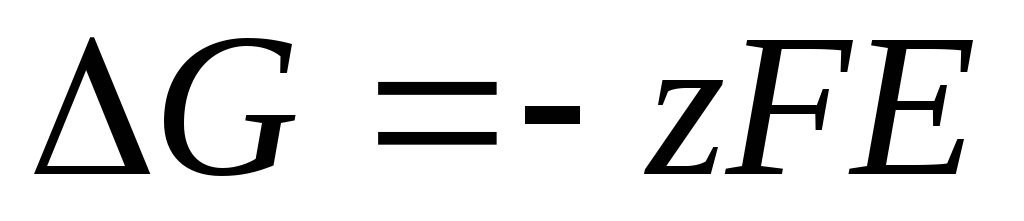 . (3.17)
. (3.17)
Тогда:
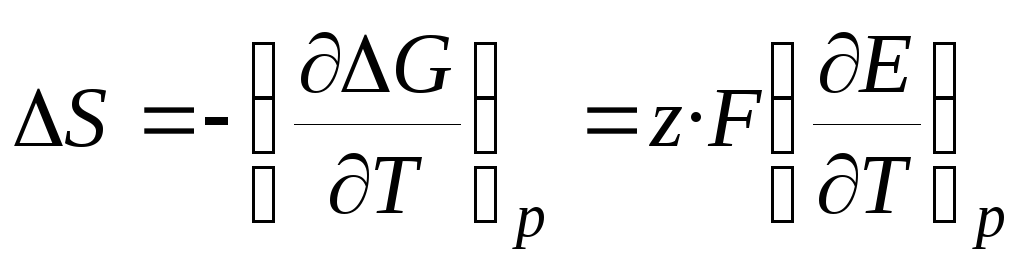 , (3.18)
, (3.18)
, (3.19)
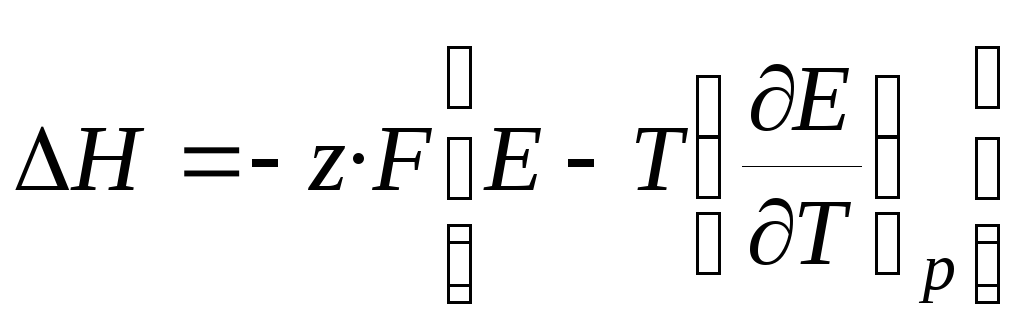 , (3.20)
, (3.20)
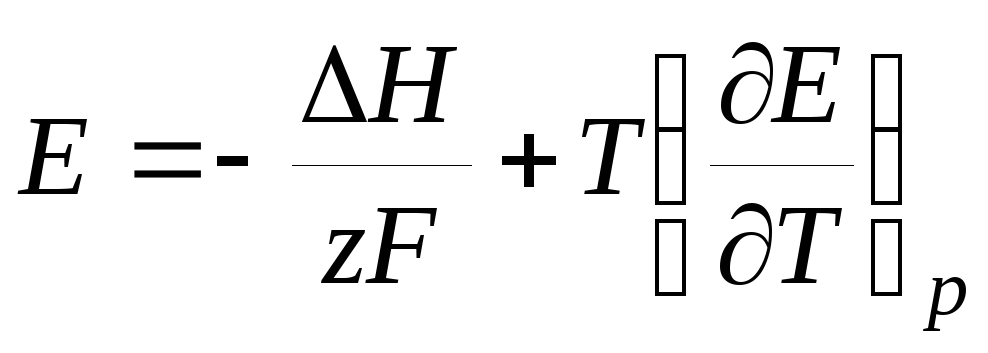 , (3.21)
, (3.21)
Следовательно,
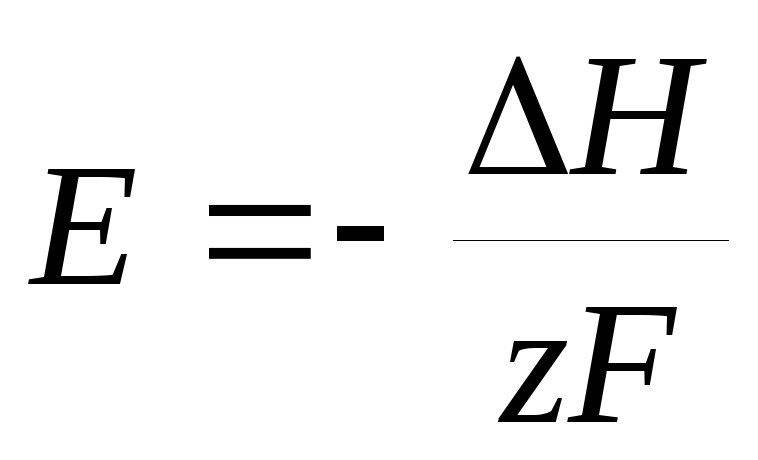 ,
если
,
если 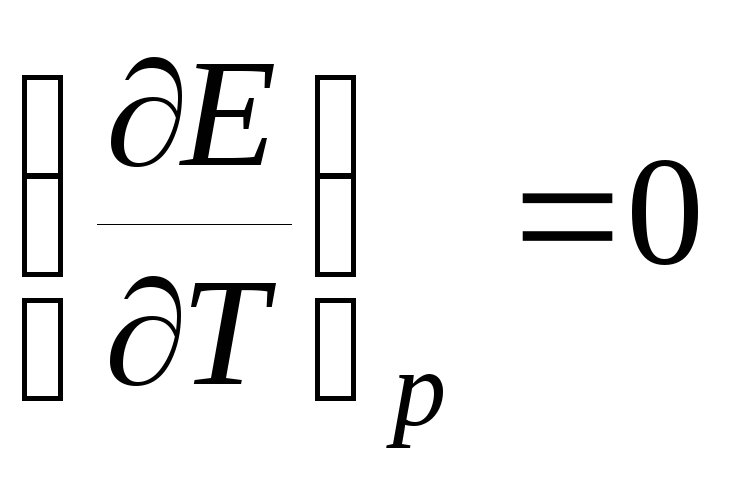 ,
,
т.е. в этом случае вся электрическая работа цепи производится за счет теплового эффекта химической реакции. Если
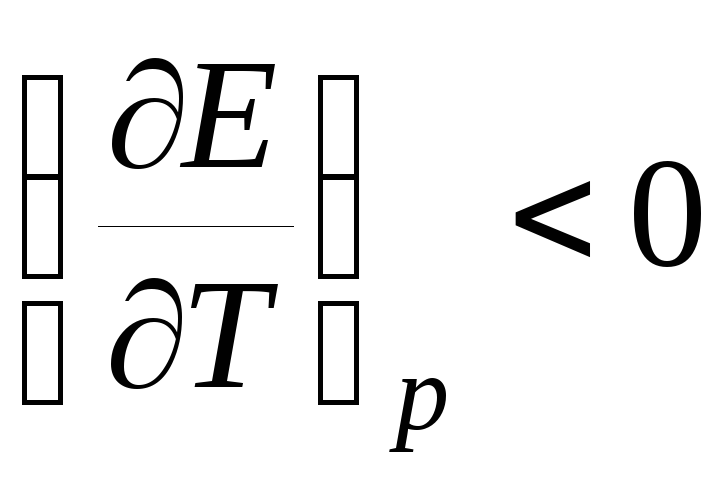 ,
то
,
то  ,
,
т. е. электрическая работа меньше теплового эффекта реакции. Гальванический элемент при изотермических условиях отдает теплоту в окружающую среду или нагревается в условиях тепловой изоляции. Если
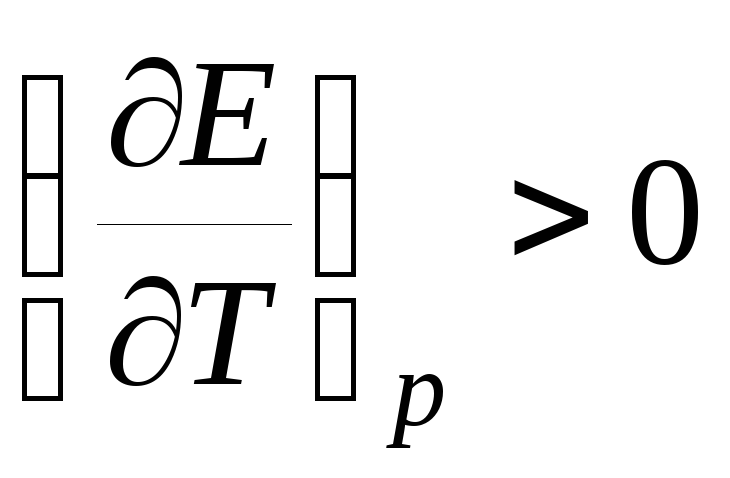 ,
то
,
то 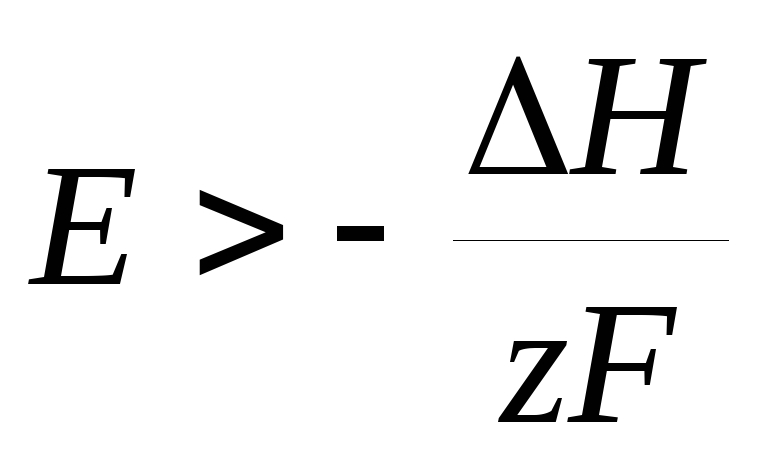 ,
,
т. е. электрическая работа больше теплового эффекта реакции. Гальванический элемент при изотермических условиях поглощает теплоту из окружающей среды или охлаждается в условиях тепловой изоляции.
Измерение ЭДС обратимых гальванических элементов при различных температурах позволяет определить термодинамические характеристики химических реакций, протекающих в них, по уравнениям (3.16), (3.18) и (3.20).
3.5. КЛАССИФИКАЦИЯ ЭЛЕКТРОХИМИЧЕСКИХ ЦЕПЕЙ.
Гальванические элементы классифицируют по двум признакам:
1. По характеру суммарного процесса, лежащего в основе действия гальванического элемента. Это или химическая реакция, или процесс выравнивания концентраций двух растворов одного и того же электролита. По этому признаку элементы делятся на химические и концентрационные.
1.1. Концентрационные цепи. Концентрационные электрохимические цепи состоят из электродов с одинаковыми потенциалопределяющими реакциями. Физические и химические свойства материала электродов одинаковы, но активности одного (или нескольких) участников реакции на каждом из электродов различны. ЭДС цепи определяется отношением активностей (по уравнению Нернста):
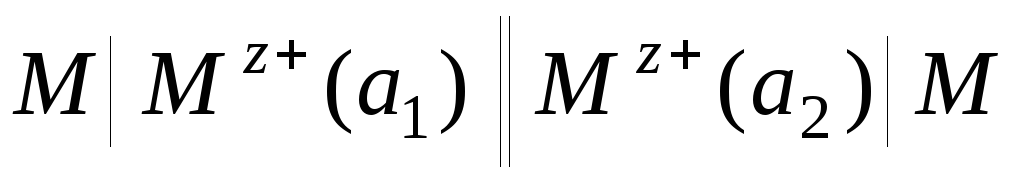 ,
, 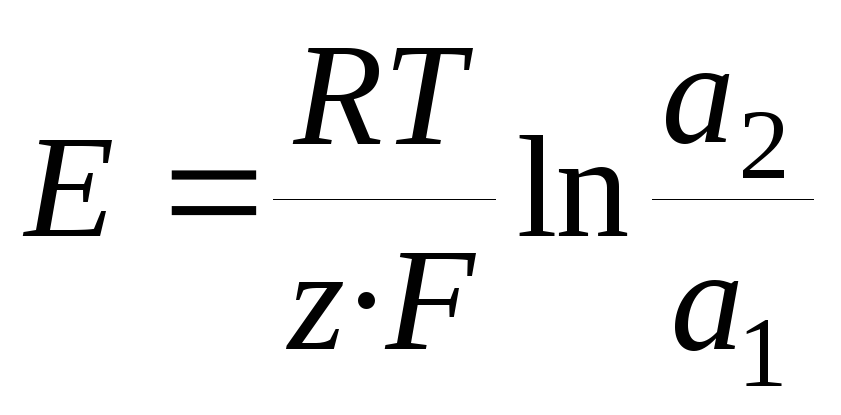 .
.
В
уравнение Нернста для ЭДС цепи не входят
стандартные электродные потенциалы,
так как они одинаковы. По результатам
измерений ЭДС такой цепи и известной
активности компонента в одном электроде
можно рассчитать активность компонента
в другом электроде. Примером концентрационной
цепи может служить следующий гальванический
элемент (а2 > a1): 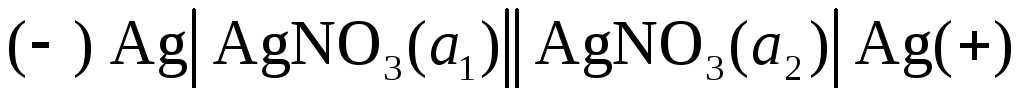 .
.
1.2. Химические
цепи. Химические цепи состоят из электродов,
потенциалопределяющие реакции которых
различны. Электроды в таких системах
отличаются и по физическим, и по химическим
свойствам. Электрическая энергия
возникает за счет энергии суммарной
химической реакции, для которой
справедливы ранее установленные
соотношения между ЭДС и тепловым эффектом
реакции, а также между стандартной ЭДС
и константой равновесия реакции.
Химические цепи разнообразны по природе
и свойствам электродов, из которых они
состоят. Примером такой цепи может
служить серебряно-цинковый элемент: 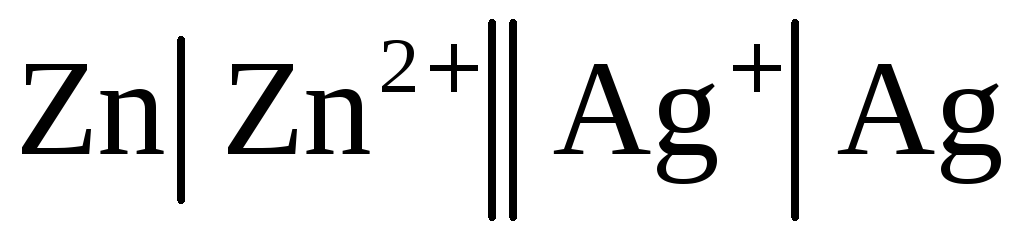 .
.
Чтобы решить вопрос о направлении суммарной химической реакции, протекающей в элементе, прежде всего следует определить полярности электродов. Катодом (положительно заряженным, правым) всегда является электрод с более положительным потенциалом. Так как
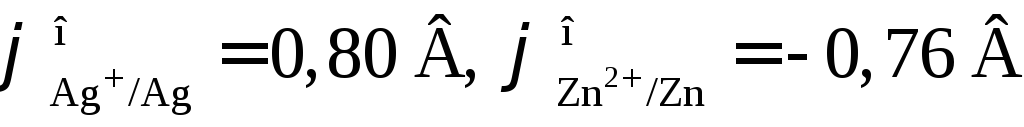 ,
,
то в стандартных условиях серебряный электрод будет катодом, а цинковый электрод ‑ анодом. Стандартная ЭДС элемента равна
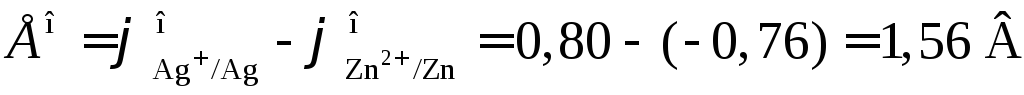 .
.
Уравнения потенциалопределяющих реакций:
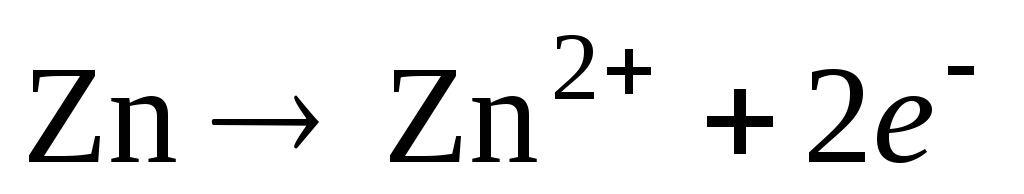 ,
, 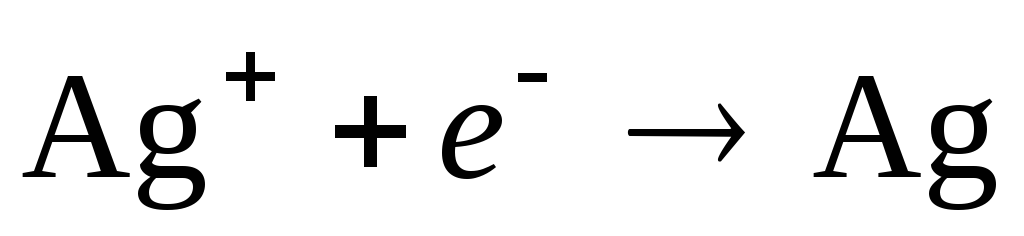 .
.
Суммарная реакция в цепи
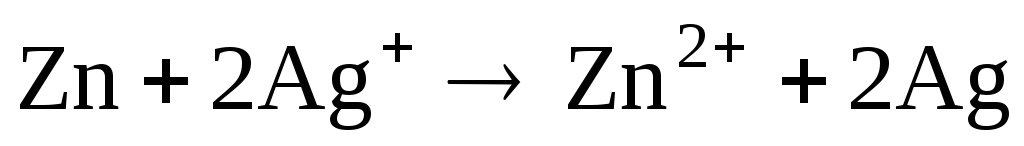
электронейтральна (электродные реакции уравнены по числу электронов и участвующих в них веществ). ЭДС элемента по уравнению Нернста равна
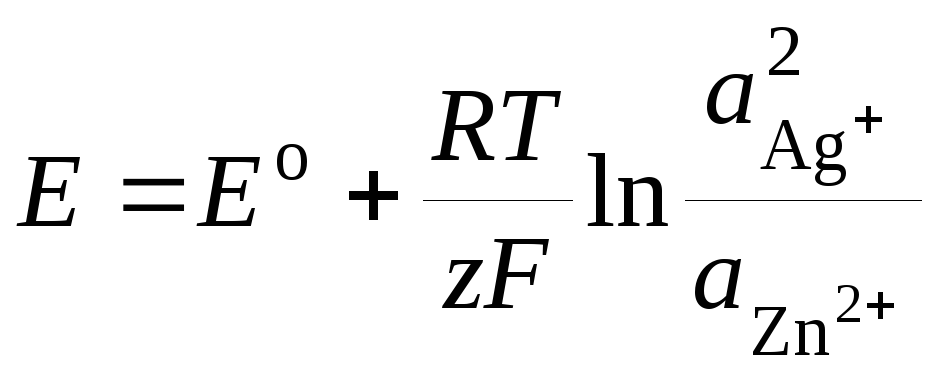 .
.
Важным частным случаем химических цепей являются цепи, в которых хотя бы один из электродов является окислительно–восстановительным. Электрический ток в таких цепях возникает за счет реакций окисления и восстановления, протекающих в растворе. Примером такой цепи является цепь, составленная из стандартного водородного электрода и железного окислительно–восстановительного (редокс) электрода:
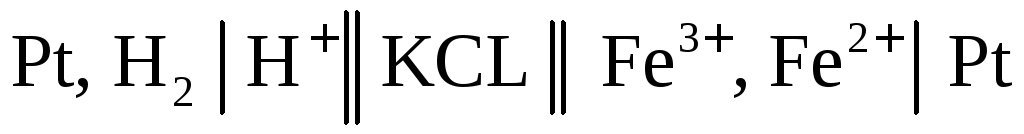 .
.
2. По наличию или отсутствию жидкостного соединения между двумя растворами гальванического элемента. По этому признаку элементы делят на цепи с переносом и цепи без переноса ионов.
2.1. Цепь с переносом – это цепь с жидкостной границей. Например, цепь вида
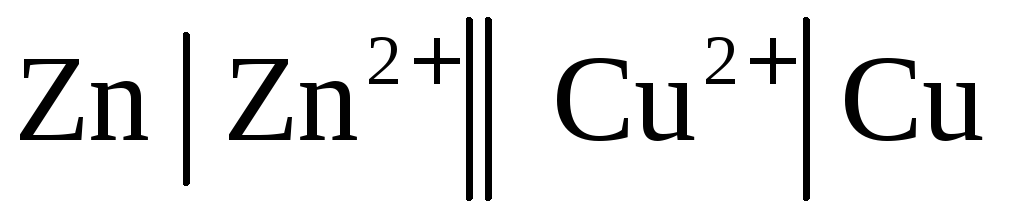 .
.
В состав цинкового и медного электродов входят растворы различной природы. Контакт между двумя растворами обеспечивается с помощью специальных приспособлений, например, солевым мостиком, состоящим из трубки, заполненной смесью влажного желеобразного вещества агар-агара с солью сильного электролита (КСl). Диффузионный потенциал на границе раздела раствор-раствор элиминирован.
2.2. Цепь без переноса – это цепь без жидкостной границы. Например, цепь вида
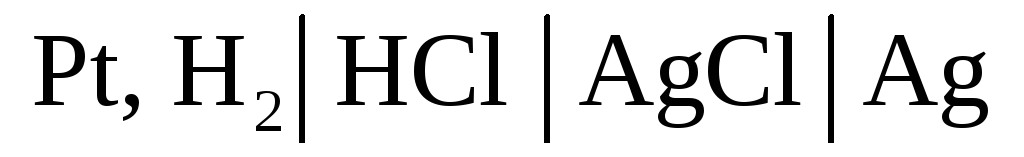 ,
,
в которой оба электрода погружены в один и тот же раствор.
3.6. КЛАССИФИКАЦИЯ Обратимых ЭЛЕКТРОДОВ.
Классификация обратимых электродов основана на свойствах веществ, участвующих в потенциалопределяющих процессах.
3.6.1. Электроды первого рода.
Это металлические электроды, обратимые относительно катионов (в том числе амальгамные) и металлоидные, обратимые относительно анионов (например, Se2-/Se). В таких электродах восстановленной формой является металл, а окисленной – ион этого металла.
Если электрод обратим относительно катиона, то
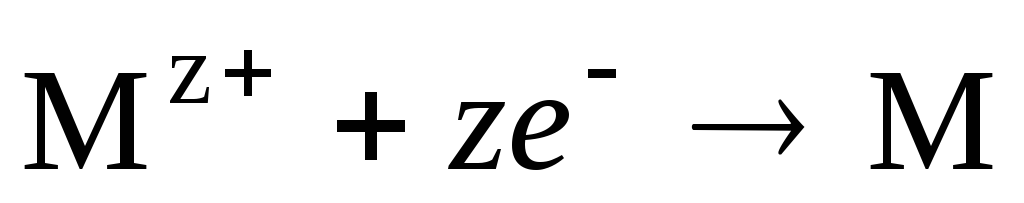 ,
, 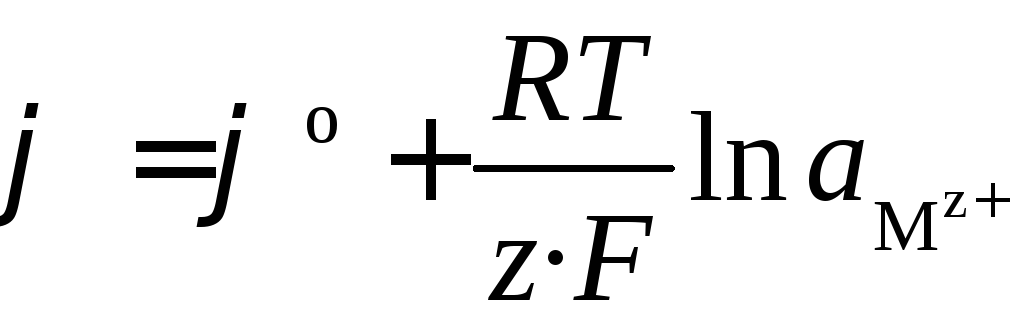 .
.
Если электрод обратим относительно аниона, то
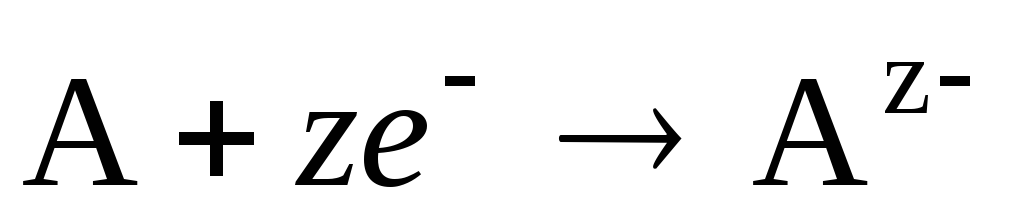 ,
, 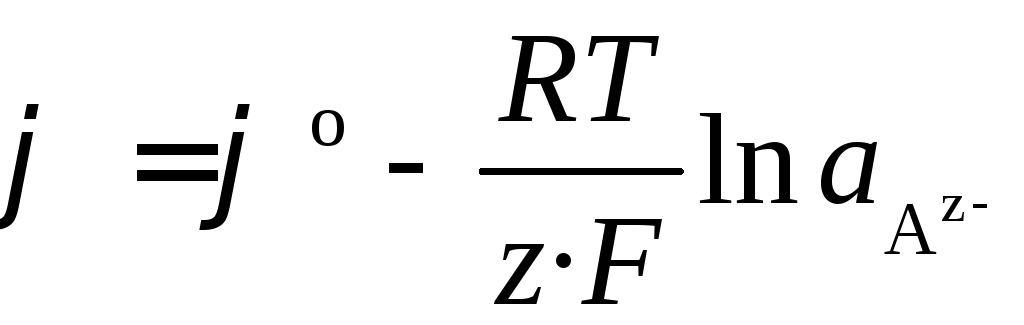 .
.
К электродам первого рода относятся также газовые электроды (водородный, кислородный, хлорный). Они могут быть обратимы по отношению к катиону или аниону. Металл в газовых электродах необходим для создания электронопроводящего контакта между газом и раствором, должен быть инертен по отношению к веществам, находящимся в растворе, и способен катализировать только один потенциалопределяющий процесс. Например, водородный электрод обратим по отношению к катиону. Уравнение электродного процесса в кислой среде
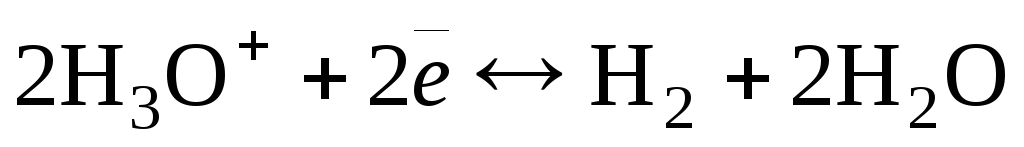
может быть записано в упрощенном виде:
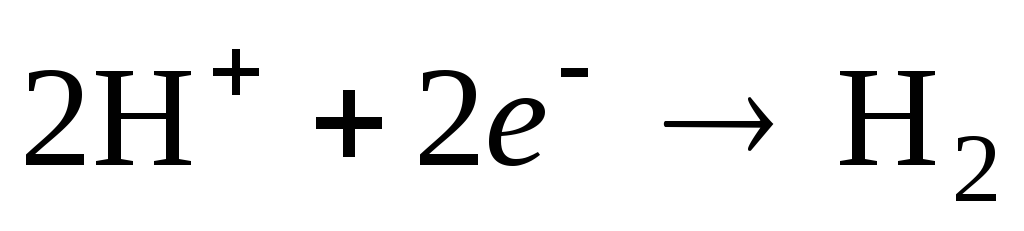 .
.
Потенциал водородного электрода определяется выражением
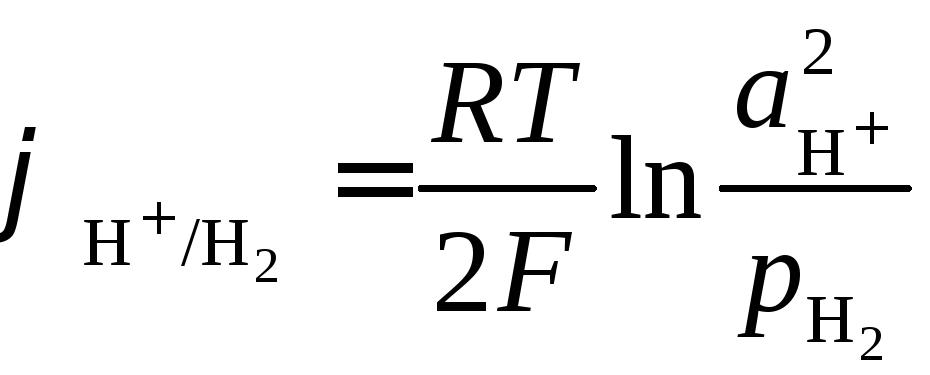 .
.
Примером
газового электрода, обратимым по
отношению к аниону, может быть хлорный
электрод с потенциалопределяющей
реакцией 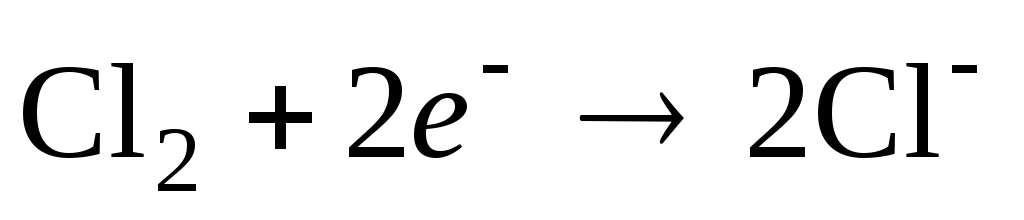 .
.
16. Гальванические элементы: химические, концентрационные. Расчет эдс.
Гальванический элемент — это устройство, в котором энергия химической реакции преобразуется в электрическую энергию.
Типы гальванических элементов:
химические,
концентрационные.
Примером химическогогальванического элемента являетсяэлемент Якоби — Даниэля, состоящий из медного и цинкового электродов, погруженных в растворы своих солей. Схематически данный элемент изображается следующим образом:
Zn / Zn2+ // Cu2+ / Cu.
При работе этого элемента протекают реакции:
анод Zno––>Zn2++2е—
катод Сu2++2е—––>Сuo
При схематическом изображении гальванических элементов слева записывают анод, справа – катод. Суммарный окислительно-восстановительный процесс, происходящий в гальваническом элементе, выражается следующим уравнением:
Сu2++Zno––>Сuo+Zn2+.
ЭДС элемента Даниэля – Якоби рассчитывается с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
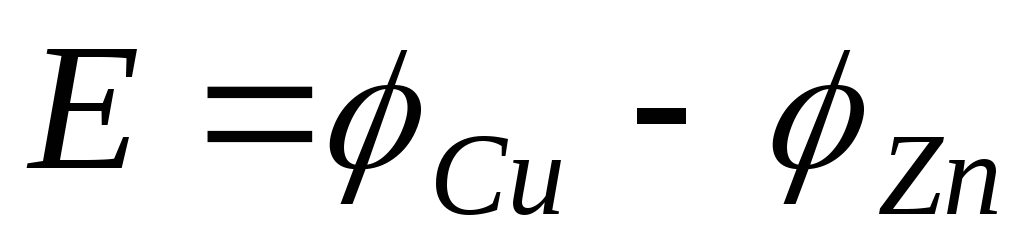 ,
,
или
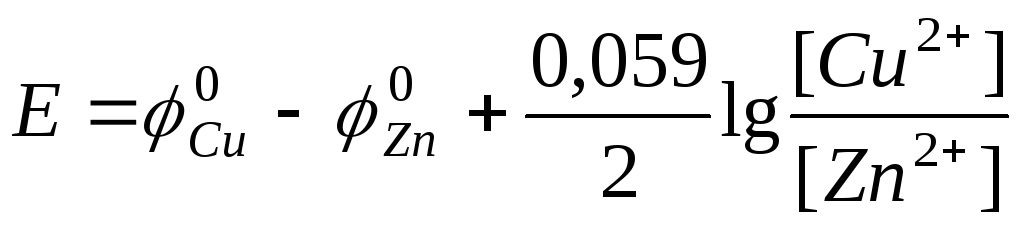 .
.
Концентрационный гальванический элемент состоит из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными активностями а1> а2. Катодом в этом случае будет являться электрод с большей концентрацией.
ЭДС концентрационного гальванического элемента равна:
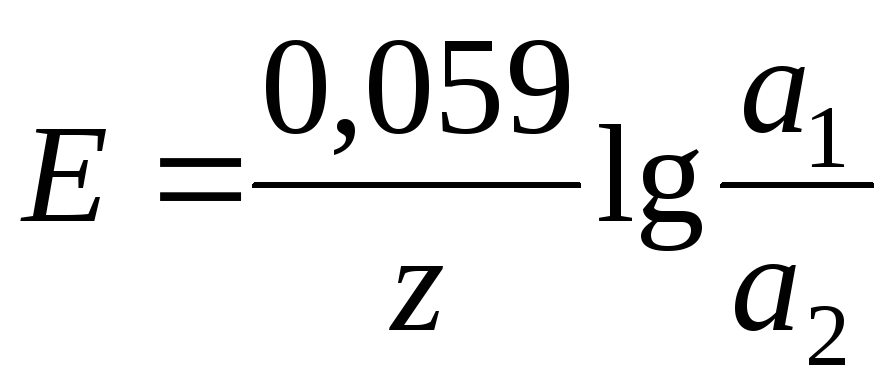 .
.
17. Электроды сравнения (водородный, хлорсеребряный, каломельный).
Электрода сравнения – это электрод с устойчивым потенциалом. К электродам сравнения относятся стандартный водородный, каломельный и хлорсеребряный электроды.
Стандартный водородный электродпредставляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода. Потенциал стандартного водородного электрода (с активностью ионов Н+1 моль/л и давлением водорода 101.3 кПа) принят равным нулю.
Схематически электрод изображают следующим образом:
Рt, Н2 / Н+
На электроде идет реакция:
2Н+ + 2е— ––> Н2
Каломельный электродсостоит из ртутного электрода, помещенного в раствор КСl определенной концентрации и насыщенный каломелью Hg2Сl2:
Нg / Нg2Сl2, КСl
Хлорсеребряный электрод, представляет собой серебряную проволоку, покрытую хлоридом серебра и помещённую в раствор хлорида калия.
Аg / АgСl, КСl
18. Индикаторные электроды (водородный, хингидронный, стеклянный).
Индикаторные электроды это электроды, потенциал которых зависит от активности ионов водорода в растворе, т. е. от pH раствора:
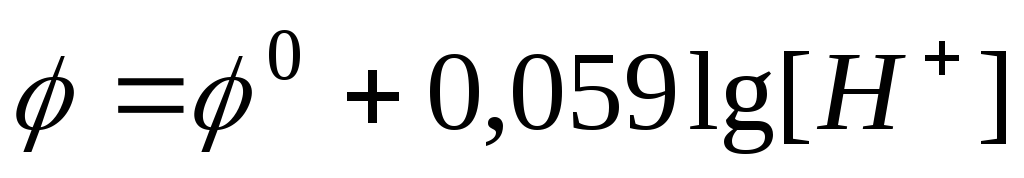
Водородный электродпредставляет собой платиновую пластинку, омываемую газообразным водородом, погруженную в раствор, содержащий ионы водорода.
На электроде идет реакция:
2Н+ + 2е— ––> Н2
Схематически электрод изображают следующим образом: Рt, Н2 / Н+
Потенциал водородного электрода зависит от активности ионов Н+в растворе;
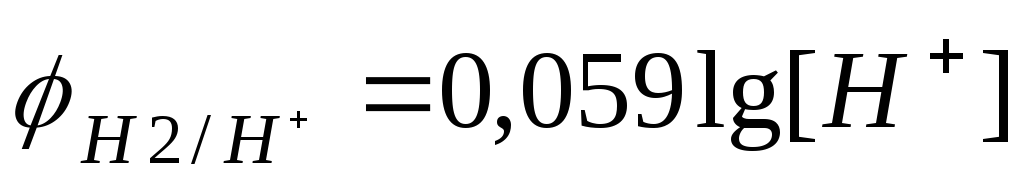
Хингидронный электродпредставляет собой платиновую проволоку, опущенную в сосуд с исследуемым раствором, в который предварительно помещена смесь хинона С6Н4О2и гидрохинона С6Н4(ОН)2. Между этими веществами идет реакция с участием ионов Н+.
С6Н4О2 + 2Н+ + 2е— ––> С6Н4(ОН)2
Схематически электрод изображают следующим образом: Рt/С6Н4О2,С6Н4(ОН)2, Н+
Потенциал хингидронного электрода равен
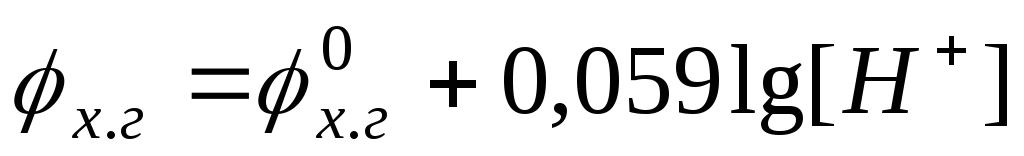
Стеклянный электрод, относится к ионоселективным или мембранным электродам. В основе работы таких электродов лежат ионообменные реакции, протекающие на границах мембран с растворами электролитов/
Электрохимия — Википедия
Электрохи́мия — раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и в ионных проводниках (электролитах). Электрохимия исследует процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов. Прямой перенос заряда с молекулы на молекулу в электрохимии не рассматривается.
XVI—XVIII столетия[править | править код]
Немецкий физик Отто фон Герике и первый генератор статического электричестваXVI столетие знаменуется началом исследования электричества. На протяжении 17 лет английский ученый Уильям Гильберт исследует магнетизм и, в некоторой степени, электричество. Его исследования оказали огромное влияние на развитие знаний о магнетизме и электричестве. Он стал известен как «Отец магнетизма».
В 1663 г. немецкий физик Отто фон Герике создаёт первый электрический генератор, который вырабатывал статическое электричество благодаря трению. Генератор представлял собой стеклянный шар с рукояткой, покрытый толстым слоем серы. Шар раскручивался вручную и при трении о подушечки пальцев, образовывалась электрическая искра. Заряженный шар использовали в экспериментах по электричеству.
В середине 18 столетия французский физик Шарль Франсуа Дюфе (Charles François de Cisternay du Fay) делает вывод о существовании двух видов статического электричества. Он высказывает мнение о том, что электричество состоит из двух «флюидов»: положительного и отрицательного. В противовес этой теории Б. Франклин предполагает что статическое электричество состоит из одного «флюида», а заряд объясняется избытком или недостатком такого флюида.
В 1781 г Шарль Огюстен Кулон (Charles-Augustin de Coulomb) излагает «Закон Кулона», описывающий взаимодействие заряженных тел.
Опыт Л. ГальваниБольшой толчок к развитию электрохимии положили опыты в 1771 г. итальянского анатома и физиолога Луиджи Гальвани (Luigi Galvani) с мышцами препарированной лягушки. Гальвани обнаружил, что при наложении на мышцы двух разных металлов, соединённых проводником, мышцы лягушки сокращаются. В 1791 гг. выходит его работа под названием «De Viribus Electricitatis in Motu Musculari Commentarius» («Трактат о силах электричества при мышечном движении»), в котором Гальвани говорит о существовании «Животного электричества», которое активируется в мышцах и нервах, при наложении на них двух металлов. Эта работа стала сенсацией. Он верил, что эта новая сила была одной из форм электричества в дополнение к «природной» форме, образующейся при ударе молнии, вырабатываемой электрическим угрём, а также «не природной», искусственной, образующейся при трении (статическое электричество). Считается, что в работах Гальвани впервые появляется предположение о связи между химическими реакциями и электричеством. 1791 год считается «днём рождения» электрохимии. Многие учёные приняли теорию Гальвани, но А. Вольта (Alessandro Volta) был против неё. Вольта считает, что мышцы являются лишь проводниками электрического тока, но не являются его источником. Тогда Гальвани демонстрирует эксперимент, при котором мышцы сокращались при наложении на них одного металла, а также и без металла — при соединении бедренного нерва с мышцей. А. Вольта на протяжении 8 лет занимается изучением органов угрей и скатов, вырабатывающих электричество. Результатом его исследований стало изготовление в 1799 году первого химического источника тока — «Вольтова столба». Это был исключительно важный (задолго до появления генераторов) источник электрического тока, способствовавший появлению многих открытий, в частности, первое получение в 1808—1809 гг. английским учёным Гемфри Дэви (Humphry Davy) в чистом виде таких металлов как натрий, калий, барий, стронций, кальций и магний.
XIX столетие[править | править код]
В конце XVIII ст. немецкий физик Вильгельм Риттер (Johann Wilhelm Ritter) пишет статью «Гальванизм» и создаёт простой аккумулятор. С У. Николсоном (англ.)) они проводят разложение воды на водород и кислород путём электролиза. Вскоре после этого В. Риттер разрабатывает процесс гальванопокрытия. Он замечает, что количество осаждаемого металла, а также образующегося кислорода, зависит от расстояния между электродами. К 1801 г. Риттер наблюдает термоэлектрический ток и поручает его исследование Томасу Зеебеку (Thomas Johann Seebeck).
В 1820 г. Г. Х. Эрстед открывает магнитный эффект электрического тока, что было эпохальным открытием. Андре-Мари Ампер (André-Marie Ampère) повторяет эксперимент Эрстеда и описывает его математически.
В 1821 г. немецко-эстонский физик Т. Зеебек демонстрирует появление термоэлектрического потенциала в точке соединения двух разнородных металлов, при наличии разницы температуры в этой точке.
В 1827 г. немецкий ученый Г. Ом (Ohm, Georg Simon) представляет свой закон в известной книге Die galvanische Kette, mathematisch bearbeitet» (гальваническая цепь, математическая обработка) и полностью описывает свою теорию электричества.
В 1832 г. знаменитый английский физик Майкл Фарадей (Michael Faraday) открывает законы электролиза и вводит такие понятия как электрод, электролит, анод, катод, анион, катион.
В 1836 г. Д. Даниэль создаёт первичный источник тока. Даниель занимается проблемой поляризации. В 1839 г. английский физик Уильям Роберт Грове (Grove) создаёт первый топливный элемент. В 1866 г. француз Жорж Лекланше (Georges Leclanché) патентует новый элемент — угольно-цинковый гальванический элемент.
В 1884 г. Сванте Аррениус (Svante August Arrhenius) публикует диссертацию «Recherches sur la conductibilité galvanique des électrolytesc» (Исследования гальванической проводимости электролитов). Он говорит, что электролиты распадаются при растворении на положительные и отрицательные ионы.
В 1886 г. Поль Луи Туссен (Paul Héroult) и Чарльз Холл (Charles M. Hall), одновременно и независимо, разрабатывают промышленный способ получения алюминия путём электролиза на основе законов Фарадея.
В 1894 г. Ф. Оствальд (Friedrich Ostwald) завершает важные исследования электропроводности и электродиссоциации органических кислот.
В 1888 г. В. Нернст развивает теорию электродвижущей силы первичного элемента, состоящего из двух электродов, разделённых раствором электролита. Он выводит уравнение, известное как Уравнение Нернста — уравнение зависимости электродвижущей силы и концентрации ионов.
XX столетие[править | править код]
Бурное развитие электрохимии. В 1902 году — создание электрохимического общества, The Electrochemical Society (ECS). 1949 год — образование Международного электрохимического общества, International Society of Electrochemistry (ISE). В 1959 году чешский учёный Ярослав Гейровский (Jaroslav Heyrovský) получает Нобелевскую премию за изобретение и развитие нового вида электрохимического анализа — полярографии.
Советская школа электрохимиков[править | править код]
Традиционно электрохимию разделяют на теоретическую и прикладную.
Теоретическая электрохимия[править | править код]
Теория электролитов[править | править код]
Электрохимия гетерогенных систем[править | править код]
Прикладная электрохимия[править | править код]
Электролиз требует внешнего источника электрической энергии, который обеспечивает возникновение и поддержание принудительного потенциала и протекание электрохимических процессов на аноде и катоде, размещённых в электролитической ячейке (например, в промышленном электролизёре).
Электролиз расплавленного хлорида натрия[править | править код]
Коррозия — термин, применяемый обычно в отношении процесса разрушения металлов ржавчиной, которое вызывается электрохимическими процессами.
Большинство людей знакомо с коррозией железа, в форме оранжево-коричневой или чёрно-бурой ржавчины. Ежегодно коррозия уничтожает приблизительно 10 % выплавляемых чёрных металлов. Другими примерами являются появление чёрных пятен на серебре или позеленение меди. Стоимость замены металлических объектов, выведенных из строя вследствие коррозии, составляет миллиарды долларов США в год.
Коррозия железа и чёрных металлов[править | править код]
Исследования в водных растворах ограничены электрохимической устойчивостью воды, как растворителя. Электролиз расплавленных сред не всегда приемлем, так как простые и комплексные солевые системы, включая эвтектические расплавы, имеют слишком высокую температуру плавления. Неводные растворы в органических растворителях, в жидком диоксиде серы и т. п. позволяют осуществить многие процессы, слишком энергоёмкие или полностью невозможные в воде или расплавах.
| |||

