«В чем измеряется проводимость?» – Яндекс.Кью
Число е появилось относительно поздно, в довольно сложных уже моделях, изучали его продвинутыми методами анализа — оно родилось в математике, а не в физике. А математика к тому времени уже оторвалась от физики. При этом могло, в принципе, случиться так, что знаменитым стало бы не число е, а скажем, корень из е. Но для многих математических моделей удобнее использовать именно е. Скорее всего, этим объясняется, что именно оно закрепилось в традиции. Исторически сложилось, что число е имеет математический смысл, а не физический.
Выбор постоянных подвержен все-таки некоторому произволу. То, что мы пользуемся числом ПИ — тоже результат традиции. Математика могла сложиться так, что специальное обозначение получило бы не отношение длины окружности к диаметру, а отношение длины окружности к радиусу. На развитие математики это не сильно бы повлияло, но некоторые формулы выглядели бы иначе, а число 3,1415… не было бы таким знаменитым и никто бы не считал кучу его знаков после запятой.
Тем не менее, число е может встречаться в законах реального мира. Например, центральная предельная теорема описывает очень многие явления. (Она говорит, что сумма многих независимых случайных одинаково распределенных величин имеет нормальное распределение.) Казалось бы, для описания нормального распределения требуется число е; но корень из е тоже бы подошел, может быть, даже еще лучше. Нельзя сказать, что здесь можно получить физический смысл числа е из ЦПТ. Скорее, наоборот — нормальное распределение стали выражать через е, потому что уже привыкли к этому числу.
Электропроводность воды что это такое
В отдельных отраслях применяются исключительно жесткие требования к качеству водоподготовки. В частности, в микроэлектронике и фармацевтике одним из важнейших показателей является электропроводность воды. Способность специально подготовленной жидкости проводить ток и величина удельного сопротивления сказывается на эффективности некоторых технологических процессов.
Физическое свойство вода — проводимость регламентируются для таких отраслей требованиями действующих нормативных документов. В статье рассматриваются основные факторы определяющие уровень ее сопротивления, единицы, методы и приборы для измерений. Читателю предлагается обзор наиболее эффективных способов снижения означенных показателей с использованием профессионального оборудования.
Что такое электропроводность воды
Самая распространенная жидкость на Земле обладает способностью проводить постоянный или переменный ток.
Электропроводности воды — это количественная характеристика этого ее свойства, которое определяется наличием заряженных частиц — положительных и отрицательных ионов. К последним относятся химические элементы, входящие в состав следующих органических и неорганических соединений:
- Щелочи.
- Соли щелочноземельных и других металлов, прежде всего хлориды и сульфиды (сульфаты).
- Карбонаты.
Этот показатель тем выше, чем больше в жидкости находится положительно заряженных ионов — катионов и отрицательных — ионов. Т.е. электропроводность напрямую связана с солесодержанием воды. Удельная электропроводность воды находится в обратной зависимости с сопротивлением воды и определяется для объема жидкости, который находится в промежутке между двумя электронами площадью в 1 см2. Последние при этом располагаются на расстоянии в 1 см друг от друга.
Нормы электропроводимости природной воды
В Российской федерации требования к параметрам качества водоподготовки регламентируются государственными стандартами и другими документами. Удельные показатели электрической проводимости воды различного назначения устанавливаются следующими нормативно-правовыми актами в зависимости от степени чистоты:
- ГОСТ 52501-2005. Для проведения лабораторных анализов — не более 0,1 и 1,0 мкСм/см для первой и второй степени соответственно.
- ГОСТ 6709-97. Для дистиллированной воды — менее 5*10-4 См/см.
- ФС 2.2.20020.15. Вода очищенная фармацевтического назначения — не выше 4,3 мкСм/см.
- ФС 2.2.0019.15. Вода для приготовления лекарственных растворов и проведения инъекций.
Жесткие технологические нормы электропроводности для воды установлены на предприятиях, выпускающих компоненты для микроэлектроники. Качество жидкости используемых в производственных процессах контролируется специализированными лабораториями и использованием сложных приборов по утвержденным методикам.
Показатели электропроводности: основные факторы
В природных водоемах содержится множество растворимых примесей неорганического происхождения. Они и определяют основные физические свойства вода, и в том числе электропроводность. Величина последней находится в прямой зависимости от ряда факторов:
- Концентрации заряженных частиц.
- Состава и природы ионов.
- Температуры жидкости.
Наибольшее влияние на электропроводность воды оказывают соли жесткости, точнее катионы натрия (Na+), калия (K+) и кальция (Ca2+), также анионы хлора (Cl—) и кислотных групп (SO42- и HCO3—). Наличие в жидкости ионов двух- и трехвалентного железа (Fe2+, Fe3+), а также марганца (Mn2+) и алюминия (Al3+) в незначительных концентрациях практически не сказывается на удельном сопротивлении.
При повышении температуры электропроводность воды существенной возрастает по причине роста скорости ионов, снижения их сольватированности и уменьшения показателей вязкости. При этом рост проводимости, связанный с увеличением концентрации катионов и анионов, наблюдается только до определенного предела. Достигнув максимума, она начинается уменьшаться, что обусловлено усилением взаимодействия заряженных частиц между собой и снижением степени диссоциации.
Определение показателей электропроводности воды
Уровень сопротивления жидкости электрическому току измеряется при помощи специальных приборов. Для количественного определения уровня электропроводности воды используются единицы измерения, установленные международной системой СИ. Применение унифицированных методов и стандартов в этой сфере упрощает лабораторные исследования и понимание получаемых результатов.
Единицы измерения
В нашей стране для измерения проводимости воды используются специальная единица — См/м (Сименс на метр). Она соотносится с удельным сопротивлением как 1 См/м= 1/1 Ом/м. При этом описываемый показатель для природной воды составляет:
- Для пресных рек: от 50 до 1500*10-6См/м.
- Для дистиллированной воды: от 0,5 до 5*10-6См/м.
- Для ультрачистой деионизированной: от 0,1 до 0,2*10-6См/м.
Для удобства в качестве единицы электропроводности воды используют производную, которая составляет одну десятитысячную от основной и записывается как мкСм/см.
Удельное сопротивление жидкости определяется в значительной мере уровнем минерализации. В США для измерения проводимости воды вместо мкСм/см используют величину TDS, указывающую на содержание растворимых солей. Этот показатель рассчитывается в частях на миллион и записывается как ppm. Для перевода этой единицы в международную используется корректирующий коэффициент.
Методы измерений и используемые приборы
В нашей стране удельная проводимость и водородный показатель жидкости определяются электрометрическим способом. Для того чтобы точно рассчитать электропроводность воды специалисты пользуются методикой, установленной РД 52.24.495-2005. Действие этого документа распространятся на поверхностные источники водоснабжения и стоки.
Для измерения электропроводности воды применяется откалиброванный кондуктометр с электродами из нержавеющей стали. Для калибровки прибора используется стандартный раствор с показателем не менее 1500 мкСм/см, при этом отклонение от номинала не должно превышать 2%.
В ходе измерений удельной электропроводности воды фиксируется ее температура, а искомая величина определяется при помощи специальных таблиц. В случае если используются приборы с температурной компенсацией, то на экране сразу же появляется истинное значение, что существенно упрощает процесс.
Снижение электропроводимости воды: профессиональные методы
Современные системы водоподготовки обеспечивают требуемые показатели качества. Для того чтобы уменьшить электропроводность воды в таких установках используются следующие методы очистки:
- обратный осмос;
- электродеионизация;
- ионный обмен.
Перечисленные технологии различаются по уровню эффективности и технико-экономическим параметрам. Выбор того или иного метода осуществляется с учетом показателей проводимости воды, необходимых заказчику. Рассмотрим подробнее возможности и особенности каждого из представленных способов.
Обратный осмос
Суть метода состоит в использовании полупроницаемых мембран для получения пермеата высокой очистки. В процессе обратного осмоса проводимость воды существенно уменьшается по причине ее глубокой деминерализации. Современные промышленные установки обратного осмоса отделяют до 99,9% всех примесей, в том числе и солей жесткости. Такие системы отличаются производительностью до 1000 л/ч.
Показатели электропроводности осмотической воды в зависимости от модели используемой установки колеблется в пределах от 0,1 до 5 мкСм/см. Пермеат без дополнительной обработки относиться к первой степени очистки, и может использоваться в медицине, фармацевтике и других высокотехнологичных отраслях промышленного производства. Обратноосмотические установки в настоящее время являются основными источниками очищенной воды.
Электродеионизация
В настоящее время разрабатываются и внедряются технологии глубокой очистки жидкостей от солей. Необходимые физические свойства воды, в том числе электропроводность на уровне 0,055 мкСм/см, обеспечивает метод электродеионизации. Водоподготовка с его использованием проводится в три этапа:
- Электродиализ. Удаление катионов и анионов из воды осуществляется при помощи конселективных мембран, которые располагаются перед электродами. К ним прикладывается постоянное напряжение, обеспечивающее движение заряженных частиц.
- Ионный обмен. Для ускорения процесса в камеру закладывается состав из специальных высокомолекулярных смол, состоящих из катионитов и анионитов. Полимеры имеют пористую структуру и поглощают заряженные частицы и замещают их.
- Регенерация. Под действием постоянного тока происходит диссоциация молекул воды, и образующиеся при этом ионы обеспечивает восстановление обменных свойств заполнителя.
Очищенная и деионизированная вода обладает крайне низкой проводимостью, что позволяет ее использовать в качестве растворителей для лекарственных препаратов. Промышленные установки электродеионизации имеют высокую производительность и могут использоваться на предприятиях теплоэнергетики.
Ионный обмен
Данная технология обеспечивает эффективное удаление заряженных частиц из жидкости при сравнительно небольших затратах. Значительное снижение ионной проводимости воды достигается за счет использования специальных веществ: ионитов или катионитов. Они выпускаются в виде заполнителей для ионообменных систем — фильтров смешанного действия.
Иониты производятся на основе сетчатых полимеров, которые имеют микропористую или сетчатую структуру. Материал имеет ковалентную связь с ионогенными группами, которые в процессе диссоциации образуют пару из свободного и фиксированного иона с противоположным зарядом. Последний закреплен на полимере.
В результате ионообменного процесса заметно снижается электропроводность воды и уровень ее минерализации. Заряженные частицы из жидкости диффундируют вначале к поверхности, а затем и внутрь сорбента. Со временем способность засыпки поглощать ионы из жидкости снижается и для ее восстановления проводится регенерация с использованием рабочих растворов.
Удельная электрическая проводимость в воде
Компания Diasel Engineering предлагает эффективные технические решения по уменьшению удельной электрической проводимости воды. Предприятие осуществляет поставки оборудования систем обратного осмоса, электродеионизации и ионного обмена. Наши специалисты выполняют монтаж установок водоподготовки, необходимые пусконаладочные работы и обеспечивают их техническое обслуживание.
Снижение электропроводности воды до требуемых показателей — задача исключительно сложная и для ее решения необходимо привлечение профессионалов. ООО «НПК «Диасел» приглашает к сотрудничеству предприятия, нуждающиеся в установках глубокой очистки. Комплексное решение проблем водоподготовки — наша основная специализация.
Молярная электрическая проводимость (λ) — это электрическая
проводимость объема раствора электролита, содержащего 1 моль раство-
ренного вещества и находящегося между двумя параллельными электродами,
расположенными на расстоянии одного метра друг от друга.
Эквивалентная электрическая проводимость относится к раствору,
содержащему 1 моль-экв растворенного электролита. Однако в настоящее
время не рекомендуется использовать этот термин. Вместо него применяется
термин «молярная электрическая проводимость» с указанием той единицы
электролита, к которой относится концентрация.
Например,
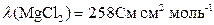 ,
,
но очевидно, что 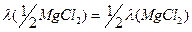 =129
=129 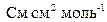 .
.
Для ионной электрической проводимости в случае
необходимости следует указывать формальную единицу: 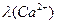 или
или 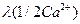 .
.
Молярная электрическая проводимость связана с удельной электрической
проводимостью простым соотношением:
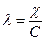 , (11)
, (11)
где 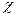 — удельная электрическая проводимость, [C]— молярная концентрация вещества.
— удельная электрическая проводимость, [C]— молярная концентрация вещества.
Следовательно, размерность 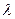 в единицах СИ:
в единицах СИ: 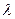 =См моль-1м2. В практических расчетах чаще используются производные единицы СИ:
=См моль-1м2. В практических расчетах чаще используются производные единицы СИ:
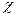 = См/см, (λ)= См моль-1 см2, [C]=моль дм-3.
= См/см, (λ)= См моль-1 см2, [C]=моль дм-3.
При этом вместо уравнения (11) получаем:
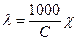 . (12)
. (12)
Зависимость λ от скорости движения для 1—1 валентных ионов выражается уравнением:
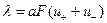 , (13)
, (13)
где 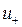 и
и 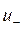 — абсолютные скорости движения положительных и отрицатель-
— абсолютные скорости движения положительных и отрицатель-
ных ионов соответственно.
Для сильных электролитов α = 1, поэтому
 . (14)
. (14)
Произведения 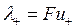 и
и 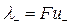 называются подвижностями ионов. Тогда:
называются подвижностями ионов. Тогда:
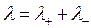 . (15)
. (15)
Для предельно разбавленных растворов 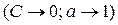
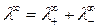 , (16)
, (16)
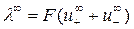 , (17)
, (17)
где 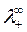 и
и 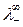 — подвижности ионов при предельном разведении.
— подвижности ионов при предельном разведении.
Уравнение (16) справедливо как для сильных, так и для слабых разбавленных электролитов и называется законом Кольрауша (законом аддитивности электропроводности), а также законом независимого движения ионов.
Численные значения подвижностей ионов 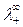 и
и 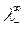 в настоящее время
в настоящее время
практически найдены для всех ионов и для Т= 298 К приводятся в справоч-
никах. Пользуясь этими данными, электропроводность предельно разбав-
ленного электролита ( 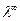 ) можно определить простым подсчетом по
) можно определить простым подсчетом по
уравнению (16).
Например, для уксусной кислоты:
 =35+315=350 См моль-1 см2.
=35+315=350 См моль-1 см2.
Сопоставление данных 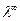 показывает, что аномально высокими
показывает, что аномально высокими
величинами электропроводностей в водном растворе обладают ионы
гидроксония и гидроксила. Это объясняется эстафетным механизмом
перемещения указанных ионов в растворе. Поэтому растворы кислот и
щелочей по сравнению с растворами солей при одинаковых концентрациях
обладают большей электрической проводимостью.
Из уравнений (14 и 17) получаем:
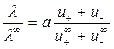 . (18)
. (18)
Откуда
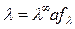 , (19)
, (19)
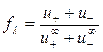 , (20)
, (20)
где 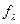 — коэффициент электропроводности, который характеризует степень элек-
— коэффициент электропроводности, который характеризует степень элек-
тростатического взаимодействия между ионами в растворе.
В разбавленных растворах слабых электролитов электростатическое
взаимодействие между ионами мало 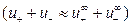 , поэтому
, поэтому 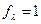 .
.
Для
таких растворов из (19) получаем
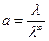 . (21)
. (21)
То есть степень диссоциации можно определить по значениям электропро-
водности, а так как 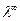 для электролита постоянна, то изменение электропро-
для электролита постоянна, то изменение электропро-
водности разбавленных растворов слабого электролита при изменении его
концентрации определяется только зависимостью от концентрации раствора.
Экспериментальные данные зависимости электропроводности разбав-
ленного слабого 1—1 валентного электролита от его концентрации позволяют
графически определить величины 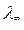 , К. Для этого уравнение (6) с использованием (21) приводят к линейному виду в координатах
, К. Для этого уравнение (6) с использованием (21) приводят к линейному виду в координатах
(1/ λ – λC):
1/ λ= 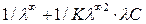 . (22)
. (22)
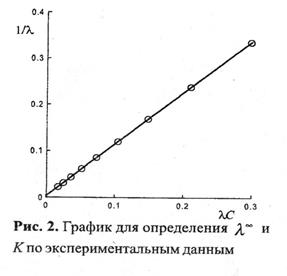
 Построив график в указанных
Построив график в указанных
координатах и продолжив прямую
линию графика до пересечения с осью
ординат, находят значение 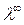 , как
, как
величину обратную величине отрезка
ординаты, отсекаемой линией графика.
К определяют из треугольника как отношение противолежащего катета к прилежащему в масштабах осей графика ( 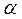 — острый угол наклона линии графика к оси абсцисс).
— острый угол наклона линии графика к оси абсцисс).
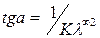 . (23)
. (23)
В тех случаях, когда, вследствие особенности распределения точек экспериментальных данных, экстраполяцию графика на ось ординат с необходимой точностью провести не удается, значение 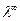 , для исследуемого раствора электролита берут из справочника.
, для исследуемого раствора электролита берут из справочника.
В концентрированных растворах слабых электролитов нужно учитывать коэффициент электрической проводимости ( 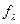 ) и коэффициенты активности ионов электролита.
) и коэффициенты активности ионов электролита.
Для сильных электролитов α = 1, тогда из (19):
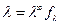 . (24)
. (24)
Таким образом, в растворах сильных электролитов изменение молярной
электрической проводимости с концентрацией раствора обусловлено
изменением коэффициента электрической проводимости ( 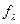 ), то есть,
), то есть,
влиянием электростатического взаимодействия ионов на скорость их движения.
Опыт показывает, что  слабых электролитов изменяется с концентрацией
слабых электролитов изменяется с концентрацией
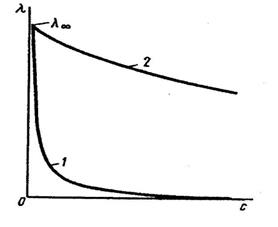
значительно сильнее, чем 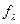 сильных электролитов. Поэтому кривая графика
сильных электролитов. Поэтому кривая графика
зависимости молярной электропроводности от концентрации раствора для
слабых электролитов падает значительно круче при увеличении концентрации,
чем кривая этой же зависимости для сильных электролитов (рис. 3).
 Наиболее известно эмпирическое уравнение Кольрауша для разбавленных растворов называемого законом квадратного корня:
Наиболее известно эмпирическое уравнение Кольрауша для разбавленных растворов называемого законом квадратного корня:
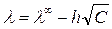 . (25)
. (25)
где h — эмпирический коэффициент.
 Эта зависимость подтверждена
Эта зависимость подтверждена
многочисленными экспериментами и
теоретически обоснована в теории Дебая —
Гюккеля — Онзагера, в которой
снижение молярной электропроводности
разбавленных растворов сильных
электролитов при увеличении
концентрации электролита объясняется
уменьшением скорости движения ионов
за счет электростатического взаимодей-
ствия ионов, окруженных их ионными
атмосферами при движении таких ионов
в электрическом поле.
Зависимость электрической проводимости растворов электролитов от
температуры
В большинстве случаев повышение температуры раствора сопровождается увеличением его электропроводности. Зависимость электропроводности от температуры можно представить эмпирическими уравнениями:
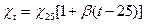 , (26)
, (26)
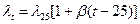 , (27)
, (27)
где 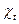 и
и 
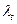 и
и 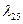 — электропроводности соответственно при температуре t
— электропроводности соответственно при температуре t
и 25°С; 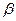 — температурный коэффициент электропроводности.
— температурный коэффициент электропроводности.
Уравнения
(26) и (27) справедливы для узкого интервала температур. Значения 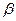 для раз-
для раз-
личных ионов, за исключением ионов водорода и гидроксила, колеблются в
пределах от 0.016 до 0.025 в зависимости от типа электролита и выражаются
уравнением:
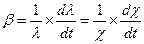 . (28)
. (28)
Из уравнения (28) следует, что температурные коэффициенты удельной и
молярной электропроводности одинаковы. Экспериментально установлено,
что кривая зависимости удельной электропроводности от температуры в
широком интервале температур проходит через максимум, который
определяется концентрацией и типом электролита, чем выше концентрация и
заряд иона, тем при более низких температурах появляется максимум.
Для
водных и органических растворителей на температурную зависимость
электропроводности влияют вязкость, диэлектрическая проницаемость,
степень диссоциации, сольватация ионов. Для водных растворов сповышением
температуры уменьшается вязкость, возрастает подвижность ионов, что
увеличивает электропроводность. Но с другой стороны увеличение
температуры уменьшает диэлектрическую проницаемость растворителя, что
приводит к понижению степени диссоциации и электропроводности. Однако
влияние этого явления оказывается незначительно, если ограничиться
температурами около 25 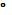 С. Необходимо учитывать также, что для
С. Необходимо учитывать также, что для
органических растворителей температурный коэффициент диэлектрической
проницаемости может быть положительным и отрицательным.
Из курса физики Вы помните, что электрическое сопротивление любого проводника может быть рассчитано по формуле:
где R — сопротивление в Ом;
l — длина проводника, см;
S — площадь поперечного сечения, см 2 ;
r — удельное сопротивление, т.е. сопротивление проводника длиной 1 см с площадью поперечного сечения 1 см 2 .
В электрохимии принято пользоваться величинами, обратными указанным:
Величина L называется электрической проводимостью и измеряется в Сименсах (См) См = Ом -1 .
Величина À называется удельной электрической проводимостью. Нетрудно вывести, что величина À измеряется в См×см -1 . На рис.3.1. представлена кондуктометрическая ячейка, применяемая для измерения электрической проводимости. Она представляет собой сосуд 1, без дна, в который вставлены два платиновых электрода 2, помещаемые в исследуемый раствор 3.
Величину К определяют экспериментально. Для этого необходимо измерить электрическую проводимость L раствора, для которого À известна. Обычно для этого используют растворы хлорида калия известной концентрации (0,1; 0,05; 0,01 моль/дм 3), величины À которых имеются в таблицах.
Из уравнения (3.5.) следует, что
удельная проводимость — это электрическая проводимость раствора, помещенного между двумя электродами площадью 1 см 2 , находящимися на расстоянии 1 см.
| À HCl KOH HF CH 3 COOH С Рис.3.2.Зависимость удельной прово-димости от концентрации | Удельная электрическая проводимость раствора зависит от природы растворителя и растворенного вещества, кон-центрации раствора и темпера-туры. На рис.3.2. приведены графики зависимости À от концентрации водных раство-ров некоторых электролитов при постоянной температу-ре.Из рисунка, прежде всего следует, что при равных концентрациях растворов про-водимость растворов сильных электролитов значительно выше, т.к. в них содержится |
больше ионов-носителей электричества. В разбавленных растворах как сильных так и слабых электролитов увеличение концентрации приводит к повышению проводимости, что связано с увеличением количества ионов. В области высоких концентраций наблюдается уменьшение À. Для сильных электролитов это связано с увеличением вязкости растворов и усилением электростатического взаимодействия между ионами. Для слабых электролитов указанный эффект связан с уменьшением степени диссоциации и, следовательно, уменьшением количества ионов.
При повышении температуры удельная проводимость электролитов увеличивается:
À 2 = À 1 [ 1 + a(T 2 — T 1)] (3.7.)
В этом уравнении À 1 и À 2 – удельная проводимость при температурах Т 1 и Т 2 , а a – температурный коэффициент проводимости. Например, для солей a » 0,02. Это означает, что повышение температуры на один градус приводит к увеличению проводимости приблизительно на 2%. Связано это с тем, что при повышении температуры уменьшается степень гидратации и вязкость растворов.
Следует отметить, что в отличие от электролитов, электричес-кая проводимость металлов при повышении температуры уменьшается.
Молярная электрическая проводимость
Молярная проводимость l связана с удельной проводимостью формулой:
l = À×1000/с (3.8.)
В этом выражении с — молярная концентрация раствора, моль×дм -3 . Молярная проводимость выражена в См×см 2 ×моль -1 . Итак,
молярная проводимость — это проводимость раствора, содержащего 1 моль вещества при расстоянии между электродами, равном 1 см.
Молярная электрическая проводимость как сильных так и слабых электролитов с увеличением концентрации понижается. Характер зависимости l от с для сильных и слабых электролитов различен, т.к. влияние концентрации обусловлено различными причинами.
Сильные электролиты . При небольших концентрациях зависимость молярной проводимости от концентрации выражается эмпирическим уравнением Кольрауша:
l = l 0 –bÖс (3.9.)
где b – определяемая опытным путем постоянная,
а l 0 – молярная электрическая проводимость при бесконечном разбавлении или предельная молярная проводимость .
Таким образом,
liml C ® 0 = l 0 (3.10.)
Приготовить раствор, концентрация которого равна нулю, невозможно. Величину l 0 для сильных электролитов можно определить графически. Из уравнения (3.9.) следует, что график зависимости l = f(Öc) для сильных электролитов представляет собой прямую линию (рис.3.3.,линия 1).
Если приготовить ряд растворов различной концентрации, измерить их проводимость L,рассчитать и построить график l = f(Öс), то экстраполируя полученную прямую на ось ординат (с = 0), можно определить l 0 . Если учесть, что сильные электролиты, независимо от концентрации раствора полностью диссоциированы, то приходим к выводу, что количество ионов, образуемых из 1 моль вещества, всегда одно и то же. Значит, от концентрации раствора зависит скорость движения ионов, с увеличением концентрации усиливается торможение ионов . Это явление, связано с образованием вокруг каждого иона в растворе ионной атмосферы , состоящей преимущественно из ионов противоположного знака. С увеличением концентрации также увеличивается вязкость раствора. Существуют и другие причины замедления движения ионов в электрическом поле, на которых мы останавливаться не будем.
Если экспериментально определить величину l для раствора данной концентрации и графически найти l 0 можно рассчитать величину коэффициента электропроводности f :
f = l / l 0 (3.11.)
Коэффициент f
EC в гидропонике | Почему это важно
EC обозначает электрическую проводимость, которая измеряет потенциал материала для проведения электричества. Несмотря на то, что большинство производителей знакомы с измерением количества кормления, которое они должны давать в унциях на галлон, грамм на литр или в любых других используемых единицах измерения, ЕС идет немного дальше, чем это. При выращивании важно иметь хорошее представление о том, что такое EC, и его значении для производителя.
Питер Клаассен Исследования CANNA
Электропроводность
EC-метр измеряет потенциал для электрического тока, который будет транспортироваться через воду, известную как молярная проводимость (электролитическая проводимость) и выраженная в сименсах (S).Электроны текут от одного набора электродов к другому в воде через пространство не из-за молекул воды, а из-за ионов в воде. Ионы переносят электроны и ограничивают количество электронов, которые могут перемещаться в пространстве, по количеству ионов, доступных или способных транспортировать; чем выше концентрация, тем больше поток. Чистая вода сама по себе является плохим проводником, поэтому EC-метр будет показывать 0.0 в дождевой воде, воде обратного осмоса или деминерализованной воде. Напротив, соленая морская вода — намного лучший проводник.
Когда мы добавляем питательные вещества (соли) в воду, мы увеличиваем молярный проводящий потенциал для тока через воду и, таким образом, увеличиваем значение EC (или CF = EC * 10). Все измерения проводимости напрямую зависят от температуры и должны быть компенсированы.
Единица
ЕС может быть выражено с использованием ряда различных единиц, но типичная единица измерения — симены на квадратный метр на моль (S / м2 / моль) или миллисимены на сантиметр (mS / cm). Единица измерения мСм / см обычно используется в Европе в качестве руководства по концентрации питательных веществ в воде.В Северной Америке электропроводность преобразуется в количество ионов в воде с использованием частей на миллион (что также может быть дано во многих единицах, включая ppm, мг / л и т. Д.). Это делается путем преобразования ЕС в значение, основанное на знании содержания ионов в растворе. К счастью, существует фиксированный расчет для отношений между этими единицами, который приведен в таблице ниже.
Соли
Вода, содержащая минеральные соли, имеет ЭК, но не все измеренные ЕС указывают на наличие ценных питательных солей для растения.Водопроводная вода может содержать натрий и хлорид, которые имеют значение ЕС, но не имеют питательной ценности при применении к растению.
Удобрение, конечно, состоит из питательных солей. Пищевая ценность, которую мы добавляем к воде, известна как EC + и должна быть добавлена к EC воды. Вот как мы измеряем общий ЕС в нашем резервуаре. Пищевые соли представляют собой твердые вещества, которые извлекаются из земли или выделяются в процессе промышленного крекинга. Мы растворяем определенную массу (грамм) солей в определенном объеме (литрах) воды, и поэтому мы также можем использовать грамм или литры для блока ЕС.Хотя у каждого удобрения есть своя собственная удобрительная ценность, можно обобщить и сказать, что ЕС 1,0 мСм / см содержит до 1,0 грамма измеренных солей на 1 литр воды.
Поглощаемость
Соль обладает способностью привлекать к себе воду, процесс, известный как гидролиз. Горшок с солью, помещенный в погреб, уменьшит атмосферную влажность там. В растворе концентрация солей всегда будет пытаться выровнять в двух разных областях концентраций путем движения воды в область более высокой концентрации.Эта разница в концентрациях известна как градиент водного потенциала. Это свойство также играет роль в нашем культивировании посредством процесса, известного как осмос, который включает в себя полупроницаемый барьер, который пропускает воду, но ограничивает движение ионов или соли.
Когда мы даем много питательных веществ (высокий EC), питательные соли притягивают воду в субстрате к себе. Это затрудняет извлечение воды из субстрата корнями. Таким образом, мы даже можем создать условия во влажном субстрате, в котором корни больше не способны извлекать больше воды из субстрата.Это известно как создание субстрата «физиологически сухим». Это приводит к тому, что растения не имеют больше воды для испарения (испарения), чтобы охладиться от жары (= света). Хотя это обычно называют чрезмерным оплодотворением, на самом деле это нехватка воды. С срезанными цветами, такими как розы, или с черенками, более высокий ЕС в вазе или пробке для черенков может буквально вытягивать воду из стеблей.
Мы можем увидеть этот осмотический процесс в U-образной трубке, когда мы разделяем две стороны проницаемой мембраной, такой как кусок стебля.Если мы теперь добавим немного соли на одну сторону, уровень воды на этой стороне повысится, потому что вода с более низким ЕС будет вытянута к ней. Вот почему мы рекомендуем, чтобы очень мало или вообще не было питательных веществ.
Соль обладает свойством притягивать молекулы воды. Когда вы добавляете соль в воду в правой половине трубки (таким образом увеличивая значение ЕС), молекулы соли будут притягивать молекулы воды с левой стороны, в которой меньше соли. Уровень воды справа поднимается до тех пор, пока значения ЕС (концентрации соли) обеих сторон снова не станут равными.
Создание пищевой ценности
После того, как растительный материал взят, мы должны постараться как можно быстрее нарастить осмотическую ценность растения (ЕС). Поскольку растение увеличивается в объеме и поглощает воду, эта осмотическая ценность падает. Питание в растении перераспределяется, и само растение становится мягким и светлее. Это делает его очень восприимчивым к обезвоживанию (увяданию), потому что вода может легко покинуть растение.
Если дать больше корней, это будет пропорционально расти.Поскольку вода, используемая в качестве транспортного средства, испарилась, питательные соли останутся в растении, и это повысит внутреннюю ЕС (осмотическую ценность). Так как это было поднято, производитель может снова дать корням более высокий ЕС.
Сильные растения
Достигнув этой положительной спирали накопления ЕС на заводе, завод также становится более способным поглощать воду и удерживать ее. Из-за этого растение не позволяет воде испаряться очень легко, поэтому оно не потеряет воду, которую впитала слишком рано.С слишком мягкими растениями интенсивность света придется уменьшить или сократить количество часов освещения, чтобы предотвратить нехватку в конце дня.
Несмотря на то, что ЕС играет важную роль в этой истории, это не единственный фактор, который влияет здесь. Общий климат-контроль вокруг завода влияет на процессы, частью которых является ЕС.
Потребности в питании
Создание ЕС на заводе и, следовательно, субстрата, должно быть сделано с учетом требований роста завода.Этот спрос контролируется ассимиляцией. Чем больше вы выращиваете растение, тем больше оно будет нуждаться в питании. Эти питательные вещества частично запираются в растении и превращаются в полезные аминокислоты, масла, жиры и т. Д., Но есть также доля, которая остается в соке растения, и это определяет внутреннюю ЕС. Калий является одним из важнейших элементов питания в этом процессе.
После того, как растение завершило вегетативный рост, оно все еще может поглощать много калия для внутренней осмотической ценности и яичников.Яичники не являются оплодотворенным «семенем». Тем не менее, это увеличение потребления также заканчивается. После ок. 60% цикла культивирования растению будет достаточно с запасом питательных веществ, находящихся в субстрате. Игра стихов о питательных веществах, применяемых ЕС, теперь начинается для производителей.
EC запас в банке
Мы можем использовать принцип «ведра», чтобы понять и хорошо понять эту игру.
Хотя вода в субстрате будет испаряться, соли не будут.Поэтому в последние недели роста вы должны — в большинстве случаев — прекратить кормить растение и добавлять только воду. Потому что, если в субстрате недостаточно воды, значение ЕС (концентрация соли) может резко возрасти.
Пример:
У нас есть ведро, которое содержит 10 литров раствора удобрений с ЕС 2,0 мСм / см. Это означает, что ведро содержит 20 граммов питательных солей (питательный запас). (2,0 г / л х 10 л). Когда испаряется 9 литров воды, остается 1 литр воды с ЕС 20 (ЕС = 20 г соли на 1 литр воды).На самом деле он никогда не будет таким экстремальным, как этот, и при возделывании с почвой происходит дальнейший процесс буферизации, который в некоторой степени связывает питательные соли с частицами органического субстрата, но принцип все еще действует. Добавление обратно 9 литров увеличивает ЕС до 2,0 мСм / см. Таким образом, если нам нужно поддерживать ЕС между 2 и 4 мСм / см, то мы должны пополнить воду на 5 литров. (4 г / л х 5 литров = 20 г, ЕС = 4 мСм / см)
Если в ведре есть растение, которое абсорбировало 5 грамм раствора, мы можем долить его при подаче воды, если нам нужно поддерживать 2.0 EC. Например, если доза воды составляет 5 литров, мы должны дать 5 граммов или кратко выразить; доза воды 5 литров с ЕС 1,0 (г / л) или мСм / см. Целью здесь и в совершенствовании является поддержание ЕС в ведре.
Это основная предпосылка удобрения. Мы стараемся поддерживать определенный уровень плодородия в контейнере, который обеспечивает достаточное количество питательных элементов для растения. Вообще говоря, мы должны снизить ЕС в последнем периоде. С системой, которая может быть истощена, мы можем сами уменьшить запас питательных веществ путем промывания с низким значением ЕС.Подложка в дренажных системах может быть исправлена намного лучше. В не дренируемых системах питательный запас постоянно добавляется с последующим применением корма. Рано или поздно этот запас питательных веществ достигнет уровня, который замедлится, затем остановит способность растения поглощать воду, а затем фактически заставит воду выходить из тканей растения в обратном направлении всего этого процесса.
Резюме
EC — это не только прибор для измерения удобрений, которые дают растениям, но и механизм управления климатом, связанный с водопоглощением.
Растения следует начинать с низким значением ЕС, которое затем собирается как можно быстрее, чтобы обеспечить потребности растений в питании, а также повысить внутреннюю осмотическую ценность для того, чтобы построить сильные растения.
Растение почти не нуждается в дальнейшем питании в последние недели культивирования. Мы продолжаем обеспечивать питание только для того, чтобы поддерживать запасы питательных веществ в горшке и поддерживать стабильность ЕС. Это обычно приводит к снижению ЕС или даже к еженедельной промывке (выщелачиванию).
Смысл проводимости, TDS и солености
Что такое проводимость в воде?
Электрическая проводимость, или удельная проводимость, относится к тому, насколько хорошо проводник среды проводит электричество. Мы знаем, что вода проводит электричество, поэтому мы не купаемся во время грозы и не пользуемся феном в ванне. Однако вода сама по себе не является хорошим проводником электричества. Чтобы вода проводила электричество, должны присутствовать ионы. Электропроводность воды часто измеряется в промышленных и экологических приложениях как простой и недорогой способ определения количества присутствующих ионов.
Единицы электропроводности
В настоящее время используются несколько различных единиц измерения электропроводности. Измерения проводимости часто преобразуются в единицы TDS, единицы солености или концентрации. Вот некоторые из этих общих единиц измерения:
Как измерять соленость и TDS
Используемые единицы измерения проводимости будут зависеть от вашего местоположения и условий вашего приложения. Каждая отрасль имеет предпочтительную единицу проводимости. Обратите внимание, что TDS (выраженный в мг / л или м.д.) фактически относится к количеству присутствующих ионов, а не к электропроводности.Однако, как упоминалось ранее, электрическая проводимость часто используется для измерения количества присутствующих ионов. Измерители TDS измеряют электрическую проводимость и преобразуют это значение в мг / л или ppm. Электропроводность также является косвенным способом измерения солености. При измерении солености, единицы обычно выражаются в ppt. Некоторые приборы для измерения электропроводности предварительно настроены с возможностью измерения солености при желании.
Обратите внимание, что измерения проводимости зависят от температуры и присутствующих ионных частиц.
Как преобразовать проводимость в концентрацию
Преобразование между проводимостью и TDS или соленостью зависит от химического состава образца. Измерения TDS обычно используются для мониторинга окружающей среды, где большинство растворенных твердых веществ являются ионными. Разные ионы дают разные значения электропроводности. Поскольку измерители TDS полагаются на один коэффициент преобразования для разных видов ионов, измеренные значения TDS почти всегда будут немного отличаться от истинных значений TDS.Чтобы определить концентрацию по проводимости, ионный состав раствора должен быть известен.
- 1 S / m = s 3 * A 2 / кг * м 3 где s — секунда, A — ампера, кг — килограмм, м — метр
- 1 мхо / м = 1 rom = 1 с / м
- 1 EC = 1 мкСм / см = 1 x 10 -6 с / м
- 1 CF = 10 EC = 10 мкСм / см = 1 x 10 -5 с / м
- ppm 500 = 500 x (проводимость в мСм / см) (США)
- ppm 640 = 640 x (проводимость в мСм / см) (Европа)
- ppm 700 = 700 x (проводимость в мСм / см ) (Австралия)
- 1 мг / л = 1 ч / млн (при условии, что плотность воды равна 1.00 г / мл)
Электропроводность при очистке воды
Различные применения требуют разных уровней чистоты воды. Например, электрическая проводимость питьевой воды обычно составляет менее 1 мСм / см. Между тем, для полупроводниковой и фармацевтической промышленности требуется чрезвычайно чистая вода с еще более низким значением электропроводности, чем питьевая вода. Проводимость чистой воды, используемой в таких применениях, обычно составляет менее 1 мкСм / см.
В таблице ниже приведены значения проводимости для некоторых распространенных решений.Вы можете прочитать больше о том, как измеряется электропроводность для одного из таких растворов, воды обратного осмоса, в нашем блоге.
Электрическая проводимость может быть измерена с помощью двухэлектродных, четырехэлектродных или тороидальных (индуктивных) датчиков проводимости. Эти измерения электропроводности могут быть преобразованы в TDS, соленость и концентрацию. Чтобы узнать больше об измерении проводимости, нажмите кнопку ниже.
Электропроводность воды
Электропроводность воды оценивает общее количество твердых веществ, растворенных в воде, — TDS, что означает общее количество растворенных твердых веществ. TDS измеряется в миллионных долях (частей на миллион) или в мг / л.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ЭЛЕКТРОПРОВОДНОСТЬ ВОДЫ
Электропроводность воды зависит от температуры воды: чем выше температура, тем выше будет электропроводность.Электропроводность воды увеличивается на 2-3% при увеличении температуры воды на 1 градус Цельсия. Многие измерители EC в настоящее время автоматически стандартизируют показания до 25 o C.
Хотя электропроводность является хорошим показателем общей солености, она по-прежнему не дает никакой информации об ионном составе воды.
Те же самые значения электропроводности могут быть измерены в воде низкого качества (например, в воде, богатой натрием, бором и фторидами), а также в воде для полива высокого качества (например,грамм. надлежащим образом оплодотворенная вода с соответствующими концентрациями и соотношениями питательных веществ).
ЕДИНИЦЫ ИЗМЕРЕНИЯ ЭЛЕКТРОПРОВОДНОСТИ ВОДЫ
Обычно используются единицы измерения электрической проводимости воды:
- мкСм / см (микросименс / см)
или
Где: 1000 мкс / см = 1 дСм / м
TDS И ЭЛЕКТРОПРОВОДНОСТЬ
Поскольку электрическая проводимость является мерой способности воды проводить электрический ток, она напрямую связана с концентрацией солей, растворенных в воде, и, следовательно, с общим содержанием растворенных твердых веществ (TDS).Соли растворяются в положительно заряженных ионах и отрицательно заряженных ионах, которые проводят электричество.
Поскольку измерять TDS в полевых условиях сложно, в качестве меры используется электропроводность воды.
Электропроводность воды можно быстро и недорого определить с помощью портативных счетчиков.
Дистиллированная вода не содержит растворенных солей и, как следствие, не проводит электричество и имеет нулевую электрическую проводимость.
Тем не менее, когда концентрация соли достигает определенного уровня, электропроводность больше не связана напрямую с концентрацией соли. Это потому, что образуются ионные пары. Ионные пары ослабляют заряд друг друга, так что выше этого уровня более высокая TDS не приведет к одинаково более высокой электропроводности.
EC можно преобразовать в TDS, используя следующий расчет:
TDS (ppm) = 0,64 X EC (мкСм / см) = 640 X EC (дСм / м)
Это соотношение дает только оценку.

Легко создайте свой план оплодотворения с помощью нашего программного обеспечения
Начните использовать и увеличьте свой урожай до 40%
Создайте свой план ,Создано Моникой З. Брукнер, Государственный университет Монтаны, Бозман
Что такое рН и электропроводность?
 Шахта Дэвиса изначально использовалась для добычи пирита. Воды возникающего потока кислые и богаты соединениями железа, которые затем используются различными бактериями, которые производят окисленные соединения железа с типичным оранжево-коричневым цветом.Изображение сайта было предоставлено Кристин Баррето, любезно предоставленной веб-сайтом микроскопа.
Шахта Дэвиса изначально использовалась для добычи пирита. Воды возникающего потока кислые и богаты соединениями железа, которые затем используются различными бактериями, которые производят окисленные соединения железа с типичным оранжево-коричневым цветом.Изображение сайта было предоставлено Кристин Баррето, любезно предоставленной веб-сайтом микроскопа.Часто полезно охарактеризовать окружающую среду, такую как водоем, путем измерения его pH и электропроводности (EC). pH является мерой кислотности воды или почвы на основе концентрации ионов водорода и математически определяется как отрицательный логарифм концентрации ионов водорода, или
pH = -log [H + ], где скобки вокруг H + символизируют «концентрацию»
. рН материала в логарифмическом масштабе находится в диапазоне от 1 до 14, где рН 1-6 — кислый, рН 7 — нейтральный, а рН 8-14 — основной.Более низкий pH соответствует более высокому [H + ], тогда как более высокий pH связан с более низким [H + ].
Электропроводность (ЕС) — это измерение растворенного материала в водном растворе, которое связано со способностью материала проводить электрический ток через него. ЕС измеряется в единицах, называемых семенами на единицу площади (например, мСм / см или миллисейменами на сантиметр), и чем выше растворенный материал в пробе воды или почвы, тем выше будет ЕС в этом материале.
Как измеряются pH и электропроводность?
Измеритель и зонд или лакмусовая бумага могут быть использованы для измерения рН образца. Более точным, но дорогим из этих методов является измеритель и зонд. pH-метры калибруются с использованием специальных растворов или буферов с известным значением pH. Протоколы калибровки можно найти в инструкциях производителя, но также можно найти упрощенный протокол.
Использование лакмусовой бумаги или pH-бумаги — более простой и недорогой способ измерения pH.В этом методе используются специальные полоски бумаги, которые меняют цвет в зависимости от рН раствора образца. Полоски бывают разных разрешений, от простого сравнения кислоты с основанием до узкого разрешения значений pH. Эти полоски бумаги могут измерять разницу 0,2-0,3 рН в образце. Лакмусовая бумага меняет цвет в зависимости от того, является ли раствор образца кислотным или щелочным, становясь красным или синим, соответственно. pH-полоски показывают pH образца также путем изменения цвета; эти цвета указаны на упаковке и различаются для разных диапазонов pH и производителей.
Электрическая проводимость может быть измерена с помощью измерителя и зонда. Зонд состоит из двух металлических электродов, расположенных на расстоянии 1 см друг от друга (таким образом, единица измерения — микросеймы или миллисемены на сантиметр ). Постоянное напряжение прикладывается к электродам, в результате чего электрический ток протекает через водный образец. Поскольку ток, протекающий через воду, пропорционален концентрации растворенных ионов в воде, можно измерить электропроводность.Чем выше концентрация растворенной соли / иона, тем более проводящий образец и, следовательно, выше показания проводимости.
How To — Протоколы и вопросы измерения pH и EC
Ниже приведены общие протоколы измерения pH и EC. Необходимо следовать инструкциям и рекомендациям производителя, если таковые имеются.

Эти pH-полоски могут измерять pH в ряде диапазонов, помещая образец на полоску и сравнивая его изменение цвета с цветами на коробке, которые соответствуют определенному pH.На полоске слева измеряется pH 0-7 и показаны результаты анализа образца сильной кислоты; центральная полоса имеет диапазон рН 5-10 и показывает результаты образца буферного раствора 6,97; полоса справа измеряет широкий диапазон (pH 1-14) и показывает результаты для 10% -ного образца водного раствора отбеливателя. Это изображение можно увеличить, нажав на него. Фото Моники Брукнер.
Измерение рН с помощью лакмусовой бумаги или полосок рН:- Поместите каплю образца на бумагу — убедитесь, что вы уронили или вылили образец на бумагу, а не погружали бумагу в образец, так как последний может загрязнить образец.
- Обратите внимание на изменение цвета на бумаге. При использовании лакмусовой бумаги бумага приобретает красный или розовый цвет, если образец кислый, тогда как синяя бумага обозначает основной образец. При использовании полосок pH цвета, соответствующие значениям pH, должны быть указаны на упаковке.
Измерение рН жидкости с помощью рН-метра и зонда:
- Включите рН-метр и откалибруйте датчик, используя два стандартных раствора (рекомендуется использовать буферы рН 4, 7 и 10, в зависимости от измеряемого диапазона).Процедуры калибровки зависят от прибора, поэтому настоятельно рекомендуется следовать инструкциям производителя. Обязательно промойте зонд тщательно между буферами, используя деионизированную воду, и осторожно промокните зонд сухим, используя чистящую салфетку KIM. pH-метры следует калибровать перед каждым использованием (перед каждой серией образцов, а не между каждым образцом) или при измерении большого диапазона pH.
- Проверьте калибровку путем измерения pH стандартных растворов в измерении, а не в режиме калибровки.
- Соберите образец воды в стеклянную или пластиковую емкость. Соберите достаточно, чтобы наконечник зонда мог быть погружен в образец; либо промойте зонд деионизированной водой (и промокните насухо), либо пробой, прежде чем вводить зонд в сосуд для сбора.
- Погрузите зонд в образец и дождитесь стабилизации показаний pH на измерителе. Многие измерители имеют автоматическую температурную коррекцию (ATC), которая рассчитывает pH с учетом температуры. Если ваш измеритель не имеет этой функции, вам может потребоваться отрегулировать ручку на измерителе, чтобы скорректировать pH для температуры.Запишите результаты измерений, когда показания pH будут стабильными.
Измерение ЭК жидкой пробы с помощью измерителя и зонда:

Эти три метра и зонды могут измерять pH (слева) и электропроводность (в центре и справа). Изображение можно увеличить, если щелкнуть по нему. Фото Моники Брукнер.
- Включите измеритель EC и откалибруйте датчик, используя стандартное решение с известной проводимостью (выберите стандарт, близкий к тому, что, по вашему мнению, является образцом).Процедуры калибровки зависят от прибора, поэтому настоятельно рекомендуется следовать инструкциям производителя. УБЕДИТЕСЬ Тщательно промойте зонд перед и после калибровки, используя деионизированную воду, и осторожно промокните зонд, высушив его с помощью протирочной машины KIM. Измерители ЕС следует калибровать перед каждым использованием (перед каждой серией образцов, а не между каждым образцом) или при измерении большого диапазона ЕС.
- Проверьте калибровку путем измерения ЕС стандартных растворов в измерении, а не в режиме калибровки.
- Соберите образец воды в стеклянную или пластиковую емкость. Соберите достаточно, чтобы наконечник зонда мог быть погружен в образец; либо промойте зонд деионизированной водой (и промокните насухо), либо пробой, прежде чем вводить зонд в сосуд для сбора.
- Погрузите пробник в образец и дождитесь стабилизации показаний ЕС на измерителе. Многие счетчики имеют автоматическую коррекцию температуры (ATC), которая рассчитывает ЕС с учетом температуры. Если ваш счетчик не имеет этой функции, вам может понадобиться отрегулировать ручку на измерителе, чтобы скорректировать ЕС по температуре.Запишите результаты измерений, когда показания ЕС будут стабильными.
Измерение pH почвы:
pH почвы можно измерить с помощью рН-метра (обычно смешивая образец почвы с водой или солевым раствором) или добавив в почву краситель и наблюдая за изменением цвета, которое можно сравнить с график определения pH. Последний метод может быть выполнен с использованием набора, который содержит необходимые химические вещества. Для получения дополнительной информации об измерении pH почвы и почему pH имеет значение, пожалуйста, посетите веб-сайт NRCS Soil pH.
Измерение EC почвы:
EC почвы можно измерить с помощью электродов, вставленных непосредственно в землю, или путем извлечения грунтовой воды с помощью лизиметра (инструмента, который использует всасывание для извлечения почвы или грунтовых вод из земли. EC грунтовых вод может также измеряется с помощью зонда, вставленного в скважину (перфорированная труба, вставленная в землю, которая может измерять высоту уровня грунтовых вод) или пьезометра (труба, открытая только снизу, которая измеряет потенциал воды на глубине, где находится отверстие).В электродном методе используются специальные серии зондов, два из которых посылают электрический ток через почву, а два из них измеряют падение напряжения. Для измерения EC почвенной воды, вода извлекается из лизиметра, скважины или пьезометра и измеряется. Альтернативно, датчик, прикрепленный к измерителю, может быть опущен в скважину или пьезометр, и таким образом может быть измерен жидкостный ЕС.
Анализ результатов
Измерения pH и EC могут сильно различаться и зависят от нескольких факторов окружающей среды, включая климат, местную биоту (растения и животные), геологическую и поверхностную геологию, а также воздействие человека на землю.Общие значения pH и EC для конкретных сред можно найти в литературе, такой как рецензируемые журнальные статьи или учебники. В общем, значения pH между 1-6 считаются кислыми, 7 — нейтральными, а 8-14 — основными. Относительно разбавленные воды, такие как дистиллированная вода или таяние ледниковых вод, имеют низкую электропроводность, варьирующуюся от нуля до диапазона микросеймов, тогда как умеренные потоки и озера, особенно те, которые вносят значительный вклад в подземные воды, как правило, имеют более высокую электропроводность.
Ссылки по теме
Педагогическая деятельность
- Измерение pH в жидких пробах и измерение pH в пробах почвы — эти действия, представленные GLOBE.gov, обеспечивают лабораторные работы, которые измеряют pH в почве и жидких пробах соответственно.
- Waterwatch Teacher Education Resources — этот веб-сайт предоставляет разнообразную информацию и ссылки на дополнительную информацию, в том числе учебные материалы, компакт-диски и онлайновые ресурсы, руководства Waterwatch, оборудование, информационные бюллетени и видеоролики.
- Изменения в проводимости Руководство для учителя — это руководство для учителя в формате PDF от UIUC обеспечивает лабораторную деятельность (с исходной информацией), включающую измерение электрической проводимости от пресноводных систем. Деятельность предназначена для 10-12 классов.
- Полевые методы Лабораторная деятельность — этот ресурс из Техасского университета в Далласе предоставляет серию лабораторных мероприятий / протоколов, которые включают измерение различных параметров, таких как температура воды, pH, ЕС, растворенный кислород и мутность.

