5.1. Электродные потенциалы. Гальванические элементы. ЭДС . Сборник основных формул по химии для ВУЗов
При соприкосновении двух химически или физически разнородных материалов (металл 1 (проводник I рода) – металл 2 (проводник I рода), металл (проводник I рода) – раствор соли металла (проводник II рода), раствор электролита 1 (проводник II рода) – раствор электролита 2 (проводник II рода) и т. д.) между ними возникает двойной электрический слой (ДЭС). ДЭС является результатом упорядоченного распределения противоположно заряженных частиц на границе раздела фаз.
Образование ДЭС приводит к скачку потенциала ?, который в условиях равновесия металл (проводник I рода) – раствор соли металла (проводник II рода) называется галъвани-потенциалом.
Система: металл (Me) – водный раствор соли данного Me – называется электродом или полуэлементом и схематически изображается следующим образом:
Меn+ | Me
Электрод (п/э) записывается так, чтобы все вещества, находящиеся в растворе, были помещены слева, а электродный материал – справа от вертикальной черты.
? > 0, если на электроде протекает реакция восстановления Меn+ + nе? ? Ме0,
? < 0, если на электроде протекает реакция окисления Ме0 ? Меn+ + nе?.
Электродным потенциалом ЕМеn+/Ме называется равновесная разность потенциалов, возникающая на границе фаз проводник I рода/проводник II рода и измеренная относительно стандартного водородного электрода.
уравнение Нернста, где n – число электронов, участвующих в электродной реакции; С
Контактный потенциал ?? – равновесный скачек потенциалов, возникающий на границе раздела двух проводников I рода.
Диффузионный потенциал ?диф – равновесная разность потенциалов, возникающая на границе фаз проводник II рода/проводник II рода.
Гальванический элемент (г. э.) – электрическая цепь, состоящая из двух или нескольких п.э. и производящая электрическую энергию за счет протекающей в ней химической реакции, причем стадии окисления и восстановления химической реакции пространственно разделены.
Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом, электрод, на котором идет процесс восстановления, – катодом.
Правила ИЮПАК для записи гальванических элементов и реакций, протекающих в них
1. В г. э. работа производится, поэтому ЭДС элемента считается величиной положительной.
2. Величина ЭДС гальванической цепи Е определяется алгебраической суммой скачков потенциала на границах раздела всех фаз, но так как на аноде протекает окисление, то ЭДС рассчитывают, вычитая из числового значения потенциала катода (правого электрода) значение потенциала анода (левого электрода) –  Поэтому схему элемента записывают так, чтобы левый электрод был отрицательным (протекает окисление), а правый – положительным (протекает процесс восстановления).
Поэтому схему элемента записывают так, чтобы левый электрод был отрицательным (протекает окисление), а правый – положительным (протекает процесс восстановления).
3. Границу раздела между проводником I рода и проводником II рода обозначают одной чертой.
4. Границу между двумя проводниками II рода изображают пунктирной чертой.
5. Электролитный мостик на границе двух проводников II рода обозначают двумя пунктирными чертами.
6. Компоненты одной фазы записывают через запятую.
7. Уравнение электродной реакции записывают так, чтобы слева располагались вещества в окисленной форме (Ох), а справа – в восстановленной (Red).
Гальванический элемент Даниэля-Якоби состоит из цинковой и медной пластин, погруженных в соответствующие растворы ZnSO4 и CuSO4, которые разделены солевым мостиком с раствором KCl: электролитический мостик обеспечивает электрическую проводимость между растворами, но препятствует их взаимной диффузии.
(-) Zn | Zn 2+:: Cu 2+| Cu (+)
Реакции на электродах:
Zn0 ? Zn2+ + 2e?
Cu2+ + 2е? ? Cu0
Суммарный окислительно-восстановительный процесс:
Cu2+ + Zn0 ? Cu0 + Zn2+
Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала.
Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть
ЭДС элемента EZn/Cu = ?Cu2+/Cu + ?Zn2+/Zn+ ?к + ?диф.
Без учета ?диф и ?к: EZn/Cu= ?Cu2+/Cu + ?Zn2+/Zn= ЕCu2+/Cu+ Е Zn2+/Zn – гальванические элементы, состоящие из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными концентрациями С
Концентрационные цепи
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный.
Работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса.
33. Термодинамическая теория эдс, уравнение Нернста.
Гальванические
элементы относятся к химическим
источникам электрического тока и
позволяют получать ток за счет протекания
химической реакции. Гальванический
элемент состоит из двух электродов –
анода и катода. Его устройство и принцип
работы рассмотрим на примере элемента
Якоби-Даниэля. В этом элементе используют
медный и цинковый электроды. Каждый
электрод помещен в емкость с раствором
электролита, катионы которых «одноименны»
материалу электрода. А емкости разделены
перегородкой. Цинковый электрод опущен
в раствор ZnSO
Zn0+2e-
— Zn2+.
Ионы цинка из электрода переходят в
раствор, а на электроде остаются
электроны, т. о. цинковая пластинка
заряжается отрицательно и становится
анодом. Между медным электродом и
окружающим его раствором CuSO4 идет реакция восстановления: Cu2+ + 2e— – Cu0.
Между медным электродом и
окружающим его раствором CuSO4 идет реакция восстановления: Cu2+ + 2e— – Cu0.
Отсюда следует, что в гальваническом элементе окисление – отдача электронов – происходит на аноде, восстановление – приобретение электронов – на катоде.
Характерной особенностью любого гальванического элемента является образование электрохимической цепи – последовательной совокупности всех скачков потенциала на различных поверхностях раздела, отвечающих данному гальваническому элементу.
Важнейшей характеристикой гальванического элемента является электродвижущая сила (ЭДС), которая определяется как предельная разность потенциалов, возникающая на границе раздела фаз в разомкнутой цепи элемента.
E=|EЭ— + E Д+ЕЭ+ +ЕК|
ЭДС является
количественной характеристикой
эффективности работы гальванического
элемента – она показывает насколько
полно осуществляется процесс перехода
химической энергии в электрическую.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
где
Электродный потенциал определяется разностью электрического потенциала между электродом и находящимся с ним в контакте раствором электролита.
Стандартный электродный потенциал — это потенциал металла, определенный относительно стандартного (нормального) водородного электрода, при условии, что концентрация ионов водорода Н+ и ионов испытуемого металла Men+ равны 1 моль-ион/л при стандартных условиях (298К, 101кП). Ряд стандартных электродных потенциалов служит для сравнительной характеристики свойств атомов и ионов металлов в растворе.
Электроды,
из которых формируются гальванические
элементы, можно условно классифицировать
на электроды первого, второго и третьего
рода.
К электродам первого рода относятся металлы и неметаллы, погруженные в раствор, который содержит их ионы и концентрация которго может быть разной. Электроды первого рода могут быть обратимыми как относительно катионов, так и относительно анионов. Обратимость относительно катионов означает, что электрод работает на основе обмена катионов означает, что электрод работает на основе обмена катионов между электродом и раствором. Она характерна для металлических электродов, а обратимость относительно анионов – для неметаллических электродов.
Электроды второго рода – это системы, в которых металл электрода покрыт слоем его малорастворимого соединения и погружен в раствор хорошо растворенной соли, содержащей тот же анион. К электродам второго рода относятся каломельный и хлорсеребряный.
К
электродам третьего рода относятся
системы из металла, который контактирует
с двумя труднорастворимыми слоями. В
результате химической реакции менее
растворимая соль превращается в более
растворимую.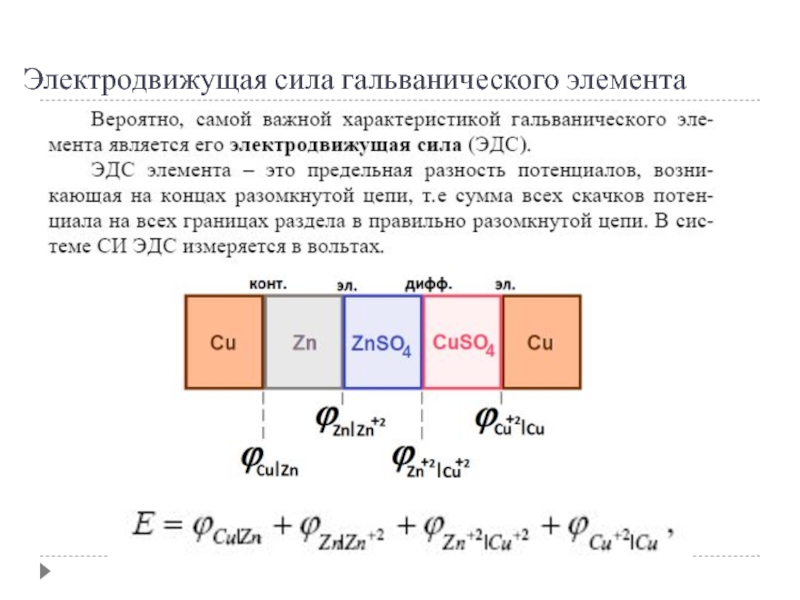
Всем электродам первого, второго и третьего рода соответствует потенциалопределяющие химические реакции с участием электронов. Эти химические реакции являются окислительно-восстановительными. В особую группу выделяют электроды, у которых окислительно-восстановительная реакция идет в растворе электролита без участия металла. Электроды только осуществляют передачу электронов. Такие электроды называют окислительно-восстановительными, или редокс-электродами.
EMF ячейки — Определение, типы и потенциал электрода
- IIT JEE
- EMF ячейки
Последний обновление Дата: 05 -й апрель 2023
•
Всего просмотров: 286,5K
•
. : 7.59k
Электрохимическая ячейка используется для выработки электроэнергии в результате химической реакции. Его можно определить как устройство, преобразующее химическую энергию в электрическую. Химическая реакция, которая включает обмен электронами, необходима для работы электрохимической ячейки.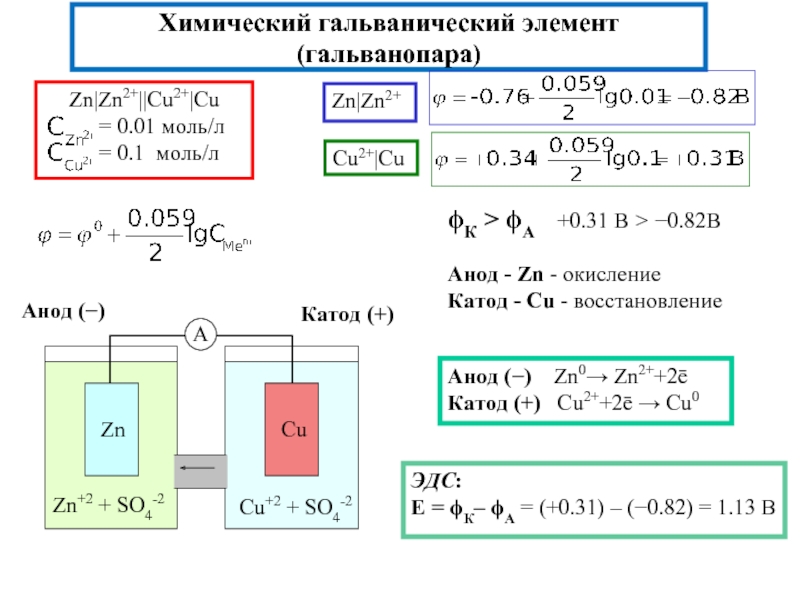 Такие реакции называются окислительно-восстановительными.
Такие реакции называются окислительно-восстановительными.
Ячейка характеризуется своим напряжением. Ячейка определенного типа генерирует одинаковое напряжение независимо от размера ячейки. Химический состав элемента зависит от напряжения элемента, если элемент работает в идеальных условиях. Напряжение ячейки может отличаться из-за нескольких факторов, таких как разница температур, изменение концентрации и т. д.
Уравнение Нернста Вальтера Нернста можно использовать для расчета значения ЭДС данной ячейки, обеспечивая стандартный потенциал ячейки.
История
Майкл Фарадей доказал, что химические реакции на каждой из двух границ раздела электрод-электролит обеспечивают «место ЭДС» для гальванического элемента около 1830 года. Эти реакции вызывают ток в цепи, которая представляет собой открытый корпус, разделение заряда продолжается до тех пор, пока электрическое поле от разделенных зарядов не станет достаточным для прекращения реакции.
Электродвижущая сила или ЭДС ячейки представляет собой максимальную разность потенциалов между двумя электродами ячейки. Электродвижущая сила клетки также может быть определена как суммарное напряжение между полуреакциями окисления и восстановления. Электродвижущая сила элемента в основном используется для определения того, является ли электрохимический элемент гальваническим или нет.
Электрохимическая ячейка
Электрохимическая ячейка — это устройство, способное генерировать электрическую энергию в результате протекающей в нем химической реакции или использовать подаваемую к нему электрическую энергию для осуществления в нем химической реакции. Эти устройства могут преобразовывать химическую энергию в электрическую и наоборот и используются для питания многих электрических устройств, таких как пульты дистанционного управления телевизором и часы.
Элементы, которые могут генерировать электрический ток в результате происходящих там химических реакций, называются гальваническими или гальваническими элементами.
Потенциал электрода
Погружение металлического электрода в раствор, содержащий его ионы, создает разность потенциалов на границе раздела, которая называется потенциалом электрода.
Рассмотрим случай, когда цинковый электрод, погруженный в раствор сульфата цинка, окисляется путем испускания двух электронов и высвобождается в раствор. Наличие электронов в электроде и ионов в растворе создает разницу потенциалов. Точно так же медь также имеет положительный потенциал. Сочетание этих двух ячеек по ячейке Потенциал.
Для определения Потенциала отдельной полуячейки всегда нужна стандартная полуячейка, значение Потенциала которой уже известно. Затем соедините эту стандартную полуячейку с неизвестной полуячейкой, чтобы определить общий потенциал.
Этот общий Потенциал представляет собой разницу между Потенциалами двух полуячеек. Стандартный водородный электрод (SHE) является примером такого стандартного полуэлемента. Потенциальное значение SHE, естественно, установлено равным нулю вольт. Подключите стандартный водородный электрод к неизвестному полуэлементу и измерьте разность потенциалов. Поскольку SHE равно нулю вольт, измеренное значение представляет собой неизвестную разность потенциалов полуэлемента.
Потенциальное значение SHE, естественно, установлено равным нулю вольт. Подключите стандартный водородный электрод к неизвестному полуэлементу и измерьте разность потенциалов. Поскольку SHE равно нулю вольт, измеренное значение представляет собой неизвестную разность потенциалов полуэлемента.
ЭДС элемента
Максимальная разность потенциалов между двумя электродами элемента определяется как электродвижущая сила элемента или ЭДС элемента. Это также известно как результирующее напряжение между полуреакциями окисления и восстановления.
Типы гальванических элементов
Гальванический элемент
Гальванический элемент, также известный как гальванический элемент, представляет собой устройство, которое может генерировать электричество в результате спонтанной окислительно-восстановительной реакции. 9{2+} (водн.) + Cu(s)\]
Состоит из цинкового электрода и медного электрода, пропитанных раствором сульфата цинка и раствором сульфата меди соответственно. Цинковый электрод действует как анод, а медь действует как катод. В контейнере слева металлический цинковый стержень (анод) погружен в раствор сульфата цинка. В емкости справа медный стержень (катод) погружен в раствор медного купороса. Медный кабель соединяет цинковый электрод и медный электрод. Раствор в анодном и катодном отделениях соединен с раствором сульфата калия солевым мостиком. 9Ионы {2+}\] перемещаются из анодной полуячейки в катодную полуячейку. Цепь завершается переносом ионов из одной полуэлемента в другую, что гарантирует постоянную подачу энергии. Ячейка будет продолжать работать до тех пор, пока не будут исчерпаны ионы металлического цинка или меди.
Цинковый электрод действует как анод, а медь действует как катод. В контейнере слева металлический цинковый стержень (анод) погружен в раствор сульфата цинка. В емкости справа медный стержень (катод) погружен в раствор медного купороса. Медный кабель соединяет цинковый электрод и медный электрод. Раствор в анодном и катодном отделениях соединен с раствором сульфата калия солевым мостиком. 9Ионы {2+}\] перемещаются из анодной полуячейки в катодную полуячейку. Цепь завершается переносом ионов из одной полуэлемента в другую, что гарантирует постоянную подачу энергии. Ячейка будет продолжать работать до тех пор, пока не будут исчерпаны ионы металлического цинка или меди.
Daniel Cell
Не отличается от гальванического элемента. Это также тот же медно-цинковый элемент, который описан для гальванического элемента. Единственное ключевое отличие состоит в том, что ячейка Даниэля может использовать только цинк и медь в качестве электродов, тогда как для гальванических ячеек она не ограничивается только цинковыми и медными электродами, она может использовать различные металлы в качестве электродов.
В элементе Daniel в качестве электролитов используются сульфат меди (II) и сульфат цинка, тогда как в гальваническом элементе в качестве электролитов используются соли металлов каждого электрода.
Недавно обновленные страницы. Сферическая оболочка — важные понятия и советы для JEE
Вектор положения и вектор смещения — важные понятия и советы для JEE
Параллельное и смешанное группирование ячеек — важные понятия и советы для JEE
Момент инерции сплошных тел — важные понятия и советы для JEE
Колебания пружинного блока — Важные концепции и советы для JEE
Равномерная чистая прокатка — Важные концепции и советы для JEE
Электрическое поле заряженной сферической оболочки — Важные концепции и советы для JEE
Вектор положения и вектор смещения — важные понятия и советы для JEE
Параллельная и смешанная группировка ячеек — важные понятия и советы для JEE
Актуальные темы
ELECTROMOTIVE FORCE, EMFs (CELLs90cellaneous) ELECTROMOTIVE FORCE, EMFs (CELLs90cellaneous) ЭЛЕКТРОДВИЖУЩАЯ СИЛА, ЭДС (ЯЧЕЙКИ) (Разное) | ОСТИ.
 GOV
GOVперейти к основному содержанию
- Полная запись
- Другие родственные исследования
Напряжение или разность электрических потенциалов на клеммах ячейки, когда от нее не поступает ток. ЭДС ячейки представляет собой сумму разностей электрических потенциалов (PD), возникающих в результате разделения зарядов (электронов или ионов), которые могут возникать на каждой фазовой границе (или границе раздела) в ячейке. Величина каждого ЧР зависит от химической природы двух контактирующих фаз. Таким образом, на границе двух разных металлов часть электронов переместится из металла с более высокой свободной энергией электронов в металл с более низкой свободной энергией электронов. Результирующее разделение зарядов приведет к частичному разряду (точно так же, как разделение зарядов создает напряжение на конденсаторе), которое в равновесии точно препятствует дальнейшему потоку электронов. Точно так же ЧР могут возникать, когда электроны проходят через границу раздела металл/раствор или металл/твердое тело, а также когда ионы проходят через границу раздела раствор/мембрана/раствор.
Точно так же ЧР могут возникать, когда электроны проходят через границу раздела металл/раствор или металл/твердое тело, а также когда ионы проходят через границу раздела раствор/мембрана/раствор.
- Авторов:
- Арчер, доктор медицины; Фельдберг, СЗ
- Дата публикации:
- Исследовательская организация:
- Брукхейвенская национальная лаборатория. (BNL), Аптон, Нью-Йорк (США)
- Организация-спонсор:
- Управление энергетических исследований Министерства энергетики США (ER) (США)
- Идентификатор ОСТИ:
- 760971
- Номер(а) отчета:
- БНЛ-65847; KC030101
Проект НИОКР: AS002CSD; КС030101; РНН: Ah300035%%46
- Номер контракта с Министерством энергетики:
- АК02-98Ч20886
- Тип ресурса:
- Разное
- Связь ресурсов:
- Прочая информация: PBD: 16 сентября 1998 г.
 ; Дополнительная информация: В: Энциклопедия науки и техники, vp.
; Дополнительная информация: В: Энциклопедия науки и техники, vp.
- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- 37 НЕОРГАНИЧЕСКАЯ, ОРГАНИЧЕСКАЯ, ФИЗИЧЕСКАЯ И АНАЛИТИЧЕСКАЯ ХИМИЯ; ЭЛЕКТРИЧЕСКИЙ ПОТЕНЦИАЛ; ЭЛЕКТРОДВИЖУЩАЯ СИЛА; СВОБОДНАЯ ЭНЕРГИЯ; ЭЛЕКТРОЛИТИЧЕСКИЕ ЯЧЕЙКИ; ЭЛЕКТРОННЫЙ ПЕРЕНОС
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Арчер, доктор медицины, и Фельдберг, SW. ЭЛЕКТРОДВИЖУЩАЯ СИЛА, ЭДС (ЯЧЕЙКИ) . США: Н. П., 1998.
Веб.
Копировать в буфер обмена
Арчер, доктор медицинских наук, и Фельдберг, С. В. ЭЛЕКТРОДВИЖУЩАЯ СИЛА, ЭДС (КЛЕТКИ) . Соединенные Штаты.
В. ЭЛЕКТРОДВИЖУЩАЯ СИЛА, ЭДС (КЛЕТКИ) . Соединенные Штаты.
Копировать в буфер обмена
Арчер, доктор медицины, и Фельдберг, С.В., 1998.
"ЭЛЕКТРОДВИЖУЩАЯ СИЛА, ЭДС (КЛЕТКИ)". Соединенные Штаты. https://www.osti.gov/servlets/purl/760971.
Копировать в буфер обмена
@статья{osti_760971,
title = {ЭЛЕКТРОДВИЖУЩАЯ СИЛА, ЭДС (КЛЕТКИ)},
автор = {Арчер, М. Д. и Фельдберг, С. В.},
abstractNote = {Напряжение или разность электрических потенциалов на клеммах ячейки, когда от нее не поступает ток. ЭДС ячейки представляет собой сумму разностей электрических потенциалов (PD), возникающих в результате разделения зарядов (электронов или ионов), которые могут возникать на каждой фазовой границе (или границе раздела) в ячейке. Величина каждого ЧР зависит от химической природы двух контактирующих фаз. Таким образом, на границе раздела двух разных металлов часть электронов переместится из металла с более высокой свободной энергией электронов в металл с более низкой свободной энергией электронов. Результирующее разделение зарядов приведет к частичному разряду (точно так же, как разделение зарядов создает напряжение на конденсаторе), которое в равновесии точно препятствует дальнейшему потоку электронов. Точно так же ЧР могут возникать, когда электроны проходят через границу раздела металл/раствор или металл/твердое тело, а также когда ионы проходят через границу раздела раствор/мембрана/раствор.},
Таким образом, на границе раздела двух разных металлов часть электронов переместится из металла с более высокой свободной энергией электронов в металл с более низкой свободной энергией электронов. Результирующее разделение зарядов приведет к частичному разряду (точно так же, как разделение зарядов создает напряжение на конденсаторе), которое в равновесии точно препятствует дальнейшему потоку электронов. Точно так же ЧР могут возникать, когда электроны проходят через границу раздела металл/раствор или металл/твердое тело, а также когда ионы проходят через границу раздела раствор/мембрана/раствор.},
дои = {},
URL-адрес = {https://www.osti.gov/biblio/760971},
журнал = {},
номер =,
объем = ,
место = {США},
год = {1998},
месяц = {9}
}
Копировать в буфер обмена
Посмотреть Разное (0,68 МБ)
Дополнительную информацию о получении полнотекстового документа см.


 ; Дополнительная информация: В: Энциклопедия науки и техники, vp.
; Дополнительная информация: В: Энциклопедия науки и техники, vp.