Диполь — вода — Большая Энциклопедия Нефти и Газа, статья, страница 1
Cтраница 1
| Ассоциация диполей воды. [1] |
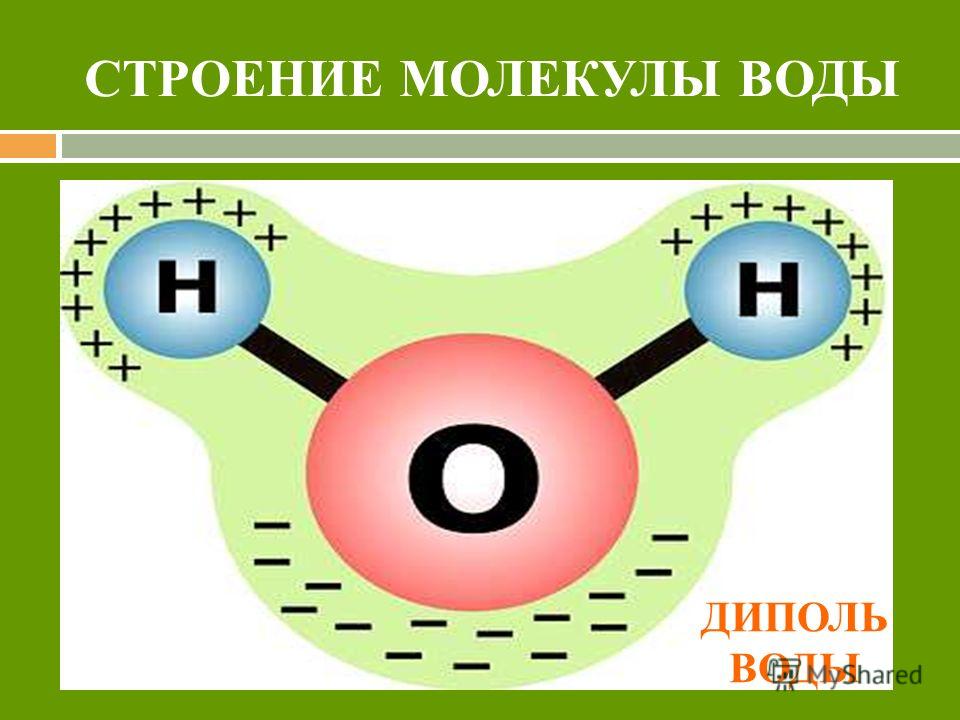
Диполи воды имеют угловую форму, так как ядра атомов в них образуют равнобедренный треугольник. В основании его расположены два протона, а в вершине — ядро атома кислорода. При этом в молекуле воды две s / Я-гибридные орбитали атома кислорода образуют две ко-валентные связи О — Н ( длина которых около 0 1 нм) и остаются еще две неподеленные пары электронов. [2]
Диполи воды соединены с гидрофильными группами белков водородными связями. Учитывая явления гидратации, можно объяснить рассмотренный нами процесс высаливания белков из растворов. При прибавлении к раствору белка высоких концентраций солей или таких органических растворителей, как спирт или ацетон, возникает конкуренция за молекулы воды между солью или спиртом, с одной стороны, и молекулами белка — с другой.
Диполи воды своими отрицательно заряженными концами притягиваются к положительным ионам металлов или водорода. Чем меньше заряд и больше размер ионов, тем быстрее и легче они отрываются диполями воды от поверхности элементарных кристаллов. Связь между листочками в пачках нарушается, и глина распускается в воде. [4]
| Полярографические максимумы. [5] |
Диполи воды, поляризуясь, образуют оболочку вокруг капли ртути, которая мешает адсорбироваться на поверхности капли новым ионам деполяризатора и предельный ток будет поддерживаться только диффузией деполяризатора через водную оболочку. [6]
Если диполи воды ориентированы в поверхностном слое кристаллической решетки цементных минералов, то расстояния между поверхностными ионами практически не изменяются.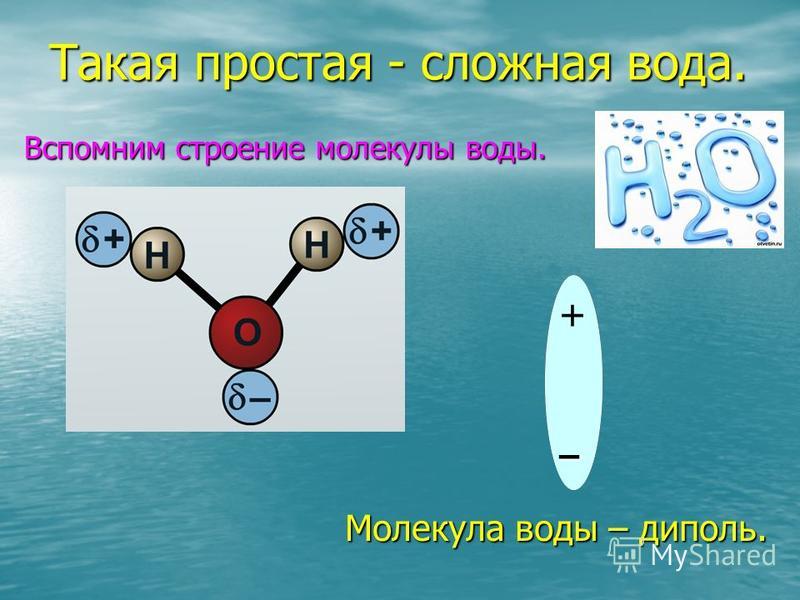 [7]
[7]
| Схема гидратации полярного электролита. [8] |
Постепенно диполи воды проникают между ионами Na и С1 — в твердой фазе, отрывая их от кристалла. [9]
При этом диполи воды Б поверхностном слое ориентированы таким образом, что кислород обращен в сторону газовой фазы, а водород — в сторону соли. [10]
| Растворение кристалла поваренной соли в воде, сопровождающееся распадом на ионы. [11] |
Окружающие кристаллик диполи воды сразу же ориентируются так, что их отрицательные полюса подходят к положительным ионам натрия, а положительные полюса — ближе к отрицательным ионам хлора. Таким образом, вокруг каждого иона поверхностного уровня кристалла образуется оболочка из молекул полярного растворителя — воды. Этот процесс называется сольватацией ( отлат.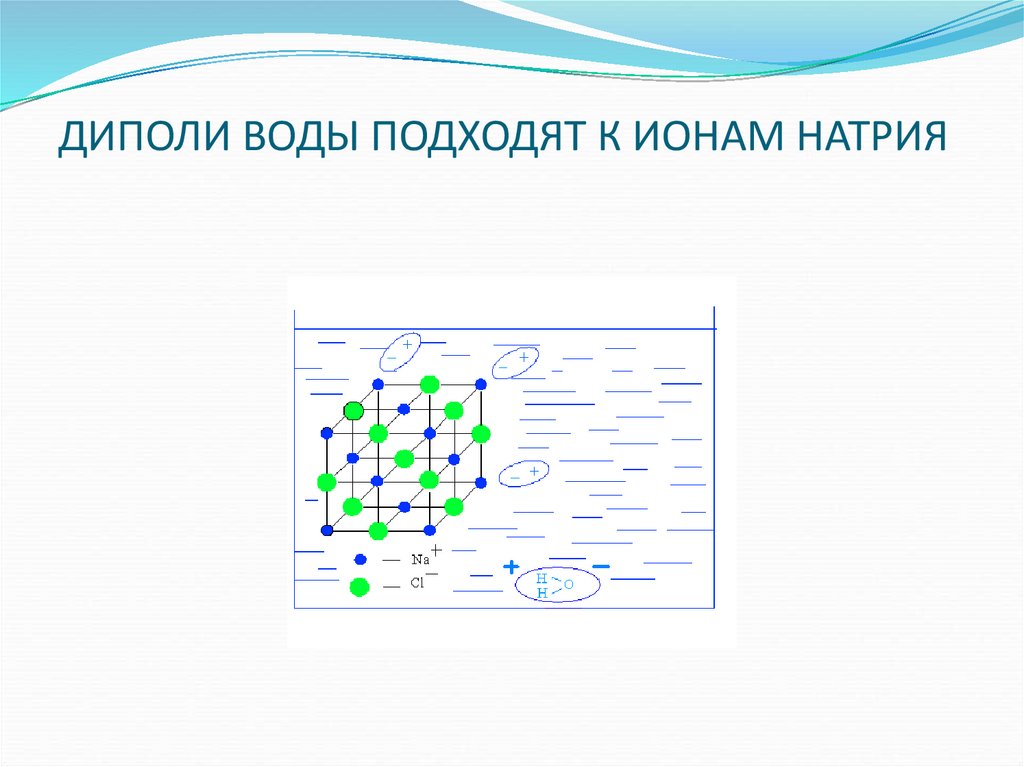
К полярным группам притягиваются диполи воды, образующие вокруг коллоидной частицы сплошную ( или почти сплошную) водную оболочку. Спонслер установил, что одна группа ОН притягивает три молекулы воды, СООН — четыре молекулы, СО — две молекулы, NH — две молекулы, Nh3 — три молекулы. [13]
К полярным группам притягиваются
Знак минус означает, что диполи воды обращены положительным концом наружу. [15]
Страницы: 1 2 3 4 5
Принцип действия. Статьи компании «ООО «НовАкваТех»»
Молекулу воды можно представить, как элементарный диполь (рис.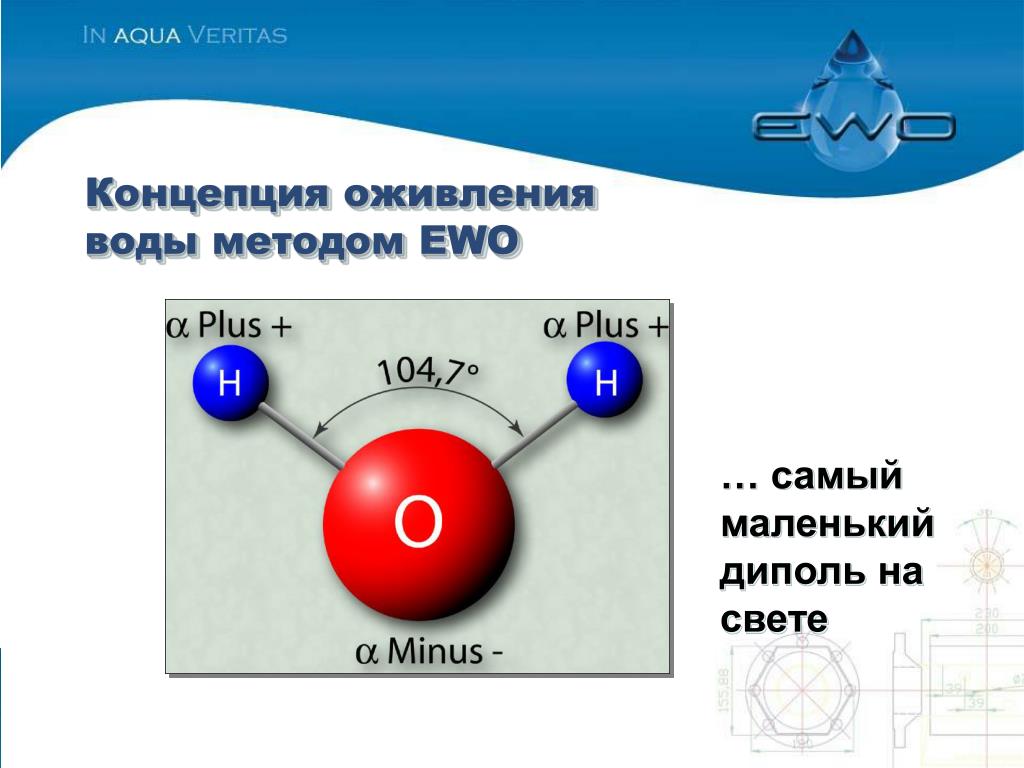 1). Под действием сил взаимного притяжения молекулы-диполи образуют кластеры (рис.2). Действие сил взаимного притяжения мало, поэтому диполи могут свободно отрываться от кластеров, примыкать к другим кластерам. Точно так же кластеры могут образовываться вокруг примесей, присутствующих в воде (Са(НС03)2, Мд(НС03)2, СаС03, МдС03). Таким образом, соли кальция и магния постоянно окружены молекулами воды.
1). Под действием сил взаимного притяжения молекулы-диполи образуют кластеры (рис.2). Действие сил взаимного притяжения мало, поэтому диполи могут свободно отрываться от кластеров, примыкать к другим кластерам. Точно так же кластеры могут образовываться вокруг примесей, присутствующих в воде (Са(НС03)2, Мд(НС03)2, СаС03, МдС03). Таким образом, соли кальция и магния постоянно окружены молекулами воды.
При нагревании кластерная структура становится нестабильной, молекулы воды больше не обволакивают примеси, и растворённые соли могут вступать в реакцию с другими солями. Таким образом, кристаллы вышеуказанных солей прочно пристанут к стенкам нагревательных элементов или трубопроводов, и начнётся процесс образования накипи. При использовании устройства магнитной водоподготовки MB или УМВ «НОВАКВАТЕХ» на молекулы воды и примеси действует магнитное поле. Диполи попадают в резонанс, и кластерная структура молекул воды разрушается. Примеси освобождаются от опеки водных кластеров и могут свободно вступать во взаимодействие друг с другом.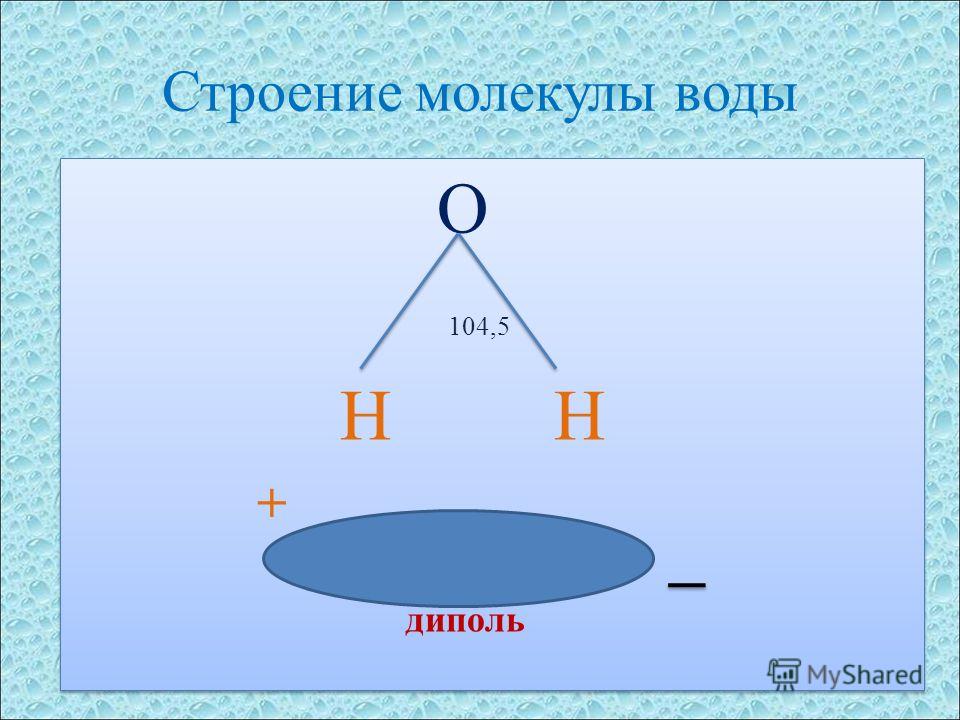
Процесс этот является лавинообразным: новые ионы кальция прикрепляются к уже выпавшему в осадок на поверхности микрокристаллов кальцию. Таким образом, ионы кальция, уже осевшие на центрах кристаллизации, не выпадают в виде накипи на нагревательных поверхностях. Микрокристаллы остаются в массе воды и выносятся в дренаж. Более того: ионы кальция из уже выпавшей в осадок накипи начинают отрываться и присоединяться к вновь образованным микрокристаллам. Со временем старая накипь разрыхляется и полностью вымывается с поверхности труб и нагревательных элементов. Если же устройства УМВ «НОВАКВАТЕХ» устанавливаются на новое оборудование, то накипь не выпадает на теплообменных поверхностях. Кроме того, с течением времени на поверхностях труб образуется тонкая оксидная плёнка, защищающая оборудование от коррозии.
РИС. | РИС. 2 |
|---|---|
Устранение жёсткости и механизм предотвращения образования накипи с помощью устройств магнитной водоподготовки сводится к инициированию структурной перестройки — фазового перехода второго рода (ФП2). Производится омагничивание воды, в результате чего карбонат кальция, который обычно, при наличии пресыщения, кристаллизуется в кристаллографической модификации кальцита, начинает кристаллизоваться в модификации арагонита. У арагонита существенно отличающиеся свойства:
высокое кристаллографическое несоответствие к окислам и карбонатам железа, которые при некачественной деаэрации образуются на стальной поверхности;
низкая адгезия к стали;
низкая когезия отдельных кристаллов друг к другу.
Вода, обработанная устройствами УМВ «НОВАКВАТЕХ», сохраняет свои свойства от 10 часов до 8 суток в зависимости от состава воды и условий эксплуатации.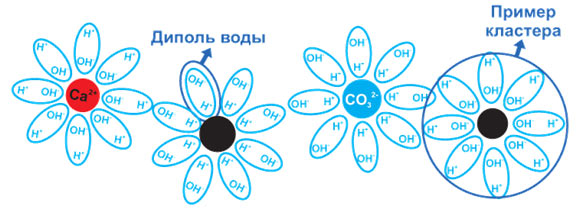 Как правило, этого времени более чем достаточно для получения успешных результатов. Способ магнитной водоподготовки нашел широкое применение во многих странах мира, в том числе таких передовых, как Япония, США, Германия.
Как правило, этого времени более чем достаточно для получения успешных результатов. Способ магнитной водоподготовки нашел широкое применение во многих странах мира, в том числе таких передовых, как Япония, США, Германия.
диполей молекул воды | Примечания к пересмотру биологии уровня A
Присоединяйся сейчас
Если вы готовы сдать экзамены по биологии уровня A, станьте участником прямо сейчас, чтобы получить полный доступ ко всей нашей библиотеке материалов для повторения.
Присоединяйтесь к более чем 22 000 учащихся, сдавших экзамены благодаря нам!
Зарегистрируйтесь ниже, чтобы получить мгновенный доступ!
Присоединиться →
Или попробуйте пример…
Еще не готовы приобрести комплект для доработки? Без проблем. Если вы хотите ознакомиться с тем, что мы предлагаем, перед покупкой, у нас есть бесплатная подписка с образцами материалов для пересмотра.
Зарегистрируйтесь в качестве бесплатного члена ниже, и вы вернетесь на эту страницу, чтобы попробовать образцы материалов перед покупкой.
Скачать образцы →
Quick Navigation
[скрыть]
Обзор диполей молекул воды- Вода является основным компонентом всех организмов
- Молекула воды называется диполярной, потому что она имеет положительный и отрицательный полюс в результате неравномерного распределения электронов внутри нее
- Природа диполя внутри молекулы воды создает силы притяжения, известные как водородные связи, что позволяет им склеиваться
- Одним из многих свойств воды является высокая удельная теплоемкость, что означает, что для нагрева данной массы воды требуется много энергии
- Большое количество водородных связей в молекулах воды также означает, что она требует много энергии, чтобы испарить один грамм воды. Энергия называется скрытой теплотой парообразования
- Вода также используется для разрушения многих сложных молекул, например, путем гидролиза; дисахарид углеводы, расщепленные на моносахариды
Вода является основным химическим компонентом всех клеток при построении новых клеток, а также используется для разрушения молекул. Он играет много важных ролей в организмах и является ключевым реагентом, используемым в фотосинтезе. По сути, вода известна как среда жизни, где около 70% поверхности Земли покрыто водой. Его полезные и уникальные свойства обусловлены его структурой. Это химическое соединение, известное как полярная молекула, где при стандартных температурах и давлении вода представляет собой жидкую водную форму, а твердое состояние воды известно как лед.
Он играет много важных ролей в организмах и является ключевым реагентом, используемым в фотосинтезе. По сути, вода известна как среда жизни, где около 70% поверхности Земли покрыто водой. Его полезные и уникальные свойства обусловлены его структурой. Это химическое соединение, известное как полярная молекула, где при стандартных температурах и давлении вода представляет собой жидкую водную форму, а твердое состояние воды известно как лед.
Подробнее о структуре и свойствах воды
Химическая структура воды- Вода имеет гораздо меньшую структуру по сравнению с другими молекулами
- Является универсальным растворителем
- Вода состоит из 2 атомов водорода, связанных с одним атом кислорода, что дает молекулярную формулу H 2 O. Атомы водорода связаны с атомами кислорода через ковалентные связи, которые представляют собой тип химической связи, которая соединяет атомы водорода и кислорода вместе
- Ковалентная связь – это связь, в которой два атома имеют одну и ту же пару электронов.

- Ковалентные связи образуются, когда электроны распределяются между двумя атомами для заполнения каждой внешней оболочки. Атому водорода требуется еще один электрон, а атому кислорода необходимо получить еще один электрон, чтобы внешняя оболочка была полной . Полярные молекулы, помещенные в воду, растворяются и диссоциируют на ионы воды. Ионные молекулы при попадании в воду диссоциируют на ионы. Именно вода обеспечивает протекание различных химических реакций:
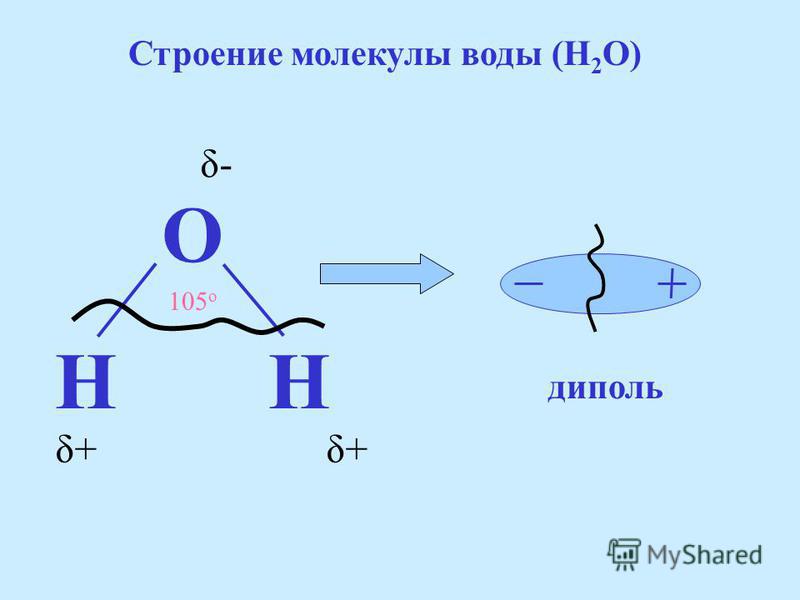
- Электроны в ковалентных связях воды распределены неравномерно и расположены ближе к ядру кислорода, чем к ядрам водорода. Это связано с тем, что отрицательно заряженные электроны в электронной паре сильнее притягиваются к ядру кислорода, поскольку положительно заряженных протонов больше. Ядро кислорода в природе намного больше, так как в нем 8 протонов, тогда как ядро водорода имеет 1 протон (рис. 1). Протоны по своей природе положительны, а электроны заряжены отрицательно. Ковалентно связанные электроны будут притягиваться к позитивным вещам, а поскольку в ядре кислорода больше протонов, чем в водороде, они будут больше притягиваться к атому кислорода.

- Неравное распределение электронов приводит к тому, что атом кислорода становится полярным и слегка отрицательным. Есть слегка отрицательный атом кислорода и слегка положительные атомы водорода.
Неравномерное распределение заряда по молекулам воды делает ее полярной молекулой .
Водородная связь в воде
Полярные молекулы — это молекулы с неравномерным распределением заряда. Полярность воды вызывает притяжение между молекулами воды. Эта сила притяжения известна как водородная связь .Связь между молекулами, при которой слегка положительные атомы водорода в одной молекуле воды притягиваются к слегка отрицательному атому кислорода в другой молекуле воды. Тип притяжения представляет собой слабое взаимодействие, которое происходит между слегка отрицательно заряженными атомами и слегка положительно заряженными атомами. Она слабее ковалентной связи, но представляет собой сильнейшую межмолекулярную силу.
 Каждая из отдельных водородных связей слаба, и вода образует многие из этих водородных связей.
Каждая из отдельных водородных связей слаба, и вода образует многие из этих водородных связей.Водородная связь представляет собой слабое взаимодействие между слегка отрицательно заряженными атомами и слегка положительно заряженными атомами.
Вода образует внутри себя водородные связи. Множество водородных связей в воде придает ей высокую стабильность, поэтому для повышения температуры воды требуется большое количество энергии.
Рисунок 1: Молекула воды Физические свойства водыХотя вода является самой распространенной жидкостью на Земле, структура молекулы воды обуславливает ее несколько необычных свойств.
В частности, многие из указанных ниже свойств обусловлены его диполярной природой и последующими водородными связями , которые он образует и допускает.Растворитель
Вода является хорошим растворителем, поскольку она представляет собой заряженную молекулу, позволяющую легко ее транспортировать, а дипольная природа ее молекулы воды позволяет другим полярным молекулам легко растворяться в воде.
 Такие примеры заряженных полярных молекул, как соли, аминокислоты и сахара, способны легко растворяться в воде. Их называют гидрофильный ; «водолюбивые» молекулы. Неполярные молекулы, такие как липиды, называются гидрофобными , «ненавидящими воду».
Такие примеры заряженных полярных молекул, как соли, аминокислоты и сахара, способны легко растворяться в воде. Их называют гидрофильный ; «водолюбивые» молекулы. Неполярные молекулы, такие как липиды, называются гидрофобными , «ненавидящими воду».Высокая теплоемкость
Склонность молекул воды слипаться известна как когезия. Следовательно, для разделения слипшихся молекул потребовалось бы больше тепловой энергии, чем если бы они не были связаны друг с другом. Что касается воды, вода не очень легко меняет температуру, поскольку ее удельная теплоемкость составляет 4,2 Дж г-1 °C-1, что, говоря простым языком, означает, что для нагрева 1 г воды на 1 °C требуется 4,2 Дж энергии. . Это очень высокий показатель, который поддерживает стабильность водной и клеточной среды.
Высокая скрытая теплота парообразования
Водородные связи между молекулами воды позволяют ей иметь высокую скрытую теплоту парообразования.
 Следовательно, для перехода воды из жидкого состояния в газообразное требуется большое количество энергии, при котором испарение оказывает охлаждающее действие на организмы, такое как потоотделение у животных и транспирация у растений
Следовательно, для перехода воды из жидкого состояния в газообразное требуется большое количество энергии, при котором испарение оказывает охлаждающее действие на организмы, такое как потоотделение у животных и транспирация у растенийПлотность
Вода обладает уникальным свойством что в твердом состоянии (лед) он менее плотный, чем в жидком состоянии, и может плавать на воде. Это свойство отличается от обычной ситуации, поскольку большинство веществ находятся в газообразной форме, когда они менее плотные, а более плотные находятся в твердом состоянии. Это показывает, насколько вода отличается. Свойство воды делает жизненно важным для водных организмов способность выживать при минусовых температурах, например, в прудах, озерах и т. д.
Когезия и поверхностное натяжение в воде
Вода обладает свойствами когезии, когда они имеют тенденцию слипаться с другими молекулами. Это связано с водородными связями внутри молекул воды, которые вызывают большие силы сцепления, что позволяет воде проходить через трубку, например, в растениях; сосуды ксилемы, которые представляют собой длинные трубки, которые помогают в транспортировке воды, чтобы обеспечить механическую поддержку плана.
 Другая сила называется 9Поверхностное натяжение 0007 также является уникальным свойством воды. Поверхностное натяжение — это сила притяжения, которая может действовать на поверхность других молекул жидкости, что придает поверхности жидкости тенденцию сжиматься до минимальной площади поверхности, а не вытекать из массы воды. Поверхностное натяжение воды позволяет фигуристам ходить по воде или позволяет насекомым, которые обычно плотнее воды, плавать по поверхности воды.
Другая сила называется 9Поверхностное натяжение 0007 также является уникальным свойством воды. Поверхностное натяжение — это сила притяжения, которая может действовать на поверхность других молекул жидкости, что придает поверхности жидкости тенденцию сжиматься до минимальной площади поверхности, а не вытекать из массы воды. Поверхностное натяжение воды позволяет фигуристам ходить по воде или позволяет насекомым, которые обычно плотнее воды, плавать по поверхности воды.pH
Вода сама по себе частично ионизирована и содержит ионы H+, которые делают некоторые биохимические реакции чувствительными к изменениям pH. Чистая вода не буферизуется при нейтральном рН, в отличие от цитоплазмы и тканевых жидкостей живых организмов, которые буферизуются при нейтральном рН 7,5.
Ионизация
Ионизация – это процесс образования или расщепления молекул на их катионы и анионы. Например, когда хлорид натрия (NaCl) растворяется в воде, они ионизируются и разделяются на положительные и отрицательные ионы (Na ++ , Cl – ).

Часто задаваемые вопросы
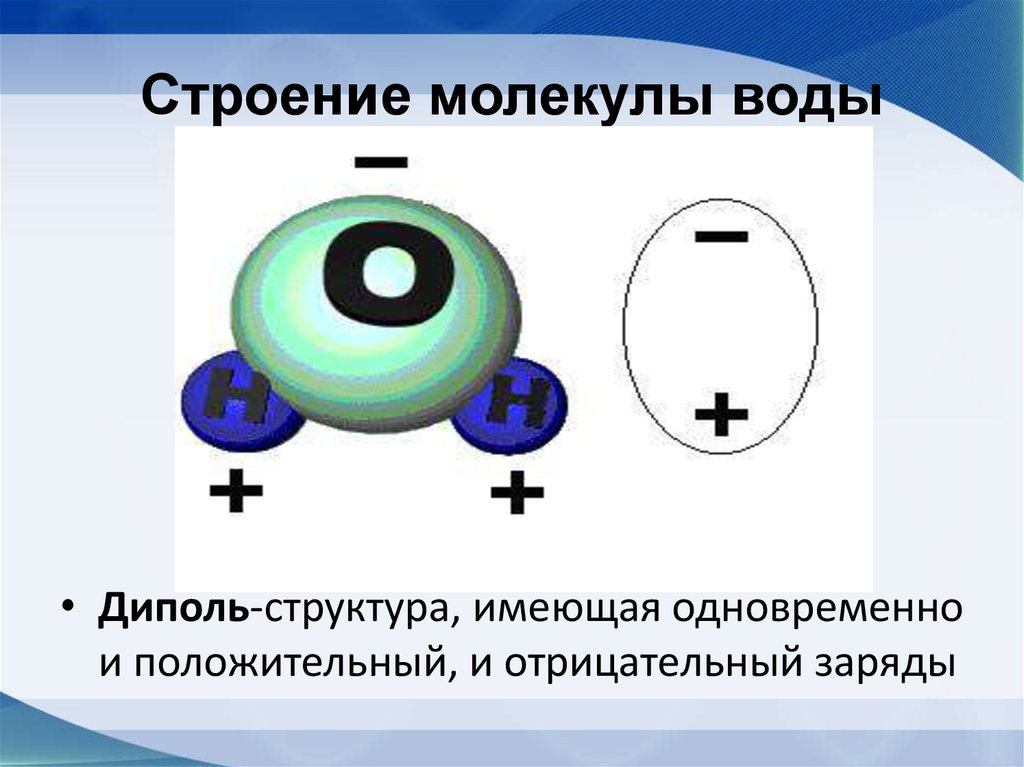
Что такое диполи воды?
Молекула воды полярна по своей природе. Он имеет два полюса, частичный положительный полюс и частичный отрицательный полюс. Атом кислорода имеет частичный отрицательный заряд, тогда как атомы водорода имеют частичный положительный заряд.
Как образуются диполи в молекуле воды?
Диполи образуются в молекулах воды из-за различий в электроотрицательности или неравного распределения электронов между атомами кислорода и водорода.
Почему важна биполярность молекул воды?
Полярность воды делает ее отличным растворителем. Большинство веществ могут растворяться в воде из-за ее полярной природы.
В чем разница между полярным и диполярным?
Полярные виды — это те, которые несут положительный или отрицательный заряд, т. е. имеют один полюс. С другой стороны, диполярные виды имеют два противоположных полюса, то есть положительный и отрицательный полюса в одной и той же молекуле.
Каталожные номера:
[1]. https://commons.wikimedia.org/wiki/File:h3O_Polarization_V.1.svg
Молекулярная структура
[2]. https://openstax.org/books/biology-2e/pages/2-2-water. Почему вода является диполем?
Да, это связано с орбиталями.
$\ce{CO2}$ является линейным, поэтому, хотя связи $\ce{C-O}$ имеют отдельные дипольные моменты, общий дипольный момент равен нулю, поскольку они компенсируются (они направлены в противоположные стороны, как показано на схему ниже).
Цвета обозначают плотность электронов, красный означает большую плотность, синий – меньшую плотность. Дипольный момент изменяется от низкой плотности к высокой плотности.
Итак, почему эти молекулы имеют разную форму? Вот здесь и появляются орбиты.
 Я постараюсь объяснить как можно больше, не вдаваясь в орбиты. 92$. Из этих четырех электронов два используются в связях $\pi$ и два в связях $\sigma$. Если вы не знаете, что это такое, просто посмотрите на это сейчас так: набор связей между двумя атомами будет иметь одну и только одну связь $\sigma$, а остальные связи $\pi$. Так, любая одинарная связь состоит только из $\sigma$-связи, двойная связь состоит из одной $\sigma$ и одной $\pi$, а тройная связь состоит из одной $\sigma$ и две связи $\pi$. Что на самом деле представляют собой эти типы связей, можно объяснить, если вы знаете, что такое орбиталь.
Я постараюсь объяснить как можно больше, не вдаваясь в орбиты. 92$. Из этих четырех электронов два используются в связях $\pi$ и два в связях $\sigma$. Если вы не знаете, что это такое, просто посмотрите на это сейчас так: набор связей между двумя атомами будет иметь одну и только одну связь $\sigma$, а остальные связи $\pi$. Так, любая одинарная связь состоит только из $\sigma$-связи, двойная связь состоит из одной $\sigma$ и одной $\pi$, а тройная связь состоит из одной $\sigma$ и две связи $\pi$. Что на самом деле представляют собой эти типы связей, можно объяснить, если вы знаете, что такое орбиталь.VSEPR говорит, что геометрия молекулы определяется только $\sigma$-связями и неподеленными парами на центральном атоме. Вы подсчитываете связи $\sigma$ и неподеленные пары (скажем, в сумме они составляют $x$) и решаете геометрию на основе этого. Геометрия представляет собой наиболее стабильную конфигурацию $x$ гибридных орбиталей. Проще говоря, если мы возьмем $x$ воздушных шариков и свяжем их вместе, то направления, в которых они указывают, помогут нам совпасть с тем, где лежат связи и неподеленные пары:
В $\ce{CO2}$ имеется две связи $\sigma$ и две связи $\pi$ (поскольку каждая двойная связь имеет по одной связи каждого типа).

- Электроны в ковалентных связях воды распределены неравномерно и расположены ближе к ядру кислорода, чем к ядрам водорода. Это связано с тем, что отрицательно заряженные электроны в электронной паре сильнее притягиваются к ядру кислорода, поскольку положительно заряженных протонов больше. Ядро кислорода в природе намного больше, так как в нем 8 протонов, тогда как ядро водорода имеет 1 протон (рис. 1). Протоны по своей природе положительны, а электроны заряжены отрицательно. Ковалентно связанные электроны будут притягиваться к позитивным вещам, а поскольку в ядре кислорода больше протонов, чем в водороде, они будут больше притягиваться к атому кислорода.



 Каждая из отдельных водородных связей слаба, и вода образует многие из этих водородных связей.
Каждая из отдельных водородных связей слаба, и вода образует многие из этих водородных связей.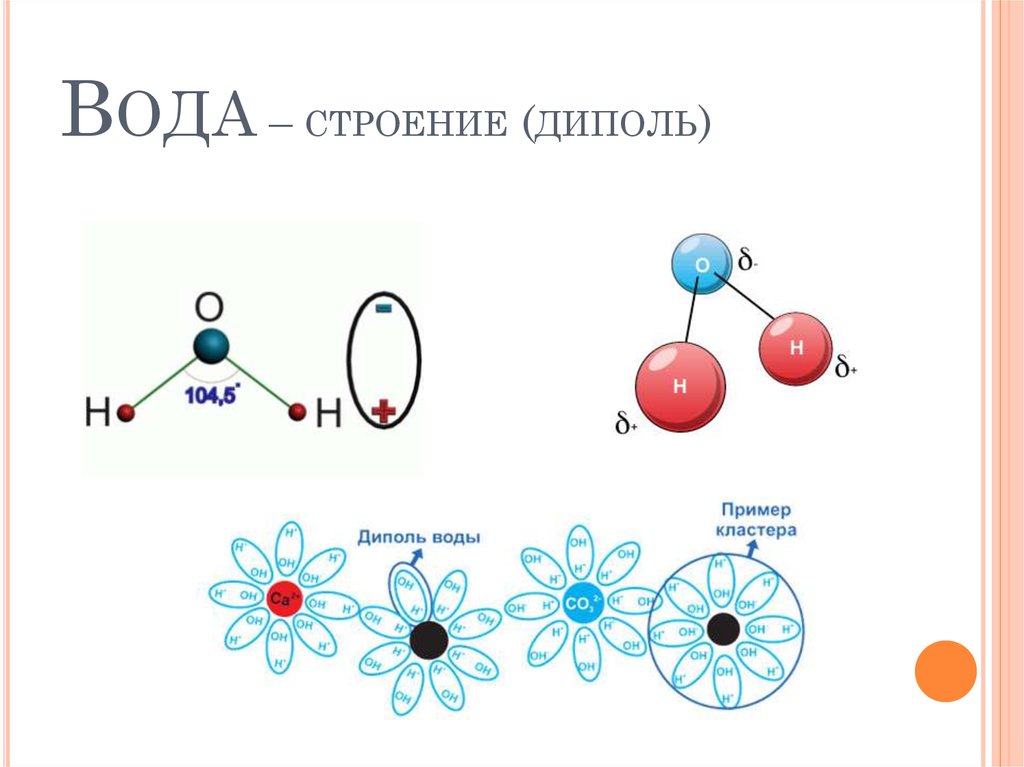 Такие примеры заряженных полярных молекул, как соли, аминокислоты и сахара, способны легко растворяться в воде. Их называют гидрофильный ; «водолюбивые» молекулы. Неполярные молекулы, такие как липиды, называются гидрофобными , «ненавидящими воду».
Такие примеры заряженных полярных молекул, как соли, аминокислоты и сахара, способны легко растворяться в воде. Их называют гидрофильный ; «водолюбивые» молекулы. Неполярные молекулы, такие как липиды, называются гидрофобными , «ненавидящими воду».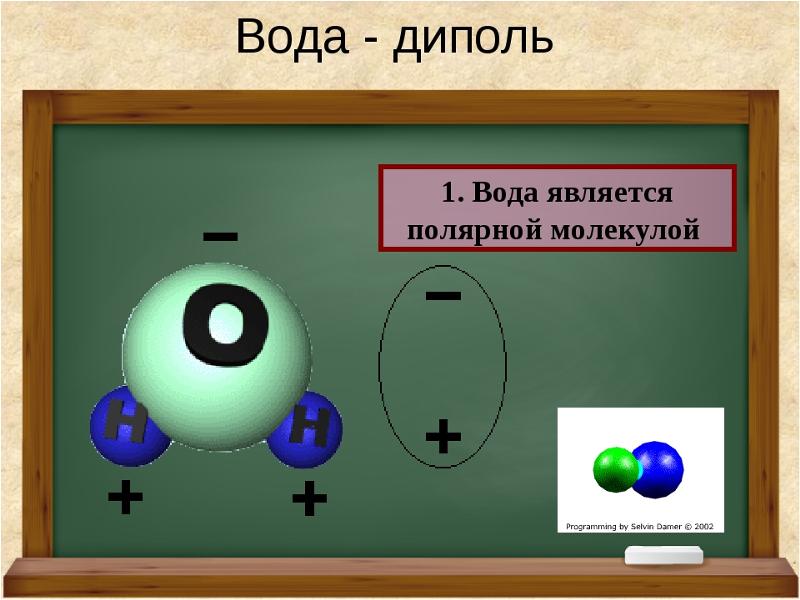 Следовательно, для перехода воды из жидкого состояния в газообразное требуется большое количество энергии, при котором испарение оказывает охлаждающее действие на организмы, такое как потоотделение у животных и транспирация у растений
Следовательно, для перехода воды из жидкого состояния в газообразное требуется большое количество энергии, при котором испарение оказывает охлаждающее действие на организмы, такое как потоотделение у животных и транспирация у растений Другая сила называется 9Поверхностное натяжение 0007 также является уникальным свойством воды. Поверхностное натяжение — это сила притяжения, которая может действовать на поверхность других молекул жидкости, что придает поверхности жидкости тенденцию сжиматься до минимальной площади поверхности, а не вытекать из массы воды. Поверхностное натяжение воды позволяет фигуристам ходить по воде или позволяет насекомым, которые обычно плотнее воды, плавать по поверхности воды.
Другая сила называется 9Поверхностное натяжение 0007 также является уникальным свойством воды. Поверхностное натяжение — это сила притяжения, которая может действовать на поверхность других молекул жидкости, что придает поверхности жидкости тенденцию сжиматься до минимальной площади поверхности, а не вытекать из массы воды. Поверхностное натяжение воды позволяет фигуристам ходить по воде или позволяет насекомым, которые обычно плотнее воды, плавать по поверхности воды.
 Я постараюсь объяснить как можно больше, не вдаваясь в орбиты. 92$. Из этих четырех электронов два используются в связях $\pi$ и два в связях $\sigma$. Если вы не знаете, что это такое, просто посмотрите на это сейчас так: набор связей между двумя атомами будет иметь одну и только одну связь $\sigma$, а остальные связи $\pi$. Так, любая одинарная связь состоит только из $\sigma$-связи, двойная связь состоит из одной $\sigma$ и одной $\pi$, а тройная связь состоит из одной $\sigma$ и две связи $\pi$. Что на самом деле представляют собой эти типы связей, можно объяснить, если вы знаете, что такое орбиталь.
Я постараюсь объяснить как можно больше, не вдаваясь в орбиты. 92$. Из этих четырех электронов два используются в связях $\pi$ и два в связях $\sigma$. Если вы не знаете, что это такое, просто посмотрите на это сейчас так: набор связей между двумя атомами будет иметь одну и только одну связь $\sigma$, а остальные связи $\pi$. Так, любая одинарная связь состоит только из $\sigma$-связи, двойная связь состоит из одной $\sigma$ и одной $\pi$, а тройная связь состоит из одной $\sigma$ и две связи $\pi$. Что на самом деле представляют собой эти типы связей, можно объяснить, если вы знаете, что такое орбиталь.