Что такое молекула? | New-Science.ru
Общие знанияХимия
30.09.2020
9 497 3 минут чтения
На протяжении тысячелетий ученые размышляли над загадкой жизни, а именно над тем, из чего она создается? Согласно большинству древних культур, жизнь и все сущее состояли из основных элементов природы — Земли, Воздуха, Ветра, Воды и Огня. Однако со временем многие философы начали выдвигать идею о том, что все вещи состоят из крошечных неделимых вещей, которые нельзя ни создать, ни уничтожить (т.е. частицы).
Однако это было в значительной степени философское понятие, и только с появлением атомной теории и современной химии ученые начали постулировать, что частицы, взятые в сочетании, производят основные строительные блоки всех вещей. Молекулы, как они их называли, взяты из латинского «moles» (что означает тяжесть, глыба, громада, массивная структура — с уменьшительным суффиксом -cula). Но используемый в контексте современной теории частиц термин относится к малым единицам массы.
Определение:
По классическому определению молекула — это наименьшая частица вещества, сохраняющая химические и физические свойства этого вещества. Она состоит из двух или более атомов, группы подобных или различных атомов, удерживаемых вместе химическими силами.
В космосе обнаружены как простые, так и сложные органические (углеродосодержащие) молекулы. Углерод образуется в ядрах красных гигантских звезд, где он циркулирует на поверхности и распределяется в пространстве.
Впечатление художника о простых и сложных органических (углеродосодержащих) молекулах, обнаруженных в космосе.Она может состоять из атомов одного химического элемента, как в случае с кислородом (O2), или из различных элементов, как в случае с водой (h3O). Как компоненты материи, молекулы распространены в органических веществах (и, следовательно, в биохимии) и являются тем, что позволяет создавать жизнетворные элементы, таким как жидкая вода и воздухопроницаемые атмосферы.
Типы связей:
Молекулы удерживаются вместе одним из двух типов связей — ковалентными связями или ионными связями. Ковалентная связь — это химическая связь, которая включает обмен электронными парами между атомами. Связь, которую они образуют, является результатом стабильного баланса сил притяжения и отталкивания между атомами, известна как ковалентная связь.
Ковалентная связь — это химическая связь, которая включает обмен электронными парами между атомами. Связь, которую они образуют, является результатом стабильного баланса сил притяжения и отталкивания между атомами, известна как ковалентная связь.
Ионная связь, напротив, представляет собой тип химической связи, которая включает электростатическое притяжение между противоположно заряженными ионами. Ионы, участвующие в такой связи, — это атомы, которые потеряли один или несколько электронов (называемые катионами), и те, которые приобрели один или несколько электронов (называемые анионами). В отличие от ковалентности, этот перенос называется электровалантом.
В простейших формах ковелантные связи возникают между атомом металла (как катион) и атомом неметалла (анион), что приводит к таким соединениям, как хлорид натрия (NaCl) или оксид железа (Fe²O³), также известные как. соль и ржавчина. Однако могут быть сделаны и более сложные устройства, такие как аммоний (NH 4+) или углеводороды, такие как метан (CH 4) и этан (H 3 CCH 3).
История
Исторически молекулярная теория и атомная теория тесно переплетены. Первые упоминания о том, что материя состоит из “отдельных единиц”, появились в Древней Индии, где последователи джайнизма придерживались идеи, что все вещи состоят из мелких неделимых элементов, которые, соединяясь, образуют более сложные объекты.
В Древней Греции философы Левкипп и Демокрит ввели термин «атомос», имея в виду «мельчайшие неделимые части материи», от которых мы получаем современный термин «атом».
Затем в 1661 году натуралист Роберт Бойл в трактате по химии под названием «Скептический химик» утверждал, что материя состоит из различных комбинаций «корпускул» (устаревший термин для обозначения мельчайшей частицы материи), а не земли, воздуха, ветра, воды и огня. Однако эти наблюдения ограничивались областью философии.
Только в конце 18-го и начале 19-го веков Закон сохранения массы Антуана Лавуазье и Закон множественных пропорций Дальтона привели атомы и молекулы в область точной науки. Первые предположили, что элементы являются основными веществами, которые не могут быть подвергнуты дальнейшему разложению, в то время как последние предположили, что каждый элемент состоит из одного уникального типа атома и что они могут соединяться вместе, образуя химические соединения.
Первые предположили, что элементы являются основными веществами, которые не могут быть подвергнуты дальнейшему разложению, в то время как последние предположили, что каждый элемент состоит из одного уникального типа атома и что они могут соединяться вместе, образуя химические соединения.
Еще одна находка пришла в 1865 году, когда Иоганн Йозеф Лошмидт измерил размер молекул, составляющих воздух, что дало ощущение масштаба молекул. Изобретение сканирующего туннельного микроскопа (СТМ) в 1981 году позволило впервые непосредственно наблюдать атомы и молекулы.
Сегодня наше понятие молекул получает дальнейшее развитие благодаря постоянным исследованиям в области квантовой физики, органической химии и биохимии. А когда речь заходит о поисках жизни в других мирах, необходимо понимание того, что нужно органическим молекулам, чтобы выйти из комбинации химических строительных блоков.
Подпишитесь на нас:Дзен. Новости / Вконтакте / Telegram
Новости / Вконтакте / Telegram
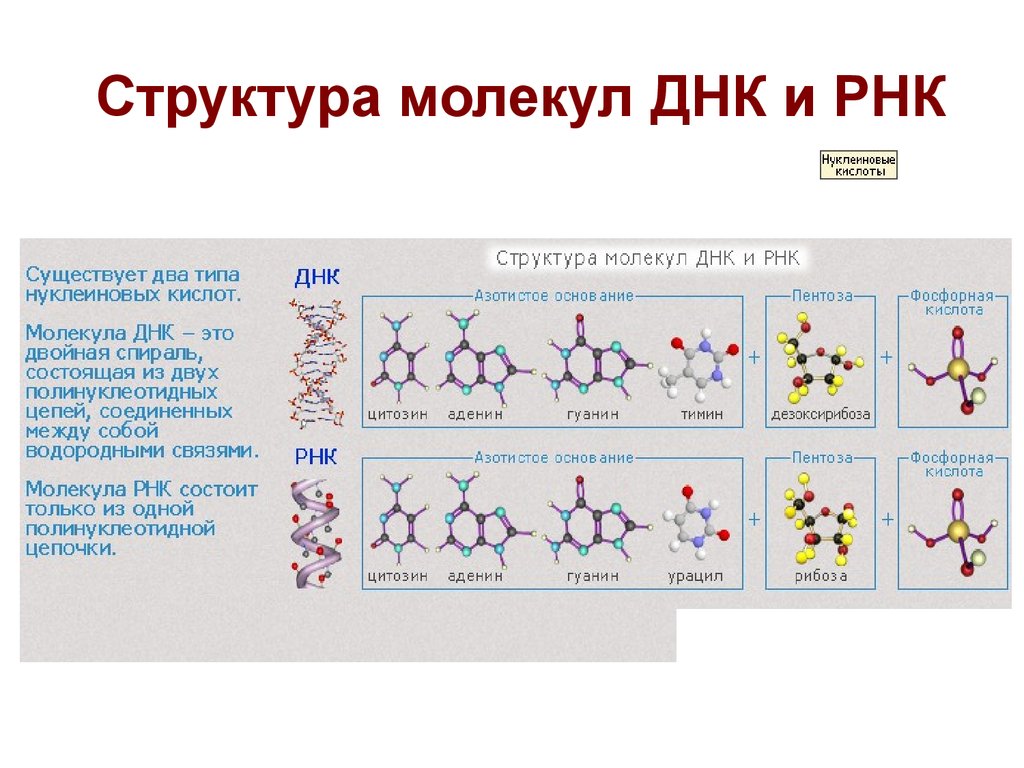
Молекула. Строение и типы химических связей
Молекула — совокупность двух или более атомов, образующих наименьшее целое, на которое можно разделить чистое вещество, сохраняя при этом состав и его химические свойства (способность вступать в соединения, вкусовые свойства, свойства растворимости).
Молекула является одной из фундаментальных концепций современной науки. Впервые ввели эту концепцию европейские учёные в 1860 году, что послужило основой для развития химии, физики и ряду других естественных наук.
Содержание:
- Что такое молекула в физике
- Что такое молекула в химии
- Строение молекулы
- Типы химической связи
- Масса (размер) молекулы
- Свойства молекулы
Молекула, по самому общему определению, — это частица, сформированная из нескольких (двух и более) атомов, связанных друг с другом ковалентной связью. Она не имеет электрического заряда, и все электроны в ее составе парные.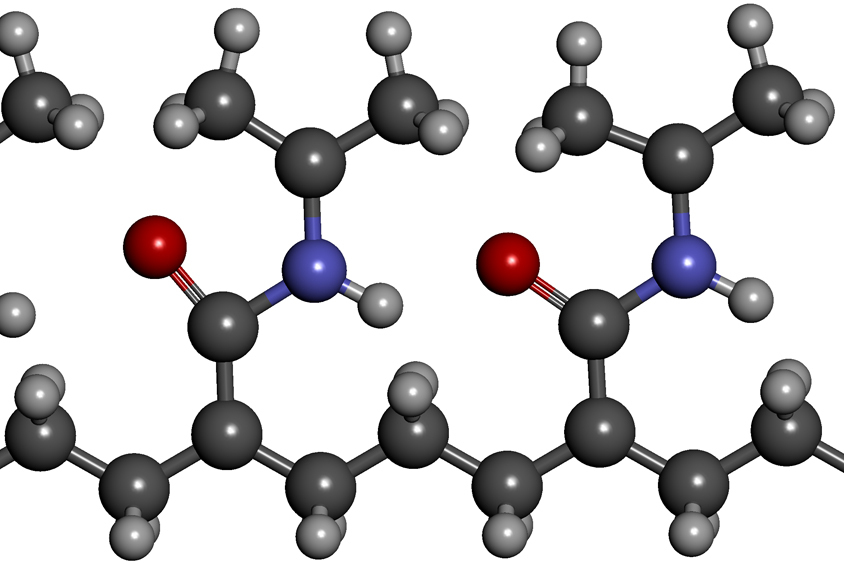
Молекулы, имеющие заряд, называются ионами, а непарные электроны — радикалами. Их качественный и количественный состав остается постоянным. Число ядер атомов, электронов и их взаиморасположение помогают различать молекулы разных веществ между собой.
Модели структур некоторых простых молекулЧто такое молекула в физике
В физике термин молекула используется для описания характеристик газов, жидкостей и твердых тел. Мобильность молекул напрямую зависит от способности вещества к диффузии, его вязкости, теплопроводности и т. д. Впервые прямое экспериментальное подтверждение факта существования молекул получил французский физик Жан Перрен в 1906 году во время изучения броуновского движения.
Броуновское движениеЧто такое молекула в химии
Для химической дисциплины изучение молекул играет одну из самых важных ролей. Благодаря химическим исследованиям была получена важнейшая информация о составе и характеристиках этой крошечной единицы материи.
Молекула является:
- наименьшей частью одного вещества;
- наименьшим электрически нейтральным множеством атомов, которые образуют определенную структуру посредством химических связей;
- может представлять собой один, несколько или множество, как одинаковых, так и разнообразных атомов.

Когда молекулы проходят через химические превращения, они обмениваются атомами и распадаются. Именно поэтому знания о строении и состоянии данных частиц являются основой для изучения химии веществ и их преобразования.
Основываясь на имеющихся знаниях о происходящих химических реакциях, мы имеем возможность прогнозировать структуру молекул задействованных в них веществ. Верен и обратный вывод: на основании знаний о структуре молекулы вещества вполне реально прогнозировать его поведенческие характеристики в ходе химической реакции.
Строение молекулы
Физико-химические свойства молекул обусловлены их конструктивным строением. Таким образом, многие свойства можно предсказать на основе структурной формулы. К таким свойствам относятся размер, форма, в некоторой степени конформация молекул (т.е. взаимное расположение отдельных атомов), в момент, когда вещество находилось в растворе, и, в заключение, реакционная способность.
Молекула воды имеет угловую структуру: это равнобедренный треугольник с углом наклона в верхней части 104°5′. Масса молекулы воды в состоянии пара составляет 18 г/моль. Вместе с тем, уровень молекулярной массы воды в жидком состоянии выше. Это указывает на то, что молекулы в жидкой воде связаны водородными связями. Когда вода замерзает, она расширяется (поскольку образуется множество водородных связей), однако лед легче воды, всплывает на ее поверхность, «самая тяжелая вода» при значении +4°C.
Масса молекулы воды в состоянии пара составляет 18 г/моль. Вместе с тем, уровень молекулярной массы воды в жидком состоянии выше. Это указывает на то, что молекулы в жидкой воде связаны водородными связями. Когда вода замерзает, она расширяется (поскольку образуется множество водородных связей), однако лед легче воды, всплывает на ее поверхность, «самая тяжелая вода» при значении +4°C.
Молекула полярна: атом кислорода несет частично отрицательный заряд, а два атома водорода несут частично положительный заряд. Это означает, что молекула воды является диполем. Поэтому взаимодействие молекул воды создает между ними водородные связи, которые сказываются на физических свойствах воды. Благодаря высокой полярности молекул вода является непревзойденным растворителем других полярных соединений. В воде распадается больше веществ, чем в других жидкостях.
Типы химической связи
- Металлическая — расположенные в узлах кристаллических решеток ядра атомов металла объединены единым массивом электронов.

- Водородная — обусловлена возможностью атома водорода формировать при смещении от него электронной плотности дополнительные связи.
- Ионная — носит электрическую сущность. Она высоко поляризована. Формируется за счет присоединения ионов, которые несут противоположный заряд.
- Ковалентная — бывает как полярной, так и неполярной. Она состоит из пары электронов, которые принадлежат двум атомам. Данная связь примечательна наивысшей стабильностью и энергетической ёмкостью.
Связи обозначаются нижеуказанными признаками:
- длина — степень, в которой ядра атомов, образовавших связь, удаляются друг от друга;
- энергия — величина силы, приложенной к разрыву соединения;
- полярность — сдвиг облака электронов в сторону одного из атомов;
- порядок или кратность — число электронных пар, которые образовали связь.
Структура молекул может быть представлена графически (структурной формулой).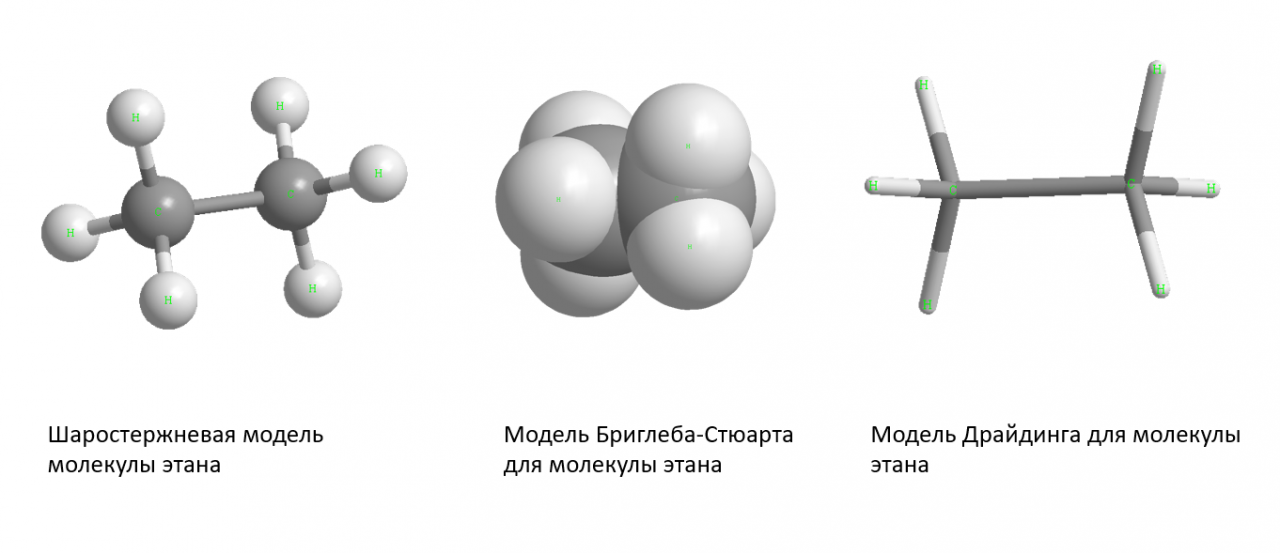 Главные взаимосвязи атомов в формуле обозначаются штрихами. В подобных структурах связи формируют целостную цепь и демонстрируют валентность элементов (атомов), которые их образовывали.
Главные взаимосвязи атомов в формуле обозначаются штрихами. В подобных структурах связи формируют целостную цепь и демонстрируют валентность элементов (атомов), которые их образовывали.
Структурные формулы также демонстрируют, каков внешний вид молекулы (линейный, циклический, наличие радикалов и т.д.).
В настоящее время интенсивно изучается структура частицы вещества. С этой целью применяются различные эксперименты и теоретические методы. Экспериментальные методы включают рентгеновский структурный анализ, спектроскопию, масс-спектрометрию и др. Теоретические методы включают методы расчета квантовой химии.
Масса (размер) молекулы
В соответствии с количеством ядер атомов могут быть выделены двух-, трехатомные и т.д. молекулы.
Mr — Относительная молекулярная (атомная) масса вещества — отношение массы молекул (или атомов) данного вещества к 1/12 массы атома углерода.
М — молярная масса — масса вещества, взятого в количестве одного моля.
M = Mr * 10-3 кг/моль
В случае большого количества атомов молекулу называют макромолекулой.
При сложении масс атомов, из которых состоит частица, определяется молекулярная масса. В зависимости от размера молекулярной массы, все химические вещества разделяются на низко- и высокомолекулярные.
Свойства молекулы
В современной науке отмечаются следующие свойства молекул:
- Электрические — эти свойства определяют поведение вещества в электрическом поле. Атомы, которые входят в состав молекулу, состоят из положительно заряженного ядра и электронов, несущих отрицательный заряд. Такие заряды внутри самой молекулы неравномерно распределены, что приводит к так называемому дипольному моменту и смещению электронной плотности в сторону какого-либо из атомов.
- Оптические — описывают поведение вещества в световолновом поле. Оптические свойства включают в себя способность к поляризации света, его преломлению и рассеиванию.

- Магнитные — объясняют распространение электронов в атомах.
Между веществами проводится разграничение:
- диамагнитные — без парных электронов;
- парамагнитные — присутствуют парные электроны.
Изучение свойств и структуры молекул имеет фундаментальное значение для развития теоретической и прикладной науки, а также играет важнейшую роль в жизнедеятельности человека.
Читайте также:
В какое время суток память работает лучше всего?
В самом начале работы исследователи заподозрили, что временные проблемы с памятью может вызывать недостаток белка под названием BMAL1.
Контактная линза измеряет уровень сахара в крови
Умные контактные линзы смогут заменить инвазивные анализы крови для диабетиков и использоваться для лечения диабетической ретинопатии и других заболеваний глаз
Всё, что нам известно о форме Вселенной, может быть ошибкой
Вполне возможно, что наша Вселенная не плоская, а шарообразная, говорят авторы нового исследования.
Ранее неизвестный вид китов обнаружен у берегов Японии
Мы могли бы ошибочно думать, что уже классифицировали всех крупных животных, но японским ученым удалось обнаружить ранее неизвестный вид китов.
Окаменелости гигантской птицы найдены в Крыму
В крымской пещере палеонтологи недавно обнаружили окаменелости одной из самых больших птиц, которые когда-либо бродили по Земле.
молекул | Определение, примеры, структуры и факты
представления молекулярной структуры
Просмотреть все средства массовой информации
- Ключевые люди:
- Дж. Фрейзер Стоддарт Джозеф Лошмидт Курт Вютрих Бернард Феринга Герберт А. Хауптман
- Похожие темы:
- радикальный биомолекула конфигурация конформация гомоядерная молекула
Просмотреть весь соответствующий контент →
Резюме
Прочтите краткий обзор этой темы
молекула , группа из двух или более атомов, которые образуют наименьшую идентифицируемую единицу, на которую можно разделить чистое вещество, сохраняя при этом состав и химические свойства этого вещества.
Характеристики молекул
Деление образца вещества на все более мелкие части не приводит ни к изменению его состава, ни к химическим свойствам до тех пор, пока не будут получены части, состоящие из отдельных молекул. Дальнейшее подразделение вещества приводит к еще более мелким частям, которые обычно отличаются от исходного вещества по составу и всегда отличаются от него химическими свойствами. На этой последней стадии фрагментации химические связи, удерживающие атомы в молекуле, разрываются.
Атомы состоят из одного ядра с положительным зарядом, окруженного облаком отрицательно заряженных электронов. Когда атомы близко подходят друг к другу, электронные облака взаимодействуют друг с другом и с ядрами. Если это взаимодействие таково, что общая энергия системы снижается, то атомы связываются вместе, образуя молекулу. Таким образом, со структурной точки зрения молекула состоит из скопления атомов, удерживаемых вместе валентными силами. Двухатомные молекулы содержат два атома, которые химически связаны. Если два атома идентичны, как, например, в молекуле кислорода (O 2 ), они составляют гомоядерную двухатомную молекулу, а если атомы разные, как в молекуле монооксида углерода (СО), то составляют гетероядерную двухатомную молекулу. Молекулы, содержащие более двух атомов, называются многоатомными, например, двуокись углерода (CO 2 ) и вода (H 2 O). Молекулы полимеров могут содержать многие тысячи атомов компонентов.
Если два атома идентичны, как, например, в молекуле кислорода (O 2 ), они составляют гомоядерную двухатомную молекулу, а если атомы разные, как в молекуле монооксида углерода (СО), то составляют гетероядерную двухатомную молекулу. Молекулы, содержащие более двух атомов, называются многоатомными, например, двуокись углерода (CO 2 ) и вода (H 2 O). Молекулы полимеров могут содержать многие тысячи атомов компонентов.
Молекулярная связь
Отношение числа атомов, которые могут быть связаны друг с другом для образования молекул, является фиксированным; например, каждая молекула воды содержит два атома водорода и один атом кислорода. Именно эта особенность отличает химические соединения от растворов и других механических смесей. Таким образом, водород и кислород могут присутствовать в любых пропорциях в механических смесях, но при искровом разряде они будут соединяться только в определенных пропорциях, образуя химическое соединение вода (H  Возможно, что одни и те же виды атомов соединяются в разных, но определенных пропорциях, образуя разные молекулы; например, два атома водорода могут химически соединиться с одним атомом кислорода с образованием молекулы воды, тогда как два атома водорода могут химически соединиться с двумя атомами кислорода с образованием молекулы перекиси водорода (H 2 O 2 ). Кроме того, атомы могут связываться друг с другом в одинаковых пропорциях, образуя разные молекулы. Такие молекулы называются изомерами и отличаются только расположением атомов внутри молекул. Например, этиловый спирт (СН
Возможно, что одни и те же виды атомов соединяются в разных, но определенных пропорциях, образуя разные молекулы; например, два атома водорода могут химически соединиться с одним атомом кислорода с образованием молекулы воды, тогда как два атома водорода могут химически соединиться с двумя атомами кислорода с образованием молекулы перекиси водорода (H 2 O 2 ). Кроме того, атомы могут связываться друг с другом в одинаковых пропорциях, образуя разные молекулы. Такие молекулы называются изомерами и отличаются только расположением атомов внутри молекул. Например, этиловый спирт (СН
Викторина «Британника»
Химия: плюсы и минусы
Возможно, вы знаете, что элементы составляют воздух, которым мы дышим, и воду, которую мы пьем, но знаете ли вы о них больше? Какой элемент почти так же легок, как водород? Что вы называете смесью двух химических элементов? Узнайте ответы в этом тесте.
Не все вещества состоят из отдельных молекулярных единиц. Хлорид натрия (поваренная поваренная соль), например, состоит из ионов натрия и ионов хлора, расположенных в решетке так, что каждый ион натрия окружен шестью равноудаленными ионами хлора, а каждый ион хлора окружен шестью равноудаленными ионами натрия. Силы, действующие между любым натрием и любым соседним ионом хлора, равны. Следовательно, не существует отдельного агрегата, идентифицируемого как молекула хлорида натрия. Следовательно, в хлориде натрия и во всех твердых телах подобного рода понятие химической молекулы не имеет значения. Поэтому формула такого соединения дается как простейшее соотношение атомов, называемое формульной единицей, в случае хлорида натрия — NaCl.
Молекулы удерживаются вместе общими электронными парами или ковалентными связями. Такие связи являются направленными, что означает, что атомы занимают определенное положение относительно друг друга, чтобы максимизировать силу связи. В результате каждая молекула имеет определенную, достаточно жесткую структуру или пространственное распределение ее атомов. Структурная химия имеет дело с валентностью, которая определяет, как атомы объединяются в определенных соотношениях и как это связано с направлениями и длинами связей. Свойства молекул коррелируют с их строением; например, молекула воды структурно изогнута и поэтому имеет дипольный момент, тогда как молекула углекислого газа является линейной и не имеет дипольного момента. Выяснение того, каким образом атомы реорганизуются в ходе химических реакций, имеет важное значение. В некоторых молекулах структура может быть нежесткой; например, в этане (H
Структурная химия имеет дело с валентностью, которая определяет, как атомы объединяются в определенных соотношениях и как это связано с направлениями и длинами связей. Свойства молекул коррелируют с их строением; например, молекула воды структурно изогнута и поэтому имеет дипольный момент, тогда как молекула углекислого газа является линейной и не имеет дипольного момента. Выяснение того, каким образом атомы реорганизуются в ходе химических реакций, имеет важное значение. В некоторых молекулах структура может быть нежесткой; например, в этане (H
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Что такое молекула? • Заявлено четко
Атомы, элементы, молекулы… Какая разница? Это третья часть серии «Ясно заявлено: введение в химию». В нем вы найдете упрощенное определение молекулы, узнаете, как мы моделируем молекулы, и увидите настоящие изображения реальных молекул и режимов их колебаний! Мы рекомендуем посмотреть нашу анимацию об атомах, прежде чем смотреть эту.
О нашем определении молекулы
В этом видео мы описываем молекулы как «группы атомов, слипшихся вместе, обычно посредством химических связей».
Это определение прекрасно, потому что его легко понять, но с ним есть некоторые проблемы. Биологи иногда считают двухцепочечную цепь ДНК «единой молекулой», хотя каждая половина цепи связана с другой нехимическими водородными связями. То же верно и для некоторых белковых комплексов, состоящих из нескольких субъединиц.
В качестве альтернативы, некоторые кристаллы, такие как кварц, состоят из повторяющихся структур атомов, все из которых химически связаны. Используя наше определение, вы должны рассматривать весь кристалл кварца как «одну молекулу». Химики обычно так не делают, вместо этого они считают каждую повторяющуюся субъединицу молекулой. У чистых металлов аналогичная проблема.
Язык — это живой, развивающийся беспорядок! Даже в формальных научных областях, где вы могли бы ожидать большей последовательности.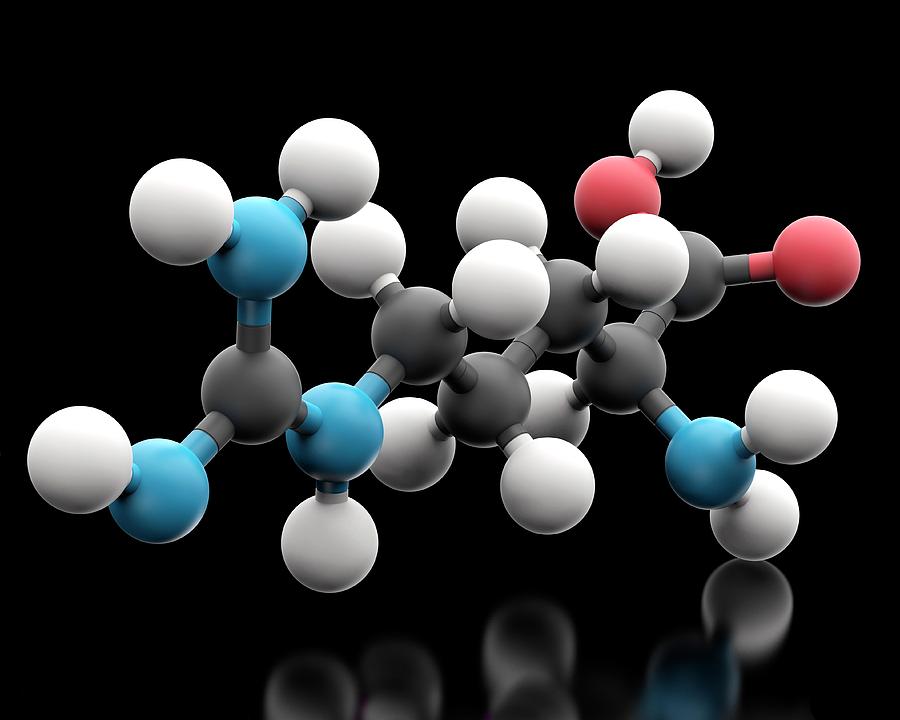
О нашем изображении образования молекулы водорода
В этой анимации мы показываем молекулу водорода, образующуюся в космосе в результате столкновения всего двух атомов. Обычно для этой реакции также требуется какая-то частица пыли или льда, чтобы улавливать атомы, когда они связываются вместе.
Чтобы не отвлекать внимание при обучении основам молекулы, мы решили проигнорировать эту техническую деталь в анимации.
Исследовать дальше
Научная статья, показывающая реальную молекулу в форме шарика и палочки:
- Химическая структура молекулы, разрешенная с помощью атомно-силовой микроскопии
Документ, показывающий реальные измерения молекулярных колебаний Исследовательским центром CaSTL:
- Визуализация нормальных мод колебаний одиночной молекулы с помощью атомарно ограниченного света
Видеоигра, обучающая тому, как атомы объединяются в молекулы:
- Разрушитель облигаций
Для учителей
Содержание этого видео соответствует критериям следующих основных дисциплинарных идей, определенных научными стандартами следующего поколения. Используйте наши видео, чтобы дополнить школьную программу.
Используйте наши видео, чтобы дополнить школьную программу.
Авторы
В наших видеороликах используются рекомендации и советы экспертов в области науки и образования. Эта анимация является результатом сотрудничества следующих ученых, педагогов и нашей творческой команды.
Advisors
- Ара Апкарян, доктор философии
- Венкат Боммисетти, доктор философии
- Даниэль Ватт, доктор философии
- Эрик Потма, доктор философии
- Джунхи Ли, доктор философии
- Уилсон Хо, доктор философии
Команда
- Энтони Данзл
- Джон Перри
- Джордан Коллвер 91091 Тайлер Проктор
Стенограмма
Хотя определения слова «молекула» в учебниках иногда могут показаться немного сложными, молекулу можно в общих чертах представить как группу атомов, слипшихся вместе — обычно химическими связями.
Здесь мы видим единственный атом водорода, путешествующий по космосу. Он состоит из одного положительно заряженного протона в ядре и одного отрицательно заряженного электрона.
Если наш одинокий атом водорода окажется достаточно близко к другому одинокому атому водорода, их электроны (которые притягиваются, как магниты к протонам) могут притягивать атомы друг к другу, пока они не столкнутся и не слипнутся
Два атома теперь делят друг друга чужие электроны в так называемой ковалентной химической связи.
То, что когда-то было двумя отдельными атомами водорода, теперь образовало единую молекулу водорода!
Эта связь не является постоянной. При достаточном количестве тепла или из-за взаимодействия с другими молекулами атомы водорода снова легко разделятся.
Различные типы атомов могут образовывать разное количество химических связей:
Атом водорода может одновременно образовывать только одну ковалентную связь. Если бы 3-й водород столкнулся с молекулой водорода, он бы просто отскочил или, если бы ударился достаточно сильно или в нужное место, он мог бы поменяться местами с одним из существующих атомов.
Атом кислорода обычно может образовывать 2 связи, атом углерода — 4, атом аргона обычно ни с чем не связывается.
Несмотря на то, что возможное число связей на атом невелико, при правильном расположении связей могут образовываться огромные молекулы.
Например, хотя водород может образовывать только одинарную связь, стандартная молекула воды всегда состоит из 3 атомов. Это возможно, потому что кислород, который может образовывать 2 связи, образует только одну связь с каждым атомом водорода.
Единственная молекула сахара, известного как глюкоза, состоит из 24 атомов, представляющих собой особый набор атомов углерода, водорода и кислорода.
Типичная жирная кислота в организме человека может иметь разную длину, здесь она состоит из 38 атомов.
Один белок (в зависимости от типа) может содержать более полумиллиона атомов, ковалентно связанных друг с другом.
Модели, которые я показывал вам до сих пор, — это то, что мы называем моделями «заполнения пространства». Они примерно показывают нам, как выглядит внешнее электронное облако каждого атома, а разным типам атомов присвоены разные цвета.
Они примерно показывают нам, как выглядит внешнее электронное облако каждого атома, а разным типам атомов присвоены разные цвета.
Когда мы смотрим на настоящие молекулы в сканирующий туннельный микроскоп, они очень похожи на эти модели заполнения пространства, но атомы не имеют цветовой кодировки, а их края размыты. Это размытие отчасти связано с ограничениями микроскопа, а отчасти потому, что у атомов действительно есть мягкие границы.
При рассмотрении сложных молекул модели заполнения пространства и особенно реальные изображения реальных молекул могут немного сбивать с толку. Какие атомы связаны друг с другом, какие атомы просто расположены близко друг к другу?
По этой причине химики иногда используют так называемые шарико-стержневые модели. Они подчеркивают связи между атомами, скелет молекулы, вместо того, чтобы показывать внешнюю поверхность каждого атома.
В 2009 году доктор Лео Гросс и его команда открыли способ делать настоящие скелетные снимки молекул.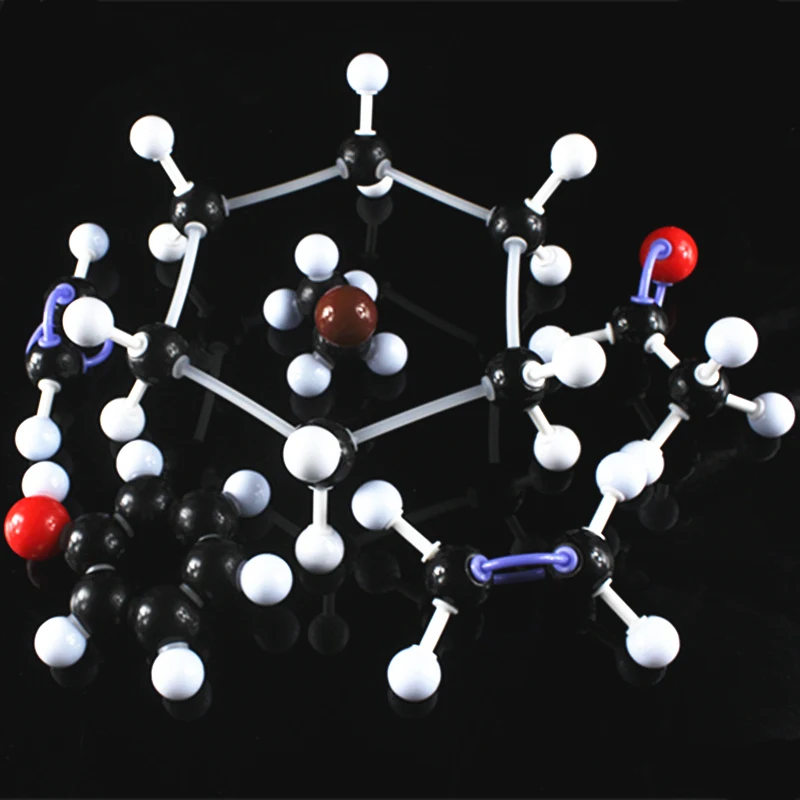
Это не рисунок, это не компьютерная модель, это реальное сканирование реальной молекулы!
Удивительно, но атомная теория позволяла ученым рисовать молекулы с удивительной точностью более чем за 100 лет до того, как это изображение было наконец получено. Это прекрасное свидетельство того, на что способна хорошая научная теория.
Когда атомы собираются вместе, чтобы сформировать молекулу, молекула колеблется между своими связями по регулярной схеме. Вы можете думать об облигации как о прыгающей пружине. Это связано с тем, что протоны в ядре каждого атома отталкивают друг друга, а общие электроны в каждой связи снова сближают атомы. Колебания, которые мы обнаруживаем в молекулах, являются результатом постоянного перетягивания каната между этими двумя силами.
Если вы добавите энергию к молекуле с помощью тепла или света, амплитуда (длительность) каждой вибрации будет увеличиваться без изменения того, как часто каждая вибрация завершает свой цикл. «Прыгающая пружина» растягивается дальше, и атомы движутся быстрее. Если вы добавите достаточно энергии, связь разорвется.
Если вы добавите достаточно энергии, связь разорвется.
Ученые увлечены движениями молекул и хотят лучше их понять. Эти вибрации имеют огромное количество потенциальных применений в химии, медицине, электронике и вычислительной технике.
Часовщики, например, используют неизменную скорость молекулярных колебаний для создания часов, которые показывают практически идеальное время. В кварцевом кристалле колебания связей между его атомами резонируют, заставляя весь кристалл, если его обрезать до нужной формы и размера, микроскопически колебаться с частотой 32 768 раз в секунду. Внутри каждых кварцевых часов находится крошечный кристалл вместе с электроникой, которая может подсчитывать вибрации кристалла, точно сообщая секундной стрелке, когда двигаться.
В апреле 2019 г., в журнале Nature Джунхи Ли и его коллеги из Центра химии на пределе пространства-времени опубликовали первые изображения молекулярных колебаний в атомном масштабе.
Хотя эти изображения могут показаться немного странными для неопытного глаза, они показывают исследователям, как именно эта молекула изгибается и пульсирует между своими связями.