Электрически ток в металлах. Сверхпроводимость.
Электрически ток в металлах. Сверхпроводимость.
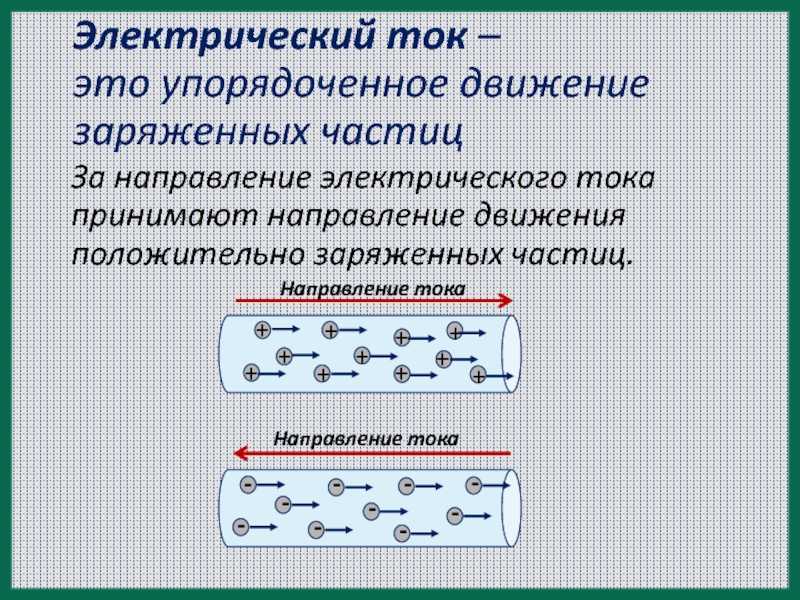
Электрический ток в металлах – это упорядоченное движение электронов под действием электрического поля. Опыты показывают, что при протекании тока по металлическому проводнику переноса вещества не происходит, следовательно, ионы металла не принимают участия в переносе электрического заряда.
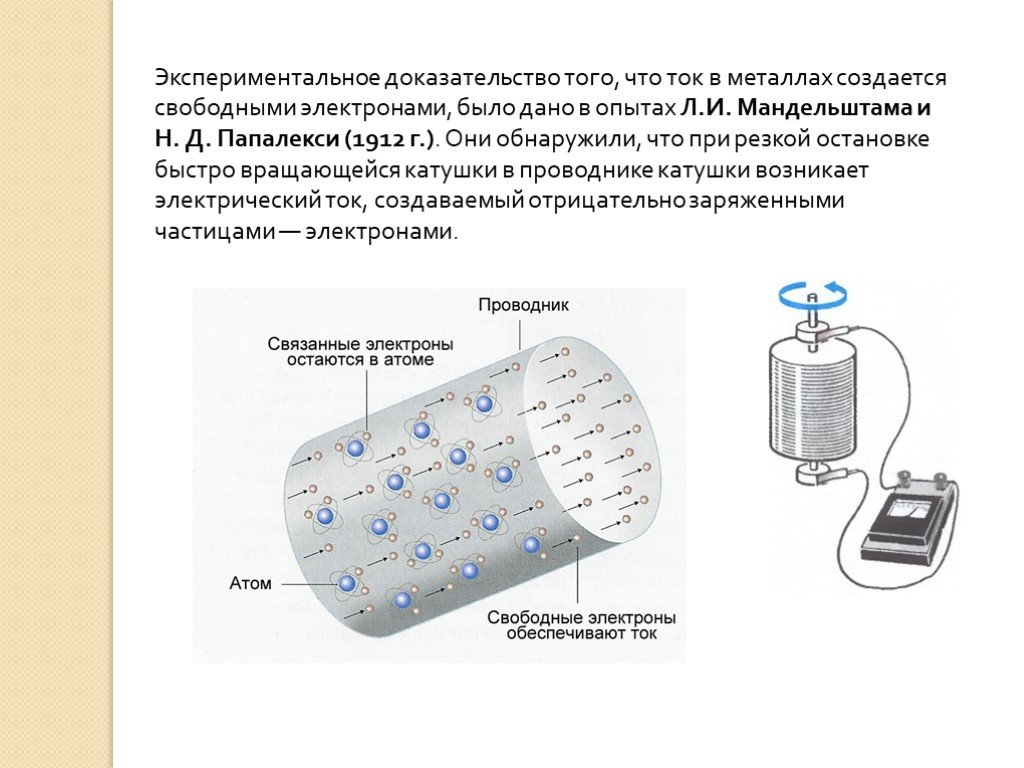
Наиболее убедительное доказательство электронной природы тока в металлах было получено в опытах с инерцией электронов. Идея таких опытов и первые качественные результаты (1913 г.) принадлежат русским физикам Л. И. Мандельштаму и Н. Д. Папалекси. В 1916 году американский физик Р. Толмен и шотландский физик Б. Стюартусовершенствовали методику этих опытов и выполнили количественные измерения, неопровержимо доказавшие, что ток в металлических проводниках обусловлен движением электронов.
Схема опыта Толмена и Стюарта показана на рис. 1.12.1. Катушка с большим числом витков тонкой проволоки приводилась в быстрое вращение вокруг своей оси.
Сверхпроводимость. В 1911 г. нидерландский ученый Гейке Камерлинг-0ннес (1853— 1926) обнаружил, что при понижении температуры ртути до 4,1 К ее удельное сопротивление скачком уменьшается до нуля (рис. 153). Явление уменьшения удельного сопротивления до нуля при температуре, отличной от абсолютного нуля, называется сверхпроводимостью.

Сверхпроводящие материалы уже используются в электромагнитах. Ведутся исследования, направленные на создание сверхпроводящих линий электропередачи. Применение явления сверхпроводимости в широкой практике может стать реальностью в ближайшие годы благодаря открытию в 1986 г. сверхпроводимости керамик — соединений лантана, бария, меди и кислорода. Сверхпроводимость таких керамик сохраняется до температур около 100 К
???Вопросы 9
- Что называют электрическим током?
- В чем заключается опыт Рике?
- В чем заключается опыт Мандельштама и Папалекси?
- Какими зарядами создается электрический ток в металлах?
- Как зависит сопротивление металлов от температуры? Формула?
Главная страница
Подписаться на: Сообщения (Atom)
чем создаётся и как возникает, свойства и область применения
Физика
12.11.21
9 мин.
Без электрического тока невозможно представить нашу жизнь. С его помощью человек работает, отдыхает и развлекается, готовит пищу, лечится, обогревает жильё. Электрический ток в металлах – это направленное движение заряженных частиц. Вот только частицы эти бывают разными, так как структура материалов различается. Например, в жидкостях или газах эту роль выполняют ионы, а в металлах ток создаётся движением электронов. Чтобы понять, как такое возможно, следует представлять, из чего «сделаны» эти материалы.
Электрический ток в металлах – это направленное движение заряженных частиц. Вот только частицы эти бывают разными, так как структура материалов различается. Например, в жидкостях или газах эту роль выполняют ионы, а в металлах ток создаётся движением электронов. Чтобы понять, как такое возможно, следует представлять, из чего «сделаны» эти материалы.
Оглавление:
- Природа металлов
- Кратко об интересных фактах
- Электрончики на службе
Природа металлов
Это вещества, обладающие высокой плотностью, теплопроводностью, а при нагреве — пластичностью. Главное их отличие от большинства неметаллов в том, что они имеют структурированную межатомную связь. Схематично это выглядит как объёмная решётка, в узлах которой размещены положительные ионы. Вокруг них вращается сколько-то электронов. Кстати, количество этих частиц у каждого металла своё. Из-за этого они и отличаются друг от друга. Однако у металлов есть общее свойство: их ионы жутко «рассеяны» и постоянно теряют свои электроны
Однако у металлов есть общее свойство: их ионы жутко «рассеяны» и постоянно теряют свои электроны
В обычном состоянии металл не имеет потенциала или какого-то электрического заряда. Обусловлено это тем, что общий заряд электронов, находящихся «в свободном поиске», равен суммарному заряду положительных ионов решётки.
Доказательство тому, что электрический ток в металлах создаётся электронами, сделали в 1913 г. Л. И. Мандельштам и Н. Д. Папалекси. Они предположили, что эти частицы имеют вес, а значит, должны подчиняться законам механики.
В своих опытах учёные сильно раскручивали катушку из металлической проволоки, а затем резко останавливали её.
Находящиеся там свободные электроны после прекращения вращения, по закону инерции, должны были какое-то время перемещаться, создавая направленное движение. Так и получалось, что подтверждалось кратким щелчком в динамике телефона.
Так и получалось, что подтверждалось кратким щелчком в динамике телефона.
Более качественно данный опыт провели в 1916 году Р. Толмен и Б. Стюарт. Для измерения возникновения тока они использовали гальванометр.
Сообщения о сделанных открытиях побудили П. Друде к исследованиям в этой области. Вскоре он представил научному миру свою теорию о возникновении электрического тока, которая была расширена Х. Лоренцем и стала называться «классическая теория электричества». Она гласит: если к концам металлического проводника приложить разноимённо заряженные потенциалы, то в нём возникает электрический ток. Таким образом, природа электрического тока в металлах заложена в их особой структуре.
- наличием отрицательно заряженных, электронов, свободно перемещающихся между ионами;
- способностью этих заряженных частиц реагировать на электрический потенциал и являться его носителем.
Кратко об интересных фактах
- Быстрота распространения электрического поля в металлах близка к скорости света.
 Это 300 000 км/с, а вот движение самих заряженных частиц невелико — меньше одного миллиметра в секунду.
Это 300 000 км/с, а вот движение самих заряженных частиц невелико — меньше одного миллиметра в секунду. - Электроны при движении по проводнику никуда не «утекают», несмотря на то, что являются носителями тока.
- Направление тока противоположно упорядоченному, направленному движению электронов.
Электрончики на службе
Способность твёрдых металлов передавать электрический ток стала очень востребована, так как во время этого процесса происходят дополнительные, полезные явления. Например, вокруг проводника с протекающим по нему током возникает магнитное поле.
Это свойство назвали магнетизм и применили его для:
- Изобретения электрического двигателя. Впоследствии разработали множество модификаций этой машины. Сейчас они помогают человеку и на производстве, и в быту.
- Создания электромагнитов. По этому принципу работает водяной насос «ручеёк». В его «теле» перемещается в изменяющемся магнитном поле металлический сердечник с закреплённой на конце мембранной.

- Трансформации напряжения. Магнетизм и электрический ток не могут существовать друг без друга. Вокруг проводника с током возникает магнитное поле. Так же и наоборот: если поместить проводник в изменяющееся магнитное поле, то на его концах возникнет разность потенциалов. Это свойство послужило для создания трансформатора. Зачем он нужен? Например, чтобы зарядить телефон. В сетевой розетке есть 220 В, а для заряда батареи надо только 5,5. Вот тут и пригодится электрическая схема на основе понижающего трансформатора. Если разобрать старую, тяжёлую телефонную «зарядку», то можно его там увидеть. Другой такой агрегат, только очень большой, постоянно гудит в своей будке, построенной почти в каждом городском дворе. Он подаёт в квартиры «положенные по прейскуранту» вольты.
Другое свойство, проявляющееся при движении электронов по проводнику — это нагрев. Формула Джоуля-Ленца гласит, что нагрев проводника (Q) прямо пропорционален произведению квадрата проходящего по нему тока (I), величины его сопротивления ® и времени (t). И выглядит это так: Q=I²R.
И выглядит это так: Q=I²R.
Такому полезному явлению человечество сразу нашло применение. Например, за окном трещит мороз, а в квартире пол с электрическим подогревом. Класс! А как приятно осознавать, что окончание написания конспекта задания не за горами, и на электроплите уже закипает чайник. Да, нагревательные приборы не поражают своей однотипностью. Вот основные из них: стиральная машина, утюг, плойка, лампа накаливания, тостер, кофеварка, электрочайник и т. д. Это только в быту, не меньше их и в производстве. Называть все займёт много времени.
Таким образом, понятно, какими частицами создаётся ток в металлах. Это трудяги — электрончики. Благодаря их работе, абсолютно вся техника, которой пользуется человек, оживает и начинает приносить ему пользу.
Не успеваете написать работу?
Заполните форму и узнайте стоимость
Вид работыПоиск информацииДипломнаяВКРМагистерскаяРефератОтчет по практикеВопросыКурсовая теорияКурсовая практикаДругоеКонтрольная работаРезюмеБизнес-планДиплом MBAЭссеЗащитная речьДиссертацияТестыЗадачиДиплом техническийПлан к дипломуКонцепция к дипломуПакет для защитыСтатьиЧасть дипломаМагистерская диссертацияКандидатская диссертацияКонтактные данные — строго конфиденциальны!
Указывайте телефон без ошибок! — потребуется для входа в личный кабинет.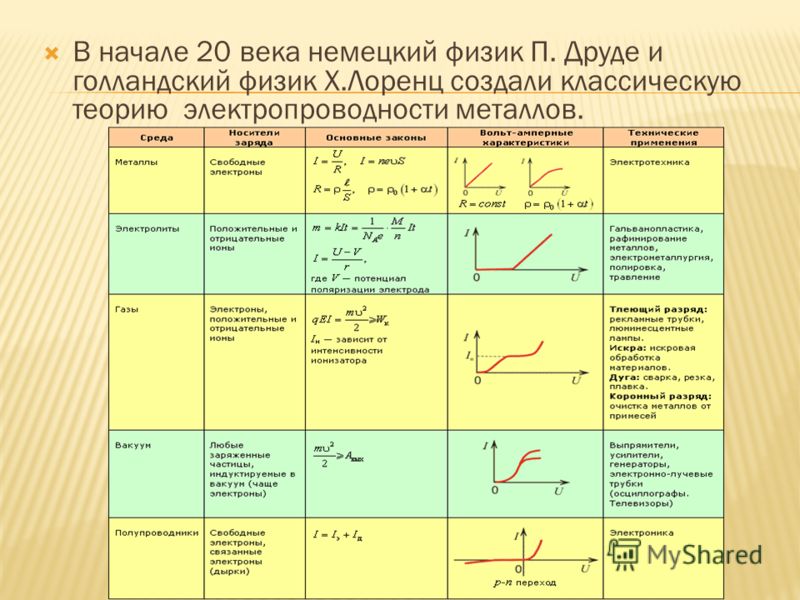
* Нажимая на кнопку, вы даёте согласие на обработку персональных данных и соглашаетесь с политикой конфиденциальности
Подтверждение
Ваша заявка принята.
Ей присвоен номер 0000.
Просьба при ответах не изменять тему письма и присвоенный заявке номер.
В ближайшее время мы свяжемся с Вами.
Ошибка оформления заказа
Кажется вы неправильно указали свой EMAIL, без которого мы не сможем ответить вам.
Пожалуйста проверте заполнение формы и при необходимости скорректируйте данные.
5.3: Электролиты — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 372210
- Мухаммад Ариф Малик
- Hampton University, Hampton, VA
Что такое электролит?
Электрический ток определяется как движение электрических зарядов.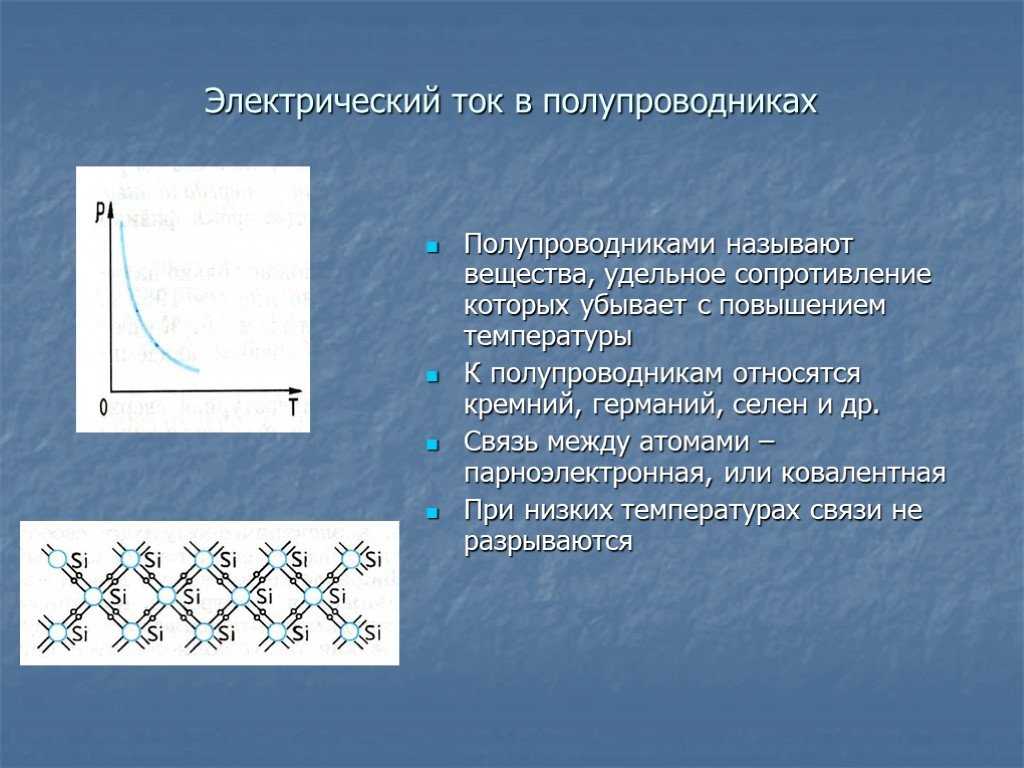 Вещества, по которым может протекать электрический ток, называются электрическими проводниками, а остальные – электрическими непроводниками. Металлы являются электрическими проводниками, потому что валентные электроны атомов металла могут перемещаться в куске металла. Ионные соединения состоят из катионов и анионов, но ионы в твердом теле не могут перемещаться. Следовательно, твердые ионные соединения являются электрическими непроводниками. Чистая вода не имеет в себе достаточной концентрации ионов и является электрическим диэлектриком. Ионные соединения диссоциируют на ионы при растворении в воде. Раствор ионных соединений в воде является электрическим проводником, поскольку ионы могут перемещаться в растворе, как показано на рис. 5.3.1.
Вещества, по которым может протекать электрический ток, называются электрическими проводниками, а остальные – электрическими непроводниками. Металлы являются электрическими проводниками, потому что валентные электроны атомов металла могут перемещаться в куске металла. Ионные соединения состоят из катионов и анионов, но ионы в твердом теле не могут перемещаться. Следовательно, твердые ионные соединения являются электрическими непроводниками. Чистая вода не имеет в себе достаточной концентрации ионов и является электрическим диэлектриком. Ионные соединения диссоциируют на ионы при растворении в воде. Раствор ионных соединений в воде является электрическим проводником, поскольку ионы могут перемещаться в растворе, как показано на рис. 5.3.1.
Вещества, образующие электропроводящий раствор при растворении в воде (или в другом полярном растворителе), называются электролитами .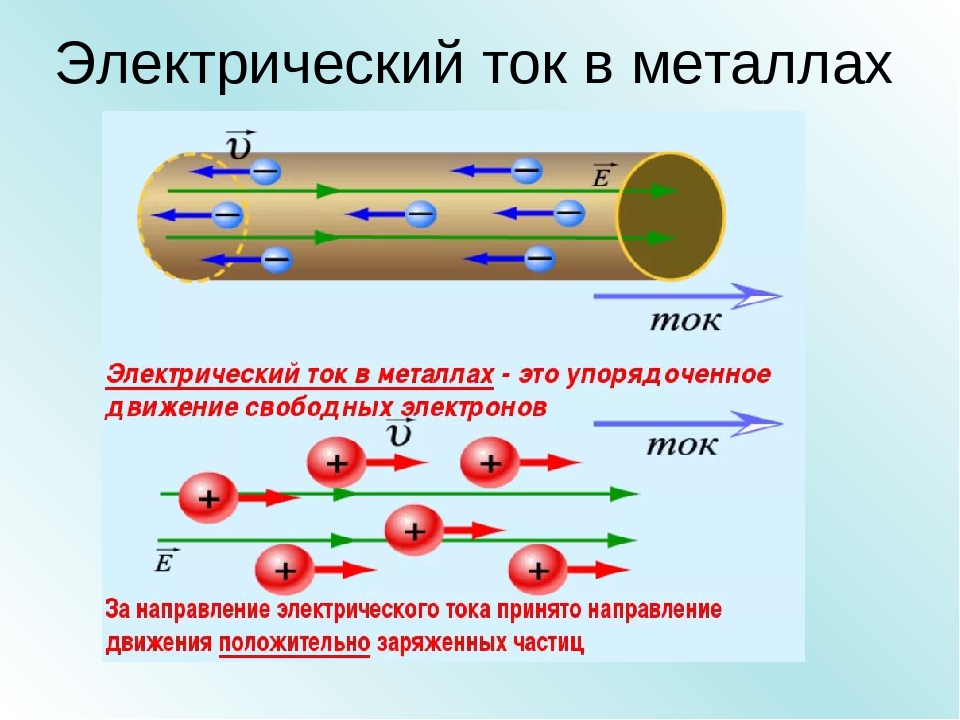
Все ионные соединения, кислоты и основания образуют ионы в воде и классифицируются как электролиты.
Вещества, образующие неэлектропроводный раствор при растворении в воде, называются неэлектролитами .
Молекулярные соединения, отличные от кислот и оснований, такие как метанол, ацетон, сахар и глюкоза, остаются нейтральными молекулами при растворении в воде. Молекулярные растворенные вещества, кроме кислот и оснований, являются неэлектролитами.
Сильные и слабые электролиты
Вещества, которые почти на 100% диссоциируют на ионы при растворении в воде, относятся к сильные электролиты .
- Все ионные соединения, растворимые в воде, являются сильными электролитами.
- Сильные кислоты являются сильными электролитами.
- Сильные основания — это ионные соединения и сильные электролиты.
Сильный электролит не обязательно хорошо растворим в воде. Это означает, что та часть растворенного вещества, которая растворяется, также диссоциирует на 100% на ионы в воде, например, все ионные соединения.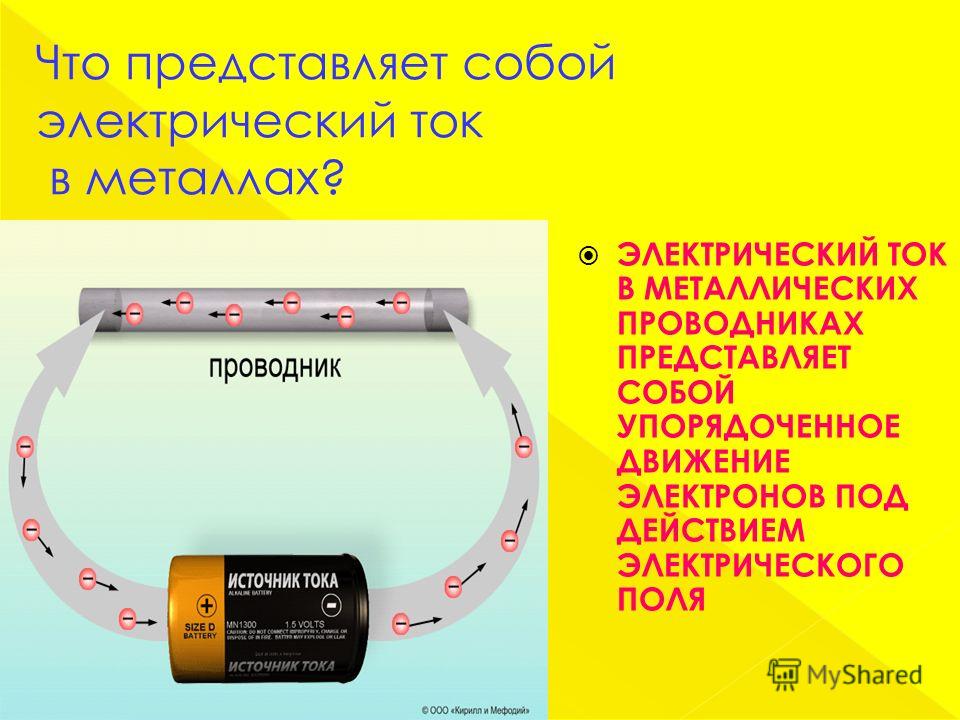 Растворимость Ca(OH) 2 содержит только 0,16 г Ca(OH) 2 /100 г воды при 20 o C, но весь растворенный Ca(OH) 2 диссоциирует на Ca 2 + 7 — и 6 OH 9006 ионы.
Растворимость Ca(OH) 2 содержит только 0,16 г Ca(OH) 2 /100 г воды при 20 o C, но весь растворенный Ca(OH) 2 диссоциирует на Ca 2 + 7 — и 6 OH 9006 ионы.
Сильные основания представляют собой гидроксиды щелочных металлов, т. е. LiOH, NaOH, KOH, RbOH и CsOH, и гидроксиды тяжелых щелочноземельных металлов, т. е. Ca(OH) 2 , Sr(OH) 2 и Ba (OH) 2 , которые являются сильными электролитами. Сильные кислоты, т. е. HCl, HBr, HI, HClO 9{1-}(\mathrm{aq})\nonumber
\end{equation}
Вещества, которые частично диссоциируют на ионы при растворении в воде, являются слабыми электролитами . Слабые кислоты и слабые основания являются слабыми электролитами.
Слабые кислоты и слабые основания, такие как уксусная кислота (CH 3 COOH) и аммиак (NH 3 ), растворимы в воде, но частично диссоциируют на ионы. Например, если 1 моль уксусной кислоты или 1 моль аммиака растворить в 1 л воды при комнатной температуре, то между растворенными молекулами и диссоциированными ионами устанавливается следующее равновесие: 9{1-}(\mathrm{aq}),
\end{aligned}\nonumber
\end{equation}
где только около 0,4% растворенных молекул диссоциируют на ионы, остальные около 99,6% молекул остаются нейтральными . Слабые кислоты и слабые основания являются слабыми электролитами.
Слабые кислоты и слабые основания являются слабыми электролитами.
На рис. 5.3.2 показаны различия между неэлектролитами, сильными электролитами и слабыми электролитами.
Рисунок \(\PageIndex{2}\): Иллюстрация неэлектролита, не проводящего электричество, сильного электролита с высокой электропроводностью и слабого электролита с низкой электропроводностью. Источник: Karishma50/ (https;//creativecommons.org/licences/by-sa/4.0)
Эквивалент
Количество молекул и атомов обычно измеряется в молях. Ионные соединения состоят из ионов, но в целом нейтральны, потому что положительный заряд уравновешивается отрицательным зарядом. Поэтому молярное отношение катионов к анионам не всегда равно один к одному. Например, NaCl имеет молярное соотношение Na + и Cl — один к одному, а CaCl 2 имеет соотношение один к двум Ca 2 + и Cl — . . Вводится новая единица, называемая эквивалентом (официально сокращенно эквив, но обычно сокращенно экв), чтобы различать моль иона и моль заряда иона. {2+}}\номер\] 9{2+}}\nonumber\]
{2+}}\номер\] 9{2+}}\nonumber\]
Первый коэффициент преобразования преобразует заданное количество в молях в эквиваленты в моли, а второй переводит заданное количество в молях в эквиваленты иона, как поясняется в следующих примерах.
Пример \(\PageIndex{1}\)
a) Рассчитать мг-экв Fe 3 + в 0,0200 моль Fe 3 + ? б) если хлорид-ион является единственным анионом в растворе, сколько мг-экв Cl — присутствует в растворе?
9{3+}\nonumber\]Пример \(\PageIndex{2}\)
Солевой раствор для внутривенного введения содержит 145 мэкв/л Na + . Сколько молей Na + содержится в 0,500 л раствора?
Раствор
a) Дано: 145 мэкв Na + /л раствора и 0,500 л раствора. Желаемое: ? моль Na +
Необходимые коэффициенты пересчета: Концентрация в мэкв/л является первым фактором для преобразования л в мэкв, равенство 1 мэкв Na + = 1 ммоль Na + дает второе преобразование, необходимое для преобразования мэкв в ммоль, и равенство 1000 ммоль Na + = 1 моль Na + , учитывая третий коэффициент преобразования, необходимый для преобразования мэкв в моль. {+}\номер\]
{+}\номер\]
Обратите внимание, как единицы числителя одной дроби сокращаются единицами знаменателя следующей дроби, оставляя несокращенными только нужные единицы, которые становятся единицами числа ответа.
Электролиты в жидкостях организма
На рис. 5.3.3 показаны электролиты и их концентрации, обычно встречающиеся в жидкостях организма. Они играют важную роль в функционировании клеток и организма. Например, ионы натрия регулируют содержание воды и играют роль в передаче электрических импульсов в нервной системе. Ионы калия играют роль в поддержании регулярного сердцебиения, а также в передаче электрических импульсов. Ионы хлорида уравновешивают заряд. Ионы карбоната участвуют в поддержании рН крови.
Концентрации электролитов в жидкостях организма недостаточно высоки, чтобы их можно было указать в молях или эквивалентных единицах. Электролиты в жидкостях организма обычно указываются в единицах миллимолей (ммоль) или миллиэквивалентов (мэкв), где: \(1000 \mathrm{~ммоль}=1 \mathrm{~моль}\) и \(1000 \mathrm{~ mEq}=1 \mathrm{~Eq}\).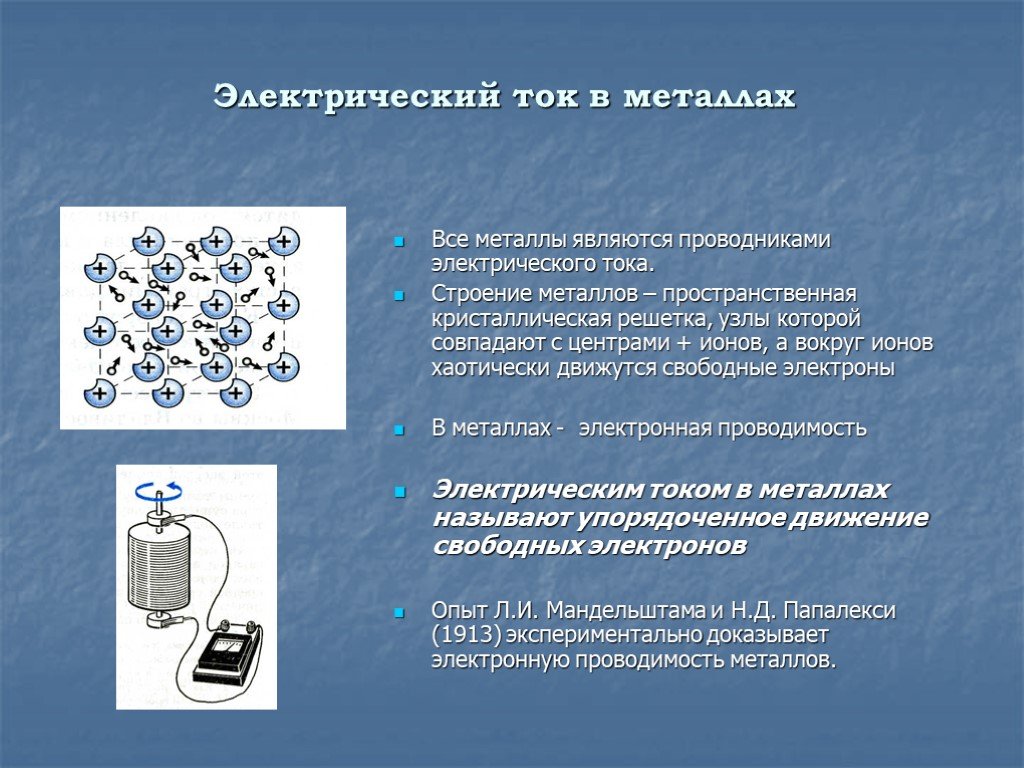
Общая концентрация электролитов во внутривенных жидкостях, вводимых пациентам, примерно такая же, как и электролитов в жидкостях организма. Например, лактатный раствор Рингера содержит примерно: 130 мэкв/л Na + , 4 мэкв/л K + , 3 мэкв/л Ca 2 + , 109 мэкв/л Cl – и 28 мэкв/л лактата –. Обратите внимание, что общий заряд +ve (130+4+3= 137 мЭкв/л) равен общему заряду -ve (109+28 = 137 мэкв/л).
Рисунок \(\PageIndex{3}\): Концентрация электролитов в жидкостях организма. Источник: Колледж OpenStax / CC BY (https://creativecommons.org/licenses/by/3.0)Эта страница под названием 5.3: Электролиты распространяется в соответствии с лицензией Public Domain, автором, ремиксом и/или куратором которой является Мухаммад Ариф Малик.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Мухаммад Малик
- Лицензия
- Общественное достояние
- Теги

Электрон — Энергетическое образование
Энергетическое образованиеМеню навигации
ИСТОЧНИКИ ЭНЕРГИИ
ИСПОЛЬЗОВАНИЕ ЭНЕРГИИ
ЭНЕРГЕТИЧЕСКОЕ ВОЗДЕЙСТВИЕ
ИНДЕКС
Поиск
Рис. 1. Рисунок, на котором изображен атом. Обратите внимание, насколько большую площадь занимает электронное облако по сравнению с ядром. [1]
Электроны — это отрицательно заряженные частицы, которые существуют в облаке вокруг ядра атома. Они невообразимо малы, настолько малы, что для объяснения их своеобразного поведения необходима квантовая механика, и, насколько физика смогла определить, они являются фундаментальными частицами. Для объема этой энциклопедии лучше всего представить электроны как крошечные частицы, которые «вращаются» вокруг ядра атома (другие ресурсы ниже предоставят более продвинутую интерпретацию). Однако вместо силы гравитации, которая отвечает за движение лун вокруг планет, электромагнитные силы заставляют электроны «вращаться» вокруг ядер. Для получения дополнительной информации о физике электронов см. гиперфизику.
9{-26}[/math] м
Однако вместо силы гравитации, которая отвечает за движение лун вокруг планет, электромагнитные силы заставляют электроны «вращаться» вокруг ядер. Для получения дополнительной информации о физике электронов см. гиперфизику.
9{-26}[/math] м
Электроны и электричество
Электричество — это поток электронов через проводник, обычно в виде проволоки, этот поток называется электрическим током. Чтобы возник этот поток, электроны должны разорвать свои атомные связи (электричество — это поток электронов, , а не поток электронов и ядер, с которыми они связаны). Разрыв атомной связи между электроном и его ядром требует ввода энергии, которая заставляет электрон преодолевать ограничивающую его электромагнитную силу и, таким образом, свободно течь. Эта необходимая энергия может быть получена из различных источников, и вот несколько примеров:
- Ископаемое топливо
- Радиоактивный материал
- Солнечное излучение
- Ветер
- Приливные течения
Проводящий материал
Все формы материи содержат электроны, однако в некоторых материалах электроны более слабо связаны с их ядрами.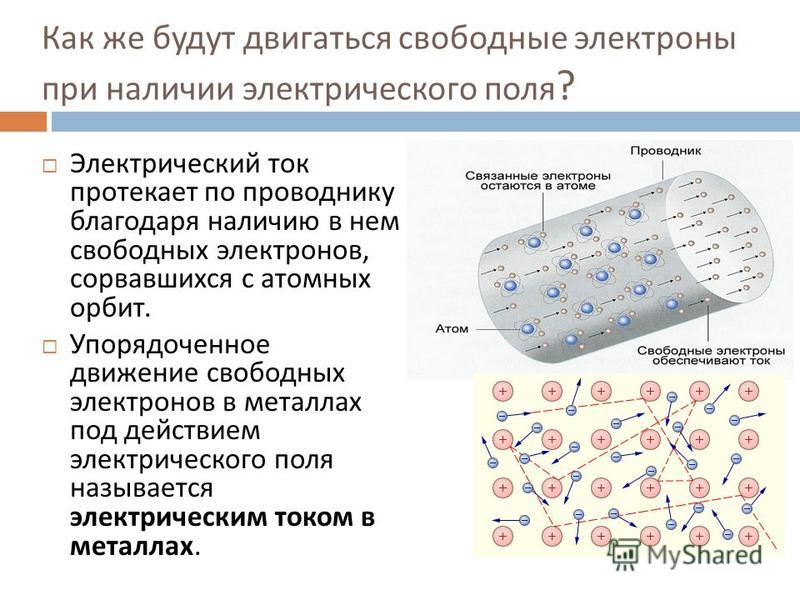 Эти материалы (известные как проводники или металлы) требуют очень мало энергии для создания электрического тока, потому что слабо связанным электронам требуется гораздо меньше энергии для преодоления электромагнитной силы, удерживающей их на месте.
Эти материалы (известные как проводники или металлы) требуют очень мало энергии для создания электрического тока, потому что слабо связанным электронам требуется гораздо меньше энергии для преодоления электромагнитной силы, удерживающей их на месте.
Что генерирует поток электронов?
Электрические генераторы — это устройства, в которых используется принцип электромагнитной индукции — это процесс перемещения проводника через магнитное поле для создания потока электронов. Примечание: требуется только относительное движение проводника и магнитного поля, что означает, что магнитное поле может двигаться, когда проводник неподвижен. Когда электроны в проводнике проходят через магнитное поле (если поле достаточно сильное и относительная скорость проводников в поле достаточно велика), тогда связи с их ядрами будут разорваны, и возникнет поток. Чтобы вызвать высокий уровень потока электронов, требуется много энергии, чтобы создать относительную скорость между проводником и магнитами.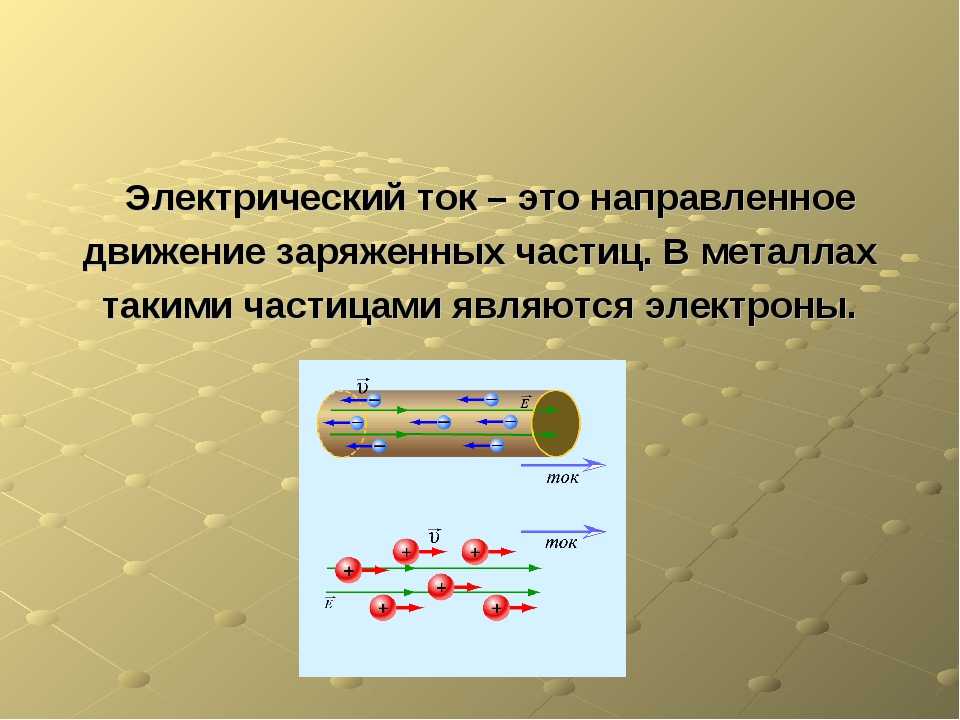
Химические реакции внутри батарей также создают электродвижущую силу, заставляющую электроны течь по цепи. Фотоны (энергия света) также могут вызывать поток электронов, когда они ударяются о фотогальванический элемент.
Внешние ресурсы
Чтобы узнать больше о том, как электроны образуют материю с протонами и нейтронами, посетите нашу страницу об атомах. Более глубокую физику электрона см. в гиперфизике. Чтобы узнать больше о том, какое отношение электроны имеют к химии, см. вики Калифорнийского университета в Дэвисе. Чтобы просто поиграть с различными моделями электронов вокруг атома, см. модели атома водорода PhET.
Для дополнительной информации
Для получения дополнительной информации см. соответствующие страницы ниже:
- Постоянный ток
- Переменный ток
- Электрическая сеть
- Электрогенератор
- Или исследуйте случайную страницу!
Ссылки
- ↑ Р.



 Это 300 000 км/с, а вот движение самих заряженных частиц невелико — меньше одного миллиметра в секунду.
Это 300 000 км/с, а вот движение самих заряженных частиц невелико — меньше одного миллиметра в секунду.