Частичный заряд — Partial charge
Частичный заряд представляет собой величину заряда нецелой при измерении в элементарных зарядах единиц. Частичный заряд обычно называют чистым атомным зарядом. Оно представлено греческой строчной буквы б , а именно или б пишется б +.
Частичные заряды создается за счет асимметричного распределения электронов в химических связей. Так , например, в полярной ковалентной связи , как HCl, общий электрон колеблется между связанными атомами. Полученные в результате частичные заряды являются свойством только в пределах зон распределения, а не сборки в целом. К примеру, химики часто выбирают смотреть на небольшое пространстве , окружающее ядро из с атома : Когда электрический нейтральный атом связь химически к другому нейтральному атому , который является более электроотрицательным , его электроны частично заблудят. Это оставляет область относительно ядра этого атома с частичным положительным зарядом, и это создает частичный отрицательный заряд на атоме , к которому он присоединен.
Полярность хлорметана (слева)
и соответствующего соединения Гриньяра
с указанием частичного заряда.
В такой ситуации, распределенные расходы , принимаемые в качестве группы всегда несут в себе целый ряд элементарных единиц заряда. Тем не менее , можно указать на зоны внутри сборки , где меньше , чем полный заряд находится, например, область вокруг ядра атома в. Это возможно , отчасти потому , что частицы не как математические точки- , которые должны быть либо внутри зоны или за его пределами, но размазывается по принципу неопределенности в квантовой механике . Из — за этого эффекта размытия, если определить достаточно малую зону, фундаментальная частица может быть как частично внутри и частично вне его.
Пользы
Частичные атомные заряды используются в молекулярной механики силовых полей для вычисления энергии электростатического взаимодействия , используя закон Кулона . Они также часто используются для качественного понимания структуры и реакционной способности молекул.
Определение частичных атомных зарядов
Частичные атомные заряды могут быть использованы для количественной оценки степени ионных по сравнению с ковалентной связью любого соединения через периодическую таблицу. Необходимость в таких количествах, возникает, например, в молекулярных моделированиях для вычисления объемных и поверхностных свойств в согласии с экспериментом. Данные для химически различных соединений показывает, что имеющиеся экспериментальные данные и химическую понимание приводит к оправданным атомным зарядам. Атомные заряды для данного соединения могут быть получены несколькими способами, такими как:
- экстрагируют из электронных плотностей, измеренных с помощью высокого разрешения рентгеновских лучей, гамма-лучей, или экспериментах по дифракции электронов пучка
- измеренные дипольные моменты
- расширенная Born термодинамический цикл, включая анализ ковалентных и ионных вкладов приклеивания
- спектроскопически измеренные свойства, такие как ядро-электронные связывания сдвиги энергии
- отношение атомных зарядов до точки плавления, растворимости, и энергии расщепления для множества подобных соединений с аналогичной степенью ковалентной связи
- отношение атомных зарядов к химическим механизмам реакционной способности и реакции для аналогичных соединений, описано в литературе.
Обсуждение отдельных соединений в предшествующей работе показала сходимость в атомных зарядах, то есть высоком уровне согласованности между присвоенной степенью полярности и физико-химическими свойствами, упомянутыми выше. В результате неопределенность в атомных зарядах ± С0,1 до ± 0.2e для сильно заряженных соединений, и часто <С0,1 для соединений с атомными зарядами ниже ± 1.0e. Часто, применение одного или двух из вышеуказанных понятий уже приводит к очень хорошие значения, особенно принимая во внимание растущую библиотеку экспериментальных эталонных соединений и соединений с проверенными силовыми полями.
Опубликованных исследований литературы по частичных атомных зарядов изменяется по качеству от крайне бедных до очень хорошо сделано. Хотя большое количество различных методов присвоения частичных атомных зарядов из квантовых вычислений химии были предложены в течение многих десятилетий, подавляющее большинство предложенных методов не работают хорошо в самых различных типов материалов. Только недавно , в 2016 году был метод теоретически вычислений частичных атомных зарядов , разработанных , которая выполняет последовательно хорошо через чрезвычайно широкий спектр типов материалов. Все предыдущих методов были основные недостатки , которые мешают им назначая точные частичные атомные заряды во многих материалах. Малликеновские и Löwdin частичных заряды физически необоснованные, потому что они не имеют математический предел , как базис улучшаются по отношению к полноте. Гиршфельд частичные заряды, как правило , слишком низкие величина. Некоторые методы для назначения частичных атомных зарядов не сходятся к единственному решению. В некоторых материалах, атомы в молекулах анализа дают неядерные аттракторы , описывающие разделы плотности электронов , которые не могут быть отнесены к любому атому в материале; в таких случаях, атомы в молекулах анализе не могут назначить частичные атомные заряды.
По словам Крамера (2002), частичные методы заряда можно разделить на четыре класса:
- Сборы класса I являются те , которые не определяются из квантовой механики, но с некоторым интуитивным или произвольным подхода. Эти подходы могут быть основаны на экспериментальных данных , таких как диполи и электроотрицательности.
- Заряды класса II являются производными от разделения молекулярной волновой функции , используя некоторую произвольную, орбитальную схему , основанной.
- Заряды III класса
- Заряды IV класса являются производными от полуэмпирического отображения заряда предшественника типа II или III , чтобы воспроизвести экспериментально определенный наблюдаемые , такие как дипольные моменты.
Ниже приведен подробный перечень методов, частично основана на Meister и Шварц (1994).
- Анализ Популяция волновых функций
- Разбиение электронной плотности распределений
- Bader заряды (полученный из атомов в молекулах анализа)
- Плотность установлены атомные заряды
- сборы Гиршфельд
- скорректированные расходы Bader Маслен в
- сборы Политцера
- Плотность Вороного Деформационные заряды
- Плотность Derived Электростатические и химической (DDEC) заряды, которые одновременно воспроизводят химические состояния атомов в материале и электростатического потенциала окружающего распределение электронной плотности материала
- Расходы, полученные из дипольных-зависимых свойств
- дипольные заряды
- Дипольные производные заряды, также называемые атомные полярный тензор (APT), полученные заряды, или рождение, Кэллен или Сигети эффективных зарядами
- Расходы, полученные из электростатического потенциала
- Расходы , полученные из спектроскопических данных
- Расходы из других экспериментальных данных
- Официальные обвинения
Рекомендации
- Франк Йенсен. Введение в вычислительной химии (2 — е изд.). Wiley. ISBN 978-0-470-01187-4 .
- ^ H. Heinz; UW Сутер (2004). «Заряды для классических имитаций полярных систем». J. Phys. Химреагент B . 108 : 18341-18352. DOI : 10.1021 / jp048142t .
- ^ H. Heinz; TZ Лин; Мишра РК; FS Emami (2013). «Термодинамически Последовательная Поля Силы для Ассамблеи неорганическая, органическая, и биологических наноструктурах: поле INTERFACE Force». Ленгмюра . 29 : 1754-1765. DOI : 10.1021 / la3038846 .
- ^ Б с д е Т. А. Манц; Н. Gabaldon-Лимас (2016). «Введение DDEC6 атомного анализ населения: Часть 1. Заряда теория разделения и методология» (PDF) . RSC Adv . 6 : 47771-47801. DOI : 10.1039 / c6ra04656h .
- ^ Б с Н. Gabaldon-Limas; ТА Манц (2016). «Введение DDEC6 атомное популяционный анализ: Часть 2. Результаты расчетов для широкого спектра периодических и непериодических материалов». RSC Adv . 6 : 45727-45747. DOI : 10.1039 / c6ra05507a .
- ^ Б А. Е. Рида; RB Вайншток; F. Вейнхолд (1985). «Естественный анализ населения». J. Chem. Phys . 83 : 735-746. Bibcode : 1985JChPh..83..735R . DOI : 10,1063 / 1,449486 .
- ^ ER Дэвидсон; С. Чакраворти (1992). «Тест на определение Гиршфельд атомных зарядов и моментов». Теор. Хим. Acta . 83 : 319-330. DOI : 10.1007 / BF01113058 .
- ^ С. Гатти; П. Fantucci; Г. Pacchioni (1987). «Плотность заряда топологическое исследование связей в кластерах лития». Теор. Хим. Acta . 72 : 433-458. DOI : 10.1007 / BF01192234 .
- ^ CJ Крамер (2002). Основы вычислительной химии: Теории и методы . Wiley. стр. 278-289.
- ^ J. Meister; WHE Шварц (1994). «Основные компоненты ионности». J. Phys. Chem . 98 : 8245-8252. DOI : 10.1021 / j100084a048 .
- ^ «Руководство Q-Chem 4.3 пользователя: Анализ волновой функции» . Источник 2017-07-23 .
- ^ А. В. Маренич; SV Jerome; CJ Крамер; DG Truhlář (2012). «Charge Model 5: Расширение Гиршфельд Анализ населения для точного описания молекулярных взаимодействий в газообразных и конденсированных фазах». J. Chem. Теория вычи . 8 : 527-541. DOI : 10.1021 / ct200866d .
- ^ FL Гиршфельд (1977). «Фрагменты Bonded-атом для описания плотностей молекулярных зарядов». Теор. Хим. Acta . 44 : 129-138. DOI : 10.1007 / BF00549096 .
- ^ EN Маслен; MA Spackman (1985). «Атомные заряды и плотность электронов разделение». Aust. J. Phys . 38 : 273-287. Bibcode : 1985AuJPh..38..273M . DOI : 10,1071 / PH850273 .
- ^ TA Манц; DS Sholl (2012). «Улучшение Атомы-в-Molecule Charge Разметка функционал для одновременного воспроизведения электростатического потенциала и химических состояний в периодических и непериодических материалах». J. Chem. Теория вычи . 8 (8): 2844-2867. DOI : 10.1021 / ct3002199 .
- ^ PJ Stephens; KJ Ялканен; RW Kawiecki (1990). «Теория колебательных вращательных сильные: сравнение априорной теории и приближенные модель». Варенье. Химреагент Soc . 112 (18): 6518-6529. DOI : 10.1021 / ja00174a011 .
- ^ . Ph Ghosez; Ж.-П. Michenaud; X. Gonze (1998). «Динамические атомные заряды: случай АВО 3 соединений». Phys. Rev. B . 58 (10): 6224-6240. Arxiv : конд-мат / 9805013 . Bibcode : 1998PhRvB..58.6224G . DOI : 10,1103 / PhysRevB.58.6224 .
Частичный заряд — Большая Энциклопедия Нефти и Газа, статья, страница 1
Частичный заряд
Cтраница 1
Частичные заряды б и б — выражают дефицит или избыток электронной плотности. Это различие в электронной плотности является следствием большей электрофильности атомов кислорода и хлора по сравнению с атомами фосфора или углерода. Какой из атомов несет частичный отрицательный заряд 6 -, а который — положительный 6, можно оценить исходя из электроотрицательности того или иного элемента. [2]
Эффективные частичные заряды Д и б различны по величине. [3]
Частичный заряд связи С-N равен 0 071 от заряда электрона. [4]
Такие частичные заряды с перерывами на 1 ч продолжаются до тех пор, пока батарее не будет дано необходимое количество ампер-часов. [5]
Величина частичных зарядов на атомах, соединенных л-связью, значительно больше, чем на атомах, соединенных о-связью. Так, в ацетоне я-электронное облако сдвинуто в сторону атома кислорода и углеродный атом карбонильной группы ( несмотря на индуктивное влияние метальных групп) приобретает значительный положительный, а кислород — соответствующий отрицательный частичные заряды. [6]
Равен величине частичного заряда в связи, умноженной па разделяющее расстояние. [7]
В большинстве случаев указываются только частичные заряды [ формула ( В. ЗО) ] или шользуются одними стрелками для обозначения / — эффекта [ формула ( В. Стрелку не следует путать с символом семиполярной связи, которым пользовались раньше. [8]
Таким образом, расчет частичного заряда на атомах, образующих связь, непосредственно из данных векторного слагаемого в направлении линии связи путем деления этой величины на длину связи и заряд электрона, как это часто делали ранее, не дает требуемого значения. Для его получения необходимо определить отдельные вышеуказанные слагаемые. Из них р гом проявляется главным образом в связях, одним из компонентов которых является атом водорода. [9]
Таким образом, расчет частичного заряда атомов, образующих связь, из дипольного момента связи и ее длины является очень приближенным, так как необходимо определить значения отдельных составляющих днподьчг) момента. Из них ur, проявляется главным образом в связях с атомом водорода. [10]
Изображение гибридной структуры с частичными зарядами в трех положениях имеет важное значение, что станет очевидным позднее. [11]
Изображение гибридной структуры с частичными зарядами в трех положениях имеет важное значение, что станет очевидным позднее. Потеря промежуточным соединением протона приводит к восстановлению ароматической системы, которая теперь представляет собой продукт замещения бензола. [12]
В тех случаях, когда частичный заряд рассматриваемого заместителя вместо отрицательного оказывается положительным, направление действия аномерного эффекта изменяется. Такого рода обратный аномерный эффект четко зафиксирован при исследовании N-гликозилимидазолов и их протонирован-ных форм. [13]
Уравнение Гаммета приводит к определению частичных зарядов в переходном состоянии реакций при использовании в качестве зонда замещенных ароматических соединений. Достигнутые при этом — результаты вызвали попытки провести сходные исследования в чисто алифатических системах. Однако здесь возникла проблема, каким образом удержать постоянным стерическое действие заместителей, когда оно уже не полностью исключено. К тому же помимо прочего здесь уже нельзя пользоваться прежними значениями 0, содержащими полярную и мезомерную составляющие, поскольку в чисто алифатической системе могут действовать только полярные эффекты. [14]
Условием для возникновения частичных тс-связей и частичных зарядов является сопряжение. [15]
Страницы: 1 2 3 4
Заряд частичный — Справочник химика 21
Присоединение к а,р-непредельным карбонильным соединениям лучше всего можно объяснить, если рассматривать атаку по всей сопряженной системе в целом. Для того чтобы образовался наиболее устойчивый ион, необходимо, чтобы атака направлялась на концевые атомы этой системы. Нуклеофильный реагент атакует р-углеродный атом, образуя ион, в котором отрицательный заряд частично перераспределен на атом кислорода электрофильный реагент атакует атом кислорода, образуя карбониевый ион, в котором положительный заряд находится на атоме углерода. [c.921]Понятие о радикалах было высказано Лавуазье в 1789 г. в его знаменитом Курсе химии прошло свыше двадцати лет, прежде чем оно получило дальнейшее развитие в работах Берцелиуса. Шведский ученый исходил из топ мысли, что природа п свойства органических соединений должны быть объяснены на основании теоретических представлений, принятых в химии неорганической. Однако взгляды Берцелиуса существенным образом отличались от взглядов Лавуазье и в области неорганической химии Берцелиусом была принята и широко использована атомистическая гипотеза, высказанная незадолго до этого Дальтоном, и Берцелиус, под влиянием успехов применения электричества в химии, поставил в тесную связь химические и электрические явления. Сущность теории неорганических соединений, развитой Берцелиусом, сводится к следующему атом каждого элемента несет электрические заряды (положительные и отрицательные одновременно), причем, в зависимости от природы элемента, один из этих зарядов больше. При соединении атомов их заряды частично нейтрализуются. Положительно заряженный атом металла, калия например, соединяется с отрицательно заряженным атомом кислорода и дает окись калия К2О таким же образом получается из атомов серы и кислорода ЗОд. Так как заряды в соединившихся эле- [c.9]
При движении жидких углеводородов по трубопроводам электростатические заряды могут достигать очень высоких значений, особенно при прохождении жидкости через фильтры. Так как рассеивание электростатического заряда зависит не только от электропроводности продукта, но и от времени течения по трубопроводу, фильтры следует устанавливать в наиболее удаленных от наливного устройства местах, чтобы дать возможность зарядам частично разрядиться. [c.153]
Конденсатор, изолированный идеальным диэлектриком, пе показывает никакого рассеивания энергии при применении переменного потенциала. Зарядный ток, называемый в технике циркулирующим, отстает на 90° по фазе от применяемого потенциала, и энергия, накапливаемая в конденсаторе в течение каждой половины цикла, полностью восстанавливается в следующем. Но ни один из существующих диэлектриков не обладает таким идеальным характером, некоторое количество энергии рассеивается под знакопеременным напряжением и выделяется в виде тепла. Такие потери производительности называются диэлектрическими потерями . Обычная проводимость содержит компонент диэлектрических потерь здесь емкостный заряд частично теряется через среду. [c.204]
Объясняется это тем, что из двух возможных промежуточных карб-катионов СНз—СН—С 1 и СНг—СНа—С1 более устойчивым, а значит, и более вероятным будет первый, так как его положительный заряд частично компенсируется сопряжением с галогеном [c.101]
После прекращения облучения заряд частично восстанавливается. В дальнейшем полимер ведет себя как электрет, не подвергшийся облучению (участок СД). [c.70]
На рис. 5, а изображено суммарное (Ар) изменение плотности при образовании комплекса. Характерным, как и на рис. 3, является уменьшение р на атоме Н мостика и атомах Н молекулы акцептора протона и увеличение р вблизи атомов О. Как видно из рис. 5,, б, при учете только электростатического (которое не приводит к изменению р) и обменного взаимодействий при сбли-жени молекул в пространстве между ними (между атомами О и Н) происходит сильное уменьшение р. Становится ясно, таким образом, что последнее обязано антисимметрии полной волновой функции, которое и вызывает отталкивание между молекулами, называемое обменным. Наглядно можно сказать, что вследствие указанной антисимметрии электроны с параллельными спинами при сближении молекул как бы избегают один другого вследствие чего вероятность их нахождения в пространстве между молекулами уменьшается. Из рис. 5, в к г видно, что поляризация электронных оболочек усиливает, а перенос заряда частично компенсирует уменьшение электронной плотности в указанном пространстве. Надо полагать, что для более сильных связей эта компенсация [c.20]
Между местом образования заряда (например, фильтром, применяемым для авиационных топлив) и рассматриваемым резервуаром заряд частично теряется в результате релаксации. [c.170]
Данные рис. 1 2 и 13 показывают, что при замене изооктана метанолом мощность увеличивается примерно на 15%. В прошлом это влияние объясняли значительно большей скрытой теплотой испарения метанола и связанным с этим лучшим охлаждением. Такое объяснение не учитывает сравнительно менее очевидного фактора — вытеснения равного количества воздуха при испарении метанола. Однако даже если это так, то влияние охлаждения на увеличение плотности рабочего заряда частично нейтрализуется. Более строгий анализ, видимо, показал бы, что если метанол вводить в цилиндр без испарения, то увеличение мощности было бы почти полностью обусловлено факторами, которые иллюстрирует рис. 13. [c.287]
Для того чтобы объяснить, каким образом ПАВ способствуют удалению загрязнений, необходимо рассмотреть силы, удерживающие загрязнение на субстрате, и явления, происходящие в процессе мытья. В состав загрязнения могут входить масляные жидкости, способные течь и, следовательно, изменяющие свою форму при удалении с поверхности субстрата (остатки пота на одежде или остатки жирной пищи на посуде), и частицы твердых веществ, переходящие в моющий раствор без изменения формы (например, сажа и окислы металлов). Хотя многие явления, участвующие в процессах удаления обоих видов загрязнений, одни и те же, каждый из них имеет и важные отличительные особенности. Возьмем, например, сухую ткань, содержащую твердое загрязнение (в данном случае загрязнение удерживается на поверхности материала вандерваальсовы-ми силами притяжения). Если погрузить ее в водный раствор ПАВ и начать перемешивать, то частицы загрязнения будут механически отрываться от поверхности ткани и переходить в раствор. Вслед за этим происходит смачивание тех участков поверхности ткани и частиц загрязнения, которые ранее находились в контакте друг с другом. В результате смачивания водным раствором ПАВ эти участки, как и остальная поверхность ткани и твердых частиц, приобретают электрический заряд, обусловленный адсорбцией на них ионов из раствора или ионизацией поверхностных полярных групп. Поскольку анионы адсорбируются легче, чем катионы, в большинстве случаев поверхность очищаемого материала станови
Частичный заряд — Большая Энциклопедия Нефти и Газа, статья, страница 1
Частичный заряд
Cтраница 1
Частичные заряды б и б — выражают дефицит или избыток электронной плотности. Это различие в электронной плотности является следствием большей электрофильности атомов кислорода и хлора по сравнению с атомами фосфора или углерода. Какой из атомов несет частичный отрицательный заряд 6 -, а который — положительный 6, можно оценить исходя из электроотрицательности того или иного элемента. [2]
Эффективные частичные заряды Д и б различны по величине. [3]
Частичный заряд связи С-N равен 0 071 от заряда электрона. [4]
Такие частичные заряды с перерывами на 1 ч продолжаются до тех пор, пока батарее не будет дано необходимое количество ампер-часов. [5]
Величина частичных зарядов на атомах, соединенных л-связью, значительно больше, чем на атомах, соединенных о-связью. Так, в ацетоне я-электронное облако сдвинуто в сторону атома кислорода и углеродный атом карбонильной группы ( несмотря на индуктивное влияние метальных групп) приобретает значительный положительный, а кислород — соответствующий отрицательный частичные заряды. [6]
Равен величине частичного заряда в связи, умноженной па разделяющее расстояние. [7]
В большинстве случаев указываются только частичные заряды [ формула ( В. ЗО) ] или шользуются одними стрелками для обозначения / — эффекта [ формула ( В. Стрелку не следует путать с символом семиполярной связи, которым пользовались раньше. [8]
Таким образом, расчет частичного заряда на атомах, образующих связь, непосредственно из данных векторного слагаемого в направлении линии связи путем деления этой величины на длину связи и заряд электрона, как это часто делали ранее, не дает требуемого значения. Для его получения необходимо определить отдельные вышеуказанные слагаемые. Из них р гом проявляется главным образом в связях, одним из компонентов которых является атом водорода. [9]
Таким образом, расчет частичного заряда атомов, образующих связь, из дипольного момента связи и ее длины является очень приближенным, так как необходимо определить значения отдельных составляющих днподьчг) момента. Из них ur, проявляется главным образом в связях с атомом водорода. [10]
Изображение гибридной структуры с частичными зарядами в трех положениях имеет важное значение, что станет очевидным позднее. [11]
Изображение гибридной структуры с частичными зарядами в трех положениях имеет важное значение, что станет очевидным позднее. Потеря промежуточным соединением протона приводит к восстановлению ароматической системы, которая теперь представляет собой продукт замещения бензола. [12]
В тех случаях, когда частичный заряд рассматриваемого заместителя вместо отрицательного оказывается положительным, направление действия аномерного эффекта изменяется. Такого рода обратный аномерный эффект четко зафиксирован при исследовании N-гликозилимидазолов и их протонирован-ных форм. [13]
Уравнение Гаммета приводит к определению частичных зарядов в переходном состоянии реакций при использовании в качестве зонда замещенных ароматических соединений. Достигнутые при этом — результаты вызвали попытки провести сходные исследования в чисто алифатических системах. Однако здесь возникла проблема, каким образом удержать постоянным стерическое действие заместителей, когда оно уже не полностью исключено. К тому же помимо прочего здесь уже нельзя пользоваться прежними значениями 0, содержащими полярную и мезомерную составляющие, поскольку в чисто алифатической системе могут действовать только полярные эффекты. [14]
Условием для возникновения частичных тс-связей и частичных зарядов является сопряжение. [15]
Страницы: 1 2 3 4
П. 3.2. Формальный и частичный заряды атомов в молекулах и ионах. — МегаЛекции
Формулу метильного катиона можно записать не только как +СН3, но и как СН3+ (практически равнозначные записи). В последнем случае знак «+» указывает на заряд частицы в целом. При записи +СН3 знак «+» тоже указывает на заряд частицы в целом, но он также указывает на валентное состояние углерода (вокруг углерода не восемь как в молекуле метана или метильном анионе, не семь, как в метильном радикале, а шесть электронов, да и сам метильный катион может быть образован из трех атомов водорода и катиона углерода С+). Этот знак «+» называется в данном случае формальным зарядом, он описывает электронное состояние атома углерода.

Итак, метильный катион имеет заряд +1, формально мы приписываем этот заряд атому углероду, поскольку этот заряд описывает его валентное состояние (напомним еще раз, что сам метильный катион может быть образован из трех атомов водорода и катиона углерода С+). Однако не следует думать, что весь положительный заряд в метильном катионе СН3+ сосредоточен только на атоме углерода. НИЧЕГО ПОДОБНОГО.
Связи углерода с водородом (С-Н) образованы за счет двух электронов (по одному неспаренному электрону от каждого атома, как и любая ковалентная связь, образованная по обменному механизму). Электроны этих связей С-Н могут смещаться к атому углерода, то есть располагаться не строго посередине между атомами углерода и водорода, а ближе к углеродному атому. При этом на атомах водорода возникает ЧАСТИЧНЫЙ ПОЛОЖИТЕЛЬНЫЙ ЗАРЯД (не целый, не формальный заряд «+1», как ранее, а именно частичный), обозначаемый символом «d+» (читается : «дельта плюс»). Строение метильного катиона можно изобразить при этом одним из нижеприведенных способов. Все они практически равнозначны, однако на практике чаще используется последнее обозначение ввиду его простоты, при этом то, что положительный заряд не сконцентрирован только на атоме углерода, а размыт, ДЕЛОКАЛИЗОВАН по всему катиону ПОДРАЗУМЕВАЕТСЯ.

Суммарный положительный заряд частицы по-прежнему равен +1, однако при такой записи (первые две формулы) указывается, что этот заряд распределен между атомом углерода и тремя атомами водорода. Конкретные значения d+ и d/+ (к примеру, +0.1 и +0.7) могут быть определены физическими методами, однако для органической химии важно понимание наличия этих частичных зарядов, конкретные величины зарядов обычно не так существенны.
Необходимо ясно уяснить для себя отличие целочисленного формального заряда, приписываемого атому, от частичного заряда δ. Поясним это подробнее.
Атом водорода можно обозначить как Н или как Н., указывая на наличие у него одного электрона. Атом водорода электронейтрален. Два атома водорода образуют молекулу водорода, в которой два электрона связи Н-Н находятся строго посередине между атомами водорода (ковалентная неполярная связь). Считается, что в молекуле водорода Н2 на атомах нет ни частичного положительного, ни частичного отрицательного заряда.
С другой стороны, рассмотрим молекулу фтороводорода, образованную из одновалентных атомов водорода и фтора. Два электрона связи Н-F располагаются ближе к более электроотрицательному атому фтора. На атоме водорода возник частичный положительный заряд «d+», а на атоме фтора – частичный отрицательный «d-» (напоминаю: электрон имеет заряд ‑1, а Вы не в магазине).

Но это именно частичные заряды «d+» и «d-», поскольку связь H-F является ковалентной полярной, а не ионной и электронная пара частично, а не полностью (как в случае ионной связи) смещена к атому фтора. Заряды «d+» и «d-» в молекуле HF по абсолютному значению (то есть по модулю) больше нуля, но меньше единицы, поскольку атом водорода лишь частично отдал свой валентный электрон атому фтора. Точные значения величин «d+» и «d-» ( к примеру, +0.30 и -0.30 или что-то около) могут быть определены физическими методами, однако для объяснения особенностей протекающих химических реакций зачастую достаточно лишь знать, что на атоме водорода имеется какой-то частичный положительный заряд. Точное его значение обычно не так важно.
Если связь Н-F разорвать гетеролитически, чтобы два электрона связи перешли к атому фотора, то получаться две частицы, обладающие уже не частичными зарядами «d+» и «d-», а полными зарядами +1 и -1, поскольку тот электрон, который раньше принадлежал атому водорода сейчас ПОЛНОСТЬЮ перешел к атому фтора:
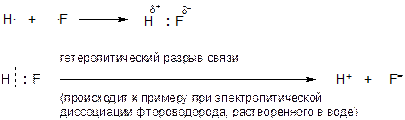
Если от атома водорода оторвать электрон, то получится частица, обозначаемая как «Н+» и называемая «протон». В данном случае знак «+» — это уже целочисленный, а не частичный заряд.
ЗАДАНИЕ № 2. Опишите при помощи символов δ+ и δ— распределение заряда в следующих частицах:
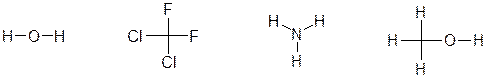
Краткий ответ: Фтор, кислород, азот и хлор – типичные неметаллы, характеризующиеся высокой электроотрицательностью и стремлением притягивать электроны от менее электроотрицательных атомов.

Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
Химическая связь. Электронная формула атома. Правило октета. Благородные газы. Электронные доноры и акцепторы. Частичный электрический заряд. Карбонильная группа. Электроотрицательность. Полярные молекулы
Main page / Генетика XXII века / АТОМЫ, АТОМНЫЕ ОБОЛОЧКИ / Химическая связь. Электронная формула атома. Правило октета. Благородные газы. Электронные доноры и акцепторы. Частичный электрический заряд. Карбонильная группа. Электроотрицательность. Полярные молекулы
Когда два атома встречаются, они могут начать друг с другом взаимодействовать. То, как именно протекает их взаимодействие, в первую и основную очередь зависит лишь от того, как именно устроены их внешние электронные оболочки. Сколько протонов или нейтронов находится у них в ядрах, совершенно неважно, ведь они слишком далеко и влияние положительно заряженных протонов прочно экранировано стадами пасущихся на электронных уровнях электронов. Неважно даже и то, сколько электронов расположено на предпоследнем электронном уровне, не говоря уже о более близких к ядру электронах, поскольку и их влияние ничтожно по сравнению с влиянием тех электронов, которые находятся на самом внешнем уровне и приходят в непосредственное соприкосновение с внешними электронами соседнего атома. Так что важно только одно — сколько электронов на самых внешних уровнях атомов, и как именно они там располагаются. «Внешним» уровнем атома мы называем тот уровень, который дальше всех расположен от ядра и при этом содержит хотя бы один электрон.
Введем важное понятие: «электронная формула атома». Это такая запись, которая зримо, наглядно показывает — сколько электронов находится у данного атома на каких уровнях и подуровнях. Например, электронная запись водорода будет такой: 1s¹. Первая цифра показывает номер уровня. Буква показывает — какой именно подуровень этого уровня имеется в виду — s (сферический) или p (три «гантели») или d (пять сложных «гантелей») или f (семь очень сложных конфигураций) и т.д. А вторая цифра показывает, сколько электронов находится на этом подуровне.
Отсюда ясно, что если электронная формула атома записывается как 1s¹, то это означает, что в этом атоме имеется лишь один электрон, и находится он, разумеется, на первом s-подуровне — это хорошо знакомый нам атом водорода.
У кислорода порядковый номер 8 в периодической таблице, а значит в его ядре 8 протонов (плюс сколько-то нейтронов, нам сейчас неважно сколько), и значит на орбитах вокруг ядра располагаются 8 электронов. На первом уровне есть только s-орбиталь, на котором помещается максимум 2 электрона, на втором уровне уже есть два подуровня — s и p, (на подуровне p максимум может быть 6 электронов — по два на каждую 2р-орбиталь). Заполнение электронами подуровней простых атомов идет строго по порядку — сначала заполняется подуровень 1s, потом 2s, потом 2p, потом 3s, потом 3p. Отсюда ясно, что электронная формула кислорода будет такой: 1s² + 2s² + 2p⁴, или, более коротко: 1s²2s²2p⁴.
Третий электронный уровень в атоме содержит три подуровня: s, p, d. Мы можем интуитивно понять и запомнить, что для электронов находиться на сферической орбитали s значительно проще, чем на сложной гантелеобразной p, и уж тем более сложно на еще более замысловатой орбитали d-подуровня. И учитывая тот факт, что чем дальше от ядра, тем плотнее расположены всё более многочисленные уровни и подуровни, мы совсем не удивимся тому, что для атома энергетически выгодней, чтобы электроны сначала заполняли простой по форме сферический подуровень 4s, и уже лишь потом вскарабкивались на сложный 3d, затрачивая на это больше энергии. То есть правило последовательного заполнения подуровней снизу вверх в данном случае нарушается, но нам легко понять — почему это происходит. В более сложных атомах порядок заполнения подуровней становится еще более сложным, и мы конечно сейчас не будем в это углубляться. На самом деле нам эти сложные атомы с большим количеством электронов почти что и не нужны, ведь самые основные химические элементы жизни очень просты: водород, углерод, азот и кислород. В меньшей степени живые организмы используют серу и фосфор, а остальные элементы еще меньше.
Самый тяжелый элемент из этой главной шестерки – сера, у нее 16 электронов. Давай посмотрим – входит ли сера в число настолько тяжелых элементов, у которых уже нарушается порядок последовательного заполнения подуровней? Просто начнем писать электронную формулу, следя, чтобы количество электронов не перевалило за 16: 1s²2s²2p⁶3s²3p⁶… стоп, перебор – уже 18, а нам надо 16, значит два лишних электрона с 3р-подуровня надо убрать, и мы получим итоговую электронную формулу серы: 1s²2s²2p⁶3s²3p⁴. До 3d-подуровня мы даже не дошли. Жизнь в основном строится из легких, сравнительно простых атомов. Формула 1s²2s²2p⁶3s²3p⁶ описывает атом, у которого на два электрона, а значит и на два протона больше, чем у серы, а значит его порядковый номер – 18. Это инертный газ аргон.
Давай теперь для закрепления знаний еще потренируемся и напишем электронную формулу атома калия – очень важного для жизни элемента. Его номер – 19, на один протон больше, чем у аргона. Значит добавляем один электрон на орбиталь 3d? Нет, не добавляем. Вспоминаем, что электрону энергетически выгоднее разместиться на 4s-орбитали, имеющей самую простую форму, и получаем электронную формулу калия: 1s²2s²2p⁶3s²3p⁶4s¹. Подуровень 3d у калия остается неиспользованным. И формулу последующего атома под номером 20 — кальция – также очень важного для жизни элемента, написать тоже легко: 1s²2s²2p⁶3s²3p⁶4s². И только теперь, когда у кальция сферический подуровень 4s полностью заполнен двумя электронами, в следующем атоме – скандии (для биологии совершенно неважен), имеющем 21 электрон, двадцать первый электрон начнет заполнять подуровень 3d, так что электронная формула скандия выглядит так: 1s²2s²2p⁶3s²3p⁶4s²3d¹.
Ты уже испытываешь чувство удовольствия и гордости от того, что такие, казалось бы, сложные электронные формулы атомов ты теперь понимаешь с легкостью?:) Есть предвкушение разбираться дальше? Надеюсь, что есть, потому что теперь мы можем сформулировать важнейшую закономерность, понимание которой проливает свет на природу химических связей: «правило октета». Эксперименты показывают, что всякий атом изо всех сил стремится иметь комплект завершенных внешних подуровней s+p. При этом незавершенность уровней d, f и т.д. значения не имеет. Почему это так, физики и сами до сих пор это достаточно ясно не понимают.
Завершенным подуровнем называется такой, на котором разместилось столько электронов, сколько это вообще для него возможно по-максимуму. Максимум возможного для s-подуровня — это 2 электрона, и максимум для p-подуровня — 6. Ситуация, когда атом имеет частично заполненные подуровни s и p, для него «некомфортна», т.е. энергетически менее выгодна, чем когда эти подуровни являются завершенными. Именно это и приводит к тому, что атомы вступают между собой во взаимодействие для того, чтобы их электронные s- и p-подуровни как можно больше приближались к состоянию завершенности за счет того, что их внешние электроны обобществляются, становятся общими. В этом и состоит физическая суть химии. Химическое взаимодействие между атомами возможно только потому, что атомам энергетически выгодно обобществить свои внешние электроны, чтобы приблизить состояние своих внешних подуровней к завершенности. Как камень стремится скатиться с горы, так и каждый атом стремится к состоянию с минимальной энергией, а значит — к состоянию, когда на его комплексе внешних (s+p)-подуровней находится ровно 8 электронов. Это правило и называется правилом октета.
И теперь легко понять, почему так называемые «благородные газы» (гелий, неон, аргон, криптон, ксенон и радон) категорически не хотят образовывать никаких химических соединений. Им это просто незачем. У них внешний комплекс (s+p)-подуровней и так уже завершен, полностью заполнен электронами, и эта конфигурация настолько энергетически выгодна, что даже всевозможные и многолетние попытки ученых заставить их вступить в химические реакции терпят неудачу. В последнее время кое-что на этом поприще ученым все-таки удалось, но для этого им пришлось невероятно изворачиваться с помощью очень высоких температур и давлений. И именно поэтому благородные газы не входят в биологические системы, не включаются в биохимию — химически они инертны, ни с кем соединяться не хотят.
Теперь представим себе, что атомы натрия (Na – номер 11) и хлора (Cl – номер 17) встретились. Чтобы понять, что при этом случится, достаточно написать их электронные формулы:
Na: 1s²2s²2p⁶3s¹
Cl: 1s²2s²2p⁶3s²3p⁵
Что мы видим? Мы видим, что у атома натрия на 3s-подуровне болтается один электрон. Ужасно неудобно! Если бы только деть его куда-то, тогда у него снаружи останется 2s²2p⁶ — завершенная пара (s+p)-подуровней — идеально удобно. Но просто вот так взять электрон и выкинуть атом не может, ведь у него в ядре, как ни крути, 11 протонов, а не 10, а значит этот неудобный электрон так и будет сидеть на своем месте, притягиваемый ядром. В то же время мы видим, что атому хлора не хватает ровно одного электрона на 3p-подуровне до достижения состояния завершенности своей внешней s-p-пары. И ему тоже чрезвычайно от этого неуютно. Стоит только ему откуда-то этот электрон взять, как снаружи и у него будет конфигурация 3s²3p⁶. Но он не может его захватить — нечем, ведь в его ядре ровно 17 протонов, а не 18, и нечем ему притянуть еще один электрон. Так вот они и бродят, неудовлетворенные жизнью, пока не встречаются. И что они тогда делают? Конечно, они бросаются в объятья друг друга, и при этом натриевый одиночный внешний электрон становится общим. Фактически он хоть и перетягивается на сторону хлора (позже будет ясно – почему), но и от натрия не отрывается насовсем, поскольку совокупный положительный заряд ядра атома натрия совершенно не собирается его с концами отпускать. Но теперь оба атома вполне удовлетворяются и этой сложившейся ситуацией, образуя соединение NaCl — хлорид натрия, или, проще говоря, поваренную соль.
Те атомы, которые для достижения октета предпочитают преподносить партнеру свои электроны, называются «электронными донорами», ну или просто «донорами». Обычно донорами являются те атомы, у которых совсем мало электронов на внешних подуровнях. А те атомы, которые предпочитают подгребать к себе электроны, называются «электронными акцепторами», или просто «акцепторами» — как правило это те атомы, которым немного не хватает электронов для заполнения s- и p-подуровней. При этом доноры и акцепторы бывают разной силы, то есть одни акцепторы сильнее притягивают к себе электроны, а другие слабее. Одни доноры легче отдают свои электроны, а другие упрямятся, и происходит это в зависимости от:
- расстояния подуровня от ядра атома. Если у донора один электрон болтается где-то на далеких внешних орбиталях, то он уже довольно слабо притягивается ядром — толпы лежащих ниже электронов его экранируют, заслоняют от положительно заряженного ядра. Поэтому чем больше у донора протонов и электронов, то есть чем дальше он расположен в периодической таблице, тем более эффективным донором он является, тем легче он отдает свой этот лишний электрон в совместное пользование.
- количества лишних электронов. Если у атома на внешнем комплексе (s+p)-подуровней болтается лишь один электрон, то атом с максимальной силой старается его отдать, ведь предчувствие комфорта так сильно! Если же электронов больше, то и донорная активность атома снижается.
Аналогично обстоят дела и у акцепторов. Чем ближе к началу периодической таблицы акцептор, тем активней он стремится захватить себе электрон, и тем более сильным акцептором он является. И чем меньше ему нужно электронов, чтобы достичь завершенности, тем активнее он их ищет и хватает. Наиболее активны те акцепторы, которым не хватает лишь одного электрона.
Удобно сравнить фтор и хлор:
фтор: 1s²2s²2p⁵
хлор: 1s²2s²2p⁶3s²3p⁵
Казалось бы — ситуация одинакова, ведь им не хватает на внешней паре (s+p)-подуровней лишь одного электрона, и они будут настойчиво его искать. Но фтор обладает гораздо большей силой, ведь у него намного меньше электронов, экранирующих положительный заряд ядра. Из всех химических элементов фтор — самый мощный акцептор, потому что он яростнее всех стремится заполнить свою пару подуровней (s+p).
Во всех живых существах непрерывно происходит огромное количество химических реакций. Это и реакции разрушения веществ (например, расщепление длинных молекул белка, добытых из сырников и сметаны, на удобные для дальнейшего использования кирпичики-аминокислоты), и созидательные реакции (например, создание органических молекул растениями из углекислого газа и воды). При этом термин «химическая реакция» прочно ассоциируется с неким активным процессом, с бурным выделением разных веществ во все стороны, поэтому иногда бывает удивительно осознавать, что именно химические реакции происходят ежесекундно везде в твоем теле. Еще удивительнее то, что эти реакции заключаются в перегруппировке атомов в составляющих наши тела молекулах. То есть клеточные механизмы при своей работе оперируют именно атомами, соединяя их или разъединяя, и часто ученые при всех достижениях современной науки не могут повторить то, на что эти клеточные механизмы способны.
Если представить себе атом как шарик, в центре которого находится ядро, вокруг которого летают электроны, то не очень понятно — каким образом такие штуки могут соединяться друг с другом. Поэтому стоит рассмотреть другую модель их взаимодействия. Можно представлять электрон не в виде частицы, летающей вокруг ядра, а в виде облака, окутывающего ядро со всех сторон. Это облако может быть толще в каких-то местах и тоньше в других, или оно может сдвигаться на одну сторону атома сильнее, чем на другую, в зависимости от того, что происходит в окрестностях атома. Например, если рядом с этим атомом находится другой атом, имеющий положительный заряд (т.е. ион), то отрицательно заряженное электронное облако будет толще со стороны этого второго атома, ведь положительные и отрицательные электрические заряды притягиваются. А иногда достаточно того, чтобы какой-то соседний атом сильнее притягивал электроны, чем тот, который мы сейчас рассматриваем. Тогда электронное «облако» частично стягивается с рассматриваемого атома и тянется в сторону соседнего, немного «оголяя» положительно заряженное ядро, и за счет этого атом приобретает частичный электрический заряд. Такой заряд по величине меньше, чем единица измерения электрического заряда: это может быть половина величины заряда протона, или треть.
Давай рассмотрим это перетягивание электронного облака на примере молекулы, образованной атомом углерода (С) и кислорода (О) – это так называемая карбонильная группа (или карбонил): >С=О. >С=O. Здесь и далее значок «>» обозначает две свободные связи, которые может образовать атом с какими-то другими атомами.
Мнемоническое правило для запоминания этой группы: «что выбрать из двух почти равных: карбон (углерод) + иль кислород?».
Здесь видно, что между атомами углерода и кислорода стоят две связывающие их палочки — это обозначает, что у них две общих пары электронов, т.е. эти четыре обобществленных электрона принадлежат одновременно обоим атомам. При этом атом кислорода имеет более сильную электроотрицательность, чем атом углерода, то есть кислород сильнее тянет общие электроны на себя, и карбонильная группа поэтому становится полярной молекулой: возле кислорода она имеет частичный отрицательный заряд, а возле углерода — частичный положительный. Эти частичные заряды позволяют карбонильной группе активно участвовать в химических реакциях. Например, положительно заряженный атом углерода начинает тянуть на себя электроны других атомов, и может дотянуть какие-то из них так, что они обобществятся между карбонильной группой и атомом-донором. В результате образуется еще одна связь между атомами, и карбонильная группа включится в часть другой крупной молекулы. В свою очередь и отрицательно заряженный атом кислорода может притягивать к себе протон, и даже захватывать его, пусть не очень устойчиво, ведь у кислорода в данной ситуации все-таки не полноценный, а лишь частичный отрицательный заряд. В такой ситуации карбонильная группа соединяется с протоном, а протон — это ядро атома водорода, так что получается молекула из трех атомов. Получается, что электроны играют роль подвижного «клея» при химических реакциях.
Логично задаться вопросом: в чём причина того, что количество орбиталей только нечетное: 1 на s-уровне, 3 на р-уровне, 5 на d-уровне, 7 на f-уровне?
Ответа никто не знает. Есть разные модели, которые более или менее логично это объясняют, но тем не менее пока что надо просто принимать это как необъяснимое явление природы. Мы ОЧЕНЬ многое не можем объяснить в атомной физике. Почему у электрона именно такой заряд? Почему именно такая масса? Почему то, почему се — на огромное число таких вопросов ответа нет. Возможно, что по крайней мере на часть этих вопросов нам даст ответы теория струн, которая является самой многообещающей в современной фундаментальной физике. Первая проблема тут в том, что развитие теории струн требует невероятно сложной математики — гораздо более сложной, чем та, что требуется для квантовой механики, квантовой хромодинамики. Поэтому в мире есть буквально несколько десятков человек, которые разбираются в ней хорошо на том уровне, который достигнут на данный момент. И есть только один человек уровня Эйнштейна, Бора, Ландау и пр. — это Эдвард Виттен:
И вот всех этих ученых пока что слишком мало, чтобы активно продвигаться вперед. Вторая проблема состоит в том, что экспериментальная физика почти ничего теории струн дать не может — наши технологии бесконечно далеки от того, чтобы достичь параметров, нужных для проверки и развития теории струн. Будем ждать.
Тема №4 «Электроотрицательность, степень окисления и валентность химических элементов»
Оглавление
- Электроотрицательность
- Степень окисления
- Валентность
- Задания для самопроверки
Электроотрицательность
В химии широко применяется понятие электроотрицательности (ЭО) — свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях называют электроотрицательностью. Электроотрицательность лития условно принимается за единицу, ЭО других элементов вычисляют соответственно. Имеется шкала значений ЭО элементов.
Числовые значения ЭО элементов имеют приблизительные значения: это безразмерная величина. Чем выше ЭО элемента, тем ярче проявляются его неметаллические свойства. По ЭО элементы можно записать следующим образом:
F > O > Cl > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs

Наибольшее значение ЭО имеет фтор. Сопоставляя значения ЭО элементов от франция (0,86) до фтора (4,1), легко заметить, что ЭО подчиняется Периодическому закону. В Периодической системе элементов ЭО в периоде растет с увеличением номера элемента (слева направо), а в главных подгруппах — уменьшается (сверху вниз). В периодах по мере увеличения зарядов ядер атомов число электронов на внешнем слое увеличивается, радиус атомов уменьшается, поэтому легкость отдачи электронов уменьшается, ЭО возрастает, следовательно, усиливаются неметаллические свойства.

Разность электроотрицательностей элементов в соединении (ΔX) позволит судить о типе химической связи.
Если величина Δ X = 0 – связь ковалентная неполярная.
При разности электроотрицательностей до 2,0 связь называют ковалентной полярной, например: связь H—F в молекуле фтороводорода HF: Δ X = (3,98 – 2,20) = 1,78
Связи с разностью электроотрицательностей больше 2,0 считаются ионными. Например: связь Na—Cl в соединении NaCl: Δ X = (3,16 – 0,93) = 2,23.
Электроотрицательность зависит от расстояния между ядром и валентными электронами, и от того, насколько валентная оболочка близка к завершенной. Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Фтор является самым электроотрицательным элементом. Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка расположена близко к ядру.
 Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем “добирать” электроны.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов. Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем “добирать” электроны.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом.
 Степень окисления
Степень окисления
Сложные вещества, состоящие из двух химических элементов, называют бинарными (от лат. би — два), или двухэлементными (NaCl, HCl). В случае ионной связи в молекуле NaCl атом натрия передает свой внешний электрон атому хлора и превращается при этом в ион с зарядом +1, а атом хлора принимает электрон и превращается в ион с зарядом —1. Схематически процесс превращения атомов в ионы можно изобразить так:

При химическом взаимодействии в молекуле HCl общая электронная пара смещается в сторону более электроотрицательного атома. Например, , т. е. электрон не полностью перейдет от атома водорода к атому хлора, а частично, обусловливая тем самым частичный заряд атомов δ: Н+0.18Сl-0.18. Если же представить, что и в молекуле HCl, как и в хлориде NaCl, электрон полностью перешел от атома водорода к атому хлора, то они получили бы заряды +1 и -1:
, т. е. электрон не полностью перейдет от атома водорода к атому хлора, а частично, обусловливая тем самым частичный заряд атомов δ: Н+0.18Сl-0.18. Если же представить, что и в молекуле HCl, как и в хлориде NaCl, электрон полностью перешел от атома водорода к атому хлора, то они получили бы заряды +1 и -1:

Такие условные заряды называют степенью окисления. При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных атомов.
Степень окисления — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов. Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно ставится над символом элемента сверху, например:

Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов или к которым смещены общие электронные пары, т. е. атомы более электроотрицательных элементов. Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, т. е. атомы менее электроотрицательных элементов. Нулевое значение степени окисления имеют атомы в молекулах простых веществ и атомы в свободном состоянии, например:

В соединениях суммарная степень окисления всегда равна нулю.







 Степень окисления
Степень окисления