Элементы жизни. Вода — Индикатор
Молекулы, в которых много ковалентных полярных связей, тоже прекрасно взаимодействуют с водой — в первую очередь потому, что образуют с ней водородные связи, «цепляясь» за молекулы воды своими частичными зарядами. Такие вещества хорошо растворяются в воде и называются гидрофильными («любящими воду»). К гидрофильным веществам относятся, например, спирты и углеводы. Каждый знает, что столовый сахар (а это типичный углевод) растворяется в воде очень хорошо. То же самое можно сказать и о спиртах, например об этиловом спирте — основе алкогольных напитков. Именно растворам спирта в воде была посвящена знаменитая диссертация Дмитрия Ивановича Менделеева.
Правда, рецепта водки Менделеев, вопреки распространенной легенде, не разрабатывал. Его интересовало происходящее при растворении взаимодействие молекул спирта и воды — тот самый процесс, который мы только что назвали гидратацией.
Менделеев убедительно показал, что растворение — это не физическое явление (простое смешивание), а химическое (включающее образование новых межмолекулярных связей). Тогда получается, что раствор — это, по сути, новое вещество.
Как правило, любое наугад взятое органическое соединение будет растворяться в воде тем лучше, чем больше в нем атомов кислорода. Это понятно: именно вокруг атомов кислорода обычно образуются водородные связи. Например, молекула глюкозы (C6H12O6, шесть атомов кислорода!) в этом отношении просто идеальна. Как раз поэтому сахара, и глюкозу в том числе, очень удобно использовать в роли быстро усваивающихся питательных веществ.
Молекулы, в которых все связи неполярные, взаимодействуют с водой гораздо слабее, чем друг с другом. Вещества, состоящие из таких молекул, плохо растворяются в воде и называются гидрофобными («боящимися воды»). Типичные гидрофобные соединения — углеводороды. Как мы знаем, они по определению состоят только из углерода и водорода, связи между которыми неполярны. Если бросить в воду парафин (смесь твердых углеводородов, из которой делают свечи), он и не подумает там растворяться — ни при каких условиях.
А если налить в воду бензин (смесь жидких углеводородов, которая служит моторным топливом), то он, скорее всего, отслоится от нее, образовав четкую поверхность раздела. Вода как бы «выталкивает» эти вещества.
Если в формуле органического соединения есть кислород, то оно, скорее всего, гидрофильное, разве что там присутствует какая-нибудь совсем уж огромная углеводородная цепочка.
Гидрофильными бывают и некоторые бескислородные органические вещества — например, амины. В биохимии значение различий между гидрофильными и гидрофобными веществами без преувеличения грандиозно. Многие детали устройства клеток без учета этих различий просто невозможно понять. А все потому, что земная жизнь — водная.
Талассогены
А могут ли подойти для жизни какие-нибудь другие растворители, кроме воды? Ответ — да. Например, углекислота (ее формула O=C=O, или просто CO2) знакома людям прежде всего в виде углекислого газа, который мы выдыхаем, но она может и замерзать, образуя так называемый сухой лед. Проблема в том, что при нагревании в условиях, характерных для Земли, сухой лед сразу испаряется в газ, минуя жидкую фазу. Потому мы и не видим в быту жидкой углекислоты. Однако при более высоких давлениях, чем наше атмосферное, углекислота может становиться жидкостью. И тогда она представляет собой хороший гидрофильный растворитель, аналогичный по свойствам воде (и легко смешивающийся с ней), в котором успешно идут многие биохимические реакции.
В этом растворителе могут жить даже земные микробы. Например, на дне Окинавского желоба в Восточно-Китайском море исследователи-океанологи нашли целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии.
Некоторые исследователи считают, что океаны жидкой углекислоты могут существовать на так называемых суперземлях — планетах с массой, в несколько раз превосходящей массу Земли. Суперземли — довольно многочисленная категория экзопланет, и возможность жизни на них сейчас активно обсуждается.
Другой перспективный кандидат на роль вмещающей среды для жизни — аммиак (NH3). Это гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом (их разница в электроотрицательности для этого вполне достаточна, см. рис. 2). Неудивительно, что по своим физико-химическим свойствам аммиак напоминает воду. На более холодных планетах, чем Земля, он находится в жидком состоянии и вполне может быть основой жизни. Теоретически возможно существование холодных землеподобных планет с аммиачными океанами. Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть серьезные сомнения (см. главу 1), то углеродную жизнь, использующую не воду, а какой-нибудь другой растворитель, представить себе гораздо легче. Никакие фундаментальные законы не запрещают ей существовать.
Просто так уж сложилось, что на нашей планете из всех растворителей преобладает вода, ну а от добра добра не ищут, и земной жизни осталось лишь развиваться в этих относительно благоприятных условиях.
Еще один гидрофильный растворитель, в котором теоретически допускают возможность жизни, — метиловый спирт, или метанол (CH3OH). Для человека это страшный яд, но тут все зависит от настройки биохимических систем. Вообще-то никакие законы природы не мешают «сконструировать» живой организм, для которого метанол будет совершенно безобиден, а то и полезен. Метанол — одно из самых простых органических веществ, и неудивительно, что образуется он очень легко. Его много в космосе, причем не только на планетах, но и в межзвездных газопылевых облаках. Некоторые ученые осмеливаются предполагать, что именно синтез метанола был ключевым химическим звеном на пути к возникновению земной жизни. Метанол очень гидрофилен и прекрасно образует водородные связи, примерно такие же, как в воде. Собственно, это и делает его хорошим гидрофильным растворителем. Как и аммиак, метанол замерзает при гораздо более низкой температуре, чем вода, и в принципе может быть средой для жизни на более холодных планетах, чем Земля. В Солнечной системе метанола хватает, например на Тритоне, крупнейшем спутнике Нептуна.
определение, образование, свойства и применение
Вода — это необыкновенная субстанция, которая не перестает нас удивлять. Она основной компонент планеты, вода необходима для жизни всего живого. Люди могут выдержать без воды только несколько дней. Если не восстановить вовремя ее потери в организме, это верная смерть. Поэтому важно научиться разумно, тратить ее и знать, что же такое вода.
Химические названия
Почему же воду назвали водой? Слово «вода» происходит от древнегерманского «мокрый, текучий». В химии могут встречаться разные названия этого соединения. Самые распространенные – гидроксид водорода и окись водорода. Также в химической литературе ее называют:
- монооксид дигидрофосфата;
- гидроксильная кислота;
- дигидромонооксид
- оксидан

Образование воды
Многих интересует, какая вода находится в реках, морях, под землей. Образовавшаяся миллиарды лет назад вода сконцентрировалась в океанах. Из океанов она испаряется и поднимается, где образуются облака. После долгого путешествия она возвращается на землю в виде осадков. Вода собирается и возвращается через реки обратно в море. Часть просачивается в почву и попадает в грунтовые воды. Там формируются новые источники, которые текут в море.
В более холодном климате вода остается на ледниках, которые очень медленно, стекают к более низким высотам, где и тают. В полярных регионах этот механизм скольжения настолько медленный, что в ледниках можно найти воду, попавшую на поверхность Земли десятки тысяч лет назад. Вот откуда берется в природе вода.
Свойства
Влияние воды на жизнь на земле огромное. Это среда обитания для многих организмов. Она является хорошим растворителем не только для солей, но и для многих других веществ. Например, питательные соли присутствуют в почве в виде ионов, то есть в растворенном виде. Только в таком виде растения могут поглощать их через корни. Поэтому не случайно вода— это источник жизни на земле.
Вода является важным источником химических и биохимических реакций, например, для фотосинтеза. Это заметно, когда растение увядает из-за потери воды, а листья и цветы опадают. Не зря говорят, что вода—это главный источник жизни.

Физические свойства
Что мы все знаем о воде? То, что она состоит из одного атома кислорода и двух атомов водорода, знают все, а вот о том что они притягиваются, друг к другу водородной мостиковой связью знают не все. Эта связь объясняет ее основные свойства.
- Н2О имеет высокое поверхностное натяжение, то есть тенденцию принимать сферический объем.
- Другим свойством является капиллярность. Молекула h3O способна перемещаться в очень узких пространствах.
- Удельная теплоемкость у нее примерно в 4 раза больше, чем у воздуха. Это определяет устойчивость к изменениям температуры.
- Плотность воды увеличивается с понижением температуры, примерно до 4 С. Ниже этого порога плотность уменьшается.
- Она обладает минимальной вязкостью при высоких давлениях. Поэтому, чем больше давление, тем легче ей проникать.
Агрегатные состояния
В нормальных условиях вода, является жидкостью. Это единственное известное вещество, которое существует в природе во всех трех классических состояниях материи: жидком, твердом, газообразном.
Кстати, термин вода используется для жидкого агрегатного состояния. В твердом, то есть в замороженном состоянии, она называется льдом, в газообразном состоянии— водяным паром или просто паром. Существует порог, где при определенных температурах и равновесного давления три состояния могут сосуществовать одновременно.

Оптические свойства
Когда свет пересекает границу раздела вода-воздух, полное отражение происходит под углом 49 град. Это означает, что световые лучи, попадающие на граничную поверхность, не излучаются из воды, а отражаются.
Преломление света приводит к оптическим иллюзиям. Поэтому под водой объекты видятся не в том месте, где они находятся на самом деле. То же самое происходит если смотреть через воду на воздух. Светопропускная ценность воды обеспечивает присутствие в ней водорослей и растений, которым необходим свет для жизни. Длинноволновый (красный) свет поглощается сильнее, чем коротковолновый (синий) свет.
Изотопные модификации
Молекулы воды состоят из разных изотопов кислорода и водорода, каждый из которых встречается в разных концентрациях. В определенных процессах, таких как образование осадков и фазовые переходы, происходит фракционирование изотопов, то есть Н2О меняет свой изотопный состав. В зависимости от условий окружающей среды и исходного состава это приводит к определенным изотопным сигналам, которые могут выступать в качестве своего рода отпечатка пальца для различных процессов и областей происхождения. Эта методология используется в гидрогеологии и палеоклиматологии.
Химические свойства
Вода амфотерна, в зависимости от окружающей среды, может действовать как кислота и основание. В водных растворах сильные кислоты и сильные основания полностью диссоциируют на ионы H 3 O + и O H. Это называется выравнивающим эффектом воды. Чтобы иметь возможность различать очень сильные кислоты по кислотности, константы равновесия определяют в неводных растворах, и переносят в растворитель воду.

Многих интересует, вода является органическим веществом или неорганическим. С точки зрения химии, она относится к неорганическим веществам. Поскольку, в органики должен присутствовать углерод, а в воде его нет.
Волновая функция основного состояния воды
Под водой скорость звука в 4,4 раза выше, чем у поверхности, и составляет 1483 м /с при температуре 20 С. Поэтому пространственное восприятие звука под водой сильно затруднено, мозг просто не успевает обработать информацию. Важно знать, что звук под водой не только проходит быстрее, но также в большей степени чем в воздухе зависит от частоты. Поэтому глубокие частоты, такие как звуки больших морских двигателей, часто могут быть услышаны драйверами на расстоянии нескольких километров.
В природе
Вода в природе везде. Реки и океаны, облака на небе, к этому добавляются грунтовые воды и те, которые постоянно хранятся в почве и обеспечивает основу для ее плодородия. Вода в природе — это жизнь, без воды все ничто. Она— основа плодородия, без нее не было бы ни растений, ни пищи.
Атмосферные осадки

Вода за пределами земли
Вода за пределами Земли на одних небесных телах находится в твердом состоянии (лед), а на других как водяной пар. В виде льда, она была обнаружена в кометах («грязные снежки»), на Марсе и на некоторых других внешних планетах. Только кольца Сатурна содержат примерно в 20-30 раз больше воды, чем Земля. Доказательства присутствия льда в метеоритных кратерах вблизи полюсов можно найти даже на Меркурии, планете, ближайшей к Солнцу.
Биологическая роль
Вода является источником здоровой жизни и очень важна для организма. Как часть крови, она снабжает нас кислородом и питательными веществами. В то же время токсины транспортируются через кровоток в почки, удаляются из организма. Вода регулирует температуру тела. Если температура воздуха высокая, человек потеет, и тело охлаждается. Однако, если пот не выделяется, то поднимается температура и самочувствие ухудшается.
Многие витамины, молекулы сахара могут использоваться организмом только через воду. Органические вещества расщепляются в воде и транспортируются к нужным органам. Кроме того, она является важным компонентом клеток и тканей. Например, мозг на 90 % состоит из жидкости.
Применение
Вода используется во всех сферах жизни. Люди пьют ее, готовят пищу, поливают растения. На гидроэлектростанциях вода используется, как источник энергии. Она также необходима на фабриках, например, для производства и переработки бумаги. Кстати, для производства одного листа бумаги требуется 10 литров воды! При тушении пожаров без нее не обойтись. Сельское хозяйство было бы невозможно без Н2О.

Многие используют ее в качестве лекарства от разных болезней. Особенно много целебных свойств, приписывают органической воде.
Исследования
Вода существует миллиарды лет, и, казалось бы, что о ней знают все, но она все равно остается тайной. Создаются целые институты, которые пытаются узнать, как сделать аналог воды, откуда она появилась на Земле и в космосе. Они изучают ее влияние на жизнь, ландшафт, природу.
Происхождение воды на планете
Многих интересует, откуда все-таки взялась вода. Она родилась четыре с половиной миллиарда лет назад в глубинах вселенной. Земля, еще не полностью сформированная, состояла в основном из вулканов. Газы, богатые водяным паром, выделялись в атмосферу, там образовывались облака. За тысячелетия земля остыла, и пары, сгущаясь, падали обратно на земную кору в виде дождя. Также формированию этого очень важного источника жизни, способствовали падающие кометы, состоящие в основном изо льда и фрагментов породы. Это явление способствовало образованию рек, озер и океанов, где миллионы лет спустя появились бы первые формы жизни.
Гидрология
Понять, как вода взаимодействует с атмосферой, как влияет на жизнедеятельность, помогает наука гидрология. Она изучает, какая вода находится в водной оболочке Земли. Гидрология помогает понять, как рационально управлять водными объектами. Она составляет прогнозы состояния водных ресурсов, и дает им оценку.
Гидрогеология
Наука, которая изучает подземные воды, гидрогеохимию называется гидрогеология. Гидрогеологи занимаются поиском новых подземных водных источников, изучают, как сделать воду из подземных источников полезной для мелиорации, водоснабжения, природного ландшафта. Данные полученные учеными помогают снизить негативные влияния деятельности людей, на подземные водные источники.
Теперь вы знаете всю правду о воде, и понимаете, насколько важно бережно к ней относится. Ведь если пропадет вода, то не станет и нас.
Тритиевая вода — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 июня 2018; проверки требуют 5 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 июня 2018; проверки требуют 5 правок.Три́тиевая вода́ (сверхтяжёлая вода) — вода, в молекулах которой атомы протия (лёгкого водорода) замещены атомами трития (тяжёлого радиоактивного изотопа водорода). В чистой форме называется оксидом трития (T2O или 3H2O) или супертяжёлой водой. Из-за собственной радиоактивности чистый T2O имеет высокую коррозионную активность — при спонтанном бета-распаде трития в 3He происходит выделение атомарного кислорода. Кроме того из-за собственной радиоактивности происходит радиолиз воды с выделением трития и кислорода. Удельная объёмная активность тяжёлой воды составляет 2650 Ки/мл, поэтому она не может быть получена в больших количествах в неразбавленном виде. Тритиевая вода, участвуя в метаболизме почти одинаковым образом с обычной водой, обладает высокой радиотоксичностью.
Для T2O температура плавления — 274,70 К (+1,25 °C), тройная точка — 277,64 К (+4,49 °C), температура кипения +101,6 °C, плотность — 1,21459 г/см³[1]. В других источниках данные о температуре плавления и кипения несколько отличаются.[2]
Тритиевая вода (HTO) в следовых количествах содержится в обычной воде, однако распределение её неравномерно.
Тритиевую (сверхтяжёлую) воду не следует путать с дейтериевой (тяжёлой) водой.
Разновидности тритиевой воды HTO, DTO и Т2О применяются в качестве радиоактивных индикаторов влагонепроницаемости вещества.
Тритиевая вода также применяется как меченое соединение для исследования водного обмена. Кроме того, тритиевая вода используется как исходное вещество для синтеза других производных трития и для изотопного обмена атомов водорода.
- ↑ Тритий // Химическая энциклопедия. — Т. 5. — М.: Научное издательство «Большая Российская энциклопедия». — 1998.
- ↑ http://www.chemport.ru/chemical_substance_1311.html — «Физические величины» под ред. Григорьева И. С., Мейлихова Е. З., М.:Энергоатомиздат 1991 стр. 297
Обсуждение:Вода — Википедия
Исследования Батмангхелиджа[править код]
Добавить бы исследования Ферейдуна Батмангхелиджа о воде. 109.169.197.34 07:51, 18 июня 2010 (UTC) Никита Демидов
- У воды много «грехов» и «достоинств». Трудно отделить истину от шарлатанства. Я не добавил бы. Спорно и нет авторитетных источников… Война будет… Со всем к Вам уважением Василий Шаломов 21:04, 17 июня 2011 (UTC)
Ведь радиус атома водорода д.б. больше, чем у кислорода? Почему картинка вводит в заблуждение? infovarius 09:33, 24 июля 2008 (UTC)
…странно, почему радиус атома водорода, состоящего из одного протона д.б. больше радиуса атома кислорода, состоящего из 16 протонов и нейтронов ? InSpiritUS 19:26, 5 марта 2010 (UTC)
- Вот именно поэтому атом кислорода более ужат — ядро в 16 раз сильнее притягивает электронные облака. infovarius 19:38, 13 марта 2010 (UTC)
- А, вот, и не подерётесь. :=) Смотрим, что даёт нам наша же ВП: Радиус атома кислорода — 60 (48) пм, радиус атома водорода — 79 пм. Теперь осталось докопаться — правильны ли эти числа… —= APh =— 01:51, 20 июня 2010 (UTC)
- На данный момент информация из нашей ВП следующая.
- Кислород: ковалентный радиус 73 пм, эфф. радиус — 60 (48) пм;
- водород: ковалентный радиус 32 пм, эфф. радиус — 53 пм.
- Значит, атомы водорода должны по сути напоминать «перевёрнутые миски» с диаметром немного меньше оного для кислородного «шарика» (радиусы отличаются ненамного). Вроде логично — у кислорода сжатию препятствует предыдущий эл. уровень, к тому же, в конце периода р-орбитали существенно «выше» s-орбиталей, насколько я понимаю. —Esmu Igors 18:23, 5 июня 2011 (UTC)
- В чём разница между ковалентным и эффективным радиусом? —infovarius 18:18, 11 сентября 2011 (UTC)
- Про ковалентный радиус в википедии написано, а вот про эффективный (для атома) не нашёл.—Александр Русский (Чем могу помочь?)ПИ 04:45, 12 сентября 2011 (UTC)
- Эффективный радиус атома (также радиус Ван-дер-Ваальса) – минимальное расстояние, на которое может другой атом сблизиться с данным атомом без образования химической связи. В общем-то, аналогично эффективному радиусу молекулы, даже более корректно, наверное (потому что атом правда «круглый»). Про это точно есть в «Органической химии» О. Я. Нейланда (М.:»ВШ», 1990), скорее всего, и ещё где-нибудь в подобной литературе. —Esmu Igors 19:42, 27 декабря 2011 (UTC)
- Что из этого следует? Правильный ли рисунок или водород надо побольше рисовать? —infovarius 14:57, 25 февраля 2012 (UTC)
- Эффективный радиус атома (также радиус Ван-дер-Ваальса) – минимальное расстояние, на которое может другой атом сблизиться с данным атомом без образования химической связи. В общем-то, аналогично эффективному радиусу молекулы, даже более корректно, наверное (потому что атом правда «круглый»). Про это точно есть в «Органической химии» О. Я. Нейланда (М.:»ВШ», 1990), скорее всего, и ещё где-нибудь в подобной литературе. —Esmu Igors 19:42, 27 декабря 2011 (UTC)
- Про ковалентный радиус в википедии написано, а вот про эффективный (для атома) не нашёл.—Александр Русский (Чем могу помочь?)ПИ 04:45, 12 сентября 2011 (UTC)
Не стал править статью, но ссылку поставил. Сам не во всём уверен. Но, если поискать источники… может и есть доля правды. Факты то интересные. По крайней мере, такую формулу H1.5O нигде не встречал. И там о воде ещё очень много… —Василий Шаломов 01:48, 10 января 2009 (UTC)
- H1.5O — это условная формула для обозначения «виртуальных» химических связей, сугубо условное понятие вроде «1,5 землекопа». —95.37.164.114 19:51, 24 июня 2009 (UTC)
Хорошо было бы еще поместить фазовую диаграмму — где все там точки: тройные критические и прочие.. 159.93.74.121 09:48, 19 февраля 2009 (UTC)
Вода и вращение Земли[править код]
Вода играет ключевую роль во вращении Земли. Испаряющаяся от тепла Солнца вода переносит электроны Земли в воздух. Приэкваториальные инерционные ветры пассаты переносят теплые пары воды с электронами на запад. Конденсируясь в средних широтах с осадками и молниями лавины электронов идут на восток, создают мощнейшие морские течения, ветры, плавят магму и этот ток электронов крутит Землю, создавая магнитное поле. Практически все морские течения идут с запада на восток, то есть против сил инерции (особенно это заметно в проливе Дрейка), западные берега более обрывистые, подверженные волновой эрозии, а восточные берега — тихие гавани. —114.78.14.66 08:51, 8 сентября 2009 (UTC)
- Резка материалов (добавить?)
Достаточно распространены установки по резке водой различных материалов: от резины до стали. Вода выходит под давлением несколько тыс. атмосфер и режет материал значительной . — высказ.уч. Камень доб.в 21:28, 25 апреля 2009 (UTC)
- Можете начать таким образом секцию «Применения воды», подобно en:Water#Human_uses. — Yrogirgtalk 05:42, 26 апреля 2009 (UTC)
Физические свойства -> Теплоемкость[править код]
Предлагаю добавить теплоемкости в физические свойства:
(-60 °С ) 1,64 кДж/кг*К
(-20 °С) 2,01
(-10°С) 2,22
Лед (0°С) 2.11
Вода чистая (0°С) 4,218
(10°С) 4,192
(20°С) 4,182
(40°С) 4,178
(60°С) 4,184
(80°С) 4,196
(100°С) 4,216
92.126.214.168 17:14, 6 июня 2009 (UTC)my_dmitry
присоединяюсь. + к этому неплохо график для наглядного представления. —91.214.50.99 17:44, 14 марта 2011 (UTC)
Предлагаю убрать ерунду[править код]
Предлагаю убрать из раздела Физические свойства нижеприведенную информацию, данную без каких-либо ссылок на источники.
Мир до сих пор исследуют воду. Ученые сделали вывод, что Вода — это не только h3O, но и источник информации. На данный момент ученые не смогли прочесть информацию, но уже очень глубоко приблизились к истине. Исследователи заморозили воду во время звучания разных слов и фраз:любовь, благодарность, спасибо, ты мне противен. При увеличении твердой воды в [микроскоп|микроскопе] они заметили, что у каждого слова разные формы молекул замороженной воды. Самая правильная форма была в словах лобовь и благодарность, а на фразу «ты мне противен» она даже сменила цвет.
Rv21 18:31, 10 октября 2009 (UTC)
- Кто-то пропустил. Убирайте, конечно. Partyzan XXI 06:05, 11 октября 2009 (UTC)
- Это исследования одного японца. Сам в это не верю (но быть может пока), но хотелось бы поместить какой-нибудь официальный отклик на это российских учёных. А то у нас уже два профессора упомянули об этом в своих лекциях. Хотелось бы прояснить вопрос. —Esmu Igors 18:04, 5 июня 2011 (UTC)
В атмосфере только 2% воды находится в видимом состоянии (облака, туман), 98% содержащейся в атмосфере воды находится в невидимом состоянии (пар). — Эта реплика добавлена участником 178.49.129.17 (о · в) 02:30, 2 апреля 2011 (UTC)
В статье, в таблице «Атмосферные осадки», в столбце «Свободно-парящие структуры», одним из подпунктов является «Морская пена». Можно узнать откуда взята информация о том, что «морская пена» относится к атмосферным осадкам, а так же к свободно-парящим структурам, наравне с облаками и туманом? Sea 13:25, 5 февраля 2010 (UTC)
Изотопные модификации воды[править код]
…цитата «И кислород, и водород имеют природные и искусственные изотопы»
Кислород и водород существуют в виде изотопов, одни из них более распространены (16O, 1H), другие встречаются реже (17O, 18O, 2H, 3H ), но все они существую независимо от человеческой деятельности, следовательно природны.
…цитата «В зависимости от типа изотопов, входящих в молекулу, выделяют следующие виды воды: Лёгкая вода (просто вода), Тяжёлая вода (дейтериевая) и Сверхтяжёлая вода(тритиевая).»
Просто вода — смесь легкой воды, состоящей из изотопов кислорода и водорода минимальной массы (16O, 1H), и тяжелой воды, имеющей в составе молекул изотопы кислорода и водорода большей массы (17O, 18O, 2H, 3H). Тяжелая составляющая (например) океанской воды достигает почти 3 грамм на килограмм. —InSpiritUS 19:40, 5 марта 2010 (UTC)
- Ответ: Не везде и не всегда! Здесь имелось ввиду приобладание легкой воды. Одна молекула из всего стакана обязательно будет дейтериевой, как ее не чисть. 92.241.226.36 15:06, 3 мая 2011 (UTC)
Было бы правильным, дополнить статью сведениями о способах получения воды из её составляющих.91.103.79.60 19:25, 5 ноября 2010 (UTC) Михаил
- Ответ: Сжиганием гремучего газа. Но это скорее микровзрывики будут. Из составляющих многие вещества довольно просто получить! 92.241.226.36 15:02, 3 мая 2011 (UTC)
- Тогда хотел бы перефразировать. Откуда она (вода), или история её возникновения не только на Земле, но и в космосе? — Эта реплика добавлена участником 91.103.79.52 (о · в) 16:20, 31 мая 2011 (UTC) Михаил
- Ответ: Солнце испускает поток свободных электронов. Земля захватывает часть этого потока своей магнитосферой и синтезирует на их основе молекулы воды, азота, кислорода, углекислого газа и инертных газов и этим непрерывно пополняет атмосферу и гидросферу планеты.^^^^
- Ответ: Сжиганием гремучего газа. Но это скорее микровзрывики будут. Из составляющих многие вещества довольно просто получить! 92.241.226.36 15:02, 3 мая 2011 (UTC)
фильм «Великая тайна воды»[править код]
Добавить инфу о мракобесах: Может все-таки можно куда-нибудь засунуть буквально пару слов, о том, что фильм «Великая тайна воды» — чушь, а то люди верят же. Там говорят о каких-то опытах и прочей белиберде, но некоторые вещи просто абсурдны. Я считаю, что надо предупредить, что в качестве самообразования лучше выбрать что-нибудь другое. RRRik 20:00, 24 января 2011 (UTC) RRRik
- АИ подтверждающие или отрицающие это? —Freezeman 16:46, 14 декабря 2011 (UTC)
- надо просто указать ссылку сюда: Вода_(фильм,_2006) — задача искать АИ по теме мракобесия или авторитетности уже относится к той статье. —speakus 16:52, 21 декабря 2015 (UTC)
аккумуляторная серная кислота содержит ≈75% воды
— Неправильная формулировка
Аккумуляторная батарея содержит 25%-й раствор серной кислоты в воде
Исправлю
— Эта реплика добавлена участником Aksmen (о · в) 13:21, 9 февраля 2011 (UTC)
что-то не нашёл информации о температуре, при которой вода разлагается на составляющие. — Эта реплика добавлена участником 91.214.50.99 (о · в) 17:46, 14 марта 2011 (UTC)
- Выше 900 градусов по Цельсию практически все молекулы воды уже диссоциированы. — Эта реплика добавлена участником 178.49.129.17 (о · в) 02:26, 2 апреля 2011 (UTC)
- Вообще-то, при атмосферном давлении и температуре в 2500K, степень диссоциации < 10%. Источник — учебник химии, автора не помню (у меня сохранилась только одна страница с этим графиком). 80.250.160.211 19:02, 6 апреля 2011 (UTC)
Предлагается убрать абзац, если не будет найден источник[править код]
Следующий абзац:
«Известно, что тяжёлая вода не поддерживает жизни, то есть, большинство живых организмов (за исключением некоторых микроорганизмов и грибов) в такой воде умирает[источник не указан 68 дней].»
выглядит довольно бредово, хим свойства соединений не зависят от конкретного изотопного состава. Если нет источника — предлагается удалить.
83.242.247.90 11:14, 18 марта 2011 (UTC)
Отбой 🙂 в статье «Тяжелая вода» есть ссылки на достоверные источники, можно сюда их указать тоже.
11:30, 18 марта 2011 (UTC)
- Абзац закомментировал пока, т. к. даже в ссылке приведённой уже видно, что там не совсем так написано. Данный абзац слишком тенденциозен. Вот, в статье «Тяжёлая вода» более корректно и нейтрально написано. Надо бы переписать этот абзац. —= APh =— 19:22, 6 октября 2012 (UTC)
- Подправил. Если устраивает, раскомментируйте Нимтар 17:33, 9 октября 2012 (UTC)
- Мои извинения, правку пришлось отменить,
потому что есть сработки поисковых машин на текст (см. ВП:КОПИВИО). Кроме того, в абстракте есть «Algae and bacteria can adapt to grow in 100 % D2O and can serve as sources of a large number of deuterated». В самой статье — «Although high D2O concentrations are certainly toxic to animals, small amounts are not. It is widely used to measure water space in animals, including humans of all ages (Coward 1979), and can be used as a tracer to measure compliance in drug trials (Rodewald et al. 1989). Commonly, 0.1 mL per killogram body water is swallowed, that is 5-7 mL for an adult human. This increases the D2O content in the blood from 150 to about 300 ppm, which subsequently decreases to the normal level with a half-life of a few days. No adverse effects have been reported from many such tests (Coward 1979). To reach a level of 10 % in body water, which might or might not be toxic, a 70-kg man (with about 50 L body water) would have to drink rapidly 5 L of pure D2O. This seems unlikely to occur either by intent or by accident. D2O concentrations as high as 23 % in human fluids were found not to be toxic over short time periods (Wallace et al. 1995).», таким образом правка в полной мере источником не подтверждается. Как-то так. —Van Helsing 13:46, 18 октября 2012 (UTC)- Эм, научились пользоваться кнопкой «отмена» и поиском и рады? Исправили б что не так, раз изучали источник. Впрочем, может быть и сам сделаю на днях. («Сработками поисковых машин», извините, насмешили) Нимтар 14:29, 18 октября 2012 (UTC)
- Проблема в том, что нет возможности написать что-то кратко и емко, типа «D2O токсичное вещество, но используется в фармакологии». Больше информации можно писать только в статью Тяжелая вода, а здесь от этих изложений начнется перекос взвешенности изложения. —Van Helsing 14:40, 18 октября 2012 (UTC)
- Да, 1000 извинений, текст же из Тяжёлая вода#Биологическая роль и физиологическое воздействие, поэтому и сработки на него есть ) Дезавуировал, сорри. —Van Helsing 14:43, 18 октября 2012 (UTC)
- Эм, научились пользоваться кнопкой «отмена» и поиском и рады? Исправили б что не так, раз изучали источник. Впрочем, может быть и сам сделаю на днях. («Сработками поисковых машин», извините, насмешили) Нимтар 14:29, 18 октября 2012 (UTC)
- Мои извинения, правку пришлось отменить,
- Подправил. Если устраивает, раскомментируйте Нимтар 17:33, 9 октября 2012 (UTC)
Зачем здесь нерусские названия? Нимтар 15:09, 25 июля 2011 (UTC) уберу оксидан. А по поводу hydroxic acid считаю, что можно перевести как водородная кислота Нимтар 18:38, 26 июля 2011 (UTC)
- Оксидан — это моющее средство. Не уверен, что можно принять за название воды! Василий Шаломов 20:59, 13 ноября 2011 (UTC)
В трех агрегатных состояниях?..[править код]
Вода единственное вещество, которое может находиться на земле в трех агрегатных состояниях? Здесь или не верно сформулировано или вообще бред!!! Василий Шаломов 20:52, 13 ноября 2011 (UTC)
- Ну да, похоже, написавший погорячился. Разве не обладает такими свойствами, например, сера? RN3AOC 22:01, 13 ноября 2011 (UTC)
«В нормальных атмосферных условиях вода закипает при температуре +98,9°С и с ростом давления эта температура растёт…» — это в каком смысле? Нормальные условия — это давление одна атмосфера и температура 0 градусов Цельсия. То есть нужно написать «при нормальном давлении» и всё же 100 градусов. Румата Эсторский 06:43, 10 апреля 2012 (UTC)
- Ну да, там вообще путаница, непонятно, почему за нормальные условия приняты не 760 мм.рт.ст. как обычно, а 731 мм.рт.ст. (при которых она кипит действительно при 98,9С). Надо бы поправить, да и источник слабоватый, А. К. Ларионов Занимательная гидрогеология. Можно взять, например, П.И.Воскресенский. Техника лабораторных работ. 9-е изд. Л.: «Химия», 1970. С. 696-697, там есть таблица температур кипения. Доберусь до дома проверить ссылку — исправлю. Пока просто напишу про нормальное атм. давление. RN3AOC 11:35, 10 апреля 2012 (UTC)
- upd: Там вообще эту фразу убрать нужно — это повтор, в начале раздела уже есть. RN3AOC 11:38, 10 апреля 2012 (UTC)
и фазовых[править код]
шведским ученым удалось наблюдать образование водных тетраэдров, что говорит о новом фазовом состоянии этого вещества. [1]
Откуда взялась? на Земле[править код]
Как появилась вода на Земле и когда? 85.26.165.195 10:51, 14 декабря 2011 (UTC)
- Точно неизвестно )) —Freezeman 16:43, 14 декабря 2011 (UTC)
- Катархей время, из которого осадочные породы не известны по причине отсутствия тогда гидросферы и кислородной атмосферы.
- Эоархе́й — геологическая эра, часть архея. Охватывает временной период от 4 до 3,6 миллиарда лет назад. Нахождение эры между Катархеем и Палеоархейской эрой. Возможно, прокариоты появились уже в конце этой эры.
- Предположительно, зарождение жизни на Земле произошло в водной среде.
Видимо где-то тогда? Старше 4 млрд лет… Gradmir 18:15, 15 декабря 2011 (UTC)
Интересные факты о воде[править код]
В одном из пунктов этого раздела написано, что свинец расширяется при переходе из жидкой фазы в твёрдую. Я уверен, что здесь ошибка. В справочниках Свойства элементов под ред. М. Е. Дрица и Теплофизические свойства материалов В. С. Чиркин показано, что при плавлении плотность свинца уменьшается на 3,44%. Так же, там представлена зависимость плотности свинца от температуры, из которой видно, что при повышении температуры от точки плавления (свинца) плотность уменьшается (для примера при 450о С плотность равна 10,536 г/см3, а при температуре 750о С — 10,168 г/см3). Следовательно, при переходе свинца из жидкой фазы в твёрдую будет происходить усадка свинца. 82.193.102.143 20:33, 21 января 2012 (UTC)
- Свинец можно смело убирать, так как ни в каком АИ не написано, что свинец при застывании увеличивается в объёме. Плюс, еще сам неоднократно плавил свинец, и при застывании наблюдается явная усадка (особенно когда затвердевает в формочке с малым поперечным сечением и большой высотой).
Sa123 22:09, 6 марта 2012 (UTC)
Материал из Вокруг света, 10.2011. Дегтярёв пехотный 03:51, 25 января 2013 (UTC)
- Ненциклопедический стиль. Что значит «загнать»? Да и форматирование статьи нарушено.—Курлович 04:19, 25 января 2013 (UTC)
- Загнать — имеется в виду вставить под давлением в пространство внутри молекулярных связей. Фуллерен C60 — это же ведь полый шарик. Молекула воды там поместится. Дегтярёв пехотный 05:05, 25 января 2013 (UTC)
Abiyoyo, привет. Взглянул в Вода и Химический элемент как Вы и посоветовали. Ни в одной из них не нашел упоминания воды как химического элемента (ну кроме текста шаблона, который Вы вернули, само собой). Можете, пожалуйста, указать в какой именно статье бинарное соединение элементов водород и кислород считается самостоятельным химическим элементом? —銅竜 04:09, 27 февраля 2015 (UTC)
- Откатил уже. Прошу прощения.—Abiyoyo 04:10, 27 февраля 2015 (UTC)
- Ага, как раз хотел закрывать тему, но получил конфликт правок 🙂 Ничего, бывает 🙂 —銅竜 04:11, 27 февраля 2015 (UTC)
- Вода это вещество, а не элемент Т_Т Кредо Мести (обс.) 11:59, 13 сентября 2019 (UTC)
интересные температуры для воды[править код]
Мне кажется будет интересно добавить в статью: 4 градуса цельсия — температура для максимальной плотности воды http://www.youtube.com/watch?v=h9JLie2Mz90&t=188 36.79 — градуса цельсия — температура с минимальным показателем удельной теплоемкости http://www.watermap.ru/articles/anomalnye-svojstva-vody —speakus 16:40, 21 декабря 2015 (UTC)
- Конечно, надо! —infovarius (обс.) 09:38, 9 февраля 2017 (UTC)
Льдоподобная структура воды в Nature Comm.[править код]
Там нет ничего в моей интерпретации, взято из аннотации и текста статьи. Статья действительно хорошая. Это кажется давно подозревалось. —Arhimedos 13:32, 27 января 2016 (UTC)
- Nature Comm. — Nature.com?
- Значимость факта (в используемом в ВП смысле) сомнительна. Почитайте ВП:ЗН и ВП:ЗФ и попробуйте показать значимость факта, о котором идёт речь в предлагаемой вами правке.
- О льдоподобности структуры воды говорят и пишут далеко не один десяток лет. —VladVD 13:43, 27 января 2016 (UTC)
- Это прямое доказательство на уровне Nature. А значимость в том, что сами авторы говорят об опровержении прежних взглядов, употребляя даже эпитет «удивительно». —Arhimedos 14:04, 27 января 2016 (UTC) Здесь прежние представления http://www.ngpedia.ru/id490103p2.html. Об этой статье я узнал из новостных лент. Поэтому значимость имеется.—Arhimedos 14:14, 27 января 2016 (UTC)
- Для науки утверждения, содержащиеся в статье, опубликованной Nature, станут научными фактами лишь после того, как их проверят и признают таковыми другие исследователи.
- Значимость для ВП состоит совсем не в том, что говорят о своих результатах сами авторы статьи. Для ВП «Значимость аспекта (факта, утверждения) оценивается по распространённости в авторитетных источниках», при этом новостные источники в том, что касается науки, авторитетными не являются.
- В общем, помещать в статью информацию о только что опубликованных результатах явно преждевременно. —VladVD 14:53, 27 января 2016 (UTC)
- Меня беспокоит вот что. Источник, конечно, авторитетный, авторы пишут что они что-то там опровергли, но это — мнение самих авторов. Лично мне совершенно непонятно, насколько их взгляды общеприняты. Мы же должны давать некое обобщённо-усреднённое описание предмета, такое как в учебнике или бумажной энциклопедии. А что, если завтра появится в том же Nature статья других авторов с прямо противоположными выводами? В общем, согласен с VladVD, рано это включать сюда. Тилик-тилик 16:42, 27 января 2016 (UTC)
- Да как хотите, просто рейтинг Nature самый высокий из существующих, уж они проверяют дотошно, с кучей резензентов.—Arhimedos 16:45, 27 января 2016 (UTC)
- Редакции не проверяют и не могут проверять экспериментальные данные, о которых сообщают авторы статей. —VladVD 17:14, 27 января 2016 (UTC)
- Для этого существуют резензенты, дорожащие своей репутацией, и не один, а несколько.—Arhimedos 19:33, 27 января 2016 (UTC)
- Рецензенты существуют для другого, они тоже никоим образом не проверяют и не могут проверять данные, о получении которых сообщается в статьях. Установки, на которых получают результаты, зачастую существуют в единственном экземпляре в мире, а выполнение измерений на них требует огромных затрат времени и стоит гигантских денег. Кто может всё это обеспечить рецензентам? Ответ на этот вопрос прост: никто и никогда. Впрочем, всё это к делу не относится, пора заканчивать. —VladVD 19:58, 27 января 2016 (UTC)
- Внятной мотивации по отказу цитирования АИ высшего ранга не получил. Перенесем на ВП:КОИ?—Arhimedos 20:52, 27 января 2016 (UTC)
- Я попробую объяснить по-другому. В Nature публикуются результаты оригинальных исследований. Если сравнить с общественно-политическими темами, статья в Nature — аналог новостного сообщения в авторитетном издании (скажем, на bbc). Можно ли писать статью по новостным сообщениям? Правила говорят, что нельзя — ВП:НЕНОВОСТИ (хотя на самом деле, пишут, но это плохо). Писать статью лучше всего по обобщающим источникам. В нашем случае таким источником может быть обзорная статья или хорошая книга. Тилик-тилик 21:07, 27 января 2016 (UTC)
- Путаница в понятиях. Это не новостной сайт, а научная статья в журнале с наивысшим индексом цитирования. И отказываться его цитировать удивительно и непонятно.—Arhimedos 21:46, 27 января 2016 (UTC)
- Уточняющий вопрос. Считаете ли вы, что каждую статью в Nature, так или иначе связанную с водой, надо немедленно цитировать здесь? Тилик-тилик 00:00, 28 января 2016 (UTC)
- Если она вносит расширение или изменение в прежние представления о природе воды. Это такой случай. Изложение можно улучшить, но замалчивать Nature…—Arhimedos 10:46, 28 января 2016 (UTC) Может надо создать отдельный подраздел о структуре воды.—Arhimedos 10:47, 28 января 2016 (UTC)
- Уточняющий вопрос. Считаете ли вы, что каждую статью в Nature, так или иначе связанную с водой, надо немедленно цитировать здесь? Тилик-тилик 00:00, 28 января 2016 (UTC)
- Путаница в понятиях. Это не новостной сайт, а научная статья в журнале с наивысшим индексом цитирования. И отказываться его цитировать удивительно и непонятно.—Arhimedos 21:46, 27 января 2016 (UTC)
- Я попробую объяснить по-другому. В Nature публикуются результаты оригинальных исследований. Если сравнить с общественно-политическими темами, статья в Nature — аналог новостного сообщения в авторитетном издании (скажем, на bbc). Можно ли писать статью по новостным сообщениям? Правила говорят, что нельзя — ВП:НЕНОВОСТИ (хотя на самом деле, пишут, но это плохо). Писать статью лучше всего по обобщающим источникам. В нашем случае таким источником может быть обзорная статья или хорошая книга. Тилик-тилик 21:07, 27 января 2016 (UTC)
- Внятной мотивации по отказу цитирования АИ высшего ранга не получил. Перенесем на ВП:КОИ?—Arhimedos 20:52, 27 января 2016 (UTC)
- Рецензенты существуют для другого, они тоже никоим образом не проверяют и не могут проверять данные, о получении которых сообщается в статьях. Установки, на которых получают результаты, зачастую существуют в единственном экземпляре в мире, а выполнение измерений на них требует огромных затрат времени и стоит гигантских денег. Кто может всё это обеспечить рецензентам? Ответ на этот вопрос прост: никто и никогда. Впрочем, всё это к делу не относится, пора заканчивать. —VladVD 19:58, 27 января 2016 (UTC)
- Для этого существуют резензенты, дорожащие своей репутацией, и не один, а несколько.—Arhimedos 19:33, 27 января 2016 (UTC)
- Редакции не проверяют и не могут проверять экспериментальные данные, о которых сообщают авторы статей. —VladVD 17:14, 27 января 2016 (UTC)
- Да как хотите, просто рейтинг Nature самый высокий из существующих, уж они проверяют дотошно, с кучей резензентов.—Arhimedos 16:45, 27 января 2016 (UTC)
- Вот когда появятся АИ, утверждающие, что «она вносит расширение или изменение в прежние представления о природе воды», возникнет повод положительно решить вопрос о вашей правке. Пока же,как вы, вероятно, и сами понимаете, ваше личное мнение для ВП авторитетным источником не является.
- Рекомендовал бы учесть, что в соответствии с ВП:НЕСВАЛКА «Если о какой-либо информации известно, что она истинна на 100 %, то это ещё не значит, что она должна быть включена в энциклопедию».
- До предоставления участником Arhimedos каких-то новых и релевантных аргументов своё участие в дискуссии приостанавливаю. —VladVD 14:25, 28 января 2016 (UTC)
- Вот, создать отдельный подраздел о структуре воды — это уже лучше. Но, есть одно но. На основе какого источника? Тилик-тилик 20:11, 28 января 2016 (UTC)
- Для начала можно использовать раздел «Структура воды» статьи «Вода» в Физ-й энциклопедии. —VladVD 20:49, 28 января 2016 (UTC)
- Кстати, пока в статье отсутствует материал, касающийся структуры воды, предлагаемая правка очевидным образом не проходит по ВП:ВЕС —VladVD 22:04, 28 января 2016 (UTC)
Вроде, не мракобесие. Пожалуйста, гляньте, стоит ли упоминания в статье. —Michael MM (обс.) 10:54, 30 мая 2018 (UTC)
Предлагаю убрать раздел. Или переименовать в «Выдержки из неизвестного женского журнала». VictorL (обс.) 12:13, 22 октября 2018 (UTC)
Т. кип.: 373,1 K (99,974 ° C) °C
В конце градус Цельсия лишний, но не пойму, как убрать. И не понятно, почему много значений показателя преломления. Если это при разной температуре/давлении/чём-то ещё, то это стоит указать явно. —Anton Tsyganenko (обс.) 19:48, 7 января 2019 (UTC)
В «Физических свойствах»:
«…При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ.»
Допустим есть полностью наполненный водой запаянный сосуд. Испарения нет. Удельная теплоёмкость та же. Так как «разрыв связей при испарении» влияет на удельную теплоёмкость? 95.58.168.181 15:14, 26 сентября 2019 (UTC)
Предложения со словосочетанием АТОМЫ ВОДОРОДА
Мы также знаем, что определённые комбинации определённых атомов, недоступные простому глазу, приводят к образованию или обусловливают появление соединений, сильно отличающихся по своей природе, качествам и возможностям от элементов, из которых они состоят; но мы, к примеру, не можем объяснить, почему устойчивое сочетание двух атомов водорода и одного атома кислорода приводит к появлению воды, которая, вне всякого сомнения, является чем-то большим, нежели просто комбинацией двух газов, — новым творением, новой формой субстанции, материальным феноменом совершенно иного порядка. Первый шаг мы только что описали: два ядра атомов водорода, а точнее, два протона плотно приближаются друг к другу в результате туннелирования. В самом пустом из пустых мест космоса находятся несколько атомов водорода в каждом кубическом метре. Эти уровни различаются ориентациями магнитных моментов ядра атома водорода (протона) и вращающегося вокруг него электрона. Значит, тяжёлые атомы водорода и кислорода, 2H и 18O, можно использовать как палеотермометр — по их содержанию в определённом слое ледника можно судить о средней температуре в тот период, когда слой образовался.
 Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Привет! Меня зовут Лампобот, я компьютерная программа, которая помогает делать
Карту слов. Я отлично
умею считать, но пока плохо понимаю, как устроен ваш мир. Помоги мне разобраться!
Спасибо! Я обязательно научусь отличать широко распространённые слова от узкоспециальных.
Насколько понятно значение слова благовестить (глагол), благовестил:
Кристально
понятно
Понятно
в общих чертах
Могу только
догадываться
Понятия не имею,
что это
Другое
Пропустить
Атом водорода — это… Что такое Атом водорода?
Атом водорода — физическая система, состоящая из атомного ядра, несущего элементарный положительный электрический заряд, и электрона, несущего элементарный отрицательный электрический заряд. В состав атомного ядра может входить протон или протон с одним или несколькими нейтронами, образуя изотопы водорода. Электрон преимущественно находится в тонком концентрическом шаровом слое вокруг атомного ядра, образуя электронную оболочку атома. Наиболее вероятный радиус электронной оболочки атома водорода в стабильном состоянии равен боровскому радиусу a0 = 0,529 Å.
Атом водорода имеет специальное значение в квантовой механике и релятивистской квантовой механике, поскольку для него проблема двух тел имеет точное или приближенное аналитическое решения. Эти решения применимы для разных изотопов водорода, с соответствующей коррекцией.
В квантовой механике атом водорода описывается двухчастичной матрицей плотности или двухчастичной волновой функцией. Также упрощенно рассматривается как электрон в электростатическом поле бесконечно тяжёлого атомного ядра, не участвующего в движении (или просто в кулоновском электростатическом потенциале вида 1/r). В этом случае атом водорода описывается редуцированной одночастичной матрицей плотности или волновой функцией.
В 1913 году Нильс Бор предложил модель атома водорода, имеющую множество предположений и упрощений, и вывел из неё спектр излучения водорода. Предположения модели не были полностью правильны, но тем не менее приводили к верным значениям энергетических уровней атома.
Результаты расчётов Бора были подтверждены в 1925—1926 годах строгим квантово-механическим анализом, основанном на уравнении Шрёдингера. Решение уравнения Шрёдингера для электрона в электростатическом поле атомного ядра выводится в аналитической форме. Оно описывает не только уровни энергии электрона и спектр излучения, но и форму атомных орбиталей.
Решение уравнения Шрёдингера
Решение уравнения Шрёдингера для водородного атома использует факт, что кулоновский потенциал является изотропным, то есть не зависит от направления в пространстве, другими словами, обладает сферической симметрией. Хотя конечные волновые функции (орбитали) не обязательно сферически симметричны, их зависимость от угловой координаты следуют полностью из изотропии основного потенциала: собственные значения оператора Гамильтона можно выбрать в виде собственных состояний оператора углового момента. Это соответствует тому факту, что угловой момент сохраняется при орбитальном движении электрона вокруг ядра. Отсюда следует, что собственные состояния гамильтониана задаются двумя квантовыми числами углового момента l и m (целые числа). Квантовое число углового момента l может принимать значения 0, 1, 2… и определяет величину углового момента. Магнитное квантовое число может принимать m = −l, …, +l; оно определяет проекцию углового момента на (произвольно выбранную) ось z.
В дополнение к математическим выражениям для волновых функций полного углового момента и проекции углового момента, нужно найти выражение для радиальной зависимости волновой функции. В потенциале 1/r радиальные волновые функции записываются с использованием полиномов Лагерра). Это приводит к третьему квантовому числу, которое называется основным квантовым числом n и может принимать значения 1, 2, 3… Основное квантовое число в атоме водорода связано с полной энергией атома. Заметим, что максимальное значение квантового числа углового момента ограничено основным квантовым числом: оно может изменяться только до n − 1, то есть l = 0, 1, …, n−1.
Из-за сохранения углового момента состояния с одинаковыми l, но различными m в отсутствие магнитного поля имеют одну и ту же энергию (это выполняется для всех задач с аксиальной симметрией). Кроме того, для водородного атома состояния с одинаковыми n, но разными l также вырождены (то есть имеют одинаковую энергию). Однако это свойство — особенность лишь атома водорода (и водородоподобных атомов), оно не выполняется для более сложных атомов, которые имеют (эффективный) потенциал, отличающийся от кулоновского (из-за присутствия внутренних электронов, экранирующих потенциал ядра).
Если мы примем во внимание спин электрона, то появится последнее, четвёртое квантовое число, определяющее состояния атома водорода — проекция углового момента собственного вращения электрона на ось Z. Эта проекция может принимать два значения. Любое собственное состояние электрона в водородном атоме полностью описывается четырьмя квантовыми числами. Согласно обычным правилам квантовой механики, фактическое состояние электрона может быть любой суперпозицией этих состояний. Это объясняет также, почему выбор оси Z для квантования направления вектора углового момента является несущественным: орбиталь для данных l и полученных для другой выделенной оси всегда представляется как подходящая суперпозиция различных состояний с разными m (но тем же самым l), которые были получены для Z.
Рассмотрим сейчас решение уравнения Шрёдингера для атома водорода. Так как потенциальная функция электрона в атоме водорода имеет вид где e — заряд электрона (и протона), r — радиус-вектор, то уравнение Шрёдингера запишется следующим образом:
Здесь ψ — волновая функция электрона в системе отсчёта протона, m — масса электрона, — постоянная Планка, E — полная энергия электрона, — оператор Лапласа. Так как потенциальная функция зависит от r, а не от координат по отдельности, удобно будет записать лапласиан в сферической системе координат В ней он выглядит следующим образом:
Уравнение Шрёдингера в сферических координатах:
В этом уравнении — функция трёх переменных Разделим его на три более простых уравнения. Для этого представим функцию как произведение трех функций: Эти функции будем обозначать просто Тогда
После подстановки значений частных производных в уравнение Шрёдингера получим:
Умножим уравнение на
Второе слагаемое тут зависит только от φ. Перенесём его в правую часть равенства.
Равенство возможно, когда обе части равны какой-то постоянной величине. Обозначим её Следовательно,
Решением этого уравнения являются функции
Угол φ может изменяться от 0 до 2π. Функция должна быть периодической с периодом 2π. Это возможно, только если Таким образом, из решения уравнения Шрёдингера получаем значение одного из квантовых чисел (конечно, из него можно получить их все). Число называется магнитным квантовым числом.
Далее, интегрируя квадрат модуля функции от 0 до 2π и приравнивая полученное выражение к единице, получим, что
Далее рассмотрим левую часть уравнения (1). Она, конечно, равна
Разделим уравнение на
После аналогичного вышеуказанному перенесению второго слагаемого в правую часть и обозначения величины, которой равны эти части, через получаем
Решение этих двух последних уравнений приводит к значениям l и n соответственно. Три квантовых числа в совокупности полностью описывают состояния электрона в атоме водорода.
Модуль полной энергии электрона в стационарном состоянии в атоме водорода обратно пропорционален Число n называется главным квантовым числом. Оно может иметь значения от 1 до Его связь с энергией см. ниже.
Число l называется азимутальным квантовым числом и определяет орбитальный момент количества движения электрона и форму электронного облака; может иметь значения от 0 до n − 1 (n здесь относится к энергетическом уровню, на котором находится рассматриваемый электрон).
Магнитное квантовое число определяет проекцию орбитального момента количества движения на выбранную ось в магнитном поле. Эта проекция равна
Математическое описание атома водорода
Энергетический спектр
Энергетические уровни атома водорода, включая подуровни тонкой структуры, записываются в виде
- где
- — постоянная тонкой структуры,
- — собственное значение оператора полного момента импульса.
Энергию можно найти в простой модели Бора, с массой электрона и зарядом электрона e:
- (в системе СИ),
где h — постоянная Планка, электрическая постоянная. Величина E0 (энергия связи атома водорода в основном состоянии) равна 13,62323824 эВ = 2,182700518·10−18 Дж. Эти значения несколько отличаются от действительного значения E0, поскольку в расчёте не учтена конечная масса ядра и эффекты квантовой электродинамики.
Волновые функции
В сферических координатах волновые функции имеют вид:
где:
- — Боровский радиус.
- — обобщённые полиномы Лагерра степени от функции
- — нормированные на единицу сферические функции.
Угловой момент
Собственные значения для оператора углового момента:
Нахождение энергии электрона из модели Бора
Вычислим уровни энергии атома водорода без учёта тонкой структуры, используя простую модель атома Бора. Для этой цели можно сделать грубое допущение электрона, двигающегося по круговой орбите на фиксированном расстоянии. Приравнивая кулоновскую силу притяжения центростремительной силе получим:
Здесь масса электрона, его скорость на орбите радиуса диэлектрическая проницаемость вакуума (электрическая постоянная).
Отсюда кинетическая энергия электрона
где расстояние от электрона до ядра.
Потенциальная его энергия
Полная энергия, соответственно, равна
Для нахождения радиуса rn стационарной орбиты с номером n рассмотрим систему уравнений, в которой второе уравнение есть математическое выражение первого постулата Бора
Отсюда получаем выражение для радиуса стационарной орбиты с номером n:
Радиус первой орбиты оказывается равным метра. Эта константа называется боровским радиусом.
Подставляя это значение в выражение для энергии, получим, что
Отсюда мы можем найти волновое число (по определению это обратная длина волны или число длин волн, укладывающихся на 1 см) фотона, излучаемого атомом водорода за один переход из возбужденного состояния с главным квантовым числом в состояние с неким фиксированным главным квантовым числом
где постоянная Ридберга (она равна 109 737,31568539 см−1).
Визуализация орбиталей атома водорода
Плотность вероятности для электрона при различных квантовых числах (l)
Изображение справа показывает первые несколько орбиталей атома водорода (собственные функции гамильтониана). Они представляют собой поперечные сечения плотности вероятности, величина которой отражена цветом (чёрный цвет соответствует минимальной плотности вероятности а белый — максимальной). Квантовое число углового момента l обозначено в каждой колонке, используя обычные спектроскопические обозначения (s означает l = 0; p: l = 1; d: l = 2). Главное квантовое число n (= 1, 2, 3…) отмечено справа от каждого ряда. Для всех картин магнитное квантовое число m равно 0, и сечение взято в плоскости — XZ, Z — вертикальная ось. Плотность вероятности в трёхмерном пространстве получается при вращении картинки вокруг оси Z.
Основное состояние, то есть состояние самой низкой энергии, в котором обычно находится электрон, является первым, состоянием 1s (n = 1, l = 0). Изображение с большим количеством орбиталей доступно до более высоких чисел n и l. Отметим наличие чёрных линий, которые появляются на каждой картинке, за исключением первой. Они — узловые линии (которые являются фактически узловыми поверхностями в трёх измерениях). Их общее количество всегда равно n − 1, которое является суммой числа радиальных узлов (равного n − l − 1) и числа угловых узлов (равного l).
Строение и свойства атома водорода
Образование атома водорода и его спектр излучения
При попадании в электрическое поле положительно заряженного протона отрицательно заряженного электрона происходит захват последнего протоном — образуется атом водорода. Образовавшийся атом водорода находится в возбуждённом состоянии. Время жизни атома водорода в возбуждённом состоянии — ничтожные доли секунды (10−8 — 10−10сек)[1], однако очень высоковозбуждённые атомы в бесстолкновительной среде могут существовать до секунд. Снятие возбуждения атома происходит за счёт излучения фотонов с фиксированной энергией, проявляющихся в характерном спектре излучения водорода. Поскольку газообразный атомарный водород содержит множество атомов в различных степенях возбуждения, спектр состоит из большого числа линий.
Схема происхождения спектра атомарного водорода представлена на рисунке.[2].
Линии спектра серии Лаймана обусловлены переходом электронов на нижний уровень с квантовым числом n = 1 с уровней с квантовыми числами n = 2, 3, 4, 5, 6… Линии Лаймана лежат в ультрафиолетовой области спектра. Линии спектра серии Бальмера обусловлены переходом электронов на уровень с квантовым числом n = 2 с уровней с квантовыми числами n = 3, 4, 5, 6… и лежат в видимой области спектра.
Линии спектра серий Пашена, Брэкета и Пфунда обусловлены переходом электронов на уровни с квантовыми числами n, равными 3, 4 и 5 (соответственно), и расположены в инфракрасной области спектра.[3].
В нормальном (основном) состоянии (главное квантовое число n = 1) атом водорода в изолированном виде может существовать неограниченное время. Согласно квантохимическим расчетам, радиус мест наибольшей вероятности нахождения электрона в атоме водорода в нормальном состоянии (главное квантовое число n = 1) равен 0,529 Å. Этот радиус является одной из основных атомных констант, он получил название боровский радиус (см. выше). При возбуждении атома водорода электрон проходит на более высокий квантовый уровень (n = 2, 3, 4 и т. д.), при этом радиус мест наибольшей вероятности нахождения электрона в атоме возрастает пропорционально квадрату главного квантового числа:
- rn = a0 · n2.
Возбуждение и ионизация атома водорода
Уровни энергии атома водорода.Возбуждение атома водорода происходит при нагревании, электроразряде, поглощении света и т. д., причём в любом случае атом водорода поглощает определённые порции — кванты энергии, соответствующие разности энергетических уровней электронов. Обратный переход электрона сопровождается выделением точно такой же порции энергии. Квантовые переходы электрона соответствуют скачкообразному изменению концентрического шарового слоя вокруг ядра атома водорода, в котором преимущественно находится электрон (шаровым слой является только при нулевом значении азимутального квантового числа l).
Согласно квантовомеханическим расчётам, наиболее вероятное расстояние электрона от ядра в атоме водорода равно боровскому радиусу ~ 0,53 Å при n = 1; 2,12 Å — при n = 2; 4,77 Å — при n = 3 и так далее. Значения этих радиусов относятся как квадраты натуральных чисел (главного квантового числа) 12 : 22 : 32…. В очень разреженных средах (например, в межзвёздной среде) наблюдаются атомы водорода с главными квантовыми числами до 1000 (ридберговские атомы), чьи радиусы достигают сотых долей миллиметра.
Если электрону в основном состоянии придать дополнительную энергию, превышающую энергию связи E0 ≈ 13,6 эВ, происходит ионизация атома водорода — распад атома на протон и электрон.
Радиальное распределение вероятности нахождения электрона в атоме.Строение атома водорода в основном состоянии
Радиальная зависимость dp(r)/dr плотности вероятности нахождения электрона в атоме водорода, находящемся в основном состоянии, представлена на рисунке. Эта зависимость даёт вероятность того, что электрон будет обнаружен в тонком шаровом слое радиуса r толщиной dr с центром в ядре. Площадь этого слоя равна S = 4πr2, его объём dV = 4πr2dr. Общая вероятность нахождения электрона в слое равна (4πr2dr) ψ2, поскольку в основном состоянии волновая функция электрона сферически симметрична (то есть постоянна в рассматриваемом шаровом слое). Рисунок выражает зависимость dp(r)/dr = 4πr2ψ2. Кривая радиального распределения плотности вероятности dp(r)/dr нахождения электрона в атоме водорода имеет максимум при a0. Этот наиболее вероятный радиус совпадает с боровским радиусом. Размытое облако плотности вероятности, полученное при квантовомеханическом рассмотрении, значительно отличается от результатов теории Бора и согласуется с принципом неопределённости Гейзенберга. Это размытое сферически симметричное распределение плотности вероятности нахождения электрона, называемое электронной оболочкой, экранирует ядро и делает физическую систему протон-электрон электронейтральной и сферически симметричной — у атома водорода в основном состоянии отсутствуют электрический и магнитный дипольные моменты (как и моменты более высоких порядков), если пренебречь спинами электрона и ядра. Следует отметить, что максимум объёмной плотности вероятности ψ2 достигается не при r = a0, как для радиальной зависимости, а при r = 0.
Атом водорода в электрическом поле
По теории деформационной поляризации, нейтральный атом водорода, попадая во внешнее электрическое поле, подвергается деформации — центр электронной оболочки атома водорода смещается относительно ядра на некоторое расстояние L, что приводит к появлению в атоме водорода наведённого электрического дипольного момента μ[4]. Величина наведённого дипольного момента прямо пропорциональна напряжённости внешнего электрического поля E:
- μ = αeE = Lq.
Коэффициент пропорциональности αe носит название электронной поляризуемости. Электронная поляризуемость атома водорода составляет 0,66 Å3.[5]
Чем выше напряжённость приложенного электрического поля, тем больше смещение центра электронной оболочки от центра атома водорода и, собственно, длина наведённого диполя
- L = αeE/q,
где q — величина заряда ядра атома водорода.
При высоких значениях напряжённости приложенного электрического поля атом водорода подвергается ионизации полем с образованием свободных протона и электрона.
Взаимодействие атома водорода с протоном
Деформационная поляризация атома водорода в электрическом поле протонаПротон, обладая положительным элементарным электрическим зарядом q = 1,602•10 −19 Кл, как и всякий точечный электрический заряд создаёт вокруг себя электрическое поле с напряжённостью E. E = q/R2, Где R — расстояние точки поля до протона.
Нейтральный атом водорода, попадая в электрическое поле протона, подвергается деформационной поляризации (рис.1.). Длина наведённого электрического диполя атома водорода обратно пропорциональна квадрату расстояния между атомом водорода и протоном L = αe E/q = αe/R2 = 0,66/R2
Отрицательный полюс наведённого электрического диполя атома водорода ориентируется в сторону протона. В результате чего начинает проявляться электростатическое притяжение между атомом водорода и протоном. Сближение частиц (атома водорода и протона) возможно до тех пор, пока центр плотности вероятности нахождения электрона станет равноудалённым от обоих протонов. В этом предельном случае d=R=2L. Центр области вероятного нахождения электрона совпадает с центром симметрии образовавшейся системы H2+ — молекулярного иона водорода, при этом d=R=2L=³√2αe = ³√2•0,66 = 1,097 Å.
Найденная величина d = 1,097 Å близка к экспериментальной величине межъядерного расстояния в молекулярном ионе водорода H2+ — 1,06 Å.[6]
Взаимодействуя с протоном, атом водорода образует молекулярный ион водорода
H2+,H + H + -> H2+ + Q,
Характеризующийся простейшей одноэлектронной ковалентной химической связью.
Взаимодействие атома водорода с электроном
Рис. Деформационная поляризация атома водорода под действием приближающегося электрона и модель гидрид-иона H—Электрон, обладая элементарным электрическим зарядом, как и протон создаёт вокруг себя электрическое поле, но в отличие от электрического поля протона с отрицательным знаком. Нейтральный атом водорода, попадая в электрическое поле электрона подвергается деформационной поляризации. Центр электронной оболочки атома водорода смещается относительно ядра на некоторое расстояние L в противоположную сторону к приближающемуся электрону. Приближающийся электрон как бы вытесняет из атома водорода находящийся в нём электрон, подготавливая место для второго электрона. Величина смещения центра электронной оболочки атома водорода L обратно пропорциональна квадрату расстояния атома водорода к приближающемуся электрону R:
L = αe/R2 = 0.66/R2 (рис)
Сближение атома водорода и электрона возможно до тех пор, пока центры областей плотностей вероятности нахождения обоих электронов не станут равноудалёнными от ядра объединённой системы — отрицательно заряженного иона водорода. Такое состояние системы имеет место при:
re = L = R = 3√0,66 = 0,871 Å.
Где re — орбитальный радиус двухэлектронной оболочки гидрид-иона H—.
Таким образом, атом водорода проявляет своеобразную амфотерность, он может взаимодействовать как с положительно заряженной частицей (протоном), образуя молекулярный ион водорода H2+, так и с отрицательно заряженной частицей (электроном), образуя гидрид-ион H—.
Рекомбинация атомов водорода
Рекомбинация атомов водорода обсуловлена силами межатомного взаимодействия. Происхождение сил, вызывающих притяжение электрически нейтральных атомов друг к другу, было объяснено в 1930 году Ф.Лондоном. Межатомное притяжение возникает вследствие флуктуации электрических зарядов в двух атомах, находящихся близко друг от друга. Поскольку электроны в атомах движутся, то каждый атом обладает мгновенным электрическим дипольным моментом, отличным от нуля. Мгновенный диполь (электродинамика) на одном атоме наводит противоположно направленный диполь в соседнем атоме. Наступает синхронизация колебаний двух атомов — двух осцилляторов, частоты которых совпадают. Результатом этого процесса является образование молекулы водорода.
Наличие мгновенного электрического дипольного момента у атома водорода выражается в характерной особенности атома водорода, проявляющейся в крайней реакционной способности атомарного водорода и склонности его к рекомбинации. Время существования атомного водорода составляет около 1 сек. Под давлением в 0.2 мм рт. ст. Рекомбинация атомов водорода имеет место, если образующаяся молекула водорода быстро освобождается от избытка энергии, выделяющейся при взаимодействии атомов водорода путём тройного столкновения. Соединение атомов водорода в молекулу протекает значительно быстрее на поверхности различных металлов, чем в самом газе. При этом металл воспринимает ту энергию, которая выделяется при образовании молекул водорода, и нагревается до очень высоких температур. Тепловой эффект реакции образования молекулярного водорода из атомов водорода составляет 103 ккал/моль.
На принципе рекомбинации атомов водорода разработана атомно-водородная сварка. Между двумя вольфрамовыми стержнями создаётся электрическая дуга, через которую по облегчающим стержни трубкам пропускается ток водорода. При этом часть молекул водорода распадается на атомы, которые затем вновь соединяются на металлической поверхности, помещаемой на небольшом расстоянии от дуги. Металл может быть таким путём нагрет до температуры выше 3500° C[7].
Константы реакции диссоциации молекулярного водорода (Kp) и степень превращения водорода в атомарное состояние (α) в зависимости от абсолютной температуры (T) представлены в таблице[8]:
| T, к | 2000 | 3000 | 4000 | 5000 | 6000 | 8000 |
|---|---|---|---|---|---|---|
| Кр | 2,62 · 10-6 | 2,47 · 10-2 | 2,52 | 4,09 · 10 | 2,62 · 102 | 2,70 · 103 |
| α | 8,10 · 10-4 | 7,83 · 10-2 | 0,621 | 0,954 | 0,992 | 0,999 |
Примечания
- ↑ Ахметов Н. С. Неорганическая химия. Учебное пособие для вузов с ил. — 2-е изд., перераб. и доп. — М.: «Высшая школа», 1975. — 672 с.
- ↑ Некрасов Б. В. Курс общей химии. — 14-е изд. — М.: ГНТИ химической литературы, 1962. — С. 113. — 976 с.
- ↑ Даниэльс Ф., Олберти Р. Физическая химия. — пер. с англ. под ред. д. х. н., проф. К. В. Топчиевой. — М.: «Мир», 1978. — С. 369-370. — 645 с.
- ↑ Потапов А. А. Деформационная поляризация: Поиск оптимальных моделей. — Новосибирск: «Наука», 2004. — 511 с. — ISBN 5-02-032065-X
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — Л.-М.: Издательство химической литературы, 1962. — Т. 1. — С. 385. — 1071 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — Л.-М.: Издательство химической литературы, 1962. — Т. 1. — С. 388. — 1071 с.
- ↑ Некрасов Б. В. Курс общей химии. — 14-е изд. — М.: ГНТИ химической литературы, 1962. — С. 110. — 976 с.
- ↑ Справочник химика. — 2-е изд., перераб. и доп. — Л.-М.: «Химия», 1964. — Т. 3. — С. 24. — 1008 с. — 65 000 экз.
См. также
Ссылки
- Griffiths David J. Introduction to Quantum Mechanics. — Upper Saddle River, NJ: Prentice Hall, 1995. — ISBN ISBN 0-13-111892-7
Параграф 4.2 описывает атом водорода, а вся глава 4 имеет отношение к теме.
ru:Протий
Особенности строения атома водорода :: SYL.ru
Самый распространенный элемент в космосе, состоящий из самых легких атомов, — это водород. Он открыт еще в 14 столетии великим алхимиком Парацельсом. Ученого по праву считают основоположником не только медицины, но и химии. Строение атома водорода было в дальнейшем детально рассмотрено Нильсом Бором. Элемент был затем обнаружен астрономами в составе Солнца и других планет, а также в газовых звездных туманностях. В них происходит процесс превращения атомов водорода в атомы гелия, иными словами, наблюдается ядерная реакция. В нашей статье мы изучим не только строение атома водорода, но и рассмотрим характерные особенности свойств этого химического элемента.
Место элемента в периодической системе Менделеева
Водород – единственный химический элемент, находящийся сразу в двух группах периодической системы: 1 и 7. Объяснить следующий факт можно так: он проявляет двойственные химические свойства. Особое строение атома водорода позволяет ему отдавать свой единственный электрон атомам, например, активных элементов – неметаллов. Это прежде всего галогены: агрессивные по своим свойствам фтор, хлор, бром и йод. Легко взаимодействует H2 и с халькогенами: серой, кислородом, селеном. В этом случае атомы водорода превращаются в катионы – положительно заряженные частицы.
Благодаря этой особенности элемент занимает место в первой группе периодической системы. Иначе выглядит механизм реакции между металлами и водородом. Согласно теории строения атома водорода по Н. Бору, элемент имеет один неспаренный электрон. Атом H принимает электроны от атомов активных щелочных или щелочноземельных металлов. Таким образом, его электронная конфигурация становится похожей на частицу инертного газа гелия. Единственный энергетический слой теперь полностью завершен. В данных процессах строение атома водорода изменяется и он переходит в форму аниона. Именно по этой причине элемент одновременно располагается в периодической системе еще и в ее 7 группе.

Все в сравнении
Продолжая изучать особенности строения водородных частиц, давайте посмотрим, насколько их внутренняя структура влияет на поведение элемента в реакциях. Для этого обратим внимание на его ближайших соседей по периодической системе и определим, каково строение атомов водорода, гелия и лития. С частицами инертного газа водород объединяет одинаковое количество энергетических уровней, с литием – похожее строение внешнего энергетического слоя, на котором расположен один электрон. Однако свойства водорода сильно отличаются как от инертного газа, так и от щелочного металла. Этот факт доказывает, что все характеристики химического элемента полостью определяются строением атома и молекулы водорода, то есть количеством энергетических уровней и распределением электронов на них.
Рождающий воду
Название элемента говорит о том, что соединение его атомов с частицами кислорода приводит к появлению такого уникального и важного для Земли вещества, как вода. В обычных условиях эта реакция не происходит, температура горения газовой смеси достигает 2800 °C. В лаборатории взаимодействие между H2 и O2 в соотношении 2:1 приводит к взрыву. Сама смесь получила название гремучего газа, а процесс, протекающий в ней, идет по свободно-радикальному механизму. Если его не контролировать, то реакция заканчивается серьезной проблемой – мощным взрывом. По этой причине, несмотря на его исключительную легкость, от водорода отказались как от наполнителя для воздушных летательных аппаратов. Печальным поводом послужило крушение в 1937 году дирижабля «Гинденбург», направлявшегося в Америку. Посмотрим теперь, как строение атома водорода влияет на физические признаки газа.

Водород, дейтерий, тритий
Пусть вас не удивляет приведенный выше перечень терминов. Речь идет все об одном и том же химическом элементе водороде, заряд ядра атома которого равен +1. Второе и третье названия – это имена изотопов. Причина их различий заключается в количестве нейтронов в ядре, тогда как протонное число всех трех видов частиц одинаково. У дейтерия два нейтрона, у трития – 3, сам же водород имеет 1 нейтрон в составе своего ядра. Вода, содержащая в составе своих молекул дейтерий, называется тяжелой. Ее можно обнаружить в прудах-охладителях атомных станций, а также в составе цитоплазмы клеток, имеющих нарушения нормального метаболизма.
Электронное строение атома водорода
Схема, приведенная ниже, поможет нам понять специфику поведения простого вещества H2 в различных химических взаимодействиях.
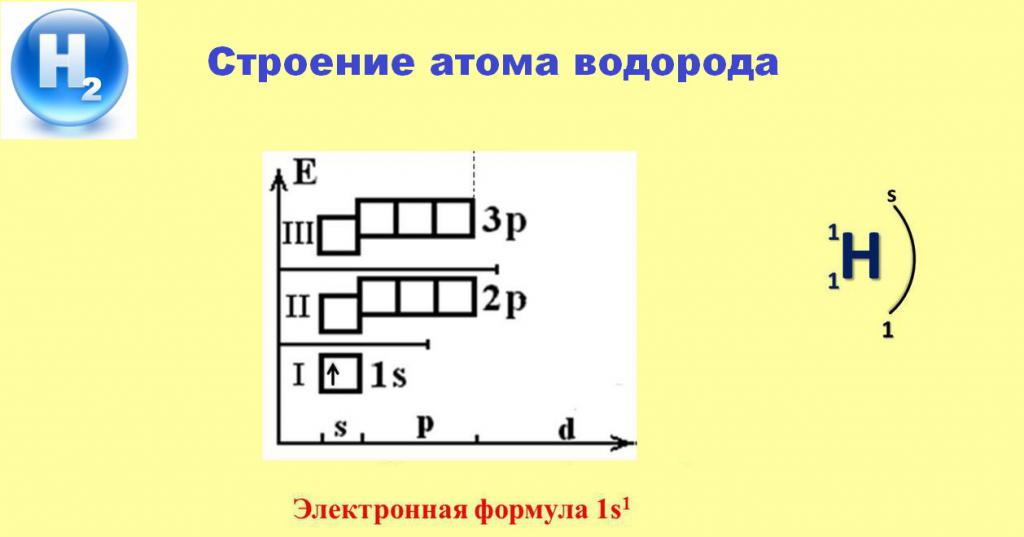
Наличие единственного электрона, занявшего s-орбиталь первого энергетического уровня, обеспечивает постоянную валентность водорода, равную 1. В большинстве случаев этот электрон покидает пространство атома и переходит во владение более электроотрицательных элементов. Лишь реакции с металлами позволяют водороду притянуть в сферу влияния собственного ядра электрон от атомов активных щелочных или щелочноземельных элементов, образуя белые кристаллические соединения — их гидриды.
Активный и агрессивный
Атомарный водород, так сказать, легок на подъем. Его быстроте в восстановлении металлов из их оксидов могут позавидовать другие восстановители вроде углерода или его окислов. Так же активно атомы H соединяются с частицами серы, кислорода, фосфора. А пламя горелки с атомарным водородом дает разогрев выше 4000 °C. По этой причине такими приборами легко обрабатывать поверхности металлов: резать или сваривать их.

Атомарный водород хорошо зарекомендовал себя в качестве восстановителя чистых металлов — вольфрама, молибдена — из их руд, представленных в основном оксидами. Встречаясь с такими же атомами, как и он сам, водород образует устойчивую и пассивную структуру – молекулу. Оба атома H держатся друг за друга с помощью общей электронной пары, являясь образцом стабильной ковалентной неполярной связи. Она прочная и обеспечивает устойчивость молекул H2 как в условиях земного существования, так и на просторах космоса. Не обошлась без водорода и пищевая промышленность, в которой его применяют для гидрогенизации масел и получения модных в современной диетологии низкокалорийных спредов.

В нашей статье мы рассмотрели, каково строение атома водорода, и выяснили, как оно влияет на свойства простого вещества

