Сорняки в электрохимии – Наука – Коммерсантъ
Ученые химфака МГУ им. М. В. Ломоносова и Сколтеха разработали метод переработки ныне самого известного в нашей стране сорняка — борщевика Сосновского — в анодный материал для натрий-ионных аккумуляторов.
Для аккумуляторов борщевик лучше собирать летом
Фото: Петр Кассин, Коммерсантъ
Для аккумуляторов борщевик лучше собирать летом
Фото: Петр Кассин, Коммерсантъ
«Ъ-Наука» уже рассказывала, как борщевик — весьма перспективная с точки зрения советской агробиологической науки времен академика Лысенко, дешевая, высокоурожайная кормовая и силосная культура, богатая протеином, витаминами, микроэлементами, сахарами, обеспечивающими хорошую силосуемость и т. п.,— начинал свою экспансию и на пике своей популярности занимал, по разным оценкам, от 20% до 40% сельскохозяйственных угодий. Но потом как отрезало: в 2012 году борщевик Сосновского был разжалован сначала из кормовой, а потом и из силосной культуры и переведен в класс ядовитых опасных сорняков, с которым надлежало бороться всеми силами.
Утилизация миллионов тонн ядовитого сорняка создала свои проблемы, но, как известно, худа без добра не бывает. Ученые химфака МГУ и Сколтеха разработали метод превращения его биомассы в анодный материал для натрий-ионных аккумуляторов (НИА). Работа была выполнена при финансовой поддержке Российского научного фонда (грант №17-73-30006 — «Перспективные материалы для электрохимических накопителей энергии нового поколения», проект по созданию научно-технологического задела для развития отечественных «пост-литий-ионных» технологий электрохимического хранения энергии).
«Конечно же, для нас это было вызовом — переработать это крайне бесполезное и очень даже вредное растение в анодный материал. Но мы решили попробовать и изумились полученному результату»,— говорит Зоя Владимировна Бобылева, сотрудник химического факультета МГУ им. М. В. Ломоносова, один из соавторов разработки.
Ненефтяная игла
В наше время множество приборов — от фонарика до электромобиля — работают на литий-ионных аккумуляторах (ЛИА). Они были изобретены в 1960-е годы, появились в продаже в 1990-е годы (их создатели были удостоены Нобелевской премии 2019 года), и с тех пор рынок ЛИА растет как на дрожжах, достиг уже $20 млрд и, похоже, останавливаться не собирается.
Они были изобретены в 1960-е годы, появились в продаже в 1990-е годы (их создатели были удостоены Нобелевской премии 2019 года), и с тех пор рынок ЛИА растет как на дрожжах, достиг уже $20 млрд и, похоже, останавливаться не собирается.
Преимущество ЛИА — их сравнительно малая масса: атом лития очень маленький как по размерам, так и по массе, небольшое количество анодного материала может вместить значительное количество атомов лития. Количество энергии, которое устройство может запасти в удельном объеме, называется плотностью энергии, и именно по этому параметру ЛИА превосходят остальные энергоносители. Кроме того, они отличаются циклостабильностью, а также сравнительно простым обслуживанием и сохраняют работоспособность в диапазоне температур от –20°С до +60°С, правда, перезарядить устройство в экстремальных условиях не получится.
Конструкция ЛИА, как и любого другого аккумулятора, включает в себя два электрода: положительно заряженный анод и отрицательно заряженный катод — сепаратор и электролит.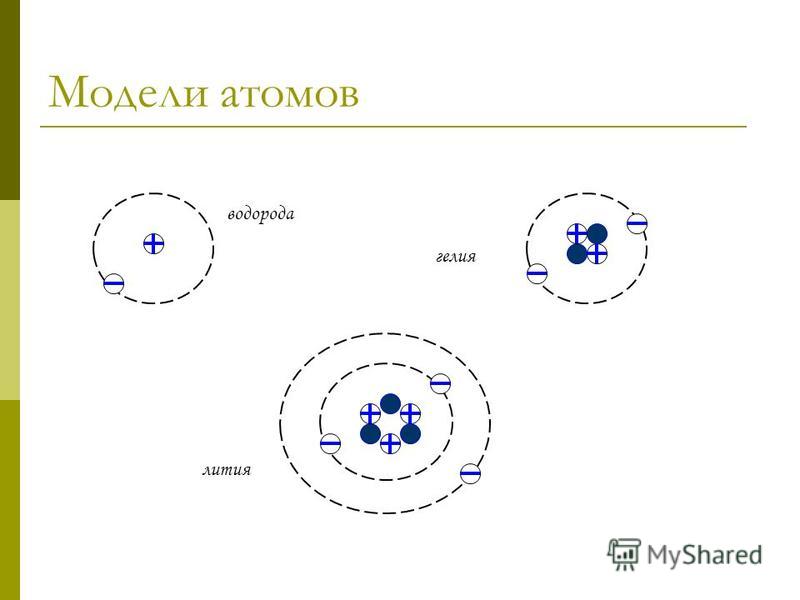 Электроды представляют собой двухкомпонентные системы: катод состоит из литийсодержащего соединения, которое помещено на алюминиевую фольгу, а анод — из материала на медной подложке.
Электроды представляют собой двухкомпонентные системы: катод состоит из литийсодержащего соединения, которое помещено на алюминиевую фольгу, а анод — из материала на медной подложке.
В зависимости от нужд потребителя энергоноситель может быть как одноразовым — первичным или же заряжаемым — вторичным.
Во вторичных ЛИА вне зависимости от материалов электрода осуществляются процессы аккумулирования носителей заряда в аноде (разрядка) и межфазного перехода ионов лития в раствор (зарядка). Во время разрядки в электрохимической ячейке протекают реакции, суть которых — переход лития, который был интеркалирован в анод, в раствор и высвобождение электрона. На катоде же происходит восстановление ионов лития и включение их обратно в химический состав вещества — электродного материала.
В 2020 году на рынок литий-ионных аккумуляторов приходилось уже более 70% мирового потребления этого металла, а объемы добычи лития выросли по сравнению с 1991 годом, когда компания Sony ввела на рынок первые перезаряжаемые ЛИА, в 13 раз — 85 тыс. т (в пересчете на металл) ежегодно. Литий уже называют «новой нефтью».
т (в пересчете на металл) ежегодно. Литий уже называют «новой нефтью».
Особенно резким был скачок цен на карбонат и гидроксид лития в последние два года, когда многие концерны наладили выпуск электромобилей. Батарея в 60 кВт, которая обеспечит электрокару путь в 300 км, содержит в среднем 8 кг лития. Если учесть тот факт, что переработка и вторичное использование аккумуляторов и батареек не является распространенной промышленной технологией, то нарастающая потребность в литии кажется очевидной.
Согласно прогнозам, в 2030–2040-х годах спрос на литий превысит предложение, даже с учетом наращивания добывающих мощностей на существующих предприятиях и введения новых в эксплуатацию. Понятно, что в такой ситуации развитие «пост-литий-ионных» технологий электрохимического хранения энергии выходит на передний край науки.
Аккумуляторы: из природы для природы
Натрий-ионные аккумуляторы — более дешевая альтернатива литий-ионным накопителям заряда. Натрия гораздо больше в земной коре по сравнению с литием, а его добыча менее трудозатратная: например, в виде хлорида его можно получать в неограниченном количестве просто испарением морской воды. Этот металл наиболее интересен с точки зрения создания аккумуляторов того же принципа действия, что и ЛИА, поскольку обладает почти такими же химическими свойствами.
Этот металл наиболее интересен с точки зрения создания аккумуляторов того же принципа действия, что и ЛИА, поскольку обладает почти такими же химическими свойствами.
Но ион натрия, обладающий координационным числом 6, вдвое больше иона лития с КЧ = 4. К тому же он менее поляризуем, что значительно влияет на диффузию иона через сепаратор и в анод. Также не представляется разумным использовать те же химические соединения в качестве катодных материалов — например, в отличие от кобальтата лития кобальтат натрия в ячейке вызывает низкую циклостабильность, и такой аккумулятор выдает очень маленький вольтаж. Из теоретических расчетов следует, что плотность энергии элементов на основе натрия должна быть ниже, чем у литиевых аналогов. Правда, ячейки НИА на основе ванадофосфатов натрия показывают себя более эффективными, чем такие же ЛИА.
Но путь более или менее равноценной замены лития натрием существует. Одним из наиболее часто используемых анодных материалов в ЛИА служит графит — легкий, дешевый, удобный в изготовлении и обладающий превосходными электрохимическими характеристиками. Однако использование его в положительно заряженном электроде НИА невозможно: атомы натрия почти вдвое больше, чем атомы лития, поэтому не могут пробраться в слоистую структуру графита и встроиться в нее, как это делает литий. И поскольку атом натрия приблизительно в три раза тяжелее атома лития, для НИА необходимо подбирать легкие анодные материалы, не проигрывая при этом по плотности энергии.
Однако использование его в положительно заряженном электроде НИА невозможно: атомы натрия почти вдвое больше, чем атомы лития, поэтому не могут пробраться в слоистую структуру графита и встроиться в нее, как это делает литий. И поскольку атом натрия приблизительно в три раза тяжелее атома лития, для НИА необходимо подбирать легкие анодные материалы, не проигрывая при этом по плотности энергии.
Ученые во всем мире начали подбирать новую аллотропную форму углерода, которая могла бы послужить надежным электродным материалом в натрий-ионных аккумуляторах. Здесь сыграло роль и то, что многие государства и корпорации развернули масштабные кампании по переработке в нечто полезное не только рукотворного мусора, но и биомассы. Не каждый источник биомассы подходит для переработки в углеродный материал: если использовать культивируемые бактерии, то необходим долгий и дорогостоящий процесс наработки необходимого для переработки количества; останки животных же очень неоднородны как по составу, так и по структуре. Не подходят и использованные синтетические полимерные материалы — для их переработки требуются очень жесткие условия, создавать которые финансово невыгодно.
Не подходят и использованные синтетические полимерные материалы — для их переработки требуются очень жесткие условия, создавать которые финансово невыгодно.
В настоящее время анод в ЛИА уже пробуют сделать из семян авокадо, банановой кожуры, сахара, кофейного и кокосового масел, хлопковой пряжи и зеленого чая. Однако в зависимости от использованного сырья очень сильно меняются электрохимические характеристики ячейки. Например, циклостабильность аккумулятора с анодом из банановой кожуры в 25 раз ниже, чем у такого же устройства с графитом из кофейного масла.
Из этого же сырья экспериментально создают и другую форму углерода — hard carbon, или неграфитизирующийся углерод, который не может быть переведен в графит термической обработкой, обладающий теми же параметрами, что и графит, за исключением плотности, которая у этой аллотропной формы углерода меньше на треть. Для временного хранения натрия эта форма подходит намного лучше, чем традиционный графит: межплоскостные расстояния между листами составляют 0,41 нм против 0,35 нм. Молекулярная структура неграфитизирующегося углерода менее упорядоченная, поэтому в ней существует множество вакантных мест, которые могут быть заняты щелочным металлом.
Молекулярная структура неграфитизирующегося углерода менее упорядоченная, поэтому в ней существует множество вакантных мест, которые могут быть заняты щелочным металлом.
Не только пищевая биомасса может быть использована в качестве прекурсора к углеродным формам — во многих лабораторных экспериментах в электродный материал перерабатывалась фитомасса, богатая лигнином и целлюлозой. Некоторые китайские и европейские компании уже производят в промышленном масштабе литий-аяионные аккумуляторы с анодом из древесных материалов, переведенных в форму неграфитизирующегося углерода.
В настоящее время основные кандидаты на роль массы-прекурсора — кукуруза, рис, природная мочалка люффа и ламинария. Все эти растения неприхотливые, быстро растут, содержат больше 30% углерода и обладают пористой многослойной структурой. Но расширение районов их культивирования может нарушить принцип биоразнообразия, который свято охраняется зелеными. Поэтому интересны растения из класса интродуцентов, и в первую очередь агрессивный интродуцент борщевик Сосновского. Борщевик уже используется в химической промышленности для получения кормовых добавок, фуранокумаринов, сахара и биоэтанола.
Борщевик уже используется в химической промышленности для получения кормовых добавок, фуранокумаринов, сахара и биоэтанола.
Первые результаты и перспективы
В своей работе химики МГУ и Сколтеха попробовали три способа обработки собранной в разные сезоны биомассы борщевика (в основном его стеблей) для получения неграфитизующегося углерода: простым одностадийным пиролизом, с гидротермальной и воздушной активацией.
Все полученные варианты углерода были смешаны с небольшим количеством карбоксиметилцеллюлозы, растворены и нанесены тончайшим слоем на графитовую фольгу для комплектации анода. Измерение электрических параметров было проведено сначала в полуячейке с натриевым электродом, а затем и в полной ячейке, где катодным материалом был Na3V2(PO4)3 — смешанная соль, которая широко используется в лабораторных и промышленных НИА.
Обнаружились отличия электродов, сконструированных из борщевика, собранного в разные сезоны: любые предварительные манипуляции с зимними побегами ведут к улучшению качества материала, что нельзя сказать про летний, значительно меняющийся лишь при определенном процессе.
В целом летние побеги демонстрируют лучшую кулоновскую эффективность, а именно этот параметр обычно не характеризует углеродные материалы на должном уровне.
В итоге получалось, что наилучшими электрохимическими характеристиками обладает неграфитизирующийся углерод, полученный из летнего борщевика с предварительной воздушной продувкой и последующей обработкой соляной кислотой, которая удалила остатки неорганических примесей из исходного сырья. Для такого образца показатель ICE — процент количества перешедших электронов из анода в катод и обратно — оказался равен 87%. У того же материала оказалась наименьшая площадь, которая могла бы сорбировать натрий по поверхности, то есть наибольшее количество атомов вошло именно внутрь анодного материала.
При этом углеродный материал приобретает большую пористость, что увеличивает способность натрия проникать в молекулярную структуру неграфитизирующегося углерода. И хотя по удельной емкости ячейки с анодами из борщевика проигрывают другому растительному сырью — лучший полученный результат составил 260 мАч против 300 мАч у НИА из литературных источников,— химики стремятся улучшить этот показатель и создать конкурентоспособный аккумулятор на основе самого распространенного щелочного металла.
«Нам бы хотелось, чтобы наша работа привлекла внимание компаний, которые ежедневно выбрасывают растительные отходы. Посмотрите, из того, что вы утилизируете, можно сделать кое-что стоящее!» — подытоживает Зоя Бобылева.
Владислава Лаврова
Емкость батарей увеличили соединения германия, «впитавшие» литий
«Это получилась «коронавирусная» работа, по двум причинам. Во-первых, и отправлена, и принята она была во время карантина. Во-вторых, ее главного героя — наноразмерный органический сесквиоксид германия — те, кто его видят, часто сравнивают с коронавирусом, хотя на самом деле он вполне себе добрый, а тонкие волокна позволяют ему обратимо впитывать катионы лития, на что неспособен диоксид германия, который он призван заменить», — прокомментировал Михаил Сыроешкин, кандидат химических наук, старший научный сотрудник Института органической химии имени Н.Д. Зелинского Российской академии наук.
Применение литий-ионных батарей, создатели которых получили Нобелевскую премию в 2019 году, касается всех областей жизни современного человека — от гаджетов до автобусов. Они заняли лидирующие позиции среди аккумуляторов благодаря своей емкости и возможности многократного перезаряда. Высокая емкость батарей достигается за счет компактности атомов лития, который выполняет функцию носителя заряда. При зарядке аккумулятора положительные ионы этого металла перемещаются из катодного материала (чаще всего это литийсодержащий сложный оксид) в анодный (слой графита, нанесенный на медную фольгу), а при разрядке — обратно. Дальнейшее развитие батарей связано с повышением их емкости, для чего необходимо увеличивать способность катода и анода «впитывать» как можно больше лития.
Они заняли лидирующие позиции среди аккумуляторов благодаря своей емкости и возможности многократного перезаряда. Высокая емкость батарей достигается за счет компактности атомов лития, который выполняет функцию носителя заряда. При зарядке аккумулятора положительные ионы этого металла перемещаются из катодного материала (чаще всего это литийсодержащий сложный оксид) в анодный (слой графита, нанесенный на медную фольгу), а при разрядке — обратно. Дальнейшее развитие батарей связано с повышением их емкости, для чего необходимо увеличивать способность катода и анода «впитывать» как можно больше лития.
Ученые из Института органической химии имени Н. Д. Зелинского РАН (Москва) и Сколковского института науки и технологий нашли альтернативу материалу, используемому в анодах батарей. Ранее исследователи предложили заменить графит на диоксид германия, что дало возможность получить вдвое более емкий анод. Однако в чистом виде диоксид германия теряет свои качества уже после нескольких циклов из-за особенностей своей химической структуры.
«Нашей идеей было попробовать сделать эту структуру более «рыхлой». Для этого мы решили заменить один из четырех таких мостиков с кислородом на органический фрагмент, который препятствовал бы сборке материала в трехмерный полимер, — поясняет Михаил Сыроешкин. — Мы получили так называемые органические сесквиоксиды германия. Приставка «sesqui» переводится с латинского как «полтора» и означает, что на один атом германия приходится полтора атома кислорода. Синтезированные вещества хорошо известны, полностью безопасны и нетоксичны в отличие от неорганических соединений германия. Они даже нашли применение в медицине, поскольку наличие органического фрагмента позволяет использовать их как хорошо усваивающийся германий. Наиболее распространенный сесквиоксид 2-карбоксиэтигермания, впервые полученный в ИОХ АН СССР, до недавнего времени использовали в качестве биодобавки».
Ученые обратили внимание на специфические структурные формы этих соединений — двумерные и одномерные полимеры. Задачей исследователей было сделать материал с как можно более мелкими частицами, тем самым увеличив общую площадь их поверхности. Важно, чтобы сесквиоксид, сохраняя структуру и не разрушаясь, мог взаимодействовать с максимальным количеством катионов лития. Для этой цели оказалось полезным другое его качество — растворимость в воде. Исследователи решили применить сублимационную сушку водных растворов — очень простой доступный метод, который применяют, например, при получении растворимого кофе. Раствор замораживают и из него сублимируют воду, то есть испаряют из твердого состояния сразу в газообразное.
Начало совместной работы ученых было положено после встречи на форуме Наука будущего. Исследования проводились совместно с коллегами из Института химических исследований Ренна (г. Ренн, Франция), Сколковского института науки и технологий (г. Москва), Института проблем химической физики РАН (г. Черноголовка), Омского государственного технического университета (г. Омск) и Российского химико-технологического университета имени Д.
Tags
Пресс-релизы
Мир атомов. Вызов имен.
Мир атомов. Вызов имен.
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Позвоните именам | ||
| Все атомы данного элемента имеют одинаковое количество протонов в ядре. Это число атомный номер элемента, и мы даем ему символ Z . Например, атомы лития содержат 3 протона. | ||
| Обозначение символами | |||||
Мы можем показать эту информацию об атоме, используя его символ и атомный номер:
Атомный номер записывается слева от символа. | |||||
| |||||||||||||||||||||||||||
Литий, атомарная структура — Stock Image — C018/3684
Похоже, вы используете старый веб-браузер, который не поддерживается. Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Некоторые части этого веб-сайта могут работать некорректно. Пожалуйста, используйте более новый веб-браузер.
Это изображение недоступно для покупки в вашей стране.
C018/3684
Управление правами
74,5 МБ (74,0 МБ со сжатием)
5197 x 5008 пикселей
43,9 x 42,4 см ⏐ 17,3 х 16,7 дюйма (300 точек на дюйм)
Это изображение недоступно для покупки в вашей стране.
Пожалуйста, свяжитесь с вашим менеджером по работе с клиентами, если у вас есть какие-либо вопросы.
Запрос
Цена Добавить в корзину Удалять ДОБАВИТЬ НА ДОСКУ ДелитьсяКупить Распечатать
Кредит
КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА КАРЛОС КЛАРИВАН / НАУЧНАЯ ФОТОБИБЛИОТЕКА
Заголовок
Литий (Li). Схема ядерного состава, электронной конфигурации, химических данных и валентных орбиталей атома лития-7 (атомный номер: 3), наиболее распространенного изотопа элемента лития.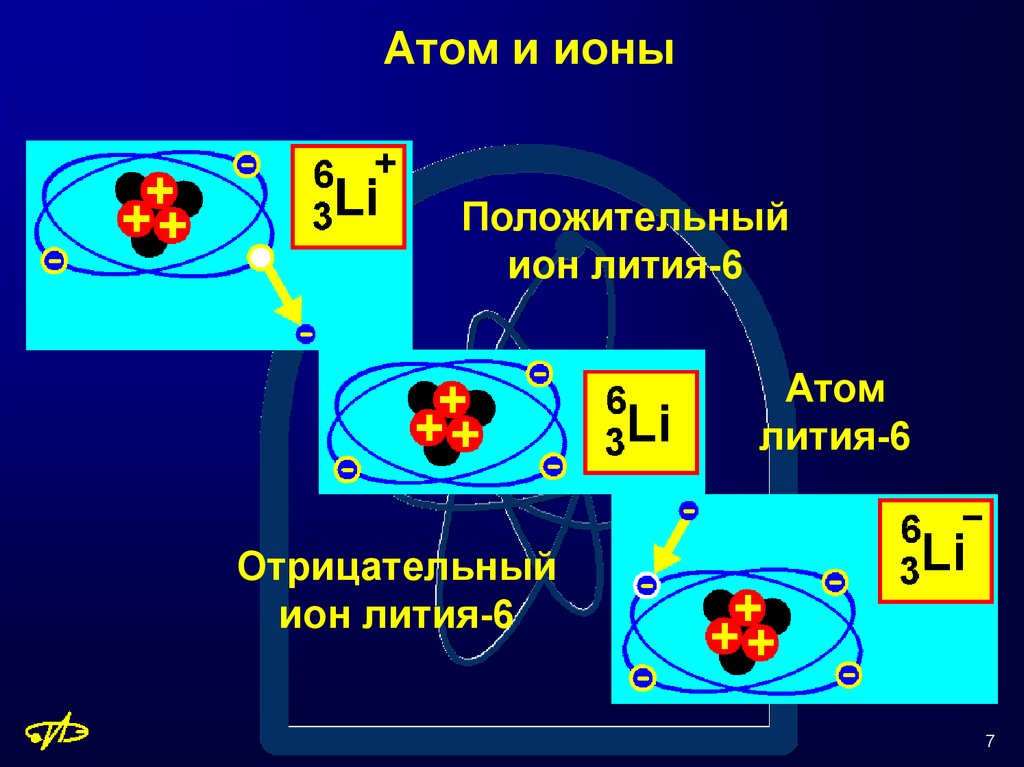


 Они даже нашли применение в медицине, поскольку наличие органического фрагмента позволяет использовать их как хорошо усваивающийся германий. Наиболее распространенный сесквиоксид 2-карбоксиэтигермания, впервые полученный в ИОХ АН СССР, до недавнего времени использовали в качестве биодобавки».
Они даже нашли применение в медицине, поскольку наличие органического фрагмента позволяет использовать их как хорошо усваивающийся германий. Наиболее распространенный сесквиоксид 2-карбоксиэтигермания, впервые полученный в ИОХ АН СССР, до недавнего времени использовали в качестве биодобавки». 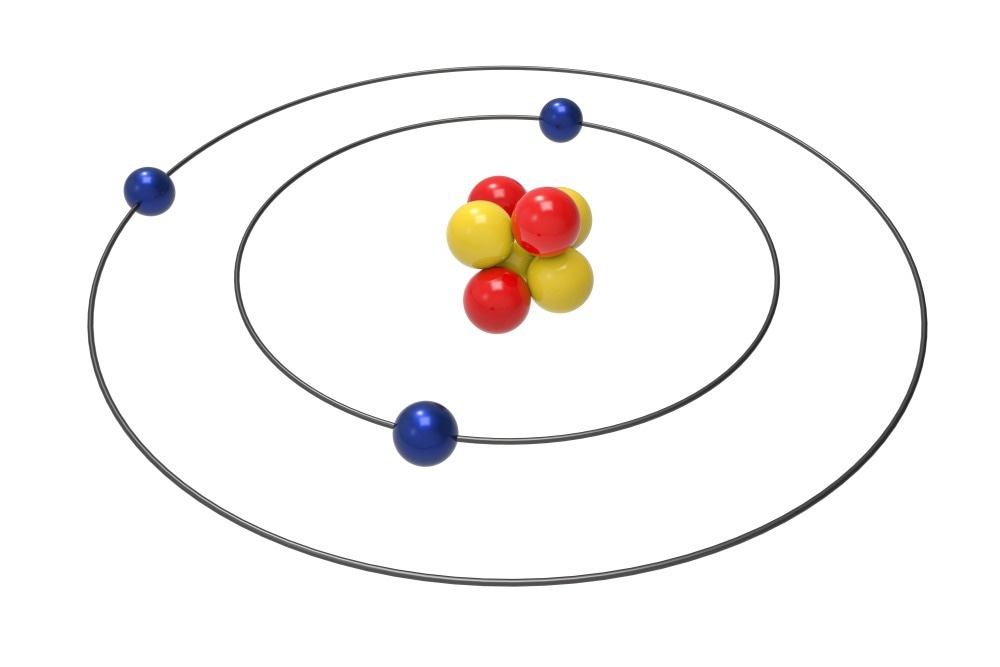
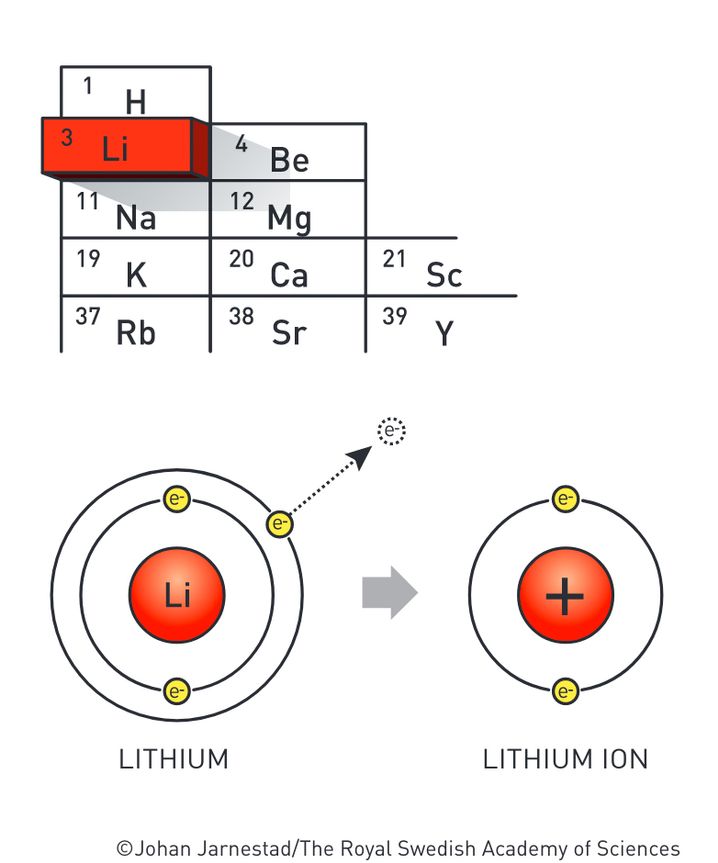
 Атомный номер лития равен 3. Любой атом, имеющий 3 протона , должен быть атомом лития.
Атомный номер лития равен 3. Любой атом, имеющий 3 протона , должен быть атомом лития.