Анод заряжен как: что это такое, плюс или минус, определяем полярность — ЭкоДом: Дом своими руками
Содержание
что это такое, плюс или минус, определяем полярность
Часто возникает проблема определения, какой из электродов является катодом, а какой — анодом. Для начала нужно разобраться с терминами.
Понятие катода и анода — простое объяснение
В сложных веществах электроны между атомами в соединениях распределены неодинаково. В результате взаимодействия частицы перемещаются от атома одного вещества к атому другого. Реакция именуется окислительно-восстановительной. Потеря электронов называется окислением, элемент, отдающий электроны — восстановителем.
Присоединение электронов носит название восстановление, принимающий элемент в этом процессе — окислитель. Переход электронов от восстановителя к окислителю может протекать по внешней цепи, и тогда его можно использовать в качестве источника электрической энергии. Устройства, в которых энергия химической реакции превращается в электрическую энергию, называются гальваническими элементами.
Простейший классический пример гальванического элемента — две пластины, изготовленные из различного металла и погруженные в раствор электролита. В такой системе окисление происходит на одном металле, а восстановление — на другом.
ВАЖНО! Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление — катодом.
Из школьных учебников химии известен пример медно-цинкового гальванического элемента, работающего за счет энергии реакции между цинком и сульфатом меди. В устройстве Якоби — Даниэля пластина из меди помещена в раствор сульфата меди (медный электрод), цинковая пластина погружена в раствор сульфата цинка (цинковый электрод). Цинковый электрод отдает катионы в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор обедняется катионами, здесь раствор заряжен отрицательно.
Замыкание внешней цепи заставляет электроны перетекать от цинкового электрода к медному.
Энергия самопроизвольно протекающей химической реакции превращается в электрическую.
Если химическую реакцию провоцирует внешняя энергия электрического тока, идёт процесс, называемый электролизом. Процессы, протекающие при электролизе, обратны процессам, протекающим при работе гальванического элемента.
ВНИМАНИЕ! Электрод, на котором происходит восстановление, также называется катодом, но при электролизе он заряжен отрицательно, а анод — положительно.
Применение в электрохимии
Аноды и катоды принимают участие во многих химических реакциях:
- Электролиз;
- Электроэкстракция;
- Гальваностегия;
- Гальванопластика.
Электролизом расплавленных соединений и водных растворов получают металлы, производят очистку металлов от примесей и извлечение ценных компонентов (электролитическое рафинирование). Из металла, подлежащего очистке, отливают пластины. Они помещаются в качестве анодов в электролизер. Под воздействием электрического тока металл подвергается растворению. Его катионы переходят в раствор и разряжаются на катоде, образуя осадок чистого металла. Примеси, содержащиеся в первоначальной неочищенной металлической пластине, либо остаются нерастворимыми в виде анодного шлама, либо переходят в электролите, откуда удаляются. Электролитическому рафинированию подвергают медь, никель, свинец, золото, серебро, олово.
Из металла, подлежащего очистке, отливают пластины. Они помещаются в качестве анодов в электролизер. Под воздействием электрического тока металл подвергается растворению. Его катионы переходят в раствор и разряжаются на катоде, образуя осадок чистого металла. Примеси, содержащиеся в первоначальной неочищенной металлической пластине, либо остаются нерастворимыми в виде анодного шлама, либо переходят в электролите, откуда удаляются. Электролитическому рафинированию подвергают медь, никель, свинец, золото, серебро, олово.
Электроэкстракция — процесс выделения металла из раствора в ходе электролиза. Для того чтобы металл перешёл в раствор, его обрабатывают специальными реагентами. В ходе процесса на катоде происходит выделение металла, характеризующегося высокой чистотой. Так получают цинк, медь, кадмий.
Чтобы избежать коррозии, придать прочность, украсить изделие поверхность одного металла покрывают слоем другого. Этот процесс называется гальваностегией.
Гальванопластика — процесс получения металлических копий с объёмных предметов электроосаждением металла.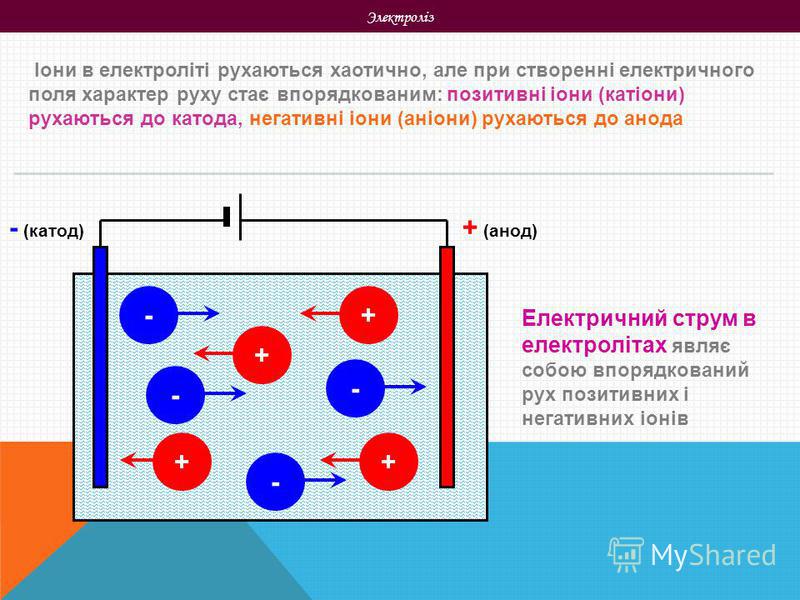
Применение в вакуумных электронных приборах
Принцип действия катода и анода в вакуумном приборе может продемонстрировать электронная лампа. Она выглядит как герметически запаянный сосуд с металлическими деталями внутри. Прибор используется для выпрямления, генерирования и преобразования электрических сигналов. По числу электродов выделяют:
- диоды;
- триоды;
- тетроды;
- пентоды и т.д.
Диод — вакуумный прибор с двумя электродами, катодом и анодом. Катод подключен к отрицательному полюсу источника питания, анод — к положительному. Предназначение катода — испускать электроны под действием нагрева электрическим током до определенной температуры. Посредством испущенных электронов создается пространственный заряд между катодом и анодом. Самые быстрые электроны устремляются к аноду, преодолевая отрицательный потенциальный барьер объемного заряда. Анод принимает эти частицы. Создается анодный ток во внешней цепи. Электронным потоком управляют с помощью дополнительных электродов, подавая на них электрический потенциал.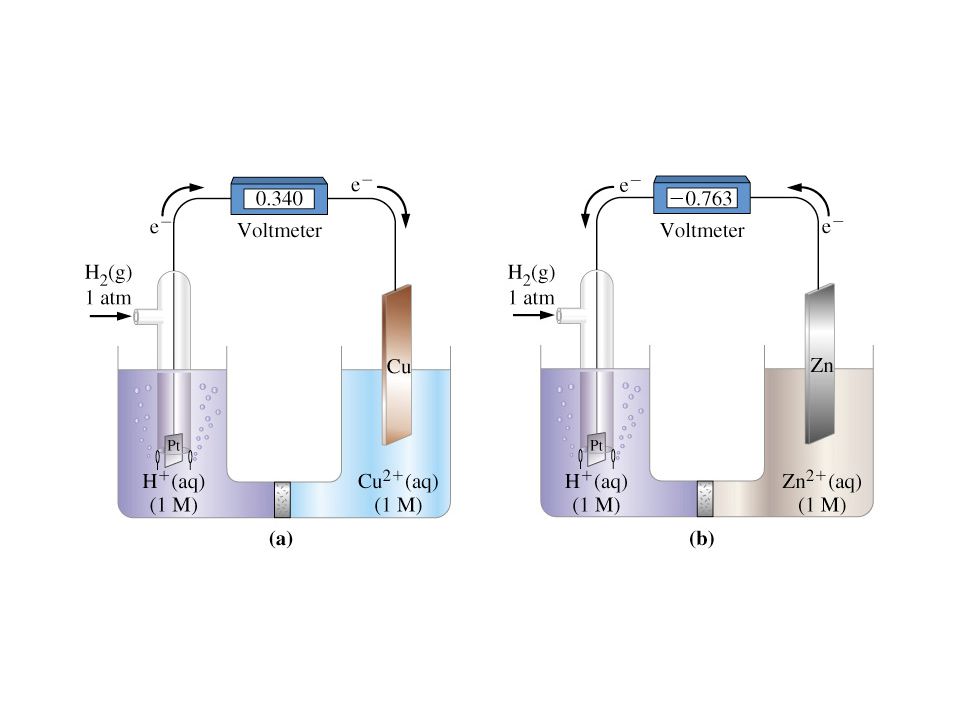
Применение в электронике
Сегодня используется полупроводниковые типы диодов.
В электронике широко используется свойство диодов пропускать ток в прямом направлении и не пропускать в обратном.
Работа светодиода основана на свойстве кристаллов полупроводников светиться при пропускании через p-n переход тока в прямом направлении.
Гальванические источники постоянного тока — аккумуляторы
Химические источники электрического тока, в которых протекают обратимые реакции, называются аккумуляторами: их перезаряжают и используют многократно.
При работе свинцового аккумулятора происходит окислительно-восстановительная реакция. Металлический свинец окисляется, отдает свои электроны, восстанавливая диоксид свинца, принимающего электроны. Металлический свинец в аккумуляторе — анод, он заряжен отрицательно. Диоксид свинца — катод и заряжен положительно.
По мере разряда аккумулятора расходуются вещества катода и анода и их электролита, серной кислоты.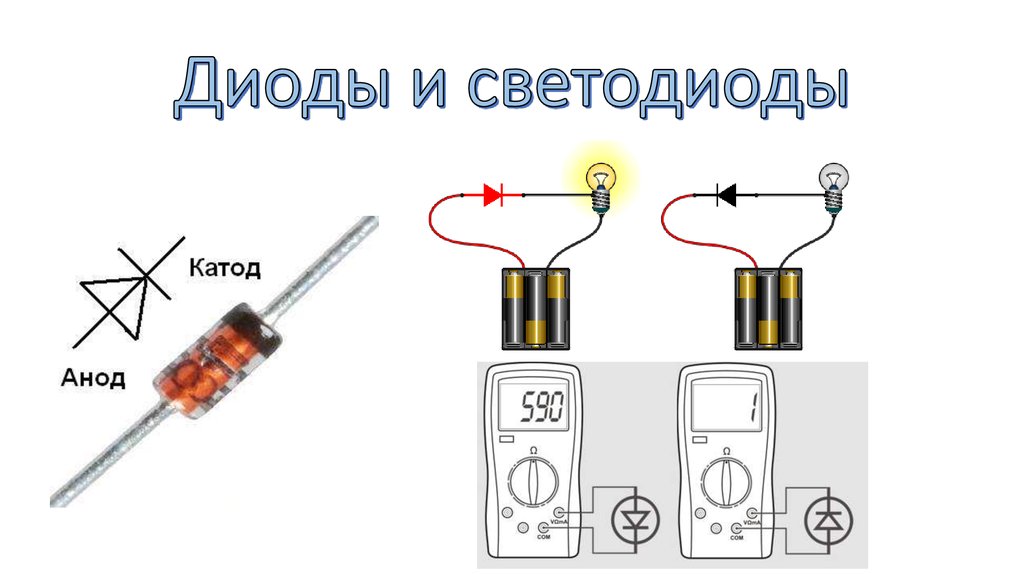 Чтобы зарядить аккумулятор, его подключают к источнику тока (плюсом к плюсу, минусом к минусу). Направление тока теперь обратное тому, какое было при разряде аккумулятора. Электрохимические процессы на электродах «обращаются». Теперь свинцовый электрод становится катодом, на нем проходит процесс восстановления, а диоксид свинца — анодом, с протекающей процедурой окисления. В аккумуляторе вновь создаются вещества, необходимые для его работы.
Чтобы зарядить аккумулятор, его подключают к источнику тока (плюсом к плюсу, минусом к минусу). Направление тока теперь обратное тому, какое было при разряде аккумулятора. Электрохимические процессы на электродах «обращаются». Теперь свинцовый электрод становится катодом, на нем проходит процесс восстановления, а диоксид свинца — анодом, с протекающей процедурой окисления. В аккумуляторе вновь создаются вещества, необходимые для его работы.
Почему существует путаница?
Проблема возникает из-за того, что определенный знак заряда не может быть прочно закреплен за анодом или катодом. Часто катодом является положительно заряженный электрод, а анодом — отрицательный. Часто, но не всегда. Все зависит от процесса, протекающего на электроде.
ВНИМАНИЕ! Деталь, которую поместили в электролит, может быть и анодом и катодом. Все зависит от цели процесса: нужно нанести на нее другой слой металла или снять его.
Как определить анод и катод
В электрохимии анод — это электрод, на котором идут процессы окисления, катод — это электрод, где происходит восстановление.
У диода отводы называются анод и катод. Ток будет идти через диод, если отвод анод подключить к «плюсу», отвод «катод» — к «минусу».
У нового светодиода с необрезанными контактами анод и катод определяются визуально по длине. Катод короче.
Если контакты обрезаны, поможет батарейка, приложенная к ним. Свет появится, когда полярности совпадут.
Знак анода и катода
В электрохимии речь правильнее вести не о знаках зарядов электродов, а о процессах, на них идущих. На катоде проходит реакция восстановления, на аноде — окисления.
В электротехнике для протекания тока катод подключают к отрицательному полюсу источника тока, анод — к положительному.
Анод и катод: что это такое
Эти физические термины затрагивают области гальваники, химии, а также источников питания, полупроводниковой и вакуумной электроники. Зная, что такое анод и катод можно, к примеру, разобраться почему греется телефон. В статье описывается, что из себя представляют анод и катод, объясняется катод и анод – это плюс или минус. Помимо этого, затрагиваются аспекты и нюансы заряда катода и анода.
Помимо этого, затрагиваются аспекты и нюансы заряда катода и анода.
Анод и катод.
Что это такое
Анод – является электродом, через который электрический ток проникает в устройство. Он является противоположностью катоду, электроду, через который электрический ток покидает электрическое устройство. Направление электрического тока в цепи отличается вектора потока электронов. В связи с этим (отрицательно заряженные) электроны вытекают из анода во внешний контур. Анод в гальваническом элементе представлен электродом, где происходит реакция окисления.
Эти понятия обусловлены не полярностью напряжения электродов, а направлением тока через электрод. Если ток, который идёт через электроды, изменяет своё направление, как это происходит, например, в перезаряжаемой батарее (во время зарядки), анод и катод меняются местами.
Обычный ток зависит не только от направления движения носителей заряда, но и от электрозаряда носителей. Электрический ток вне устройства обычно переносится электронами в проводнике из металла.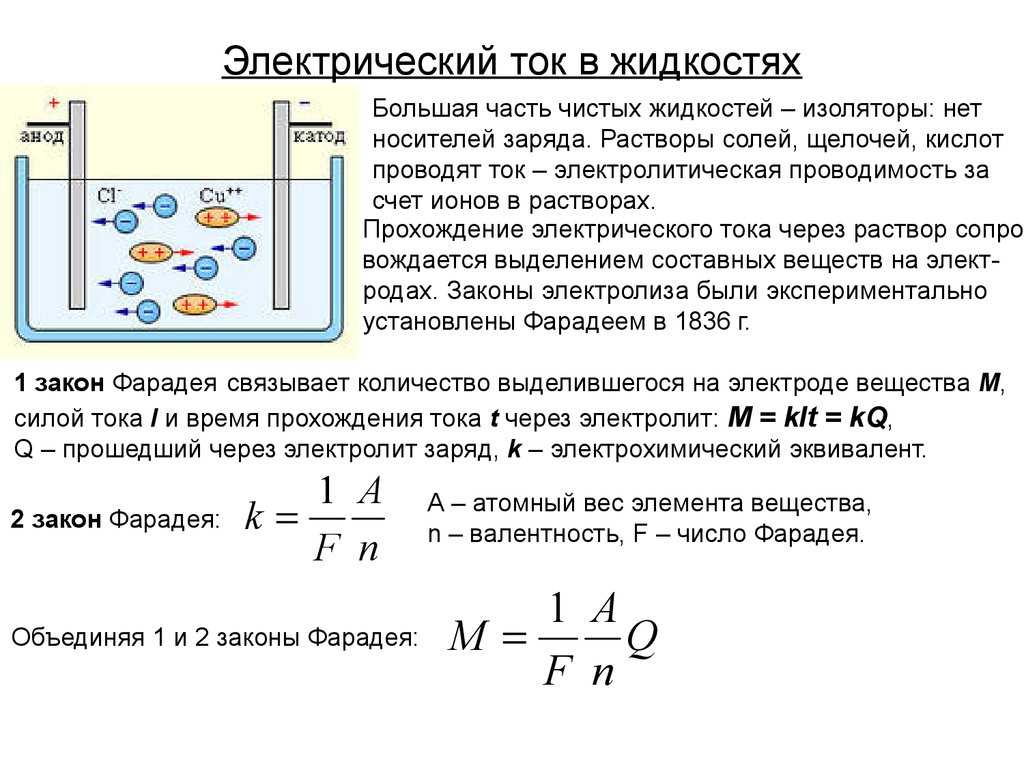
Полярность напряжения на аноде по отношению к связанному катоду меняется из-за разновидности аппарата и его режима работы. В представленных примерах анод является отрицательным в устройстве (обеспечивает питание) и положительным в устройстве, которое потребляет энергию. В разных областях применения анод может быть положительным или отрицательный.
Анод в гальваническом элементе
Тут он является отрицательным выводом, потому что именно там обычный ток протекает в устройство (элемент аккумулятора). Этот внутренний электрический ток переносится извне электронами, движущимися наружу. Притом отрицательный заряд, протекающий в одном направлении, электрически эквивалентен положительному заряду, который протекает противоположном направлении.
В перезаряжаемой батарее или в электролизере
Здесь же анод является положительным выводом, который получает ток от внешнего генератора.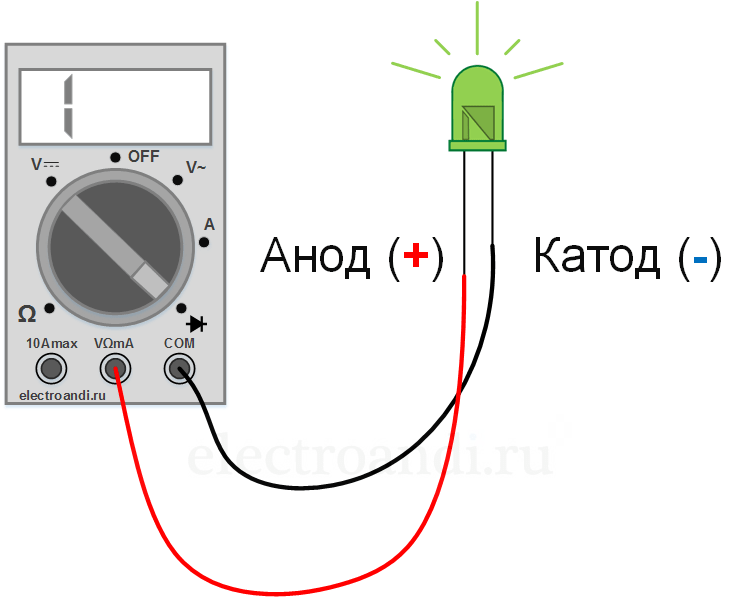 Ток через перезаряжаемую батарею противоположен направлению тока во время разряда. Иными словами, электрод, который был катодом во время разрядки батареи, становится анодом во время процесса её зарядки.
Ток через перезаряжаемую батарею противоположен направлению тока во время разряда. Иными словами, электрод, который был катодом во время разрядки батареи, становится анодом во время процесса её зарядки.
Электронно-лучевая труба
Тут является положительным выводом, через который электроны вытекают из устройства. Иначе: туда, где течет положительный электрический ток.
Вакуумная трубка анода
В электронных вакуумных устройствах, таких как электронно-лучевая трубка, анод – это положительно заряженный электронным коллектор. В трубке анод представляет собой заряженную положительную пластину, которая собирает электроны, испускаемые катодом через электрическое притяжение. Это параллельно ускоряет поток этих электронов.
В электрохимии анод находится там, где происходит окисление, и является контактом с положительной полярностью в электролизере. На аноде электрические потенциалы заставляют анионы (отрицательные ионы) вступать в химическую реакцию и испускать электроны (окисление), которые затем попадают в цепь управления.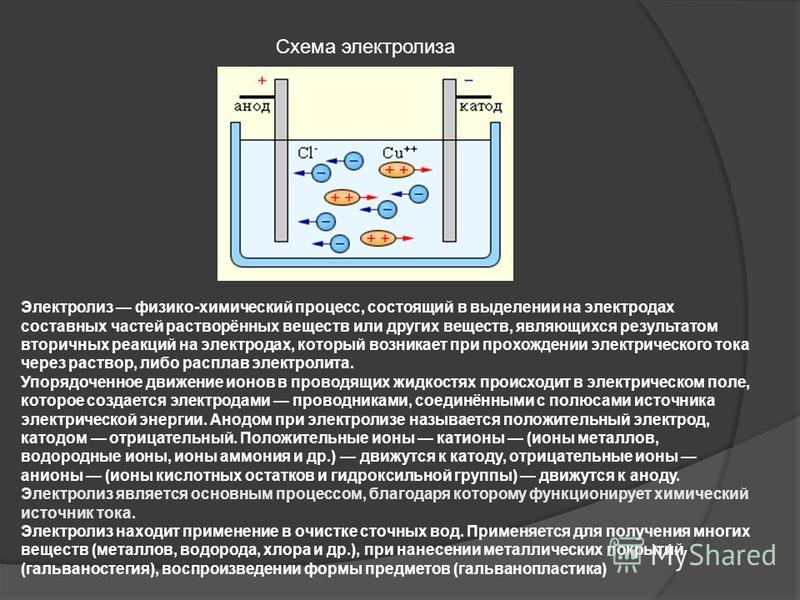
Диодный анод
В полупроводниковом диоде анодом является легированным слоем P, который изначально создает отверстия для соединения. В области соединения отверстия, подаваемые анодом, объединяются с электронами, подаваемыми из области с N-легированием, создавая истощённую зону. Когда положительное напряжение подается на анод диода из схемы, большее количество отверстий может быть перенесено в обедненную область, и это приводит к тому, что диод становится проводящим, позволяя току протекать по цепи.
Термины «анод» и «катод» не должны применяться к стабилитрону, так как он даёт возможность протекать току в любом направлении в зависимости от полярности напряжения.
В электрохимии
Тут анод расположен там, где происходит окисление, и является контактом с положительной полярностью в электролизере. На аноде электрические потенциалы заставляют анионы (отрицательные ионы) вступать в химическую реакцию и испускать электроны (окисление), которые затем попадают в цепь управления.
Такой процесс широко применяется для рафинирования металлов. При рафинировании меди медные аноды (те промежуточные продукты из печей) претерпевают электролиз в подходящем растворе (таком как серная кислота) для получения катодов высокой чистоты. Медные катоды, полученные с использованием этого метода, также называют электролитической медью.
Катод – это электрод, от которого обычный ток покидает электрический аппарат. Тут у электронов заряд электрический заряд под знаком «минус», поэтому движение электронов противоположно движению обычного потока тока. Катодный электрический ток отходит, что также означает, что электроны поступают в катод устройства из внешней цепи.
Полярность катода и анода – это положительное или отрицательное значение, что зависит от работы устройства. Хотя положительно заряженные катионы всегда движутся к катоду (отсюда и их название), а отрицательно заряженные анионы удаляются от него, полярность катода зависит от типа устройства и может даже варьироваться в зависимости от режима работы.
В устройстве, поглощающем энергию заряда (зарядка батареи), катод является отрицательным (электроны вытекают из катода, и заряд проникает туда) и в аппарате, который снабжает энергией (используемая батарея), катод положительный (электроны втекают в него и заряд уходит). Используемая батарея обладает катодом (положительный вывод), поскольку именно там ток течет из устройства. Этот внешний ток переносится изнутри положительными ионами, движущимися от электролита к положительному катоду (химическая энергия отвечает за движение в гору). Это поддерживается электронами, которые направляются к батарее.
Например, медный электрод гальванического элемента Даниэля является положительным выводом и одновременно катодом. Это происходит тогда, когда заряд поступает в батарею. Например, изменение направления тока в гальваническом элементе Даниэля превращает его в электролизер. Тут медный электрод одновременно является как положительным выводом, так и анодом. В диоде катод является отрицательным выводом на остроконечном конце символа стрелки, откуда ток течет из устройства.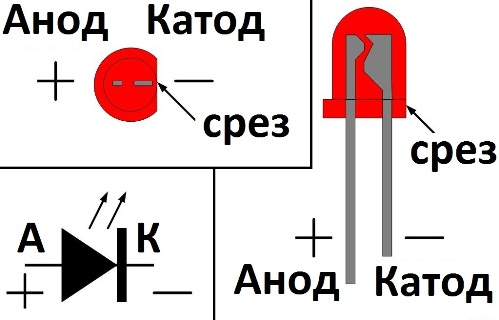
В электролизере на катоде применяется отрицательная полярность для активации элемента. Общими результатами восстановления на катоде являются газообразный водород или чистый металл из ионов металлов. Говоря об относительной восстановительной способности двух окислительно-восстановительных агентов, считается, что пара для генерирования большего количества восстанавливающих веществ является более «катодной» по сравнению с более легко восстанавливаемым реагентом.
Как определить анод и катод
Электрическая схема катода и анода:
Различие между катодом и анодом основано исключительно на токе, а не на напряжении. Металл, используемый для катода, имеет значительно большее количество электронов, чем нейтроны или протоны.
Например, один из потребителей энергии находится в прямом включении. Далее, ток по аноду из внешней цепи проникает в элемент. Во внешнюю цепь прямо через катод из элемента выходит электрический ток. Это чем-то напоминает перевёрнутое изображение.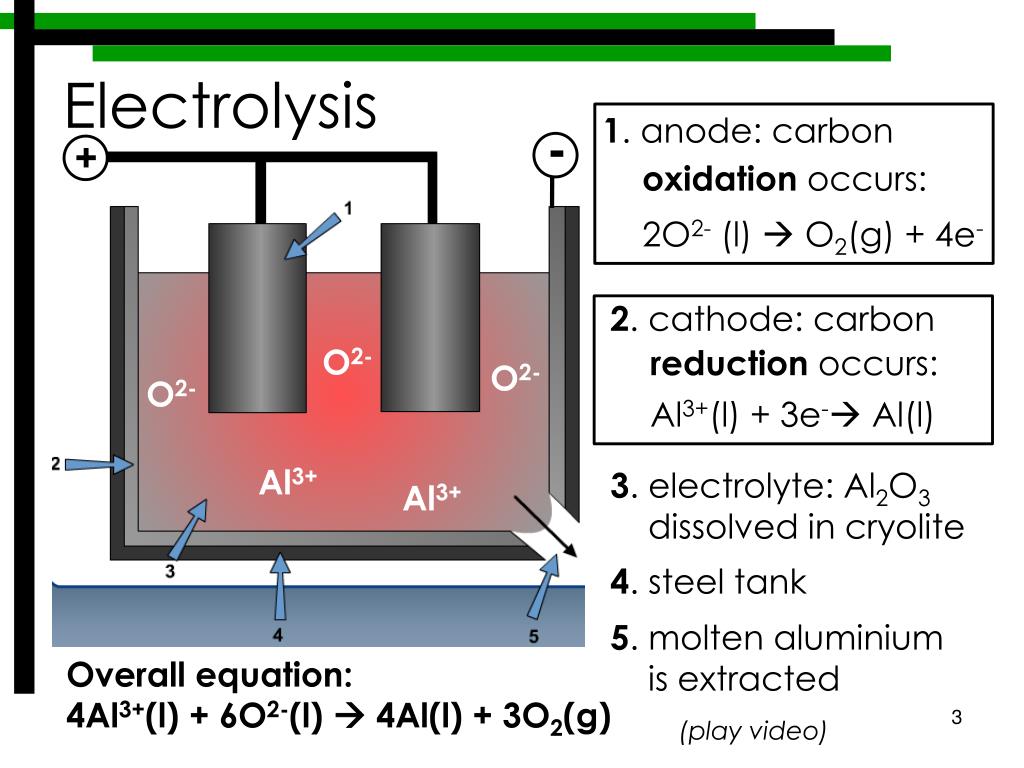 Если данные обозначения сложные, то тут разобраться с ними могут только химики. Теперь надо сделать обратное включение. В этом случае диоды полупроводникового типа почти не будут проводить электрический ток. Тем не менее, есть вероятность обратного пробоя у элементов.
Если данные обозначения сложные, то тут разобраться с ними могут только химики. Теперь надо сделать обратное включение. В этом случае диоды полупроводникового типа почти не будут проводить электрический ток. Тем не менее, есть вероятность обратного пробоя у элементов.
Электровакуумные диоды (например, радиолампы) совсем не обладают способностью проводить ток обратного типа. Условно принято считать, что ток через них не протекает. В связи с этим формально выводы анода и катода у диодов не отвечают за выполнение этих функций.
При катодной защите металлический анод электрически связан с защищаемой системой и частично разъедает или растворяет металл защищаемой системы. Этот металлический анод большей степени реагирует на коррозионную среду защищаемой системы. Корпус железного или стального судна может быть защищен цинковым анодом, который растворяется в морской воде и предотвращает коррозию корпуса.
Менее очевидным примером такого типа защиты является процесс цинкования железа.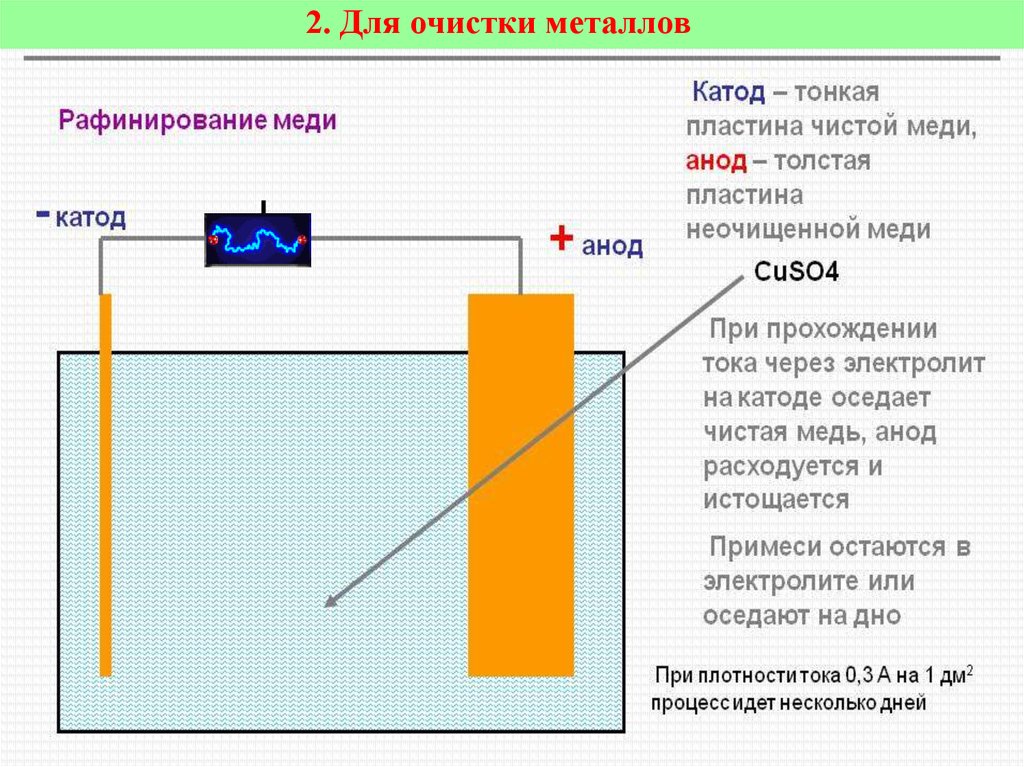 Такой процесс покрывает железные конструкции (такие как ограждение) покрытием из металлического цинка. Пока цинк остается неповрежденным, железо защищено от коррозии. С течением времени цинковое покрытие становится поврежденным, в результате потрескивания или физического повреждения.
Такой процесс покрывает железные конструкции (такие как ограждение) покрытием из металлического цинка. Пока цинк остается неповрежденным, железо защищено от коррозии. С течением времени цинковое покрытие становится поврежденным, в результате потрескивания или физического повреждения.
Знание того, что такое анод и катод, является ключевым в электрохимии и помогает понять основные принципы работы простейших аккумуляторов и гальванических элементов.
Анод — это… Что такое Анод?
Ано́д (др.-греч. ἄνοδος — движение вверх) — электрод некоторого прибора, присоединённый к положительному полюсу источника питания. Электрический потенциал анода положителен по отношению к потенциалу катода.
Анод в электрохимии
При процессах электролиза (получение элементов из солевых растворов и расплавов под действием постоянного электрического тока), анод — электрически положительный полюс, на нём происходят окислительно-восстановительные реакции (окисление), результатом которых, в определённых условиях, может быть разрушение (растворение) анода, что используется, к примеру, при электрорафинировании металлов.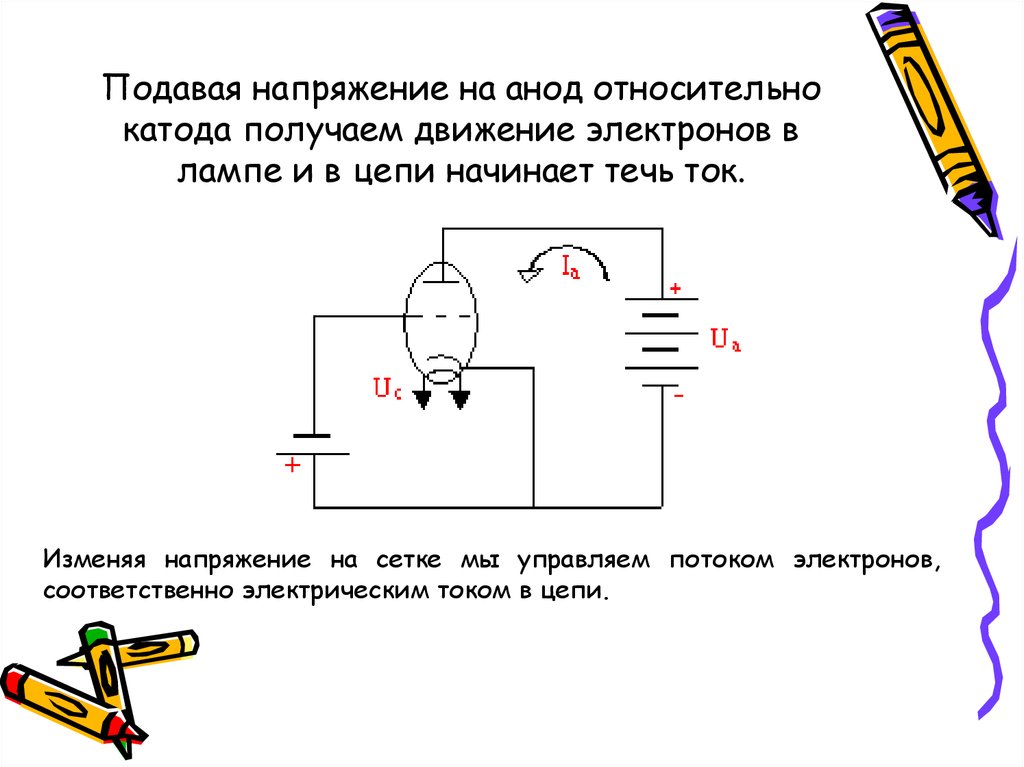
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде. Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Анод в вакуумных электронных приборах
В вакуумных электронных приборах анод — электрод, который притягивает к себе летящие электроны, испущенные катодом. В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны. А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
Анод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключённый к положительному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют анодом, подключённый к отрицательному полюсу — катодом.
Знак анода и катода
В литературе встречается различное обозначение знака анода — «+» или «-», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление[1]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод.
В соответствии с таким толкованием, для аккумулятора анод и катод меняются местами в зависимости от направления тока внутри аккумулятора[2][3].
В электротехнике анод — положительный электрод, ток течет от анода к катоду, электроны, соответственно, наоборот.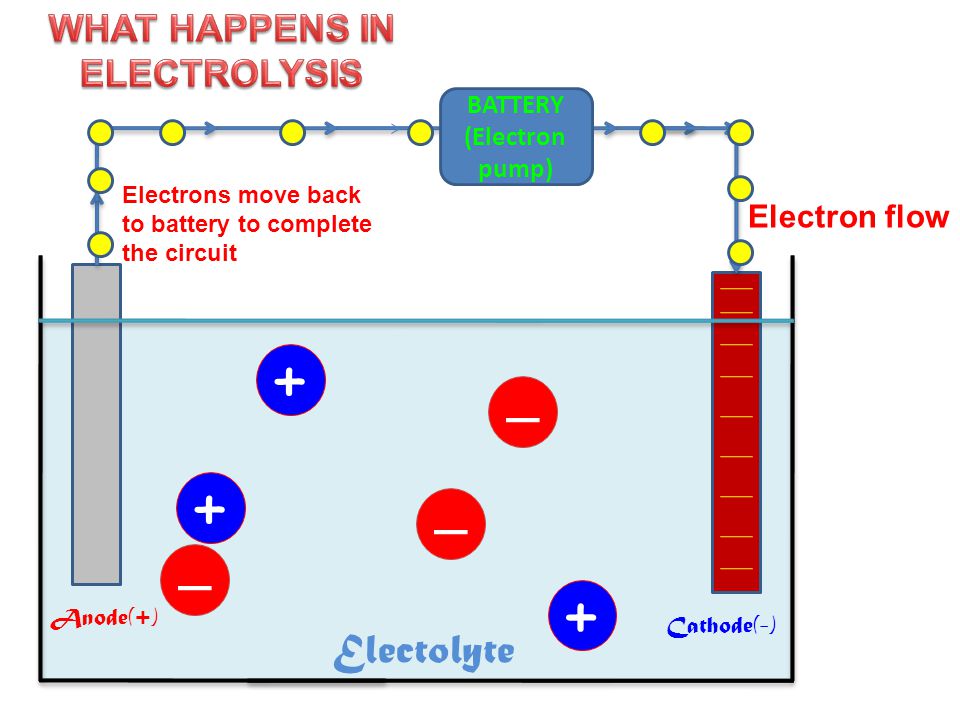
См. также
Литература
- ↑ Антропов Л. И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
Катод — это… Что такое Катод?
Катод (от греч. κάθοδος — ход вниз; возвращение) — электрод некоторого прибора, присоединённый к отрицательному полюсу источника тока.
Катод в электрохимии
В электрохимии катод — электрод, на котором происходят реакции восстановления. Например, при электролитическом рафинировании металлов (меди, никеля и пр.) на катоде осаждается очищенный металл.
Катод в вакуумных электронных приборах
В вакуумных электронных приборах катод — электрод, который является источником свободных электронов, обычно вследствие термоэлектронной эмиссии. В электронно-лучевых приборах катод входит в состав электронной пушки.
В электронно-лучевых приборах катод входит в состав электронной пушки.
Катод у полупроводниковых приборов
Электрод полупроводникового прибора (диода, тиристора), подключённый к отрицательному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют катодом, подключённый к положительному полюсу — анодом.
Знак анода и катода
В литературе встречается различное обозначение знака катода — «-» или «+», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает процесс окисления[1][2]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.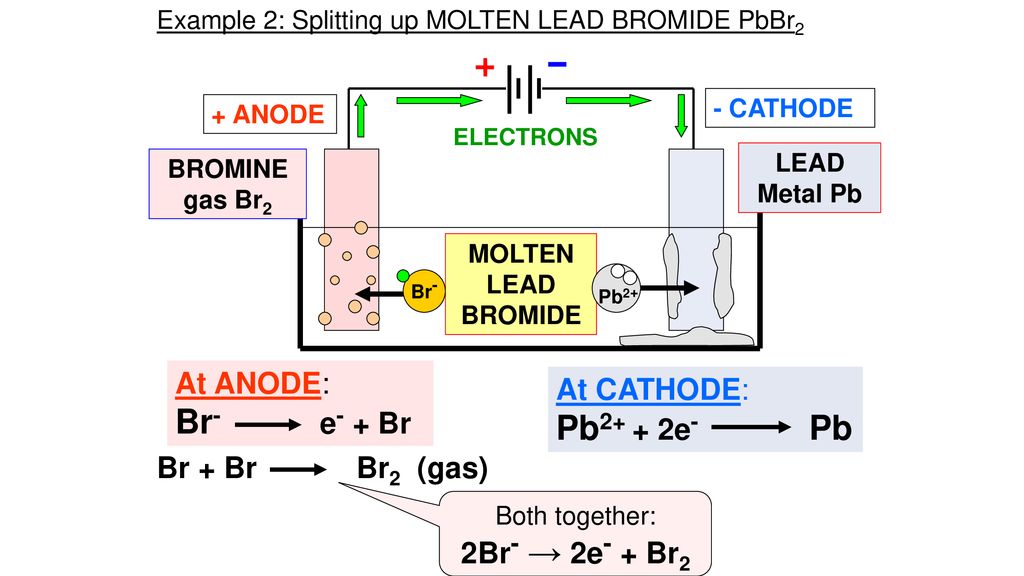
В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод. Так, на приведённой иллюстрации изображён обозначенный знаком «+» катод гальванического элемента, на котором происходит восстановление меди.
В соответствии с таким толкованием, для аккумулятора знак анода и катода меняется в зависимости от направления протекания тока. [2][3][4].
В электротехнике катод — отрицательный электрод, ток течет от анода к катоду, электроны, соответственно, наоборот.
См. также
Литература
- ↑ Антропов Л.
 И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13. - ↑ 12Лукомский Ю. Я., Гамбург Ю. Д. Физико-химические основы электрохимии: Учебник. — Долгопрудный : Издательский Дом «Интеллект», 2008. — С. 19 — ISBN 978-5-91559-007-5
- ↑ Левин А. И. Теоретические основы электрохимии. — М.: Металлургиздат, 1963. — С. 131.
- ↑ Справочник по электрохимии / Под ред. А. М. Сухотина. — Л. : Химия, 1981. — С. 405.
Ссылки
Катоды и аноды отрицательно и положительно заряженные электроды
Катод – это электрод устройства, который подключен к отрицательному полюсу источнику тока. Анод – противоположность ему. Это электрод прибора, подключенный к положительному полюсу источника тока.
Окислительно-восстановительный процесс на электродах
Обратите внимание! Чтобы легче запомнить разницу между ними, используют шпаргалку.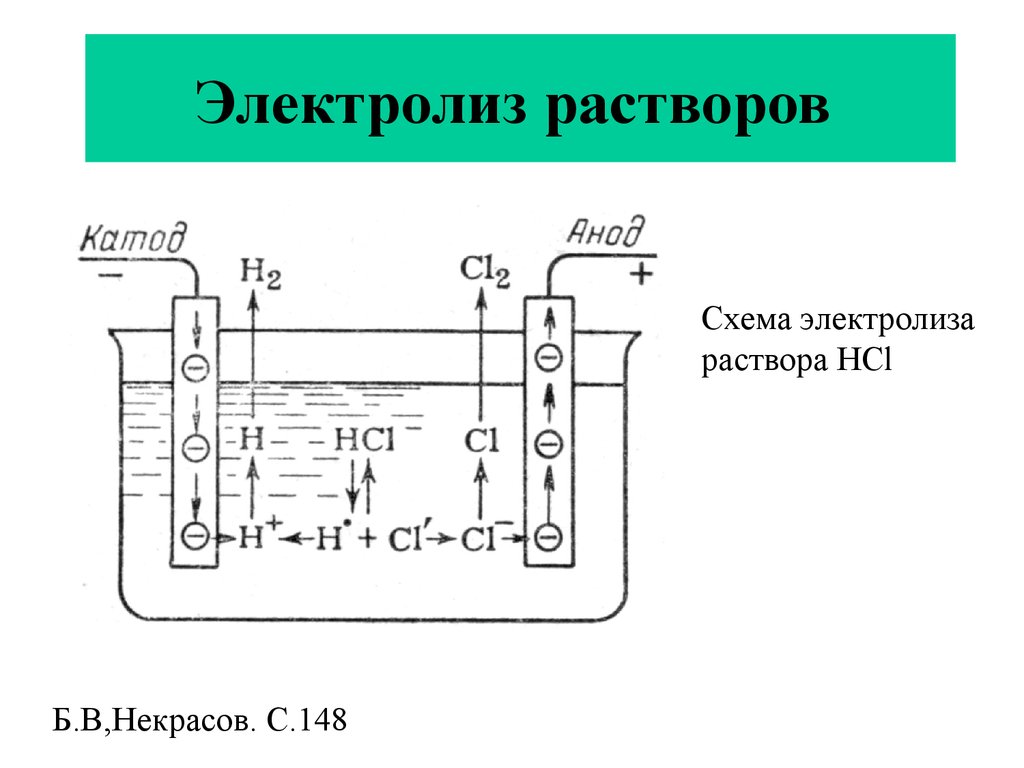 В словах «катод»-«минус», «анод»-«плюс» одинаковое число букв.
В словах «катод»-«минус», «анод»-«плюс» одинаковое число букв.
Применение в электрохимии
В этом разделе химии катод – это отрицательно заряженный электрический проводник (электрод), притягивающий к себе положительно заряженные ионы (катионы) во время процессов окисления и восстановления.
Электролитическое рафинирование – это электролиз сплавов и водных растворов. Большинство цветных металлов подвергаются такой очистке. При помощи электролитической очистки получается металл с высокой чистотой. Так, степень чистоты меди после рафинирования достигает 99,99%.
Электролиз меди
На положительном электрическом проводнике во время рафинирования или очистки проходит электролитический процесс. Во время него металл с примесями помещают в электролизер и делают анодом. Такие процессы проводятся при помощи внешнего источника электрической энергии и называются реакциями электролиза. Осуществляются в электролизерах. Он выполняет функцию электронасоса, нагнетающего отрицательно заряженные частицы (электроны) в отрицательный проводник и удаляющего его из анода. Откуда исходит ток, неважно.
Откуда исходит ток, неважно.
На катоде очищается металл от посторонних примесей. Простой катод изготавливается из вольфрама, иногда – из тантала. Достоинством вольфрамового отрицательного электрода является стойкость его изготовления. Из недостатков – имеет низкую эффективность и неэкономичность. Сложные катоды имеют разное устройство. У многих таких типов проводников на чистый металл сверху наносится специальный слой, который активирует получение большей производительности при относительно низких температурах. Они очень экономичны. Их недостаток состоит в небольшой устойчивости производительности.
Готовый чистый металл тоже называется катодом. Например, цинковый или платиновый катод. На производстве отрицательный проводник отделяют от катодной основы при помощи катодосдирочных машин.
При удалении отрицательно заряженных частиц из электрического проводника на нем создается анод, а при нагнетании отрицательно заряженных частиц на электрический проводник – катод. При электролизе очищаемого металла его положительные ионы притягивают к себе отрицательно заряженные частицы на отрицательном проводнике, и происходит восстановительный процесс. Чаще всего используют такие аноды:
Чаще всего используют такие аноды:
- цинковые;
- кадмиевые;
- медные;
- никелевые;
- оловянные;
- золотые;
- серебряные;
- платиновые.
Чаще всего на производстве используют цинковые аноды. Они бывают:
- катанные;
- литые;
- сферические.
Больше всего применяют катанные цинковые аноды. Еще используют никелевые и медные. А вот кадмиевые почти не используются из-за их токсичности для экологии. Бронзовые и оловянные аноды применяют при изготовлении радиоэлектронных печатных плат.
Гальванизация (гальваностегия) – процесс нанесения тонкого слоя металла на другой предмет с целью предотвращения коррозии изделия, окисления контактов в электронике, износостойкости, декорации. Суть процесса такая же, как при рафинировании.
Цинк и олово используют для повышения стойкости изделия при коррозии. Цинкование бывает холодным, горячим, гальваническим, газотермическим и термодиффузионным. Золото используют в основном в защитно-декоративных целях. Серебро повышает стойкость контактов электроприборов к окислению. Хром – для увеличения износостойкости и защиты от коррозии. Хромирование придает изделиям красивый и дорогой вид. Используется для нанесения на ручки, краны, колесные диски и т.д. Процесс хромирования токсичен, поэтому строго регламентируется законодательством разных стран. Ниже на картинке представлен метод гальванизации при помощи никеля.
Золото используют в основном в защитно-декоративных целях. Серебро повышает стойкость контактов электроприборов к окислению. Хром – для увеличения износостойкости и защиты от коррозии. Хромирование придает изделиям красивый и дорогой вид. Используется для нанесения на ручки, краны, колесные диски и т.д. Процесс хромирования токсичен, поэтому строго регламентируется законодательством разных стран. Ниже на картинке представлен метод гальванизации при помощи никеля.
Никелирование чайника методом гальванизации
Применение в вакуумных электронных приборах
Здесь катод выступает источником свободных электродов. Они образуются в ходе их выбивания из металла при высоких температурах. Положительно заряженный электрод притягивает электроны, выпущенные отрицательным проводником. В разных аппаратах он в разной степени собирает их в себя. В электронных трубках он полностью притягивает отрицательно заряженные частицы, а в электронно-лучевых приборах – частично, формируя в завершении процесса электронный луч.
Маркировка
Стандартно катод маркируют как «-». Знак анода – «+». А вот в гальванике, из-за того, что отрицательный заряд на проводнике снабжается не источником тока извне, а реакцией окисления металла, катод получит положительный заряд электрического проводника. Поэтому в аккумуляторах, когда ток меняет направление, происходит смена знаков «+» и «-».
Эти свойства катодов и анодов нашли широкое применение в промышленности при очистке металла и в гальваностегии.
Видео
Оцените статью:
Что такое анод и катод, в чем их практическое применение
Анод и катод известны многим людям, даже тем, которые не связаны с электрикой или электроникой. Катод это электрод, имеющий отрицательный заряд, а анод заряжен положительно. Чтобы это легко и быстро запомнить, есть одно правило. В слове «катод» пять букв, также как и в слове «минус», а «анод» – четыре буквы, аналогично слову «плюс». Катоды и аноды используются для электролиза, в том числе для получения многих металлов, например алюминия.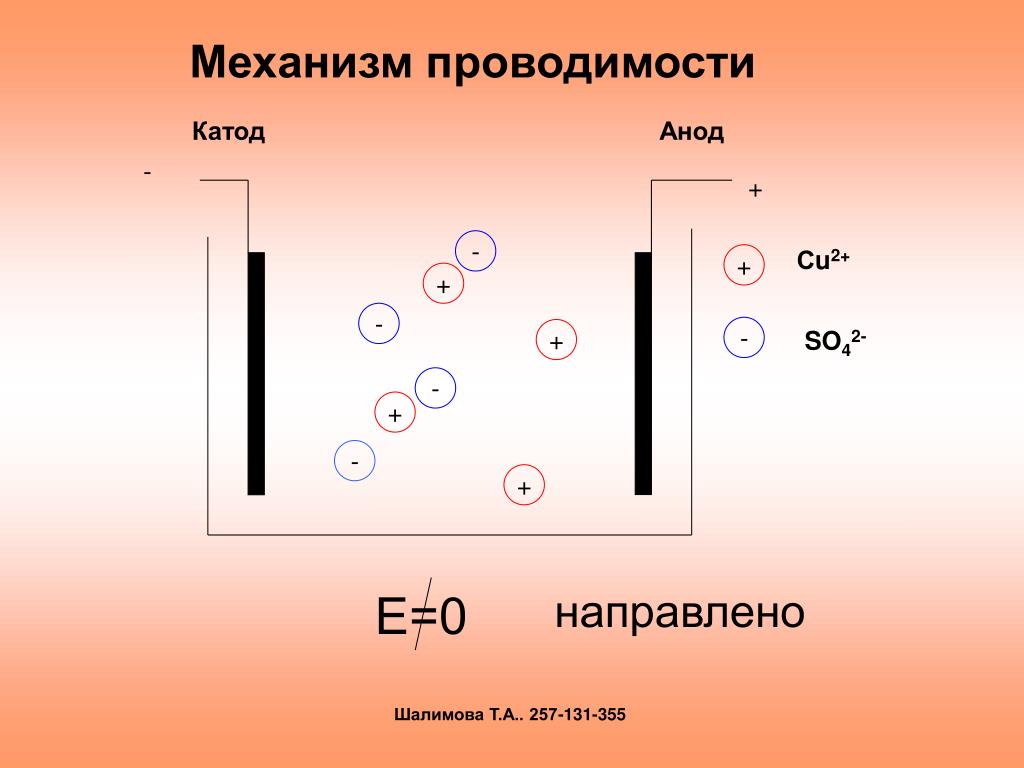 Они нашли широкое применения в современной промышленности, электроники и других сферах.
Они нашли широкое применения в современной промышленности, электроники и других сферах.
В статье будет подробно рассказано о том, что такое Анод и катод, а также для чего именно они нужны и какие физические законы за ними стоят. В качестве дополнения, настоящая статья имеет два ролика и статью, которую можно скачать по ссылке.
Анод и катод
Процессы, протекающие при электролизе
Электролиз получил широкое распространение в металлургии цветных металлов и в ряде химических производств. Такие металлы, как алюминий, цинк, магний, получают главным образом путем электролиза. Кроме того, электролиз используется для рафинирования (очистки) меди, никеля, свинца, а также для получения водорода, кислорода, хлора и ряда других химических веществ.
Сущность электролиза заключается в выделении из электролита при протекании через электролитическую ванну постоянного тока частиц вещества и осаждении их на погруженных в ванну электродах (электроэкстракция) или в переносе веществ с одного электрода через электролит на другой (электролитическое рафинирование). В обоих случаях цель процессов – получение возможно более чистых незагрязненных примесями веществ.
В обоих случаях цель процессов – получение возможно более чистых незагрязненных примесями веществ.
Любой электровакуумный прибор имеет электрод, предназначенный для испускания (эмиссии) электронов. Этот электрод называется катодом. Электрод, предназначенный для приема эмиттированных катодом электронов, называется анодом. На анод подают более высокий и положительный относительно катода потенциал.
В отличие от электронной электропроводности металлов в электролитах (растворах солей, кислот и оснований в воде и в некоторых других растворителях, а также в расплавленных соединениях) наблюдается ионная электропроводность. Электролиты являются проводниками второго рода. В этих растворах и расплавах имеет место электролитическая диссоциация – распад на положительно и отрицательно заряженные ионы.
Химия электролиза.
Если в сосуд с электролитом – электролизер поместить электроды, присоединенные к электрическому источнику энергии, то в нем начнет протекать ионный ток, причем положительно заряженные ионы – катионы будут двигаться к катоду (это в основном металлы и водород), а отрицательно заряженные ионы – анионы (хлор, кислород) – к аноду. У анода анионы отдают свой заряд и превращаются в нейтральные частицы, оседающие на электроде. У катода катионы отбирают электроны у электрода и также нейтрализуются, оседая на нем, причем выделяющиеся на электродах газы в виде пузырьков поднимаются кверху.
У анода анионы отдают свой заряд и превращаются в нейтральные частицы, оседающие на электроде. У катода катионы отбирают электроны у электрода и также нейтрализуются, оседая на нем, причем выделяющиеся на электродах газы в виде пузырьков поднимаются кверху.
Электрический ток во внешней цепи представляет собой движение электронов от анода к катоду. При этом раствор обедняется, и для поддержания непрерывности процесса электролиза приходится его обогащать. Так осуществляют извлечение тех или иных веществ из электролита (электроэкстракцию). Если же анод может растворяться в электролите по мере обеднения последнего, то частицы его, растворяясь в электролите, приобретают положительный заряд и направляются к катоду, на котором осаждаются, тем самым осуществляется перенос материала с анода на катод. Так как при этом процесс ведут так, чтобы содержащиеся в металле анода примеси не переносились на катод, такой процесс называется электролитическим рафинированием.
Если электрод поместить в раствор с ионами того же вещества, из которого он изготовлен, то при некотором потенциале между электродом и раствором не происходит ни растворения электрода, ни осаждения на нем вещества из раствора.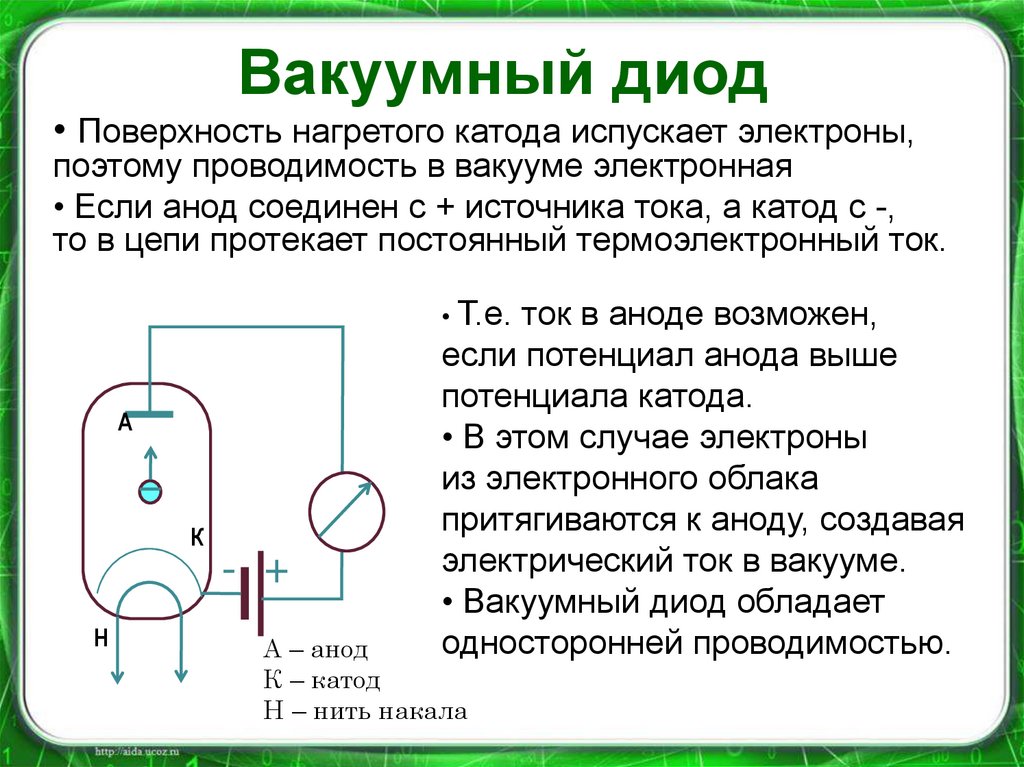
Такой потенциал называется нормальным потенциалом вещества. Если на электрод подать более отрицательный потенциал, то на нем начнется выделение вещества (катодный процесс), если же более положительный, то начнется его растворение (анодный процесс). Значение нормальных потенциалов зависит от концентрации ионов и температуры. Принято считать нормальный потенциал водорода за нуль. В табл. 1 даны нормальные электродные потенциалы некоторых водных растворов веществ при +25° С.
Если в электролите имеются ионы разных металлов, то первыми на катоде выделяются ионы, имеющие меньший отрицательный нормальный потенциал (медь, серебро, свинец, никель), щелочноземельные металлы выделить труднее всего. Кроме того, в водных растворах всегда имеются ионы водорода, которые будут выделяться ранее, чем все металлы, имеющие отрицательный нормальный потенциал, поэтому при электролизе последних значительная или даже большая часть энергии затрачивается на выделение водорода.
Два разнополярных электрода
Путем специальных мер можно воспрепятствовать в известных пределах выделению водорода, однако металлы с нормальным потенциалом меньше 1 В (например, магний, алюминий, щелочноземельные металлы) получить электролизом из водного раствора не удается. Их получают разложением расплавленных солей этих металлов. Нормальные электродные потенциалы веществ являются минимальными, при них начинается процесс электролиза, практически требуются большие значения потенциала для развития процесса.
Их получают разложением расплавленных солей этих металлов. Нормальные электродные потенциалы веществ являются минимальными, при них начинается процесс электролиза, практически требуются большие значения потенциала для развития процесса.
Разность между действительным потенциалом электрода при электролизе и нормальным для него потенциалом называют перенапряжением. Оно увеличивает потери энергии при электролизе. С другой стороны, увеличивая перенапряжение для ионов водорода, можно затруднить его выделение на катоде, что позволяет получить электролизом из водных растворов ряд таких более отрицательных по сравнению с водородом металлов, как свинец, олово, никель, кобальт, хром и даже цинк. Это достигается ведением процесса при повышенных плотностях тока на электродах, а также введением в электролит некоторых веществ.
Это интересно! Все о полупроводниковых диодах.
Течение катодных и анодных реакций при электролизе определяется следующими двумя законами Фарадея.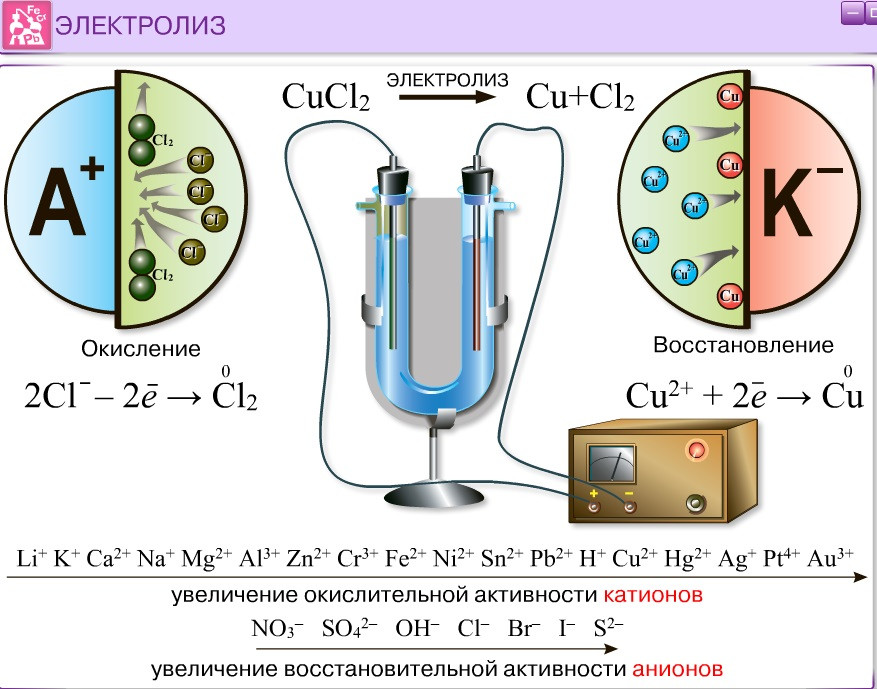
- Масса вещества mэ, выделившегося при электролизе на катоде или перешедшего с анода в электролит, пропорциональна количеству прошедшего через электролит электричества Iτ: mэ = α/τ,здесь а – электрохимический эквивалент вещества, г/Кл.
- Масса выделенного при электролизе вещества одним и тем же количеством электричества прямо пропорциональна атомной массе вещества А и обратно пропорциональна его валентности n: mэ= А / 96480n, здесь 96480 – число Фарадея, Кл х моль-1.
Таким образом, электрохимический эквивалент вещества α= А / 96480n представляет собой массу вещества в граммах, выделяемую единицей проходящего через электролитическую ванну количества электричества – кулоном (ампер-секундой).
Для меди А = 63,54, n =2, α =63,54/96480-2= 0,000329 г/Кл, для никеля α =0,000304 г/Кл, для цинка α=0,00034 г/Кл. В действительности масса выделившегося вещества всегда меньше указанной, что объясняется рядом побочных процессов, проходящих в ванне (например, выделением водорода на катоде), утечками тока и короткими замыканиями между электродами. Отношение массы фактически выделившегося вещества к массе его, которая должна была бы выделиться по закону Фарадея, носит название выхода вещества по току η1.
В действительности масса выделившегося вещества всегда меньше указанной, что объясняется рядом побочных процессов, проходящих в ванне (например, выделением водорода на катоде), утечками тока и короткими замыканиями между электродами. Отношение массы фактически выделившегося вещества к массе его, которая должна была бы выделиться по закону Фарадея, носит название выхода вещества по току η1.
Следовательно, для реального процесса mэ = η1 х (А / 96480n) х It. Естественно, всегда η1<1. Выход по току существенно зависит от плотности тока на электроде. С увеличением плотности тока на электроде выход по току растет и повышается эффективность процесса.
Напряжение Uэл, которое необходимо подвести к электролизеру, состоит из: напряжения разложения Ер (разность потенциалов анодной и катодной реакций), суммы анодного и катодного перенапряжений падения напряжения в электролите Еп, падения напряжения в электролите Uэ = IRэп (Rэп – сопротивление электролита), падения напряжения в шинах, контактах, электродах Uс = I(Rш+Rк+Rэ).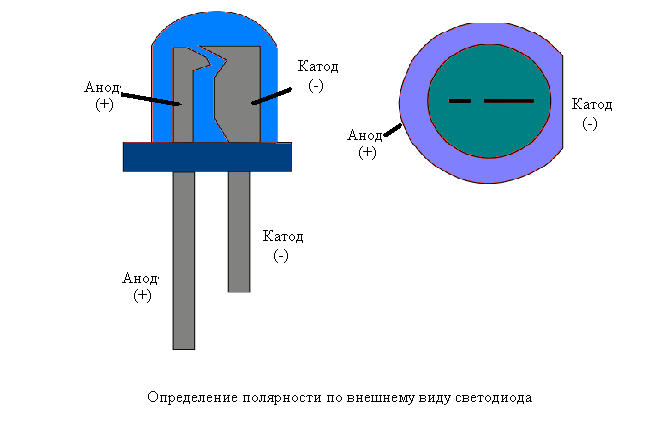 Получаем: Uэл = Ер + Еп + Uэ + Uс.
Получаем: Uэл = Ер + Еп + Uэ + Uс.
Устройство гальванической цепи.
Мощность, потребляемая при электролизе, равна: Рэл = IUэл = I(Ер + Еп + Uэ + Uс). Из этой мощности только первая составляющая расходуется на проведение реакций, остальные являются тепловыми потерями процесса. Лишь при электролизе расплавленных солей часть теплоты, выделяющейся в электролите IUэ, используется полезно, так как расходуется на расплавление загружаемых в электролизер солей.
Эффективность работы электролизной ванны, может быть оценена массой вещества в граммах, выделяемого на 1 Дж затраченной электроэнергии. Эта величина носит название выхода вещества по энергии.Ее можно найти по выражению qэ = (αη1)/Uэл100, здесь α – электрохимический эквивалент вещества, г/Кл, η1 – выход по току, Uэл – напряжение на электролизере, В.
Определение анода и катода
Для начала возьмем очень серьезный документ, который является ЗАКОНОМ для науки, техники и, конечно, школы. Это «ГОСТ 15596-82. ИСТОЧНИКИ ТОКА ХИМИЧЕСКИЕ.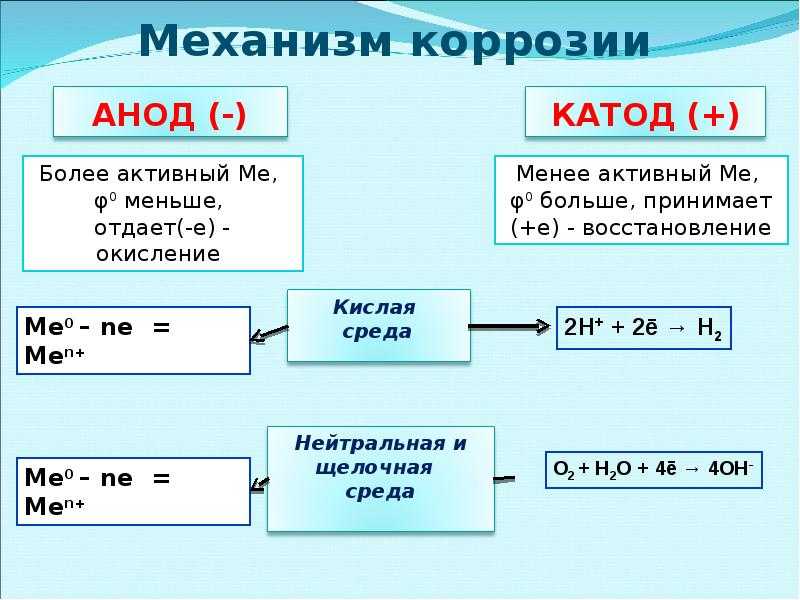 Термины и определения». Там на странице 3 можно прочесть следующее: «Отрицательный электрод химического источника тока это электрод, который при разряде источника является анодом». То же самое, «Положительный электрод химического источника тока это электрод, который при разряде источника является катодом». (Термины выделены мной. БХ). Но тексты правила и ГОСТа противоречат друг-другу. В чем же дело?
Термины и определения». Там на странице 3 можно прочесть следующее: «Отрицательный электрод химического источника тока это электрод, который при разряде источника является анодом». То же самое, «Положительный электрод химического источника тока это электрод, который при разряде источника является катодом». (Термины выделены мной. БХ). Но тексты правила и ГОСТа противоречат друг-другу. В чем же дело?
Материал по теме: Как подключить конденсатор
А всё дело в том, что, например, деталь, опущенная в электролит для никелирования или для электрохимического полирования, может быть и анодом и катодом в зависимости от того наносится на нее другой слой металла или, наоборот, снимается. Электрический аккумулятор является классическим примером возобновляемого химического источника электрического тока. Он может быть в двух режимах – зарядки и разрядки. Направление электрического тока в этих разных случаях будет в самом аккумуляторе прямо противоположным, хотя полярность электродов не меняется.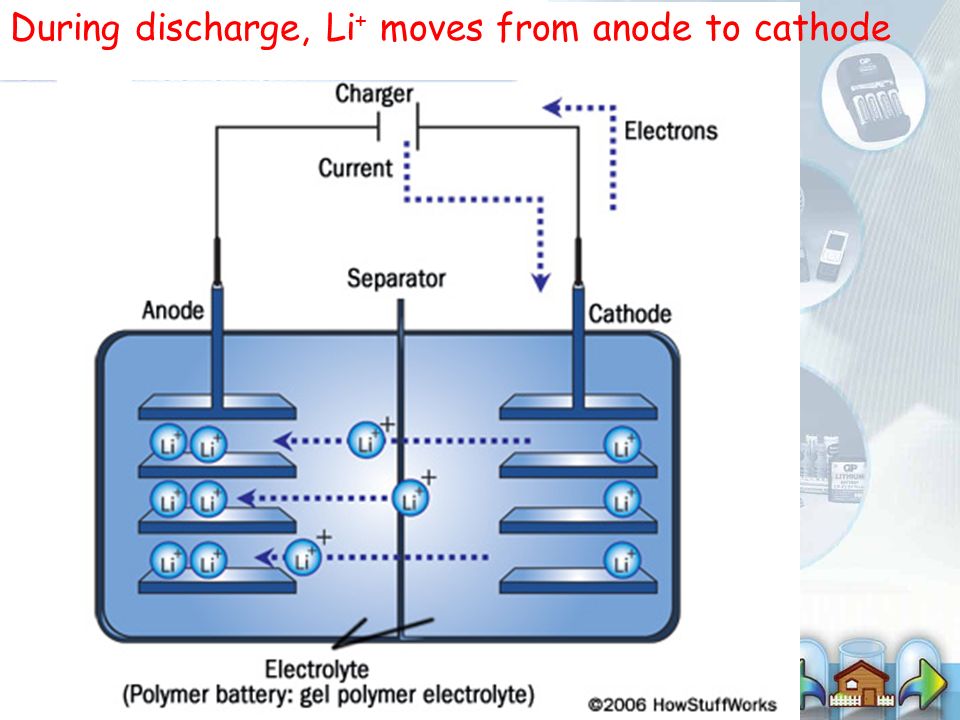
В зависимости от этого назначение электродов будет разным. При зарядке положительный электрод будет принимать электрический ток, а отрицательный отпускать. При разрядке – наоборот. При отсутствии движения электрического тока разговоры об аноде и катоде бессмысленны.
«Поэтому, во избежание неясности и неопределенности, а также ради большей точности, – записал в своих исследованиях М.Фарадей в январе 1834г., – я в дальнейшем предполагаю применять термины, определение которых сейчас дам».
Каковы же причины введения новых терминов в науку Фарадеем? А вот они: «Поверхности, у которых, согласно обычной терминологии, электрический ток входит в вещество и из него выходит, являются весьма важными местами действия и их необходимо отличать от полюсов». В те времена после открытия Т. Зеебеком явления термоэлектричества имела хождение гипотеза о том, что магнетизм Земли обусловлен разностью температур полюсов и экватора, вследствие чего возникают токи вдоль экватора. Она не подтвердилась, но послужила Фарадею в качестве «естественного указателя» при создании новых терминов. Магнетизм Земли имеет такую полярность, как если бы электрический ток шел вдоль экватора по направлению кажущегося движения солнца.
Магнетизм Земли имеет такую полярность, как если бы электрический ток шел вдоль экватора по направлению кажущегося движения солнца.
Обозначение анода и катода
Фарадей записывает: «На основании этого представления мы предлагаем назвать ту поверхность, которая направлена на восток – анодом, а ту, которая направлена на запад – катодом». В основе новых терминов лежал древнегреческий язык и в переводе они значили: анод – путь (солнца) вверх, катод – путь (солнца) вниз.
В русском языке есть прекрасные термины ВОСХОД и ЗАХОД, которые легко применить для данного случая, но почему-то переводчики Фарадея этого не сделали. Мы же рекомендуем пользоваться ими, ибо в них корнем слова является ХОД и, во всяком случае, это напомнит пользователю термина, что без движения тока термин не применим. Для желающего проверить рассуждения создателя термина с помощью других правил, например правила пробочника, сообщаем, что северный магнитный полюс Земли лежит в Антарктиде, возле Южного географического полюса.
Ошибкам в применениях терминов АНОД и КАТОД нет числа. В том числе и в зарубежных справочниках и энциклопедиях. Поэтому в электрохимии пользуются другими определениями, более понятными читателю. У них анод – это электрод, где протекают окислительные процессы, а катод – это электрод, где протекают восстановительные процессы. В этой терминологии нет места электронным приборам, но при электротехнической терминологии указать анод радиолампы, например, легко. В него входит электрический ток. (Не путать с направлением электронов).
Как работает батарейка.
Основные свойства катодов
Любой электровакуумный прибор имеет электрод, предназначенный для испускания (эмиссии) электронов. Этот электрод называется катодом. Электрод, предназначенный для приема эмиттированных катодом электронов, называется анодом. На анод подают более высокий и положительный относительно катода потенциал. Катод должен отдавать с единицы поверхности большой ток эмиссии при возможно низкой температуре нагрева и обладать большим сроком службы.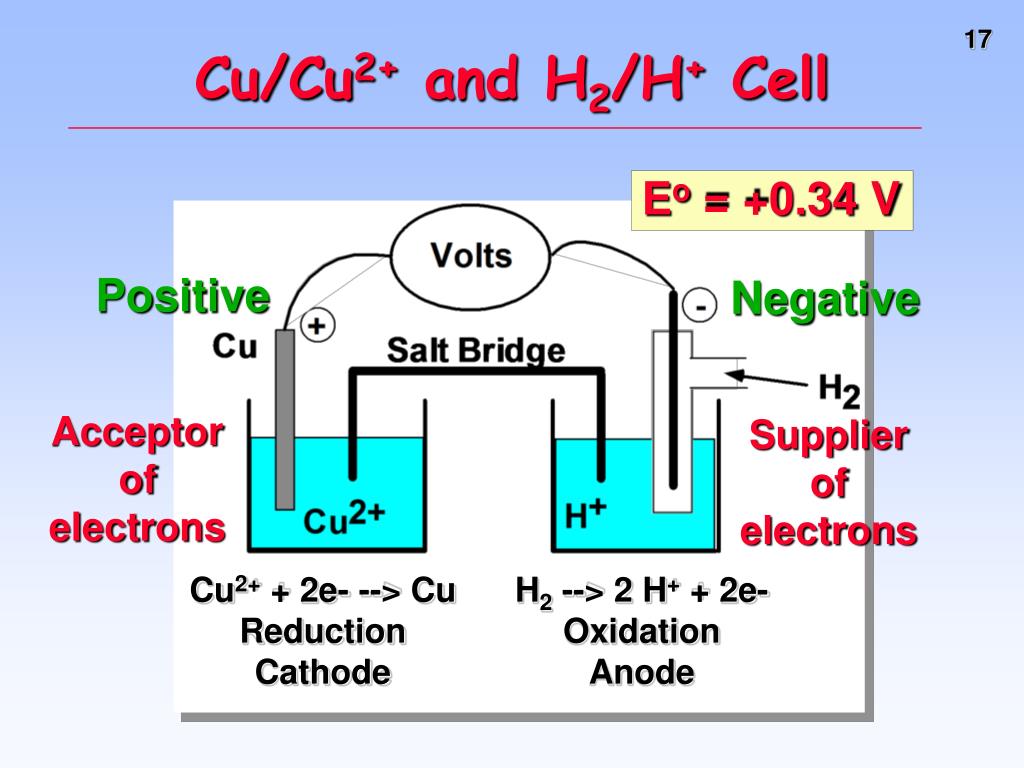 Нагрев катода в электровакуумном приборе производится протекающим по нему током.
Нагрев катода в электровакуумном приборе производится протекающим по нему током.
Такие термоэлектронные катоды разделяются на две основные группы:
- катоды прямого накала,
- катоды косвенного накала (подогревные).
Катоды прямого накала представляют собой металлическую нить, которая непосредственно разогревается током накала и служит для излучения электронов.Поверхность излучения катодов прямого накала невелика, поэтому от них нельзя получить большой ток эмиссии. Малая теплоемкость нити не позволяет использовать для нагрева переменный ток. Кроме того, при нагреве переменным током температура катода не постоянна во времени, а следовательно, меняется во времени и ток эмиссии.
Положительным свойством катода прямого накала является его экономичность, которая достигается благодаря малому количеству тепла, излучаемого в окружающую среду вследствие малой поверхности катода.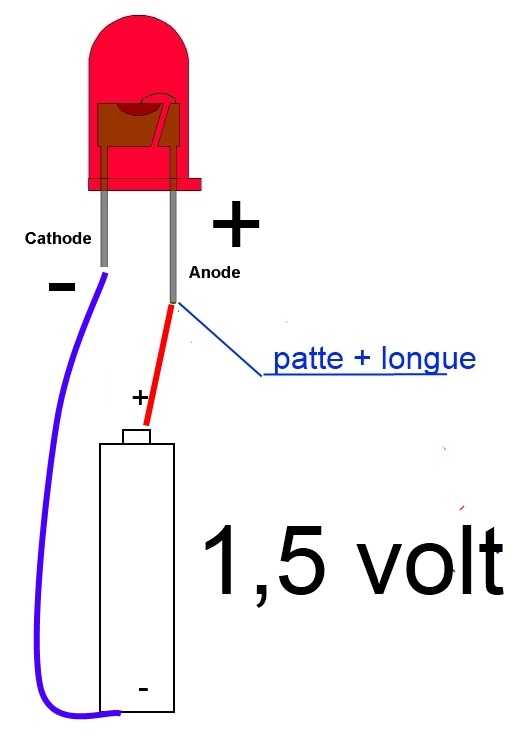 Катоды прямого накала изготовляются из вольфрамовой и никелевой проволоки. Однако большая работа выхода (W = 4,2÷4,5 в) определяет высокую рабочую температуру катода, вследствие чего катод становится неэкономичным. Для повышения экономичности катода вольфрамовую или никелевую проволоку (керн) «активируют» — покрывают пленкой другого элемента. Такие катоды называются активированными.
Катоды прямого накала изготовляются из вольфрамовой и никелевой проволоки. Однако большая работа выхода (W = 4,2÷4,5 в) определяет высокую рабочую температуру катода, вследствие чего катод становится неэкономичным. Для повышения экономичности катода вольфрамовую или никелевую проволоку (керн) «активируют» — покрывают пленкой другого элемента. Такие катоды называются активированными.
Если на поверхность керна нанесена электроположительная пленка (пленка из цезия, тория или бария, имеющих меньшую работу выхода, чем материал керна), то происходит поляризация пленки: валентные электроны переходят в керн, и между положительно заряженной пленкой и керном возникает разность потенциалов, ускоряющая движение электрона при выходе его из керна.
Работа выхода катода с такой мономолекулярной электроположительной пленкой оказывается меньше работы выхода электрона как из основного металла, так и из металла пленки. При покрытии керна электроотрицательной пленкой, например кислородом, работа выхода катода увеличивается.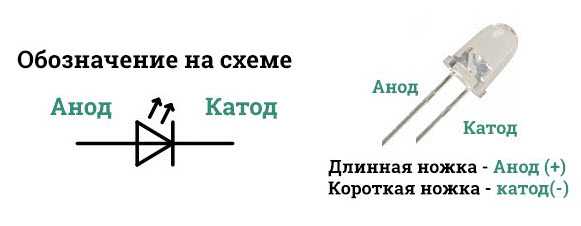 Подогревные катоды выполняются в виде никелевых гильз, поверхность которых покрывается активным слоем металла, имеющим малую работу выхода. Внутри катода помещается подогреватель— вольфрамовая нить или спираль, подогрев которой может осуществляться как постоянным, так и переменным
Подогревные катоды выполняются в виде никелевых гильз, поверхность которых покрывается активным слоем металла, имеющим малую работу выхода. Внутри катода помещается подогреватель— вольфрамовая нить или спираль, подогрев которой может осуществляться как постоянным, так и переменным
Как работает гальванизация.
током.
Для изоляции подогревателя от гильзы внутренность последней покрывается алундом (Аl2O3). Подогревные катоды, благодаря их большой тепловой инерции, обычно питают переменным током, значительная поверхность гильзы обеспечивает большой эмиссионный ток. Подогревные катоды, однако, менее экономичны и разогреваются значительно дольше, чем катоды прямого накала.
Заключение
Рейтинг автора
Автор статьи
Инженер по специальности «Программное обеспечение вычислительной техники и автоматизированных систем», МИФИ, 2005–2010 гг.
Написано статей
Принцип работы анода и катода можно более подробно изучить из статьи Анод и катод в диодах. Если у вас остались вопросы, можно задать их в комментариях на сайте.
Если у вас остались вопросы, можно задать их в комментариях на сайте.
Также в нашей группе ВК можно задавать вопросы и получать на них подробные ответы от профессионалов. Для этого приглашаем читателей подписаться и вступить в группу. В завершение статьи хочу выразить благодарность источникам, откуда мы черпали информацию во время подготовки материала:
www.electricalschool.infol
www.meanders.ru
www.electrik.info
www.elel.ru
www.kristallikov.net
www.obrazovaka.ru
Предыдущая
ТеорияЧто такое индуктивность
Следующая
ТеорияЗаконы Кирхгофа простыми словами: определение для электрической цепи
Анод и катод — что это и как правильно определить?
Про анод и катод источника питания необходимо знать тем, кто занимается практической электроникой. Что и как называют? Почему именно так? Будет углублённое рассмотрение темы с точки зрения не только радиолюбительства, но и химии. Наиболее популярное объяснение звучит следующим образом: анод – это положительный электрод, а катод – отрицательный. Увы, это не всегда верно и неполно. Чтобы уметь определить анод и катод, необходимо иметь теоретическую базу и знать, что да как. Давайте рассмотрим это в рамках статьи.
Увы, это не всегда верно и неполно. Чтобы уметь определить анод и катод, необходимо иметь теоретическую базу и знать, что да как. Давайте рассмотрим это в рамках статьи.
Анод
Обратимся к ГОСТ 15596-82, который занимается химическими источниками тока. Нас интересует информация, размещённая на третьей странице. Согласно ГОСТу, отрицательным электродом химического источника тока является именно анод. Вот так да! А почему именно так? Дело в том, что именно через него электрический ток входит из внешней цепи в сам источник. Как видите, не всё так легко, как кажется на первый взгляд. Можно посоветовать внимательно рассматривать представленные в статье картинки, если содержимое кажется слишком сложным – они помогут понять, что же автор хочет вам донести.
Катод
Обращаемся всё к тому же ГОСТ 15596-82. Положительным электродом химического источника тока является тот, при разряде из которого он выходит во внешнюю цепь. Как видите, данные, содержащиеся в ГОСТ 15596-82, рассматривают ситуацию с другой позиции. Поэтому при консультировании с другими людьми насчет определённых конструкций необходимо быть очень осторожным.
Поэтому при консультировании с другими людьми насчет определённых конструкций необходимо быть очень осторожным.
Возникновение терминов
Их ввёл ещё Фарадей в январе 1834 года, чтобы избежать неясности и добиться большей точности. Он предлагал и свой вариант запоминания на примере с Солнцем. Так, у него анод – это восход. Солнце движется вверх (ток входит). Катод – это заход. Солнце движется вниз (ток выходит).
Пример радиолампы и диода
Продолжаем разбираться, что для обозначения чего используется. Допустим, один из данных потребителей энергии у нас имеется в открытом состоянии (в прямом включении). Так, из внешней цепи диода в элемент по аноду входит электрический ток. Но не путайтесь благодаря такому объяснению с направлением электронов. Через катод во внешнюю цепь из используемого элемента выходит электрический ток. Та ситуация, что сложилась сейчас, напоминает случаи, когда люди смотрят на перевёрнутую картину. Если данные обозначения сложные – помните, что разбираться в них таким образом обязательно исключительно химикам.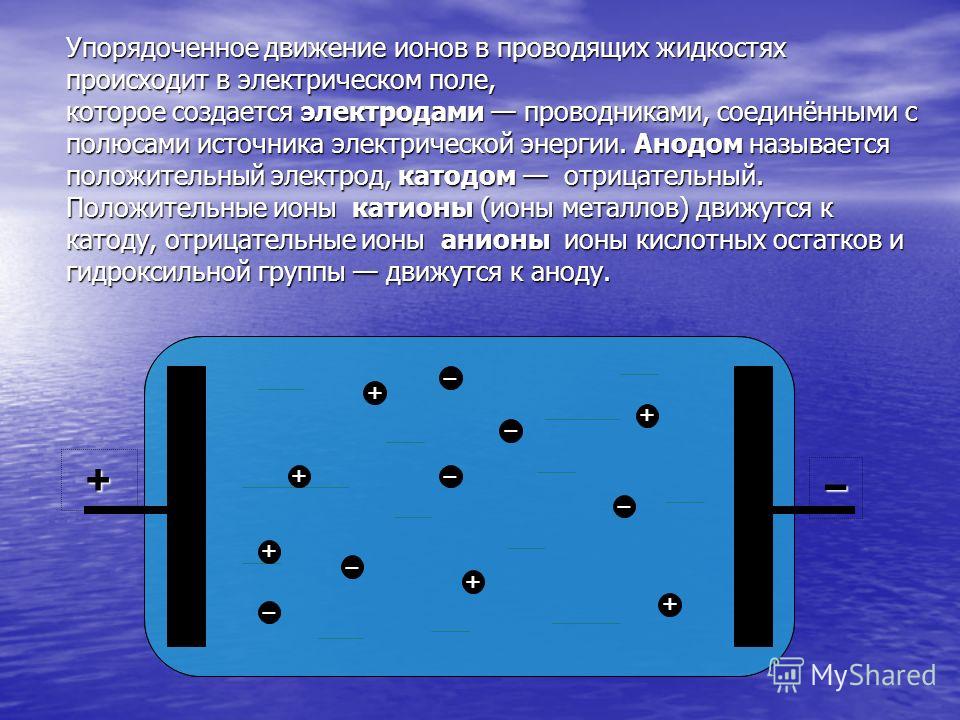 А сейчас давайте сделаем обратное включение. Можно заметить, что полупроводниковые диоды практически не будут проводить ток. Единственное возможное здесь исключение – обратный пробой элементов. А электровакуумные диоды (кенотроны, радиолампы) вообще не будут проводить обратный ток. Поэтому и считается (условно), что он через них не идёт. Поэтому формально выводы анод и катод у диода не выполняют свои функции.
А сейчас давайте сделаем обратное включение. Можно заметить, что полупроводниковые диоды практически не будут проводить ток. Единственное возможное здесь исключение – обратный пробой элементов. А электровакуумные диоды (кенотроны, радиолампы) вообще не будут проводить обратный ток. Поэтому и считается (условно), что он через них не идёт. Поэтому формально выводы анод и катод у диода не выполняют свои функции.
Почему существует путаница?
Специально, чтобы облегчить обучение и практическое применение, было решено, что диодные элементы названия выводов не будут менять зависимо от своей схемы включения, и они будут «прикреплены» к физическим выводам. Но это не относится к аккумуляторам. Так, у полупроводниковых диодов всё зависит от типа проводимости кристалла. В электронных лампах этот вопрос привязан к электроду, который эмитирует электроны в месте расположения нити накала. Конечно, тут есть определённые нюансы: так, через такие полупроводниковые приборы, как супрессор и стабилитрон, может немного протекать обратный ток, но здесь существует специфика, явно выходящая за рамки статьи.
Разбираемся с электрическим аккумулятором
Это по-настоящему классический пример химического источника электрического тока, что является возобновляемым. Аккумулятор пребывает в одном из двух режимов: заряд/разряд. В обоих этих случаях будет разное направление электрического тока. Но обратите внимание, что полярность электродов при этом меняться не будет. И они могут выступать в разных ролях:
- Во время зарядки положительный электрод принимает электрический ток и является анодом, а отрицательный его отпускает и именуется катодом.
- При отсутствии движения о них разговор вести нет смысла.
- Во время разряда положительный электрод отпускает электрический ток и является катодом, а отрицательный принимает и именуется анодом.
Об электрохимии замолвим слово
Здесь используют немного другие определения. Так, анод рассматривается как электрод, где протекают окислительные процессы. И вспоминая школьный курс химии, можете ответить, что происходит в другой части? Электрод, на котором протекают восстановительные процессы, называется катодом.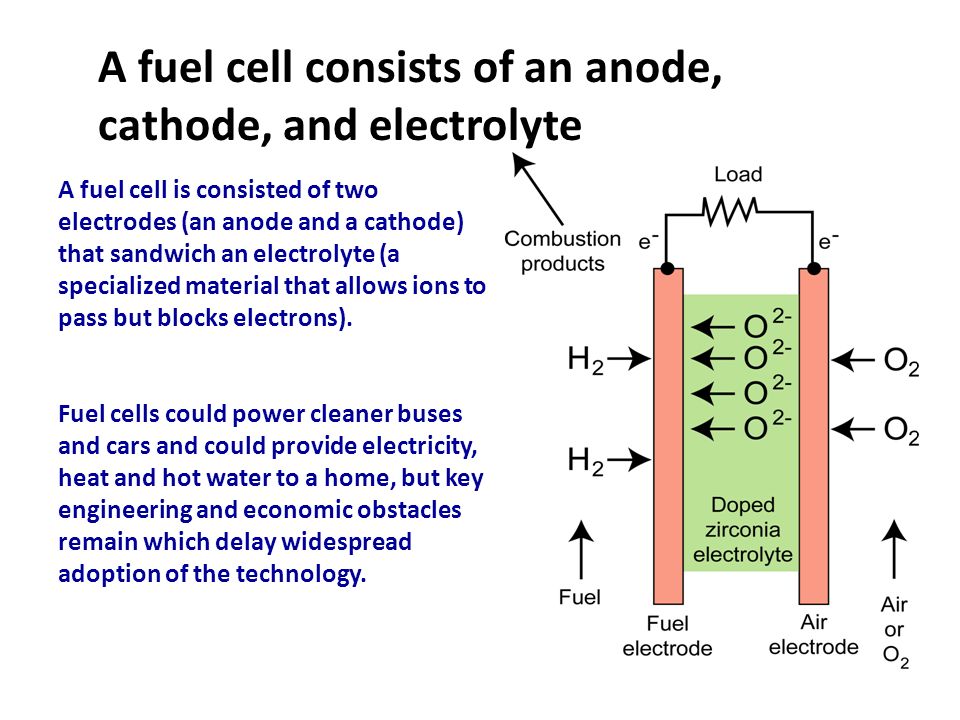 Но здесь нет привязки к электронным приборам. Давайте рассмотрим ценность окислительно-восстановительных реакций для нас:
Но здесь нет привязки к электронным приборам. Давайте рассмотрим ценность окислительно-восстановительных реакций для нас:
- Окисление. Происходит процесс отдачи частицей электрона. Нейтральная превращается в положительный ион, а отрицательная нейтрализуется.
- Восстановление. Происходит процесс получения частицей электрона. Положительная превращается в нейтральный ион, а потом в отрицательный при повторении.
- Оба процесса являются взаимосвязанными (так, количество электронов, что отданы, равняется присоединённому их числу).
Также Фарадеем для обозначения были введены названия для элементов, что принимают участие в химических реакциях:
- Катионы. Так называются положительно заряженные ионы, что двигаются в растворе электролита в сторону отрицательного полюса (катода).
- Анионы. Так называются отрицательно заряженные ионы, что двигаются в растворе электролита в сторону положительного полюса (анода).
Как происходят химические реакции?
Окислительная и восстановительная полуреакции являются разделёнными в пространстве.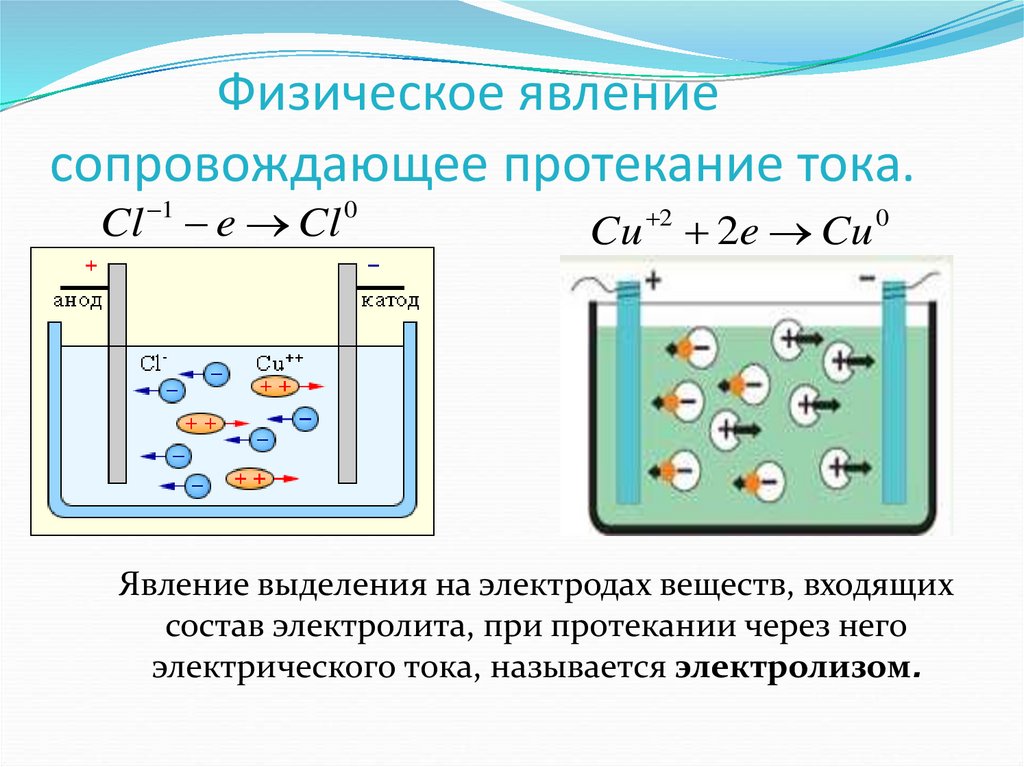 Переход электронов между катодом и анодом осуществляется не непосредственно, а благодаря проводнику внешней цепи, на котором создаётся электрический ток. Здесь можно наблюдать взаимное превращение электрической и химической форм энергии. Поэтому для образования внешней цепи системы из проводников разного рода (коими являются электроды в электролите) и необходимо пользоваться металлом. Видите ли, напряжение между анодом и катодом существует, как и один нюанс. И если бы не было элемента, что мешает им напрямую произвести необходимый процесс, то ценность источников химического тока была бы весьма низка. А так, благодаря тому, что заряду необходимо пройтись по той схеме, была собрана и работает техника.
Переход электронов между катодом и анодом осуществляется не непосредственно, а благодаря проводнику внешней цепи, на котором создаётся электрический ток. Здесь можно наблюдать взаимное превращение электрической и химической форм энергии. Поэтому для образования внешней цепи системы из проводников разного рода (коими являются электроды в электролите) и необходимо пользоваться металлом. Видите ли, напряжение между анодом и катодом существует, как и один нюанс. И если бы не было элемента, что мешает им напрямую произвести необходимый процесс, то ценность источников химического тока была бы весьма низка. А так, благодаря тому, что заряду необходимо пройтись по той схеме, была собрана и работает техника.
Что есть что: шаг 1
Теперь давайте будем определять, что есть что. Возьмём гальванический элемент Якоби-Даниэля. С одной стороны он состоит из цинкового электрода, который опущен в раствор сульфата цинка. Затем идёт пористая перегородка. И с другой стороны имеется медный электрод, который расположен в растворе сульфата меди. Они соприкасаются между собой, но химические особенности и перегородка не дают смешаться.
Они соприкасаются между собой, но химические особенности и перегородка не дают смешаться.
Шаг 2: Процесс
Происходит окисление цинка, и электроны по внешней цепи двигаются к меди. Так получается, что гальванический элемент имеет анод, заряженный отрицательно, и катод — положительный. Причем данный процесс может протекать только в тех случаях, когда электронам есть куда «идти». Дело в том, что попасть напрямую от электрода к другому мешает наличие «изоляции».
Шаг 3: Электролиз
Давайте рассмотрим процесс электролиза. Установка для его прохождения является сосудом, в котором имеется раствор или расплав электролита. В него опущено два электрода. Они подключены к источнику постоянного тока. Анод в этом случае – это электрод, который подключен к положительному полюсу. Здесь происходит окисление. Отрицательно заряженный электрод – это катод. Здесь протекает реакция восстановления.
Шаг 4: Напоследок
Поэтому при оперировании данными понятиями всегда необходимо учитывать, что анод не в 100% случаев используется для обозначения отрицательного электрода.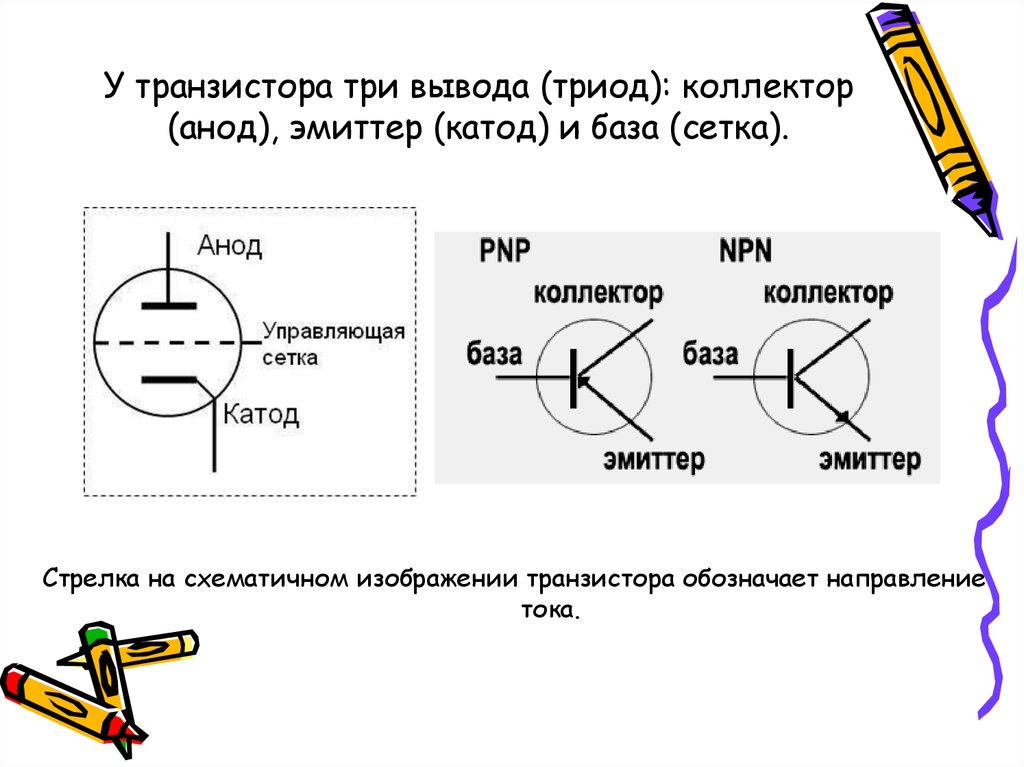 Также катод периодически может лишаться своего положительного заряда. Всё зависит от того, какой процесс на электроде протекает: восстановительный или окислительный.
Также катод периодически может лишаться своего положительного заряда. Всё зависит от того, какой процесс на электроде протекает: восстановительный или окислительный.
Заключение
Вот таким всё и является – не очень сложно, но не скажешь, что и просто. Мы рассмотрели гальванический элемент, анод и катод с точки зрения схемы, и сейчас проблем с соединением источников питания с наработками у вас быть не должно. И напоследок нужно оставить ещё немного ценной для вас информации. Всегда приходится учитывать разницу, которую имеет потенциал катода/потенциал анода. Дело в том, что первый всегда будет немного большим. Это из-за того, что коэффициент полезного действия не работает с показателем в 100 % и часть зарядов рассеивается. Именно из-за этого можно увидеть, что аккумуляторы имеют ограничение на количество раз заряда и разряда.
17.2: Электролиз — Химия LibreTexts
Типичная электролитическая ячейка может быть изготовлена, как показано на рисунке \ (\ PageIndex {1} \). Два электрических проводника ( электродов ) погружены в жидкость, подлежащую электролизу. Эти электроды часто изготавливаются из инертного материала, такого как нержавеющая сталь, платина или графит. Жидкость, подлежащая электролизу, должна быть способна проводить электричество, поэтому обычно это водный раствор электролита или расплавленное ионное соединение. Электроды подключены проводами к батарее или другому источнику постоянного тока.Этот источник тока можно рассматривать как «электронный насос», который забирает электроны с одного электрода и выталкивает их на другой электрод. Электрод, с которого удаляются электроны, становится положительно заряженным, в то время как электрод, к которому они подводятся, имеет избыток электронов и отрицательный заряд.
Два электрических проводника ( электродов ) погружены в жидкость, подлежащую электролизу. Эти электроды часто изготавливаются из инертного материала, такого как нержавеющая сталь, платина или графит. Жидкость, подлежащая электролизу, должна быть способна проводить электричество, поэтому обычно это водный раствор электролита или расплавленное ионное соединение. Электроды подключены проводами к батарее или другому источнику постоянного тока.Этот источник тока можно рассматривать как «электронный насос», который забирает электроны с одного электрода и выталкивает их на другой электрод. Электрод, с которого удаляются электроны, становится положительно заряженным, в то время как электрод, к которому они подводятся, имеет избыток электронов и отрицательный заряд.
Рисунок \ (\ PageIndex {1} \): электролитическая ячейка. Батарея откачивает электроны от анода (делая его положительным) в катод (делая его отрицательным). Положительный анод притягивает к себе анионы, а отрицательный катод притягивает к себе катионы.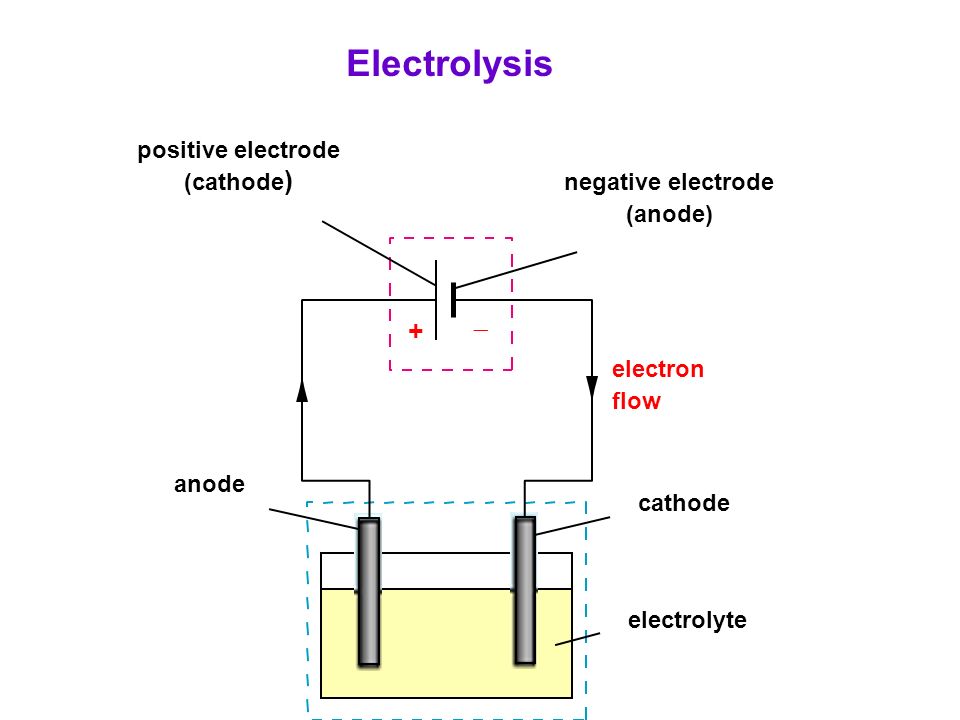 Электрический ток переносится электронами в проводе и электродах, но он переносится анионами и катионами, движущимися в противоположных направлениях в самой ячейке. Поскольку анод может принимать электроны, на этом электроде происходит окисление. Катод является донором электронов и может вызвать восстановление. из Википедии (кредит XXX).
Электрический ток переносится электронами в проводе и электродах, но он переносится анионами и катионами, движущимися в противоположных направлениях в самой ячейке. Поскольку анод может принимать электроны, на этом электроде происходит окисление. Катод является донором электронов и может вызвать восстановление. из Википедии (кредит XXX).
Отрицательно заряженный электрод притягивает к себе положительные ионы (катионы) из раствора. Он может отдавать часть своих избыточных электронов таким катионам или другим частицам в жидкости, подвергаемой электролизу.Следовательно, этот электрод фактически является восстановителем. В любом электрохимическом элементе (электролитическом или гальваническом) электрод, на котором происходит восстановление , называется катодом .
Положительный электрод, с другой стороны, притягивает к себе отрицательные ионы (анионы). Этот электрод может принимать электроны от этих отрицательных ионов или других частиц в растворе и, следовательно, ведет себя как окислитель.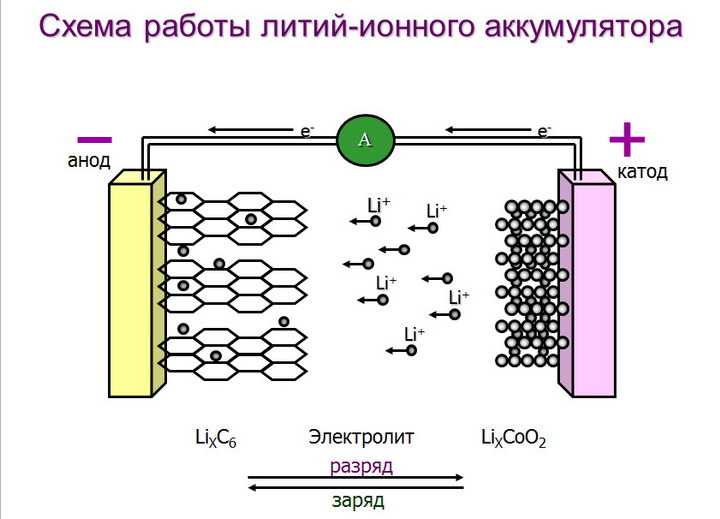 В любой электрохимической ячейке анод — это электрод, на котором происходит окисление .Простой способ запомнить, какой электрод — это то, что анод и окисление начинаются с гласных, в то время как катод и восстановление начинаются с согласных.
В любой электрохимической ячейке анод — это электрод, на котором происходит окисление .Простой способ запомнить, какой электрод — это то, что анод и окисление начинаются с гласных, в то время как катод и восстановление начинаются с согласных.
На следующем видео показан этот процесс в нейтральном водном растворе с некоторыми присутствующими электролитами.
В качестве примера того, как электролиз может вызвать химическую реакцию, предположим, что мы пропускаем постоянный электрический ток через 1 M HCl. Ионы H 3 O + в этом растворе будут притягиваться к катоду, а ионы Cl — будут мигрировать к аноду.{-} (aq) \ rightarrow \ text {H} _2 (g) + \ text {Cl} _2 (g) + \ text {2H} _2 \ text {O} (l) \]
Чистая реакция [Уравнение \ (\ ref {3} \)] — это , обратная спонтанной комбинации H 2 ( г ) с Cl 2 ( г ) с образованием HCl ( водн ). Такой результат справедлив для электролиза в целом: электрический ток , подаваемый извне системы, вызывает несамопроизвольную химическую реакцию.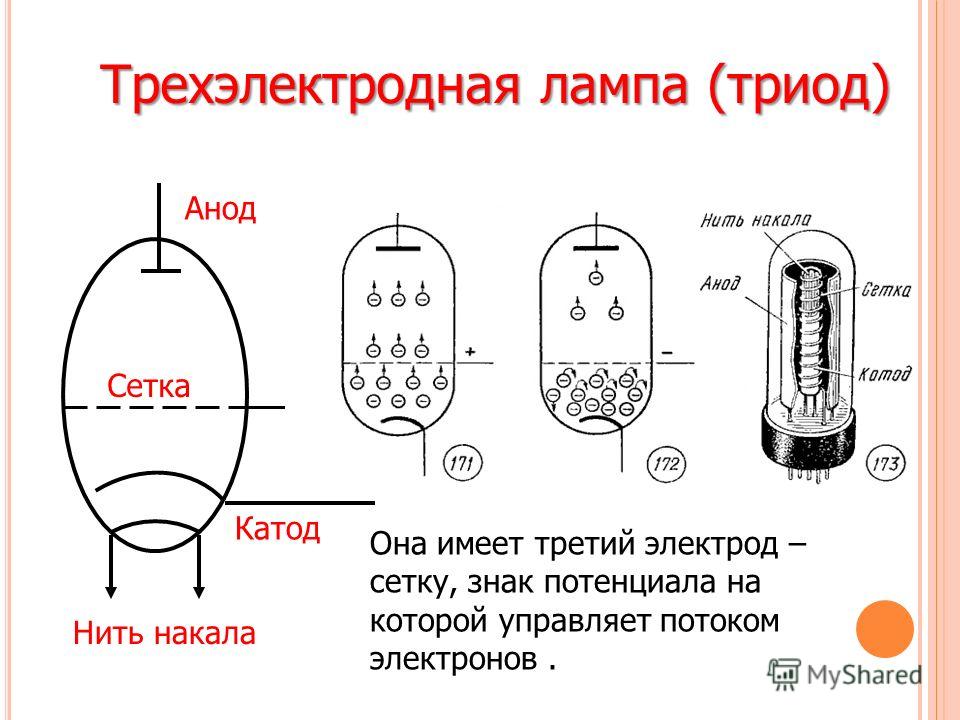 {-} \]
{-} \]
Однако Li + — очень плохой акцептор электронов, и поэтому очень трудно заставить выполняться уравнение \ (\ ref {5} \).{-} \ label {8} \]
Общее уравнение можно получить, умножив уравнение \ (\ ref {7 } \ ) на 2, добавив его к уравнению \ (\ ref {8} \) и сложив H + с OH — для получения H 2 O:
\ [\ text {2H} _2 \ text {O} (l) \ rightarrow \ text {2H} _2 (g) + \ text {O} _2 (g) \]
На следующем видео показан процесс электролиза воды с использованием серной кислоты в качестве моста для передачи заряда. После завершения электролиза идентичность образующихся газов проверяется с помощью тестов на горючие шины.
Таким образом, этот электролиз обращает спонтанную комбинацию H 2 и O 2 с образованием H 2 O. При обсуждении окислительно-восстановительных реакций мы упоминаем несколько окислителей, например, которые достаточно сильны, чтобы окислять H 2 O. В то же время мы описываем восстановители, которые достаточно сильны для восстановления H 2 O, такие как щелочные металлы и более тяжелые щелочноземельные металлы. Как правило, такие вещества не могут быть получены электролизом водных растворов, потому что вместо этого H 2 O окисляется или восстанавливается.Вещества, которые подвергаются спонтанной окислительно-восстановительной реакции с H 2 O, обычно получают электролизом расплавов солей или в каком-либо другом растворителе. Однако из этого правила есть некоторые исключения, потому что некоторые электродные реакции протекают медленнее, чем другие. Например, используя таблицу 11.5, мы можем предсказать, что H 2 O является лучшим восстановителем, чем Cl —.
В то же время мы описываем восстановители, которые достаточно сильны для восстановления H 2 O, такие как щелочные металлы и более тяжелые щелочноземельные металлы. Как правило, такие вещества не могут быть получены электролизом водных растворов, потому что вместо этого H 2 O окисляется или восстанавливается.Вещества, которые подвергаются спонтанной окислительно-восстановительной реакции с H 2 O, обычно получают электролизом расплавов солей или в каком-либо другом растворителе. Однако из этого правила есть некоторые исключения, потому что некоторые электродные реакции протекают медленнее, чем другие. Например, используя таблицу 11.5, мы можем предсказать, что H 2 O является лучшим восстановителем, чем Cl —.
Следовательно, мы ожидаем, что O 2 , а не Cl 2 , будет получен путем электролиза 1 M HCl, что противоречит уравнению \ (\ ref {1} \).Оказывается, O 2 образуется медленнее , чем Cl 2 , и последний пузырится из раствора до того, как H 2 O может быть окислен.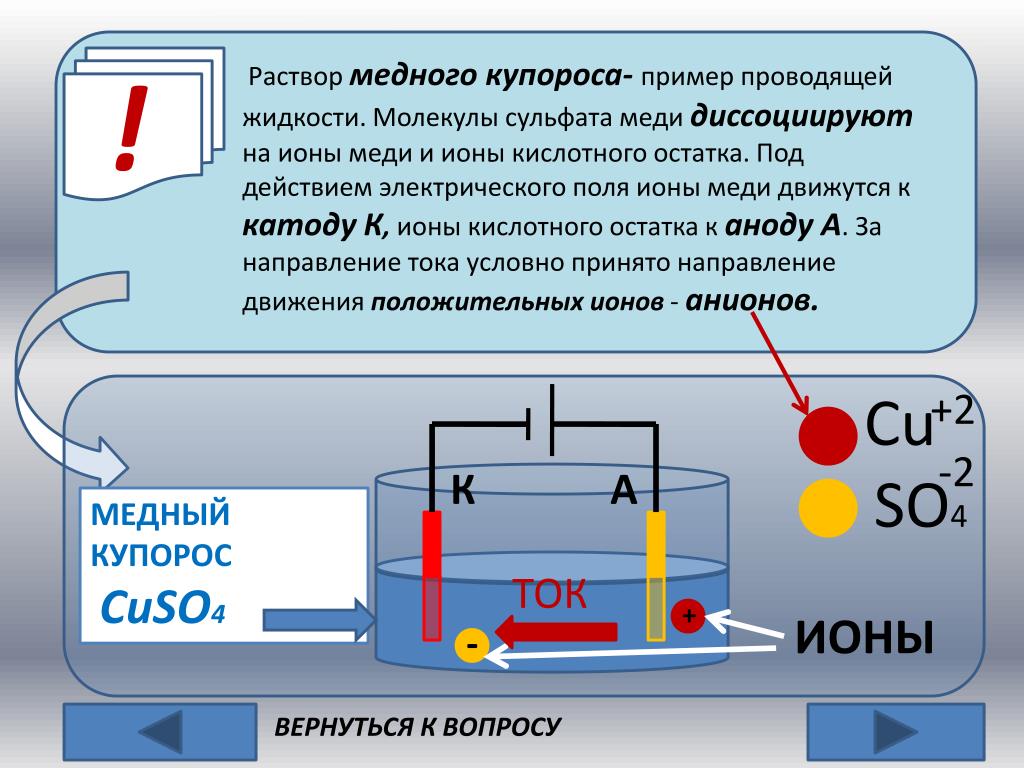 По этой причине Таблицу 1 из раздела Редокс-пары не всегда можно использовать для прогнозирования того, что произойдет при электролизе.
По этой причине Таблицу 1 из раздела Редокс-пары не всегда можно использовать для прогнозирования того, что произойдет при электролизе.
Химия батарей и элементов
Cell Chemistries
Как работают клетки
Гальваническое действие
Проще говоря, аккумуляторы можно рассматривать как электронные насосы.В
внутренняя химическая реакция внутри батареи между электролитом и
отрицательный металлический электрод производит накопление свободных электронов, каждый с отрицательным зарядом, на батарее.
отрицательная (-) клемма — анод. Химическая реакция между электролитом и
положительный (+) электрод внутри батареи производит избыток положительных (+) ионов
(атомы, у которых отсутствуют электроны, поэтому с чистым положительным зарядом) на
положительная (+) клемма — катод АКБ.Электрический
(насос) давление или разность потенциалов между клеммами + и —
называется напряжением или электродвижущей силой (ЭДС).
Разное
металлы имеют различное сродство к электронам. Когда два непохожих
металлы (или соединения металлов) контактируют или соединяются через
в проводящей среде электроны имеют тенденцию уходить из
металл с меньшим сродством к электронам, который становится положительно
заряжен, к металлу с большим сродством, который становится
отрицательно заряженный.Разница потенциалов между металлами будет
поэтому наращивайте до тех пор, пока он не уравновесит тенденцию электрона
передача между металлами. В этот момент «равновесный потенциал»
это то, что уравновешивает разницу между склонностями двух
металлы, чтобы получить или потерять электроны.
А
батарея или гальванический элемент хранит энергию в химической форме в своей активной
материалы и может ли это преобразовать это в электрическую энергию по запросу,
обычно с помощью электрохимического окисления-восстановления (окислительно-восстановительного)
реакция.(Обратите внимание, что общее название «окислительно-восстановительный потенциал», похоже, было
использованные в недавней конструкции проточной батареи с использованием двух ванадиевых
окислительно-восстановительные пары).
Каждая гальваническая или энергетическая ячейка состоит как минимум из трех, а иногда и из четырех компонентов
Анод
или отрицательный электрод (восстановительный или топливный электрод), который отказывает
электронов во внешнюю цепь и окисляется во время
электрохимическая (разрядная) реакция.Обычно это металл или
сплав, но также используется водород. Анодный процесс — это окисление
металл с образованием ионов металлов.(LEO теряют электроны — окисление)
- Катод
или положительный электрод (окисляющий электрод), который принимает электроны
от внешнего контура и уменьшается во время электрохимического
(разрядка) реакция.Обычно это оксид или сульфид металла, но
кислород также используется. Катодный процесс — это восстановление оксида
оставить металл.
(GER усиление электронов — уменьшение). Помните мнемоническое рычание льва. - Электролит
(ионный проводник), который обеспечивает среду для передачи заряда
в виде ионов внутри ячейки между анодом и катодом. Электролит
Электролит
обычно представляет собой растворитель, содержащий растворенные химические вещества, обеспечивающие ионный
проводимость.Он должен быть непроводником электронов, чтобы избежать
разряд ячейки. - Разделитель , который электрически изолирует положительный и отрицательный электроды.
Процесс разгрузки
Когда
аккумулятор полностью заряжен, на нем есть избыток электронов.
анод дает ему отрицательный заряд и дефицит на катоде дает
это положительный заряд, приводящий к разнице потенциалов на
клетка.
Когда цепь завершена
избыточные электроны текут во внешнюю цепь из отрицательно
заряженный анод, который теряет весь свой заряд в пользу положительно заряженного
катод, который принимает его, нейтрализуя его положительный заряд. Это действие
уменьшает разность потенциалов на ячейке до нуля. Схема
завершается или уравновешивается потоком положительных ионов в
электролит от анода до катода.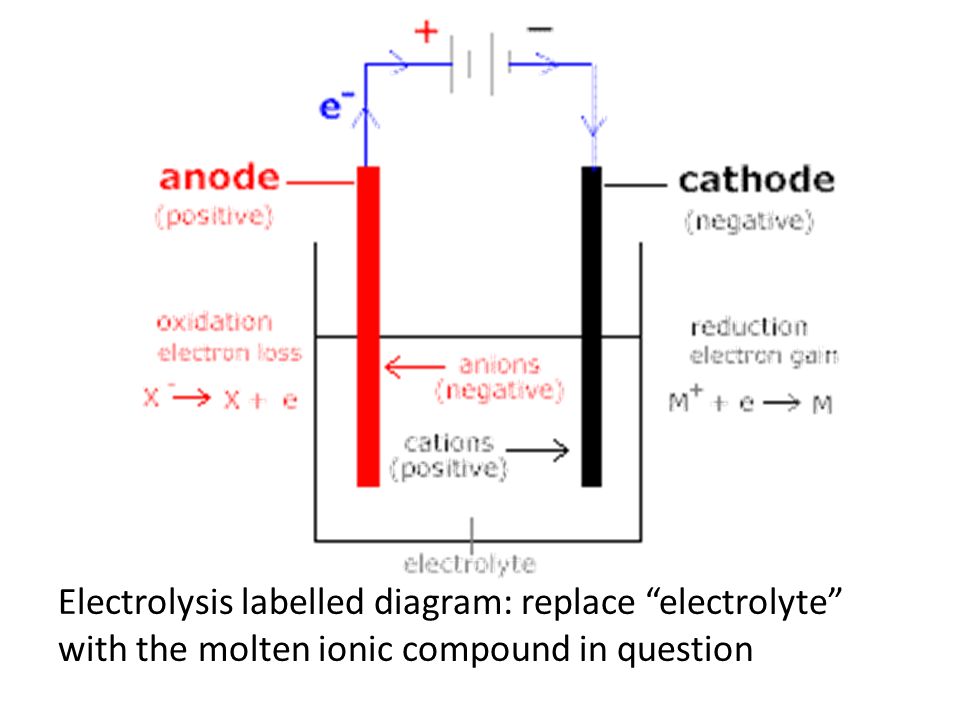
С
электроны заряжены отрицательно, электрический ток, который они
представляют потоки в обратном направлении от катода (положительный
клемма) к аноду (отрицательная клемма).
Две системы электролита
Принципы работы гальванического элемента могут быть продемонстрированы работой элемента Даниэля, системы с двумя электролитами.
КАТОД | ЯЧЕЙКА DANIELL | АНОД |
плюс полюс батареи | Отрицательный полюс аккумулятора | |
Цинк теряет электроны быстрее, чем медь | ||
Принимает электроны от внешней цепи | Подает электроны во внешнюю цепь | |
Отложения металлической меди на катоде | Цинк переходит в водный раствор | |
Сайт Редукция | Участок окисления | |
Полуячейка с наивысшим потенциалом электрода | Полуячейка с наименьшим электродным потенциалом | |
GER | LEO |
Две системы первичных ячеек с электролитом существуют с 1836 года, когда была изобретена ячейка Даниэля для преодоления проблем поляризации.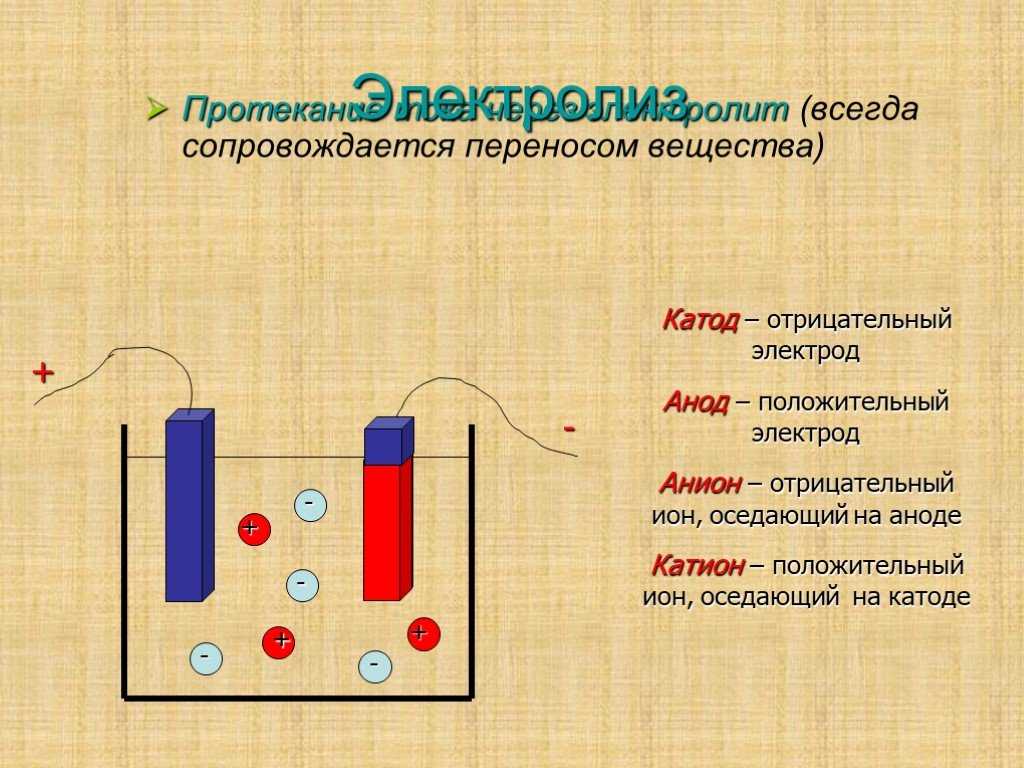 Эта компоновка показывает, что фактически имеется две полуэлементов , в которых происходят химические воздействия. Каждый электрод погружен в другой электролит, с которым он реагирует. Потенциал электрода ,
Эта компоновка показывает, что фактически имеется две полуэлементов , в которых происходят химические воздействия. Каждый электрод погружен в другой электролит, с которым он реагирует. Потенциал электрода ,
положительный или отрицательный — это напряжение, развиваемое одиночным
электрод. Электролиты отделены друг от друга солевым мостиком или пористой мембраной
который нейтрален и не принимает участия в реакции. В процессе
осмоса, он пропускает ионы сульфата, но блокирует металлический
ионы.
Эта схема с двумя электролитами дает больше степеней свободы или контроля над химическим процессом.
Хотя
более сложные эти клетки позволили построить клетки с более длительным сроком жизни
оптимизация комбинации электролит / электрод отдельно на каждом
электрод.
Совсем недавно они были использованы в качестве основы для проточных батарей, в которых электролиты прокачиваются через батарею, обеспечивая практически неограниченную емкость.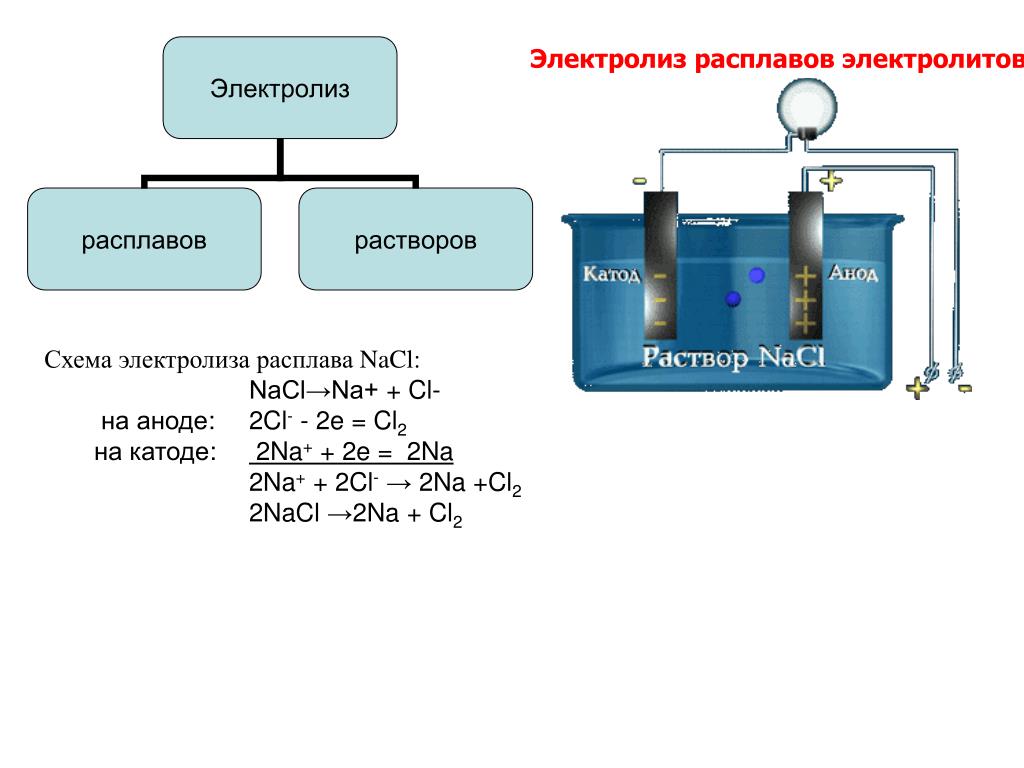
Цинк — очень популярный анодный материал, и вышеперечисленное химическое воздействие приводит к его растворению в электролите.
Можно сказать, что показанный элемент Даниэля «сжигает цинк и осаждает медь»
Примечание-
Простая ячейка с одним электролитом также может быть представлена двумя половинными
клетки. Это можно рассматривать как частный случай ячейки Даниэля с
два электролита одинаковы.
модель ячейки в виде двух полуячейков используется электрохимиками и ячейкой
проектировщиков для расчета электродных потенциалов и определения характеристик
химические реакции внутри клетки. Напряжение ячейки или электродвижущая сила (ЭДС)
для внешнего тока, полученного от ячейки, — это разница в
стандартные электродные потенциалы двух реакций полуэлементов при
стандартные условия. Но настоящие гальванические элементы обычно отличаются от
стандартные условия.Уравнение Нернста
связывает фактическое напряжение химической ячейки со стандартным электродом
потенциалы с учетом температуры и концентраций
реагентов и продуктов. ЭДС ячейки будет уменьшаться по мере того, как
ЭДС ячейки будет уменьшаться по мере того, как
концентрация активных химикатов уменьшается по мере их использования
пока один из химикатов полностью не иссякнет.
Теоретическая энергия, доступная из ячейки, может быть рассчитана с использованием уравнения свободной энергии Гиббса для начального и конечного состояний равновесия.
К счастью
такое глубокое знание химии клетки и термодинамики не
обычно требуется инженером по применению аккумуляторов.
Первичные элементы
В
В первичных ячейках эта электрохимическая реакция необратима. В течение
выгрузка химических соединений постоянно меняется и
электрическая энергия высвобождается до тех пор, пока исходные соединения не станут
полностью истощен.Таким образом, ячейки можно использовать только один раз.
Вторичные элементы
В
вторичных ячеек эта электрохимическая реакция обратима и
исходные химические соединения могут быть восстановлены путем применения
электрический потенциал между электродами, инжектирующий энергию в
сотовый.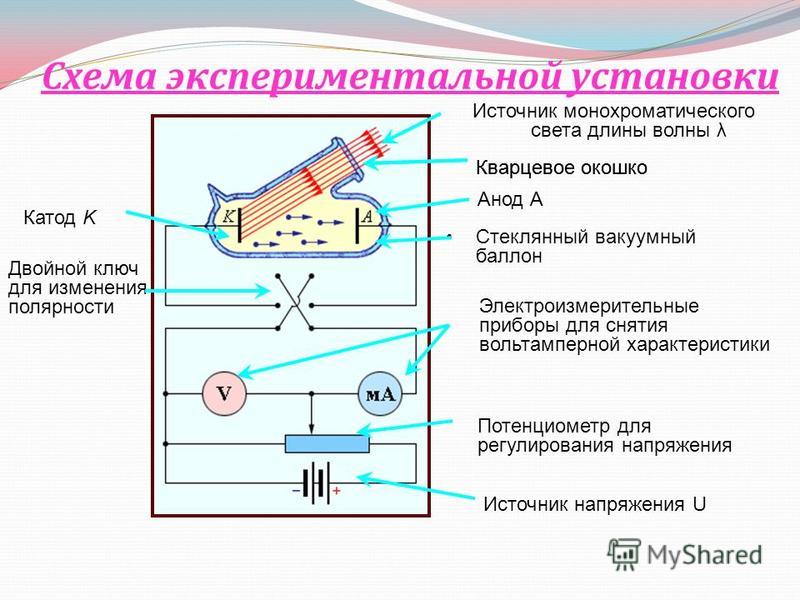 Такие элементы можно многократно разряжать и перезаряжать.
Такие элементы можно многократно разряжать и перезаряжать.
Аккумулятор Action | ||
Процесс зарядки
зарядное устройство снимает электроны с катода, оставляя его с сеткой
положительный заряд и заставляет их на аноде, давая ему отрицательный
заряжать.Энергия, закачиваемая в клетку, преобразует активные химические вещества.
вернуться в исходное состояние.
Выбор активных химикатов
напряжение и ток, генерируемые гальваническим элементом, напрямую связаны с
типы материалов, используемых в электродах и электролите.
Склонность отдельного металла или металлического соединения к выигрышу или проигрышу
электроны по отношению к другому материалу известны как его электрод
потенциал.Таким образом, сильные стороны окислителей и восстановителей равны
обозначены их стандартными потенциалами электродов. Соединения с
Соединения с
потенциал положительного электрода используется для анодов и анодов с
потенциал отрицательного электрода для катодов. Чем больше разница
между электродными потенциалами анода и катода, тем больше
ЭДС клетки и большее количество энергии, которое может быть
производится клеткой.
Электрохимическая серия
список или таблица металлических элементов или ионов, упорядоченных в соответствии с
их электродные потенциалы.Порядок показывает тенденцию одного металла
для восстановления ионов любого другого металла в ряду ниже него.
Образец из таблицы стандартных потенциалов показывает крайние значения из таблицы.
Сила окислителей и восстановителей | ||||||||||||||||||||
| ||||||||||||||||||||
значения для записей в таблице являются потенциалами восстановления, поэтому литий при
верхняя часть списка имеет самое отрицательное число, что указывает на то, что это
сильнейший восстановитель.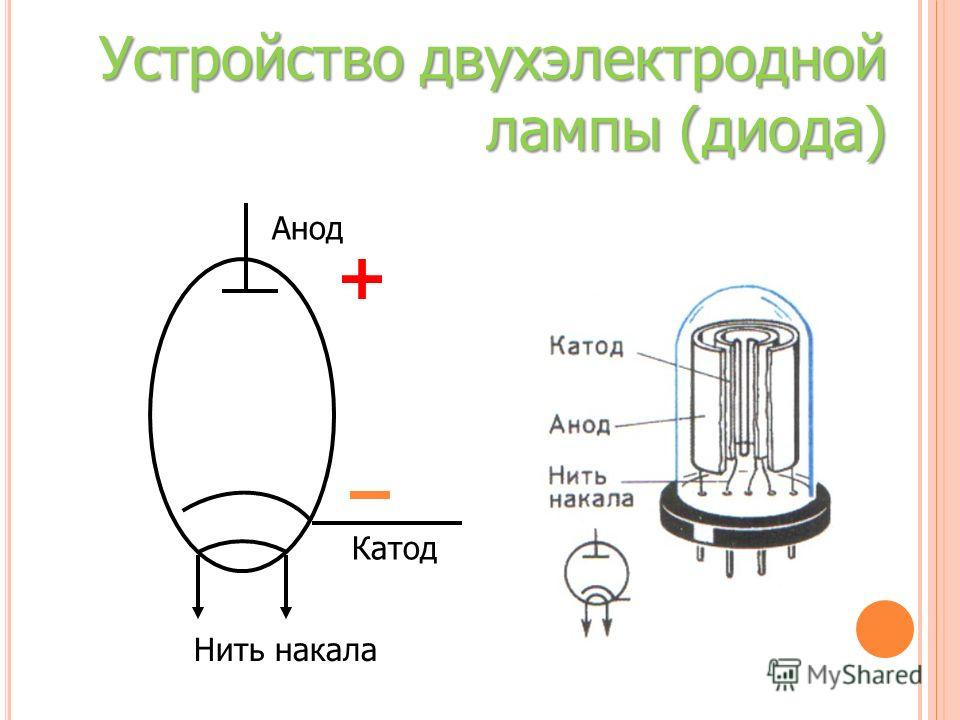 Самый сильный окислитель — фтор.
Самый сильный окислитель — фтор.
с наибольшим положительным числом для стандартного потенциала электрода.
В таблице ниже показаны некоторые общие химические вещества, используемые для электродов батареи.
расположены в порядке их относительных электродных потенциалов.
Материалы анода | Материалы катода | |||||
(отрицательные клеммы) | (положительные выводы) | |||||
НАИЛУЧШИЕ — самые отрицательные | НАИЛУЧШИЕ Самые положительные | |||||
| Литий | Феррат | |||||
| Магний | Оксид железа | |||||
| Алюминий | Оксид меди | |||||
| цинк | Йодат | |||||
| Хром | Оксид меди | |||||
| Утюг | Оксид ртути | |||||
| Никель | Оксид кобальта | |||||
| Олово | Диоксид марганца | |||||
| Свинец | Диоксид свинца | |||||
| Водород | Оксид серебра | |||||
| Медь | Кислород | |||||
| Серебро | Оксигидроксид никеля | |||||
| Палладий | Диоксид никеля | |||||
| Меркурий | Перекись серебра | |||||
| Платина | Перманганат | |||||
| Золото | Бромат | |||||
НАИМЕНЕЕ Наименьшее отрицательное | НАИМЕНЕЕ Наименьшее положительное | |||||
Ячейки
использование водных (содержащих воду) электролитов ограничено по напряжению
до менее 2 вольт, потому что кислород и водород в воде
диссоциировать в присутствии напряжений выше этого напряжения. Литий
Литий
батареи (см. ниже), в которых используются неводные электролиты, не имеют
Эта проблема доступна для напряжений от 2,7 до 3,7 В.
Однако использование неводных электролитов приводит к тому, что эти клетки
имеющий относительно высокий внутренний импеданс.
Альтернативные химические реакции
Совсем недавно был разработан новый химический состав клеток с использованием химических реакций, альтернативных традиционной окислительно-восстановительной схеме.
Металлогидридные элементы
Металл
химический состав гидридных клеток зависит от способности некоторых металлов поглощать
большое количество водорода. Эти металлические сплавы, называемые гидридами,
может обеспечить накопитель водорода, который может обратимо реагировать в
химия аккумуляторных элементов. Такие металлы или сплавы используются для негативных
Электроды.Положительный электрод — гидроксид никеля, как в NiCad.
батареи.Электролит, который также является водным абсорбентом водорода.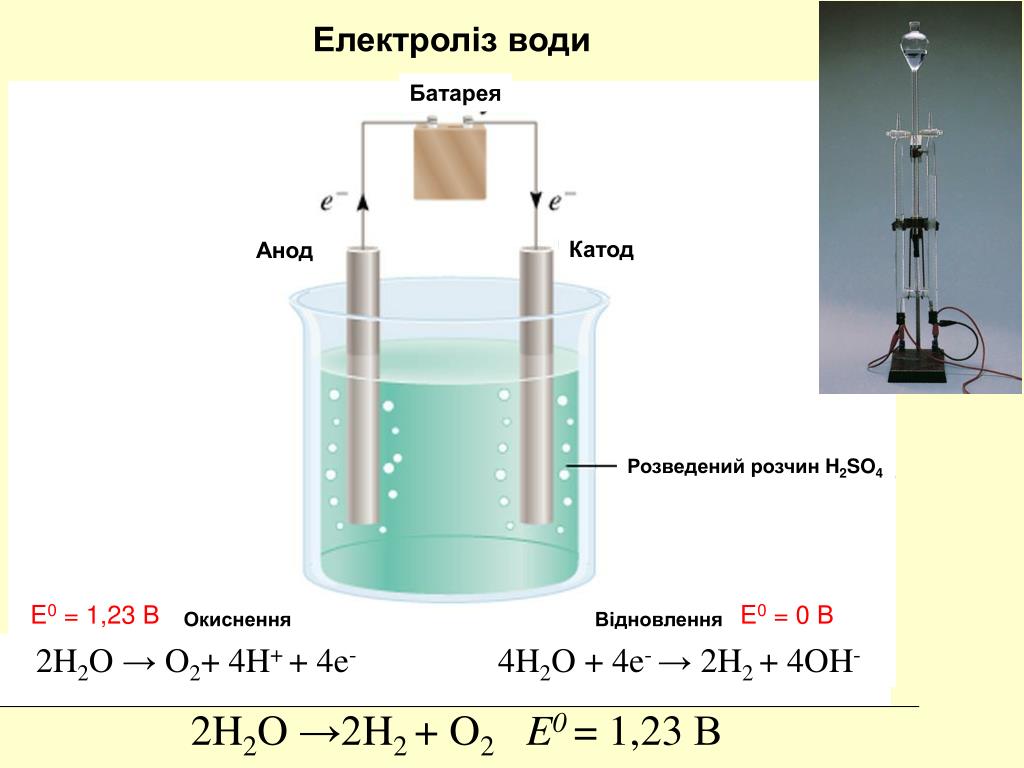
раствор, такой как гидроксид калия, не принимает участия в реакции, но
служит для транспортировки водорода между электродами.
Литий-ионные элементы
Скорее
чем традиционное окислительно-восстановительное гальваническое действие, литий-ионный вторичный элемент
химия зависит от механизма «интеркаляции». Это включает
внедрение ионов лития в кристаллическую решетку матрицы
электрод без изменения его кристаллической структуры.Эти электроды имеют
два ключевых объекта недвижимости
- Открытые кристаллические структуры, которые позволяют вводить или извлекать ионы лития
- Способность одновременно принимать компенсирующие электроны
Такие электроды называются хозяевами интеркаляции.
В
типичный литиевый элемент, анод или отрицательный электрод основан на
Углерод и катод или положительный электрод изготовлены из лития.
Диоксид кобальта или диоксид марганца лития.(Другие химические вещества также
возможно)
Поскольку литий реагирует
сильно с водой, электролит состоит из неводных
органических солей лития и действует исключительно как проводящая среда и
не принимают участие в химическом действии, а так как вода не участвует в
химическое действие, выделение водорода и кислорода, как в
многие другие батареи также исключены.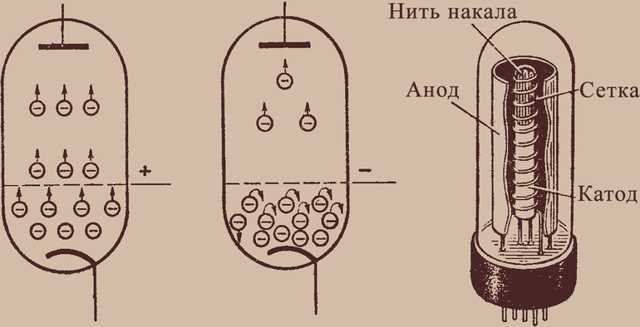
Во время
разряда ионы лития диссоциируют от анода и мигрируют
через электролит и вставлены в кристаллическую структуру
соединение-хозяин.В то же время компенсирующие электроны перемещаются
во внешней цепи и принимаются хостом для балансировки
реакция.
Процесс полностью
обратимый. Таким образом, ионы лития проходят между
электроды во время зарядки и разрядки. Это привело к
названия «Кресло-качалка», «Качели» или «Волан» для литиевых элементов.
ионные батареи.
Варианты
по литиевой технологии также используются в первичных элементах, которые были
изначально разрабатывался для космического и военного применения.Это включает
Литий-тионилхлорид и литий-диоксид серы, которые
использовать реактивные электролиты и жидкие катоды для получения более высокой энергии
и плотности мощности.
Альтернативные химические вещества — особые ароматизаторы
Проектирование
лучший аккумулятор — это не просто вопрос выбора пары элементов
с большей разницей электродных потенциалов существует множество других
факторы, которые вступают в игру.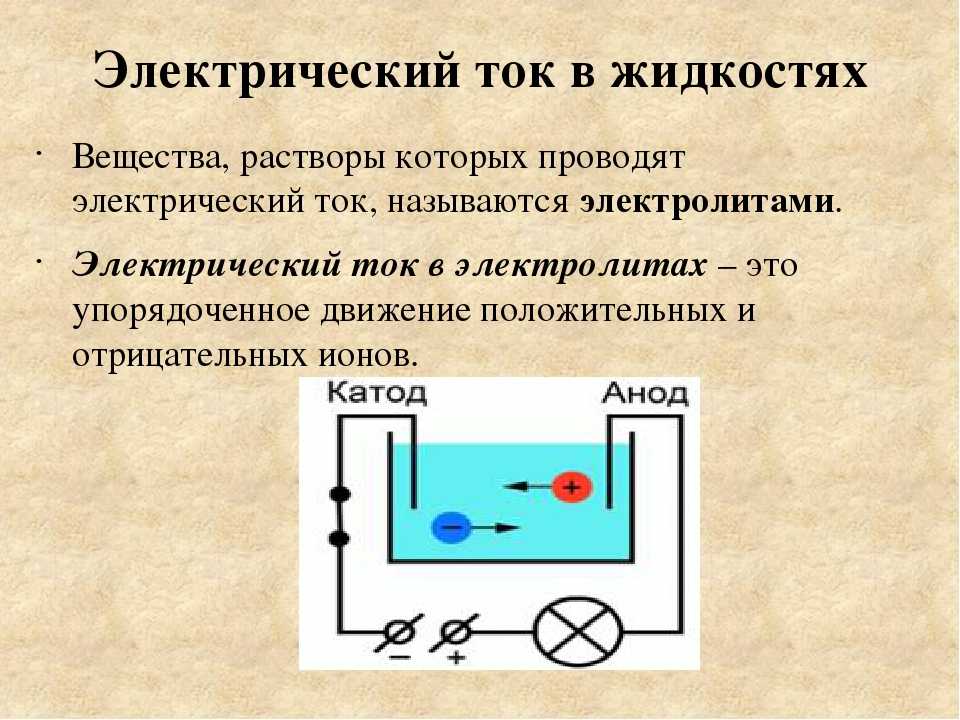 Это могут быть: наличие и стоимость
Это могут быть: наличие и стоимость
сырье, стабильность или безопасность химической смеси,
технологичность комплектующих, обратимость
электрохимическая реакция, проводимость компонентов, рабочие
температурный диапазон и вполне возможно желание обойти некоторые
другой патент производителя. Все эти соображения приводят к
использовать ограниченный набор основных химикатов, но с более широким разнообразием
составы запатентованных материалов.
Больше
годы был разработан широкий спектр химического состава клеток и добавок.
разработан для оптимизации производительности ячеек для различных приложений.
Альтернатива
активные соединения могут быть заменены для увеличения плотности энергии (см.
ниже), увеличьте ток, уменьшите внутреннее сопротивление,
уменьшить саморазряд, увеличить напряжение на клеммах, улучшить
кулоновский КПД или снижение затрат.
Дополнительно
соединения могут быть включены для изменения поведения активного
составы для увеличения срока службы, для предотвращения коррозии или утечки, для
контролировать поляризацию или повысить безопасность.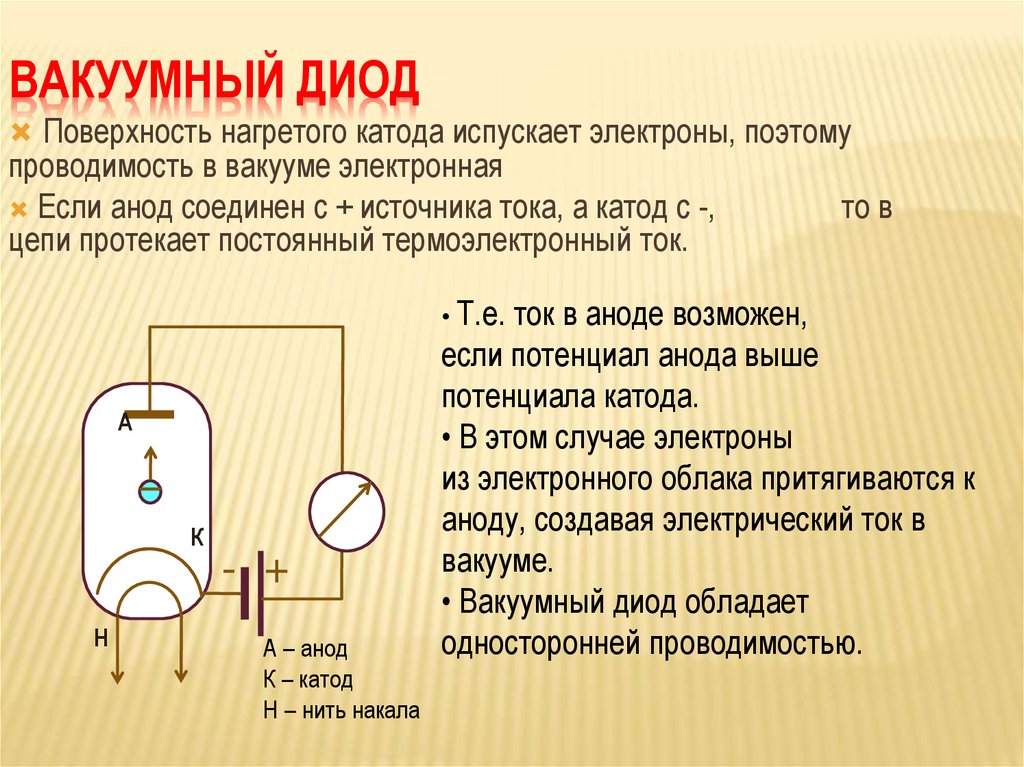 Они могут включать
Они могут включать
катализаторы, которые можно использовать для промотирования или ускорения желаемого химического
такие действия, как рекомбинация активных химических веществ в запечатанных ячейках.
Они также могут включать ингибиторы, которые могут быть добавлены для замедления или
предотвратить нежелательные физические или химические воздействия, такие как образование
дендриты.
Добавлено
к диапазону доступного химического состава клеток относятся разные клетки
емкости и физические конструкции ячеек, батареи
Таким образом, у прикладного инженера есть множество вариантов, от которых
выберите.
Плотность энергии
плотность энергии — это мера количества энергии на единицу веса или
на единицу объема, который может храниться в батарее. Таким образом, для данного
вес или объем, химия ячейки с более высокой плотностью энергии будет хранить больше
энергия или, альтернативно, для данной емкости хранения более высокая энергия
ячейка плотности будет меньше и легче. На диаграмме ниже показаны некоторые
На диаграмме ниже показаны некоторые
типичные примеры.
Относительная плотность энергии некоторых общепринятых химических составов вторичных ячеек
В
как правило, более высокая плотность энергии достигается за счет использования более реактивных
химикаты. Обратной стороной является то, что более химически активные химические вещества имеют тенденцию быть
нестабильно и может потребовать специальных мер безопасности.
Плотность энергии также зависит от качества активного
материалы, используемые в конструкции ячейки, с примесями, ограничивающими ячейку
возможности, которые могут быть достигнуты.Вот почему клетки из разных
производители с аналогичным химическим составом ячеек и аналогичной конструкцией
могут иметь другое энергосодержание и разрядные характеристики.
Примечание
что часто бывает разница между цилиндрической и призматической
клетки. Это связано с тем, что указанная плотность энергии обычно не относится к
только химическим веществам, но всей клетке, принимая во внимание
материалы корпуса ячеек и соединений. Таким образом, плотность энергии
Таким образом, плотность энергии
зависит или ограничивается практичностью построения клеток.
Поставка основных химических элементов
Обеспокоены наличием экзотических химикатов и влиянием будущего спроса на цены?
На диаграмме ниже показано относительное содержание химических элементов в земной коре.
Источник — Информационный бюллетень Геологической службы США 087-02
Примечание. Из приведенной выше таблицы лития в 20–100 раз больше.
больше, чем свинец и никель.Причина, по которой это менее распространено, заключается в том, что
Литий, будучи гораздо более активным, чем любой другой металл, обычно
находится в свободном состоянии, но сочетается с другими элементами. От
контраст. Свинец, обладающий меньшей реактивностью, чаще встречается в свободном состоянии.
и его легче извлекать и очищать. Тяжелые металлы Кадмий и
Ртуть, использование которой в настоящее время не рекомендуется из-за их токсичности, составляет 1000
раз реже лития.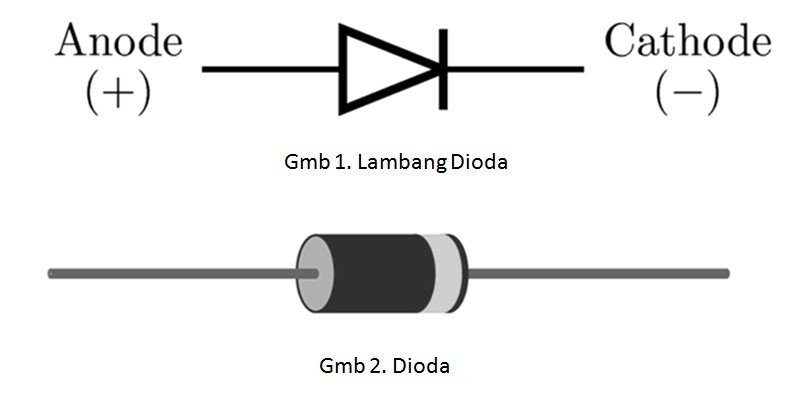
Токсичность лития
В
если вы задались вопросом, были ли какие-либо токсические эффекты, связанные с
Литий, утверждают, что литий, напротив, обладает терапевтическими свойствами.
преимущества.Безалкогольный напиток «7Up» появился в 1929 году, за два месяца до этого.
крах на Уолл-стрит с запоминающимся названием «Bib Label Lithiated»
Лимонно-лаймовая сода ».« 7Up »содержала цитрат лития до 1950 года, когда она
была переформулирована, как говорят некоторые из-за связи лития с умственными
болезнь. С 1940-х годов литий в форме карбоната лития
успешно использовался при лечении психических расстройств, в частности
маниакальная депрессия. Однако, как и в случае с большинством химикатов, небольшие дозы могут быть
безопасно или терапевтически, но слишком много может быть фатальным.
Сделайте аккумулятор дома или в школе
См. В разделе «Домашние батареи» инструкции о том, как сделать батарею из простых материалов, доступных в домашних условиях.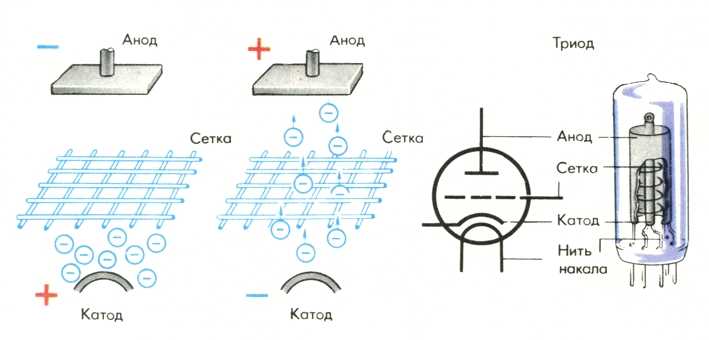
Практическая химия клеток
Некоторые
описаны наиболее распространенные химические составы клеток и их применение
для чего они подходят, если вы перейдете по ссылкам ниже: —
Первичные элементы
Вторичные элементы
Необычные батареи
Сравнительная таблица химического состава клеток
Альтернативные методы производства и хранения энергии
Определение: анод | Информация об открытой энергии
Положительный электрод в электрохимическом элементе или батарее. [1]
Определение Википедии
- Анод — это электрод, через который обычный ток входит в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода во внешнюю цепь.
 В гальваническом элементе анод — это электрод, на котором происходит реакция окисления. Анод — это также проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство».Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь. В гальваническом элементе анод — это электрод, на котором происходит реакция окисления. Анод — это также проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду.
В гальваническом элементе анод — это электрод, на котором происходит реакция окисления. Анод — это также проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство».Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь. В гальваническом элементе анод — это электрод, на котором происходит реакция окисления. Анод — это также проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство.Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь. В гальваническом элементе анод — это электрод, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд.Следовательно, анионы будут стремиться двигаться к аноду. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство.
Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство.Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь. В гальваническом элементе анод — это электрод, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд.Следовательно, анионы будут стремиться двигаться к аноду. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь.В гальваническом элементе анод — это электрод, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство.Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь.
Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь.В гальваническом элементе анод — это электрод, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство.Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь. В электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению.Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь.Как в гальванической ячейке, так и в электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд.
В электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению.Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь.Как в гальванической ячейке, так и в электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство.Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь. Как в гальванической ячейке, так и в электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению.Исторически анод также был известен как цинкод.
Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство.Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь. Как в гальванической ячейке, так и в электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению.Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю / внешнюю цепь, подключенную к элементу.Как в гальванической ячейке, так и в электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство.
Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю / внешнюю цепь, подключенную к элементу.Как в гальванической ячейке, так и в электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство.Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю или внешнюю цепь, подключенную к элементу. Как в гальванической ячейке, так и в электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд.Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению. Исторически анод также был известен как цинкод.
Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство.Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю или внешнюю цепь, подключенную к элементу. Как в гальванической ячейке, так и в электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд.Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению. Исторически анод также был известен как цинкод.
- Связанные термины
- Электрод, аккумулятор, электрический ток, солнечный элемент, электролит
Список литературы
- ↑ http://www1.
 eere.energy.gov/solar/solar_glossary.html
eere.energy.gov/solar/solar_glossary.html
Electrical Charge — обзор
3.3.4 Анализ Мотта-Шоттки
Электрический заряд, подавляемый на границе раздела электрод / электролит из-за окислительно-восстановительных реакций, можно использовать для характеристики коррозионных свойств электрода в электрохимической установке.Соотношение Мотта-Шоттки (уравнение 13.4) используется для расчета плотности пространственного заряда C на границе электрод / электролит как функции приложенного потенциала V. Уравнение Мотта-Шоттки для полупроводника типа n имеет вид [62 –65];
(13,4) 1C2 = 2ɛ ° ɛeNDV − VFb − KBTe
где; ɛ — диэлектрическая проницаемость полупроводника, ɛ o — диэлектрическая проницаемость свободного пространства, равная 8,84 × 10 −14 Ф / см, N D — концентрация доноров, e — электронная заряда, В FB — потенциал плоской зоны, K B — постоянная Больцмана и T — абсолютная температура. Для полупроводника P-типа соотношение Мотта-Шоттки имеет вид [62–66];
Для полупроводника P-типа соотношение Мотта-Шоттки имеет вид [62–66];
(13,5) 1C2 = −2ɛ ° ɛeNAV − VFb + KBTe
Как обсуждалось ранее, плотность заряда на границе раздела электрод / электролит состоит из двух областей заряда, двойного электрического слоя и области рассеянного заряда, называемой пространственным зарядом. область, край. Эти две плотности заряда образуют два последовательно соединенных конденсатора, поэтому общая емкость распределения заряда может быть задана как [43,63];
(13,6) 1C = 1CSC + 1Cdl
, где C SC — емкость области пространственного заряда, а C dl — емкость двойного слоя.Следовательно, поскольку Cdl≻≻CSC в большинстве случаев, полная емкость принимается за емкость области пространственного заряда.
Для измерения емкости области пространственного заряда напряжение постоянного тока в зависимости от опорного потенциала прикладывается к электрохимической ячейке с образцом в качестве рабочего электрода. Сигнал переменного тока накладывается на сигнал постоянного тока, и электрохимический импеданс измеряется на одной частоте, обычно на частоте кГц. Емкость области пространственного заряда может быть вычислена из мнимой части импеданса, то есть Z ”= 1 / 2πfC.
Сигнал переменного тока накладывается на сигнал постоянного тока, и электрохимический импеданс измеряется на одной частоте, обычно на частоте кГц. Емкость области пространственного заряда может быть вычислена из мнимой части импеданса, то есть Z ”= 1 / 2πfC.
Потенциал плоской зоны V FB и плотность дефектов N D могут быть определены из графика Мотта-Шоттки путем построения обратного квадрата емкости как функции приложенного потенциала. Это дает линейный график с точкой пересечения напряжения при потенциале плоской зоны и наклоном, пропорциональным концентрации доноров N D . Плотности дефектов N A, D можно вычислить из наклона графика Мотта-Шоттки a s ; [67–69]
(13.7) dC − 2dV = −2ɛrɛoQNA, D ⇒ NA, D = 2ɛrɛoQdC − 2dV
Коррозионная стойкость, пожалуй, второе наиболее изученное свойство тонких пленок нитрида хрома после его механических свойств. Благодаря превосходным трибологическим свойствам этих пленок, они широко изучаются на предмет их использования в областях, которые более подвержены коррозии. Твердые покрытия обычно изготавливают путем физического осаждения из паровой фазы для достижения наилучших механических свойств (твердости, износостойкости и низкого трения), но, с другой стороны, эти пленки характеризуются столбчатой структурой зерен и поверхностными дефектами.Эти дефекты и межколончатые пустоты приводят к появлению отверстий и трещин, что в конечном итоге приводит к местной коррозии [44,54,60,70–72]. Для минимизации структурных дефектов и повышения коррозионной стойкости применяются различные методы, от изготовления пленок при низкой температуре до многослойных покрытий.
Твердые покрытия обычно изготавливают путем физического осаждения из паровой фазы для достижения наилучших механических свойств (твердости, износостойкости и низкого трения), но, с другой стороны, эти пленки характеризуются столбчатой структурой зерен и поверхностными дефектами.Эти дефекты и межколончатые пустоты приводят к появлению отверстий и трещин, что в конечном итоге приводит к местной коррозии [44,54,60,70–72]. Для минимизации структурных дефектов и повышения коррозионной стойкости применяются различные методы, от изготовления пленок при низкой температуре до многослойных покрытий.
Пассивные пленки, сформированные на поверхности образцов в электролите, можно охарактеризовать емкостным поведением пленки как функцией приложенного потенциала.Графики Мотта-Шоттки были получены для образцов без покрытия и с покрытием из нитрида хрома в 0,5 М растворе NaCl. После построения графиков Мотта-Шоттки для всех образцов линейные области этих графиков были экстраполированы, чтобы найти их интервал x для измерения их соответствующих потенциалов плоских полос.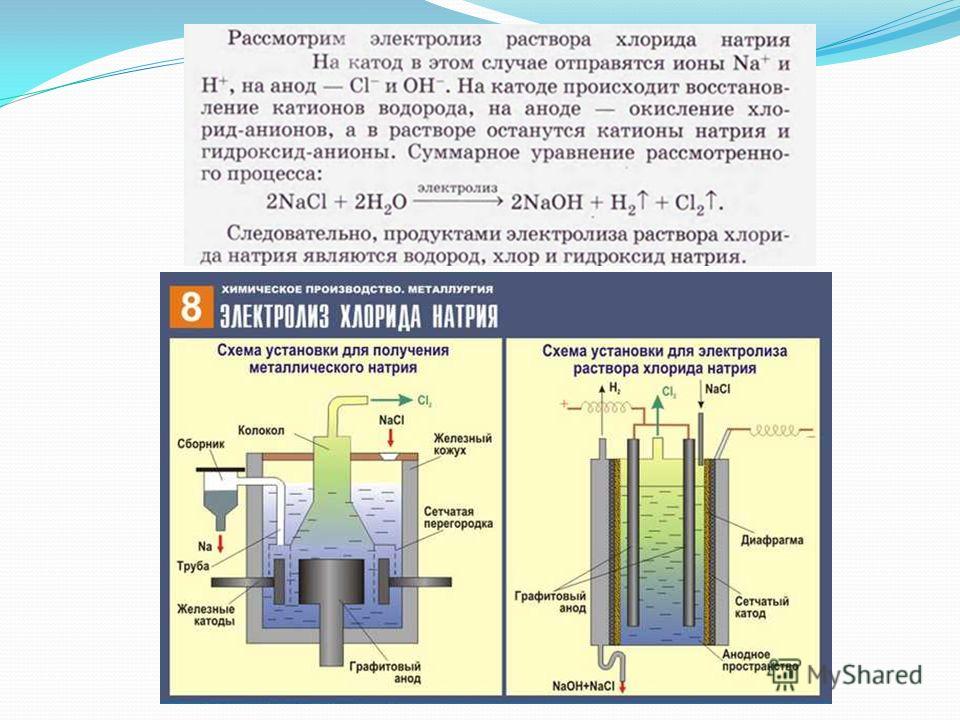 Наклоны этих областей были также измерены для расчета плотности дефектов в пассивных пленках, сформированных на поверхности каждого образца.
Наклоны этих областей были также измерены для расчета плотности дефектов в пассивных пленках, сформированных на поверхности каждого образца.
На рис. 13.12 показаны графики Мотта-Шоткки для нержавеющей стали 304 без покрытия и с покрытием из нитрида хрома, испытанной в 0.5 M раствор NaCl при 37 o C. Все графики имеют отрицательные наклоны в области положительного приложенного потенциала, а также положительные наклоны в области отрицательного приложенного потенциала. Это индикатор образования двух различных типов полупроводниковых пассивных слоев, то есть полупроводников n-типа и p-типа в двух потенциальных областях. Оксидный слой p-типа является обычным для материалов на основе Cr и в большинстве случаев считается Cr 2 O 3 [43,53,73], в то время как слой n-типа возникает из-за образования глубокий слой Fe 2 O 3 на границе электролит / подложка в случае образца без покрытия.Слой Cr 2 O 3 на образцах с покрытием ведет себя как полупроводник n-типа, но с увеличением приложенного потенциала их характер меняется на p-тип из-за окисления Cr 3+ до CrO 4 2− ионов и образование катионных вакансий [74].
Рисунок 13.12. Графики Мотта-Шоттки для подложек из нержавеющей стали с покрытием и без покрытия, испытанных в 0,5 М растворе NaCl при 37 ° C.
Из рис. 13.12 видно, что область обеднения (область границы раздела полупроводник / металл, где приложенное напряжение более положительно, чем потенциал плоской зоны [75] пассивного слоя n-типа, выходит за пределы приложенного отрицательного напряжения. Напряжение.Точно так же область обеднения оксидного слоя p-типа, сформированного на образцах с покрытием, начинается от 0,5 В / нас. С другой стороны, обедненная область пассивного слоя n-типа, сформированного на голой подложке, находится между 0 и -0,5 В / SCE в соответствии с литературой [76], в то время как для слоя p-типа эта область является областью накопления. Способность переноса заряда на границе раздела полупроводник / проводник увеличивается, когда находится в состоянии накопления, и уменьшается, если он находится в области истощения [75].Таким образом, способность к переносу заряда образцов с покрытием на границе раздела электролит / покрытие намного меньше, чем у подложки без покрытия, поскольку пассивные пленки, сформированные на образцах с покрытием, не находятся в области накопления в диапазоне приложенного потенциала, то есть от −1 до +1 В / СЭ.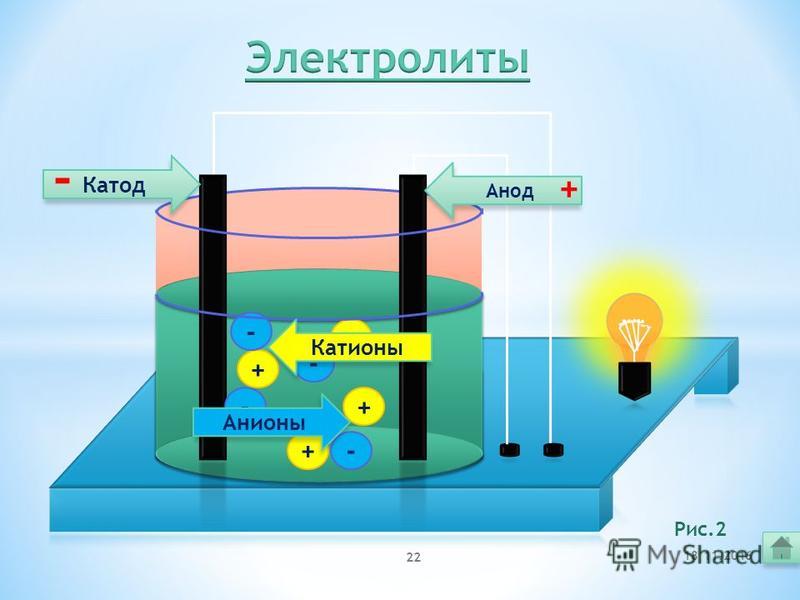 Поскольку обедненные области оксидных слоев, сформированных на пленках CrN, больше, чем оксидные слои, сформированные на нержавеющей стали без покрытия, поэтому оксидные слои, сформированные на пленках CrN, более стабильны и обеспечивают лучшую коррозионную стойкость [75].
Поскольку обедненные области оксидных слоев, сформированных на пленках CrN, больше, чем оксидные слои, сформированные на нержавеющей стали без покрытия, поэтому оксидные слои, сформированные на пленках CrN, более стабильны и обеспечивают лучшую коррозионную стойкость [75].
Идеальный график Мотта-Шоттки должен быть прямой линией, но в этом случае нелинейное поведение этих графиков указывает на дефектный характер пассивных пленок [77]. Потенциалы плоских полос этих пассивных слоев были измерены путем экстраполяции этих графиков на точку пересечения x , поскольку уравнение Мотта-Шоткки (уравнение 13.4) аналогично уравнению прямой линии.
Наклоны на рис. 13.12 в областях 0,0–0,5 В использовались для расчета плотности дефектов пассивных оксидных слоев, если емкостный отклик оксидного слоя определяется областью пространственного заряда, поскольку емкость двойного слоя намного больше. и им можно пренебречь, поскольку две области соединены последовательно.
На рис. 13.12 показано изменение пассивных пленок, сформированных на пленках нитрида хрома, осажденных с различной мощностью осаждения, то есть от 250 до 400 Вт, по сравнению с графиком Мотта-Шоттки пассивного слоя, сформированного на чистой нержавеющей стали. . Согласно соотношению Мотта-Шоткки (уравнения 13.4 и 13.5), плотность дефектов пассивного слоя обратно пропорциональна наклону графика Мотта-Шоткки. Следовательно, как видно из рис. 13.12 и таблицы 13.5, пассивный слой, сформированный на образце с покрытием из нитрида хрома, приготовленном при 350 Вт, имеет самую высокую плотность дефектов после образца без покрытия, а пленка, полученная при 300 Вт, имеет наименьшую.
13.12 показано изменение пассивных пленок, сформированных на пленках нитрида хрома, осажденных с различной мощностью осаждения, то есть от 250 до 400 Вт, по сравнению с графиком Мотта-Шоттки пассивного слоя, сформированного на чистой нержавеющей стали. . Согласно соотношению Мотта-Шоткки (уравнения 13.4 и 13.5), плотность дефектов пассивного слоя обратно пропорциональна наклону графика Мотта-Шоткки. Следовательно, как видно из рис. 13.12 и таблицы 13.5, пассивный слой, сформированный на образце с покрытием из нитрида хрома, приготовленном при 350 Вт, имеет самую высокую плотность дефектов после образца без покрытия, а пленка, полученная при 300 Вт, имеет наименьшую.
В таблице 13.5 показаны плотности дефектов и потенциалы плоских зон для всех образцов. Потенциалы плоских полос были взяты как точки пересечения x линейных областей графиков Мотта-Шоттки, полученные экстраполяцией этих областей. Плотности дефектов N D были рассчитаны из наклонов графиков Мотта-Шоттки с использованием уравнения. (13.7)
(13.7)
Таблица 13.5. Параметры Мотта-Шоттки для нержавеющей стали 304 без покрытия и с покрытием из нитрида хрома, наплавленной при различной мощности наплавки и испытанной при 0.5 М раствор NaCl при 37 ° C.
| Образец | Н / см 3 | E FB (мВ) | Тип дефекта |
|---|---|---|---|
| 250 W | |||
| 300 W | 3.62E + 20 | 587,36 | p-тип |
| 350 W | 1.69E + 21 | 536.59 | p-образный |
| 400 W | 1.05E + 21 | 563.87 | p-образный |
| SS | 2.10E + 21 | N − 21 |
Где м — наклон линейной области на графиках Мотта-Шоттки; ɛ o , постоянная диэлектрической проницаемости была принята равной 8,814 × 10 −14 Ф / см, ɛ r как 25 для слоя оксида хрома [78].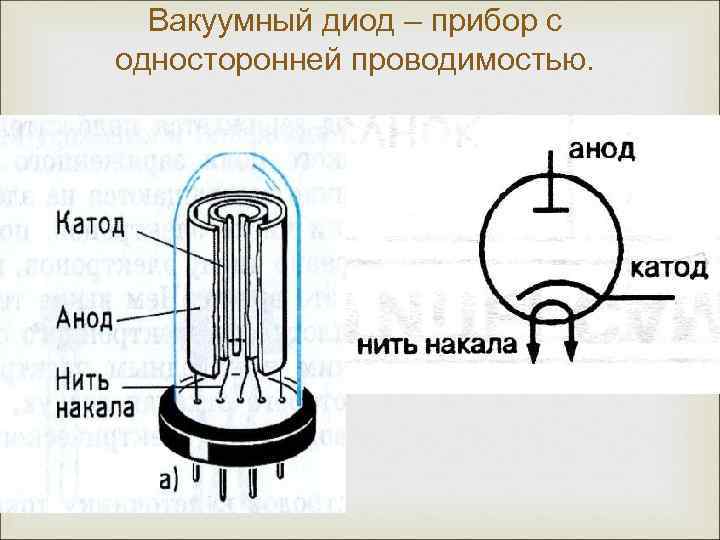 Из этих таблиц видно, что пассивные пленки, сформированные на покрытиях CrN, имеют меньшую плотность дефектов по сравнению с чистой нержавеющей сталью. Это указывает на большую компактность оксидного слоя, сформированного на покрытии CrN, чем оксидный слой, сформированный на нержавеющей стали.
Из этих таблиц видно, что пассивные пленки, сформированные на покрытиях CrN, имеют меньшую плотность дефектов по сравнению с чистой нержавеющей сталью. Это указывает на большую компактность оксидного слоя, сформированного на покрытии CrN, чем оксидный слой, сформированный на нержавеющей стали.
Электролиз | Химия [Магистр]
Прогнозирование продуктов электролиза
Электролиз — это способ разделения соединения путем пропускания через него электрического тока; продукты представляют собой ионы, входящие в состав соединения.
Цели обучения
Предсказать продукты реакции электролиза
Основные выводы
Ключевые моменты
- Основными компонентами электролитической ячейки являются электролит, постоянный ток и два электрода.
- Ключевой процесс электролиза — это обмен атомами и ионами путем удаления или добавления электронов во внешнюю цепь.
- Окисление ионов или нейтральных молекул происходит на аноде, а восстановление ионов или нейтральных молекул происходит на катоде.

Ключевые термины
- электролит : Вещество, которое в растворе или в расплавленном состоянии ионизирует и проводит электричество.
- электролиз : химическое изменение, возникающее при пропускании электрического тока через проводящий раствор или расплав соли.
Что такое электролиз?
Чтобы предсказать продукты электролиза, нам сначала нужно понять, что такое электролиз и как он работает. Электролиз — это метод разделения связанных элементов и соединений путем пропускания через них электрического тока.Он использует постоянный электрический ток (DC), чтобы запустить в противном случае несамопроизвольную химическую реакцию. Электролиз очень важен с коммерческой точки зрения как стадия отделения элементов из природных источников, таких как руды, с использованием электролитической ячейки.
Основными компонентами, необходимыми для проведения электролиза, являются:
- Электролит: вещество, содержащее свободные ионы, которые являются переносчиками электрического тока в электролите.
 Если ионы неподвижны, как в твердой соли, то электролиз не может происходить.
Если ионы неподвижны, как в твердой соли, то электролиз не может происходить. - Источник постоянного тока (DC): обеспечивает энергию, необходимую для создания или разряда ионов в электролите. Электрический ток переносится электронами во внешней цепи.
- Два электрода: электрический проводник, который обеспечивает физический интерфейс между электрической цепью, обеспечивающей энергию, и электролитом.
Обмен атомами и ионами
Ключевым процессом электролиза является обмен атомами и ионами путем удаления или добавления электронов во внешнюю цепь.Необходимые продукты электролиза находятся в физическом состоянии, отличном от состояния электролита, и могут быть удалены некоторыми физическими процессами.
Каждый электрод притягивает ионы противоположного заряда. Положительно заряженные ионы или катионы движутся к катоду, обеспечивающему электроны, который является отрицательным; отрицательно заряженные ионы или анионы движутся к положительному аноду. Вы могли заметить, что это противоположность гальванической ячейки, где анод отрицательный, а катод положительный.
Вы могли заметить, что это противоположность гальванической ячейки, где анод отрицательный, а катод положительный.
На электродах электроны поглощаются или высвобождаются атомами и ионами. Те атомы, которые приобретают или теряют электроны, становятся заряженными ионами, которые переходят в электролит. Те ионы, которые приобретают или теряют электроны, чтобы стать незаряженными атомами , отделяются от электролита. Образование незаряженных атомов из ионов называется разрядкой. Энергия, необходимая для миграции ионов к электродам, и энергия, вызывающая изменение ионного состояния, обеспечивается внешним источником.{4 -} _ 6 [/ латекс]
Нейтральные молекулы также могут реагировать на любом из электродов. Реакции электролиза с участием ионов H + довольно распространены в кислых растворах. В щелочных водных растворах реакции с участием гидроксид-ионов (OH — ) обычны. Окисленные или восстановленные вещества также могут быть растворителем, которым обычно является вода, или электродами.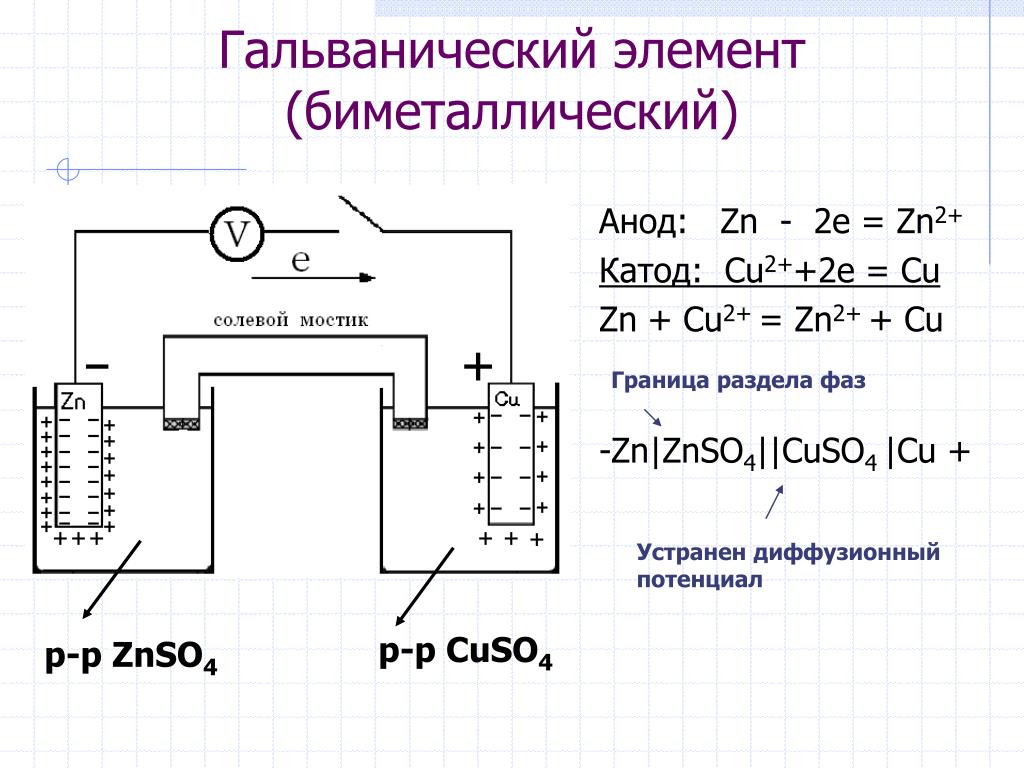 Возможен электролиз с участием газов.
Возможен электролиз с участием газов.
Прогнозирование продуктов электролиза
Давайте посмотрим, как прогнозировать продукты.Например, на какие два иона распадется CuSO 4 ? Ответ: Cu 2+ и SO 4 2- . Давайте посмотрим на эту реакцию внимательнее.
Электролиз сульфата меди : два медных электрода помещают в раствор синего сульфата меди и подключают к источнику электрического тока. Ток включен на некоторое время.
Берем два медных электрода и помещаем их в раствор синего сульфата меди (CuSO 4 ) и включаем ток.- [/ латекс]
Мы только что видели электрический ток, используемый для расщепления CuSO 4 на составляющие ионы. Это все, что нужно для прогнозирования продуктов электролиза; все, что вам нужно сделать, это разложить соединение на составляющие ионы.
Электролиз хлорида натрия
Два обычно используемых метода электролиза включают расплав хлорида натрия и водный раствор хлорида натрия, которые дают разные продукты.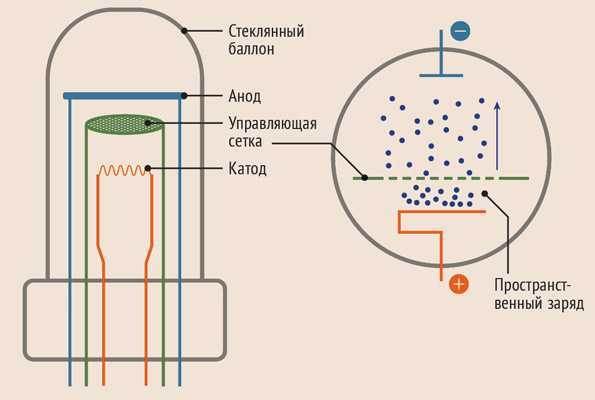
Цели обучения
Предсказать продукты электролиза хлорида натрия в расплавленных и водных условиях
Основные выводы
Ключевые моменты
- Металлический натрий и газообразный хлор могут быть получены электролизом расплавленного хлорида натрия.
- Электролиз водного раствора хлорида натрия дает водород и хлор, при этом водный гидроксид натрия остается в растворе.
- Причина различия в том, что восстановление Na + (E ° = –2,7 v) энергетически сложнее, чем восстановление воды (–1,23 v).
Ключевые термины
- анод : электрод электрохимической ячейки, на которой происходит окисление.
- катод : электрод электрохимической ячейки, на которой происходит восстановление.
Электролиз NaCl
Как мы уже говорили, электролиз — это прохождение постоянного электрического тока через ионное вещество, которое либо расплавлено, либо растворено в подходящем растворителе. Это приводит к химическим реакциям на электродах и разделению материалов. Два обычно используемых метода электролиза включают расплав хлорида натрия и водный раствор хлорида натрия. Вы можете подумать, что оба метода дадут вам одинаковые продукты, но это не так. Давайте рассмотрим каждый из методов, чтобы понять различные процессы.
Это приводит к химическим реакциям на электродах и разделению материалов. Два обычно используемых метода электролиза включают расплав хлорида натрия и водный раствор хлорида натрия. Вы можете подумать, что оба метода дадут вам одинаковые продукты, но это не так. Давайте рассмотрим каждый из методов, чтобы понять различные процессы.
Электролиз расплавленного NaCl
Если хлорид натрия расплавляется (выше 801 ° C), два электрода вставляются в расплав и через расплав соли пропускается электрический ток, после чего на электродах происходят химические реакции.
Электролизная ячейка для расплавленного хлорида натрия : Промышленная электролизная ячейка для производства металлического натрия и газообразного хлора из расплавленного NaCl. Жидкий натрий всплывает в верхнюю часть расплава над катодом и сливается в резервуар для хранения.{-} [/ латекс]
Общая реакция — это разложение хлорида натрия на элементы:
[латекс] 2 \ text {NaCl} \ rightarrow 2 \ text {Na} (\ text {s}) + {\ text {Cl}} _ {2} (\ text {g}) [/ latex]
Электролиз водного NaCl
Что происходит, когда у нас есть водный раствор хлорида натрия? Что ж, мы не можем забыть, что мы должны учитывать воду в уравнении. Поскольку вода может как окисляться, так и восстанавливаться, она конкурирует с растворенными ионами Na + и Cl — .Вместо производства натрия производится водород.
Поскольку вода может как окисляться, так и восстанавливаться, она конкурирует с растворенными ионами Na + и Cl — .Вместо производства натрия производится водород.
Электролиз водного раствора хлорида натрия : Электролиз водного раствора NaCl приводит к образованию водорода и хлористого газа. На аноде (A) хлорид (Cl-) окисляется до хлора. Ионоселективная мембрана (B) позволяет противоиону Na + свободно проходить через нее, но предотвращает диффузию анионов, таких как гидроксид (OH-) и хлорид. На катоде (C) вода восстанавливается до гидроксида и газообразного водорода. Чистый процесс представляет собой электролиз водного раствора NaCl на промышленно полезные продукты — гидроксид натрия (NaOH) и газообразный хлор.{-} (\ text {aq}) + {\ text {H}} _ {2} (\ text {g}) + \ frac {1} {2} {\ text {Cl}} _ {2} ( \ text {g}) [/ latex]
Восстановление Na + (E ° = –2,7 об.) Энергетически сложнее, чем восстановление воды (–1,23 об.), Поэтому в водном растворе будет преобладать последнее.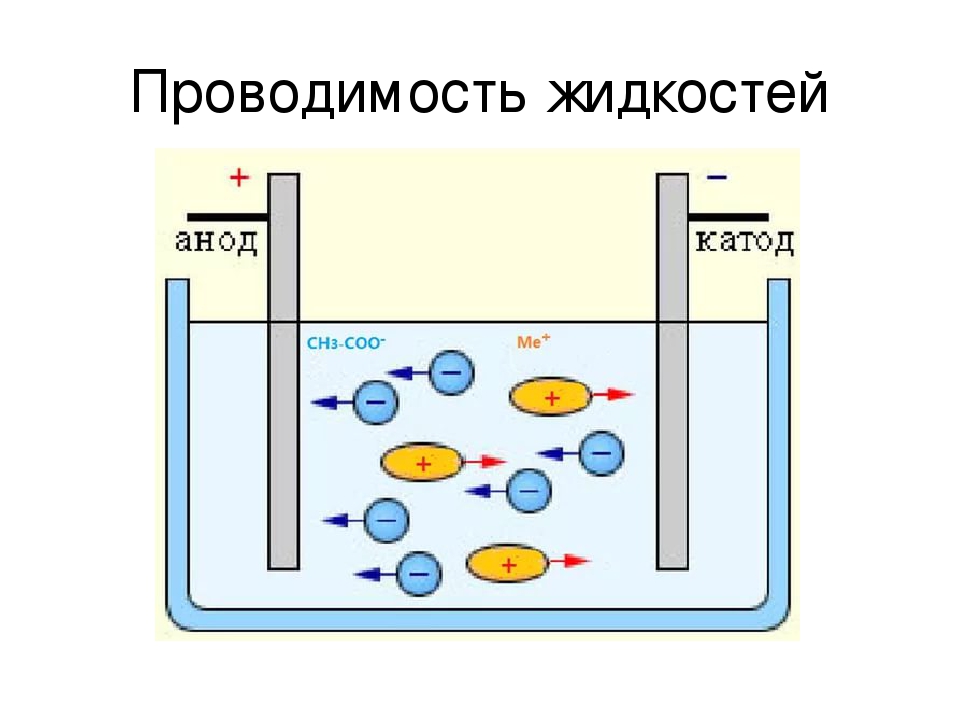
Вывести продукты электролиза расплава соли : Электролиз расплава соли дает элементы из соли. Итак, электролиз WCl4 дает W и Cl2.Ионы металлов получают электроны на отрицательном электроде, а неметаллы теряют их на положительном электроде.
Электролиз воды
Чистая вода не может подвергаться значительному электролизу без электролита, такого как кислота или основание.
Цели обучения
Вспомните свойства электролита, которые позволяют проводить электролиз воды
Основные выводы
Ключевые моменты
- Электролиз раствора серной кислоты или соли, такой как NaNO 3 , приводит к разложению воды на обоих электродах.
- На катоде появится водород, а на аноде появится кислород.
- Количество образующегося водорода в два раза превышает количество молей кислорода, и оба они пропорциональны общему электрическому заряду, проводимому раствором.

Ключевые термины
- электролиз : химическое изменение, возникающее при пропускании электрического тока через проводящий раствор или расплав соли.
Чистая вода не может подвергаться значительному электролизу без добавления электролита.{-} [/ латекс]
E ° = -1,23 В
Умножение катодной реакции на 2, чтобы соответствовать количеству перенесенных электронов, дает это чистое уравнение после объединения ионов OH — и H + с образованием воды:
Сеть: [латекс] 2 {\ text {H}} _ {2} \ text {O} (\ text {l}) \ rightarrow 2 {\ text {H}} _ {2} (\ text {g} ) + {\ text {O}} _ {2} (\ text {g}) [/ latex]
E = -1,23 v
Водород появится на катоде, отрицательно заряженном электроде, где электроны входят в воду, и кислород появится на аноде, положительно заряженном электроде.Количество образовавшихся молей водорода в два раза больше количества молей кислорода, и оба они пропорциональны общему электрическому заряду, проводимому раствором. Количество электронов, проталкиваемых через воду, в два раза превышает количество образованных молекул водорода и в четыре раза больше, чем количество образованных молекул кислорода.
Количество электронов, проталкиваемых через воду, в два раза превышает количество образованных молекул водорода и в четыре раза больше, чем количество образованных молекул кислорода.
Иоганн Риттер, который изобрел первый электрохимический элемент, был одним из первых, кто открыл разложение воды электричеством.
Электролиз воды : Устройство, изобретенное Иоганном Вильгельмом Риттером для разработки электролиза воды.
Стехиометрия электролиза
Количество химического изменения, которое происходит при электролизе, стехиометрически связано с количеством электронов, проходящих через элемент.
Цели обучения
Предсказать, сколько кулонов потребуется для данной электрохимической реакции
Основные выводы
Ключевые моменты
- С точки зрения источника напряжения и цепи вне электродов, поток электронов обычно описывается в терминах электрического тока с использованием кулонов и ампер в единицах СИ.
- Требуется 96 485 кулонов, чтобы составить моль электронов, единицу, известную как фарадей (F).

- Эквивалентный вес вещества определяется как молярная масса, деленная на количество электронов, необходимых для окисления или восстановления каждой единицы вещества.
Ключевые термины
- кулонов : В Международной системе единиц — производная единица электрического заряда; количество электрического заряда, переносимого током в 1 ампер, протекающим в течение 1 секунды.Символ: C.
- фарадей : количество электричества, необходимое для депонирования или высвобождения 1 грамма эквивалентного веса вещества во время электролиза; приблизительно 96 487 кулонов.
Стехиометрия электролитической ячейки
Степень химического изменения, происходящего в электролитической ячейке, стехиометрически зависит от количества молей электронов, проходящих через ячейку. С точки зрения источника напряжения и цепи вне электродов, поток электронов обычно описывается в терминах электрического тока с использованием единиц СИ — кулонов и ампер.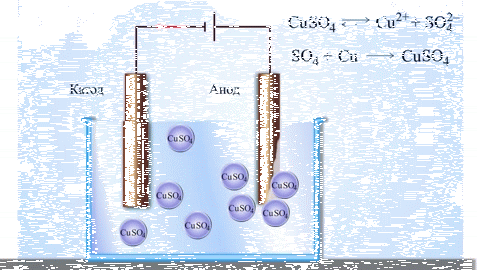 Чтобы составить моль электронов, требуется 96 485 кулонов — единица, известная как фарадей (F).
Чтобы составить моль электронов, требуется 96 485 кулонов — единица, известная как фарадей (F).
Это соотношение было впервые сформулировано Майклом Фарадеем в 1832 году в форме двух законов электролиза:
- Вес веществ, образующихся на электроде во время электролиза, прямо пропорционален количеству электричества, которое проходит через электролит.
- Вес различных веществ, образованных при прохождении одного и того же количества электричества, пропорционален эквивалентному весу каждого вещества.- \ rightarrow \ text {V} [/ latex]).
Большинство стехиометрических задач, связанных с электролизом, могут быть решены без явного использования законов Фарадея. «Химия» в этих задачах обычно очень элементарна; основные трудности обычно возникают из-за незнания основных электрических устройств:
- ток (в амперах) — это скорость переноса заряда: 1 ампер = 1 [латекс] \ frac {\ text {Coulombs}} {\ text {second}} [/ latex].
- (в ваттах) — это скорость производства или потребления энергии: 1 Вт = 1 [латекс] \ frac {\ text {Джоуль}} {\ text {second}} [/ latex].
 -} = 1184 \ \ text {Coulombs} [/ latex]
-} = 1184 \ \ text {Coulombs} [/ latex]1.5 часов эквивалентны 5400 секундам:
[латекс] \ frac {1184 \ \ text {Coulombs}} {5400 \ \ text {seconds}} = 0,22 \ \ text {Amps} [/ latex]
Электрофорез — MCAT Physical
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает
или несколько ваших авторских прав, сообщите нам об этом, отправив письменное уведомление («Уведомление о нарушении»), содержащее
то
информацию, описанную ниже, назначенному ниже агенту.Если репетиторы университета предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как
в виде
ChillingEffects. org.
org.Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатам), если вы существенно
искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится
на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например, мы требуем
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; а также
Ваше заявление: (а) вы добросовестно полагаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105Или заполните форму ниже:
Рентгеновская трубка
ВОПРОСЫ
- Внутри рентгеновской трубки находятся анод и катод. Что заряжено отрицательно, а какое положительно?
- Какова роль анода и катода в производстве рентгеновских лучей?
- Почему анод сделан из вольфрама и почему он установлен на меди.
 Если на то пошло, почему он крутится?
Если на то пошло, почему он крутится? - Что такое цепь низкого напряжения рентгеновского аппарата?
- Что, черт возьми, является фокусом вашего рентгеновского аппарата?
- Что такое эффект каблука?
- Что такое «несфокусное» или «стволовое» излучение?
- Что заставляет большинство рентгеновских аппаратов выходить из строя? (Какая часть обычно выходит из строя первой)?
- В идеале вам нужна техника с высоким KVP и низким мАс. (меньше секунд = меньше артефактов движения и меньше износа нити).Хорошо, допустим, мы используем 60 квп и 10 мА при 0,4 сек. Как мы могли получить такую же пленку, но с более высоким КПД и более низким мА?
- Если говорить о рентгеновском аппарате, что, черт возьми, такое «исправление»?
ОТВЕТА
- Это вопрос дислексического типа, потому что электроды названы не по тому, как они заряжены, а по тому, как частицы движутся к ним. «Кат» означает положительный, означающий, что положительно заряженные частицы направляются к катоду.
 «An» означает, что отрицательно заряженные и отрицательно заряженные частицы направляются к аноду. Это означает, что катод заряжен отрицательно, а анод — положительно.
«An» означает, что отрицательно заряженные и отрицательно заряженные частицы направляются к аноду. Это означает, что катод заряжен отрицательно, а анод — положительно. - Катод представляет собой нить накала, которая нагревается при зарядке машины. Другими словами, мы помещаем на катод кучу электронов. Анод — это цель (поле атомов, через которое мы будем пропускать электроны. Когда мы нажимаем педаль полностью вниз, мы помещаем разность потенциалов между анодом и катодом, и в этот момент электроны перемещаются по на мишени и производится рентгеновское излучение.
- Там довольно жарко, все эти электроны летают и генерируются рентгеновские лучи. Фактически, когда электронный луч ударяет по аноду, 99% потерянной энергии теряется в виде тепла, а не в виде фотонов (я ненавижу, когда это происходит). Мы вращаем анод, чтобы рассеять тепло, а медь помогает отводить тепло. Фактическая мишень сделана из вольфрама из-за высокого числа Z у вольфрама (мы получаем рентгеновские лучи, а не какой-либо другой вид света).

- Схема низкого напряжения нагревает нить накала (катод), то есть помещает электроны на катод.Обратите внимание, что катод имеет форму чашки, чтобы фокусировать электроны. В схеме есть переменный резистор, который позволяет вам установить, сколько электронов вы поместите на катод (установка мА). Также есть «понижающий трансформатор» — нам нужно около 10 вольт в этой цепи, а в стене — около 220. Также есть цепь высокого напряжения, которая создает высокий потенциал на электродах. В нем есть повышающий трансформатор, поэтому мы можем получать киловольт на наших электродах, а не только жалкие 220 вольт на стене.
- Фокусное пятно — это область на анодной мишени, куда попадает электронный луч. Более крупное фокусное пятно может вместить больше тепла и, таким образом, помогает машине прослужить дольше. Это особенно необходимо, если вы собираетесь быстро снимать фильмы или пытаетесь проникнуть в большое животное. Однако небольшое фокусное пятно дает лучшую детализацию рентгенограммы.
 На самом деле это еще не все, но без фотографий я не могу вам показать.
На самом деле это еще не все, но без фотографий я не могу вам показать. - Ладно, попробую без картинок объяснить.Представьте себе прямоугольник, высокий и худой. Отрежьте левый нижний угол. Так выглядит анод с мишенью в срезанном углу. Скажем, электронный луч направляется прямо в этот отрезанный угол. Рентгеновские лучи излучаются из этой точки во всех направлениях на 360 градусов вокруг фокального пятна. Но у нас нет первичного луча, который вращается на 360 градусов, потому что анод сделан из металла, а металл хорошо поглощает рентгеновские лучи. Сотрите ту часть фасоли на 360 градусов, которую снимает анод.Таким образом, первичный пучок более тяжелый для рентгеновских лучей на стороне катода и более слабый (меньше фотонов) на стороне анода. Вы должны приложить самую толстую часть вашего пациента к катоду, чтобы воспользоваться эффектом пятки. (Имеет ли это смысл? Если нет, я попытаюсь загрузить графику.)
- Этот тип излучения относится к рентгеновским лучам, возникающим в результате взаимодействия электронов и частей трубки, кроме мишени.
 Мы не можем контролировать направление полученных фотонов, поэтому они будут способствовать запотеванию пленки, а не первичному лучу.Мы бы хотели убрать их из поля зрения (без каламбура). Встраивание мишени в графит с низким числом Z помогает гарантировать, что полученные в результате расфокусированные фотоны имеют низкую энергию и будут поглощены корпусом трубки задолго до того, как они увидят пленку ниже.
Мы не можем контролировать направление полученных фотонов, поэтому они будут способствовать запотеванию пленки, а не первичному лучу.Мы бы хотели убрать их из поля зрения (без каламбура). Встраивание мишени в графит с низким числом Z помогает гарантировать, что полученные в результате расфокусированные фотоны имеют низкую энергию и будут поглощены корпусом трубки задолго до того, как они увидят пленку ниже. - Нить накала (катод) обычно сначала выходит из строя. Когда вы покупаете рентгеновский аппарат, нить накаливания выдерживает 500 минут при максимальной температуре, прежде чем она сломается. Вы знаете, тепловой стресс. Вы можете испортить машину намного раньше, настроив пленку, нажав переключатель режима ожидания (который нагревает пленку и раскручивает анод), а затем не снимая пленку.(Вы тратите ценные минуты жизни нити накала.) Когда нить накаливания выходит из строя, амперметр на машине не двигается, когда вы щелкаете пленку, и пленка не экспонируется, когда выходит из процессора.
 Следующая наиболее вероятная причина неисправности — это перегретые анодные подшипники. Жужжание анода просто звучит забавно или вообще не звучит. Без вращения поверхность анода будет ямиться, и луч не будет надежно соответствовать настройкам kvp.
Следующая наиболее вероятная причина неисправности — это перегретые анодные подшипники. Жужжание анода просто звучит забавно или вообще не звучит. Без вращения поверхность анода будет ямиться, и луч не будет надежно соответствовать настройкам kvp. - Когда вы увеличиваете kvp на 10, вы можете сократить мА вдвое и получить ту же пленку.Таким образом, мы могли использовать 70 кВп и 10 мА за 0,2 секунды. Мы также можем использовать 90 квп, 5 мА и 0,1 сек.
- В настенную розетку подается переменный ток. Это означает, что потенциал, заставляющий электроны двигаться по медному проводу вашего компьютера, подключенного к стене, заставляет электроны двигаться вперед, затем они останавливаются, затем движутся назад и продолжают чередоваться таким образом. Что ж, ваш рентгеновский аппарат не использует движущихся назад электронов, поэтому нам нужно внести некоторые изменения (исправление.)
При использовании устройства, называемого «выпрямитель», обратный ток блокируется. Это единственное, что решает проблему, потому что теперь можно использовать только половину электронов (мы заблокировали те, которые идут назад).

alexxlab
Мощность
Анод и катод: что это такое
Содержание
- Как определить анод и катод
- Основные свойства катодов
- Анод на аккумуляторе, гальваническом элементе, в диоде и в других приборах. Анод при электролизе водного и иного раствора. Процессы на аноде:
- Гальванотехника
- Похожие статьи
- Понятие катода и анода — простое объяснение
- Электрохимия и гальваника
- Назначение
- Электролиз расплавов
- Вывод
Как определить анод и катод
Что это такое катод и анод, выясняют в частных моментах: при определении выводов у полупроводниковых элементов или при идентификации электродов в электрохимических процессах.
Полупроводниковый диод требует позиционного размещения в электросхемах. Для правильного соединения необходимо отождествить выводы. Это можно сделать по следующим признакам:
- маркировка, нанесённая на корпус элемента;
- длина выводов детали;
- показания тестера при измерениях в режиме омметра или проверки диодов;
- использование источника тока с известной полярностью.

Маркировка полупроводников такого типа может быть выполнена при помощи нанесения на корпус графического обозначения диода. Тогда минус (К) – это вывод со стороны вертикальной линии, в которую упирается контур стрелки. Ножка диода, от которой выходит стрелка, – это плюс (А). Так графически указано прямое направление тока – от «А» к «К».
Другим способом обозначения анода у диодного элемента могут быть нанесённые на корпус одна или две цветные точки или пара узких колец. Существуют конструктивно выполненные диоды, у которых минусовой (катодный) вывод обозначен широким серебряным кольцом. Диод 2А546А-5 (ДМ) служит таким примером.
Примеры нанесения меток на диоды
Длина ножек светодиодов, ни разу не паянных в платы, также может указывать на полярность выводов. У led-диодов длинная ножка – это положительный электрод, короткая – отрицательный вывод. К тому же форма корпуса (обрез края окружности) может служить ориентиром.
Полярность выводов led-диодов
При определении мультиметром полярности контактных выводов полупроводника подключают его в режиме тестирования диодов. Если на дисплее появились цифры, значит, диод подключён в прямом направлении. При этом красный щуп подсоединён к аноду «+», чёрный – к катоду «-».
Если на дисплее появились цифры, значит, диод подключён в прямом направлении. При этом красный щуп подсоединён к аноду «+», чёрный – к катоду «-».
Если под рукой нет тестера, определить названия выводов диода можно, собрав последовательную цепь из батарейки, лампочки и диода. При прямом включении лампочка загорится, значит, плюс батарейки – на аноде и аналогично минус – на другом электроде.
Информация. Электроды светодиода можно идентифицировать с помощью постоянного ИП с заведомо известной полярностью и включенного последовательно резистора, ограничивающего ток. Свечение элемента укажет на прямое включение. Для этой цели можно взять батарейку RG2032 на 3 вольта и резистор сопротивлением 1кОм.
Включение светодиода через ограничивающий резистор
Что касается полупроводников, всегда существует строгое соответствие наименований. В других случаях правильное определение проходящих электрохимических реакций поможет чётко ориентироваться в отождествлении электродов.
Основные свойства катодов
Любой электровакуумный прибор имеет электрод, предназначенный для испускания (эмиссии) электронов. Этот электрод называется катодом. Электрод, предназначенный для приема эмиттированных катодом электронов, называется анодом. На анод подают более высокий и положительный относительно катода потенциал. Катод должен отдавать с единицы поверхности большой ток эмиссии при возможно низкой температуре нагрева и обладать большим сроком службы. Нагрев катода в электровакуумном приборе производится протекающим по нему током.
Этот электрод называется катодом. Электрод, предназначенный для приема эмиттированных катодом электронов, называется анодом. На анод подают более высокий и положительный относительно катода потенциал. Катод должен отдавать с единицы поверхности большой ток эмиссии при возможно низкой температуре нагрева и обладать большим сроком службы. Нагрев катода в электровакуумном приборе производится протекающим по нему током.
Будет интересно Чему равна электроемкость конденсатора?
Такие термоэлектронные катоды разделяются на две основные группы:
- катоды прямого накала,
- катоды косвенного накала (подогревные).
Катоды прямого накала представляют собой металлическую нить, которая непосредственно разогревается током накала и служит для излучения электронов.Поверхность излучения катодов прямого накала невелика, поэтому от них нельзя получить большой ток эмиссии. Малая теплоемкость нити не позволяет использовать для нагрева переменный ток. Кроме того, при нагреве переменным током температура катода не постоянна во времени, а следовательно, меняется во времени и ток эмиссии.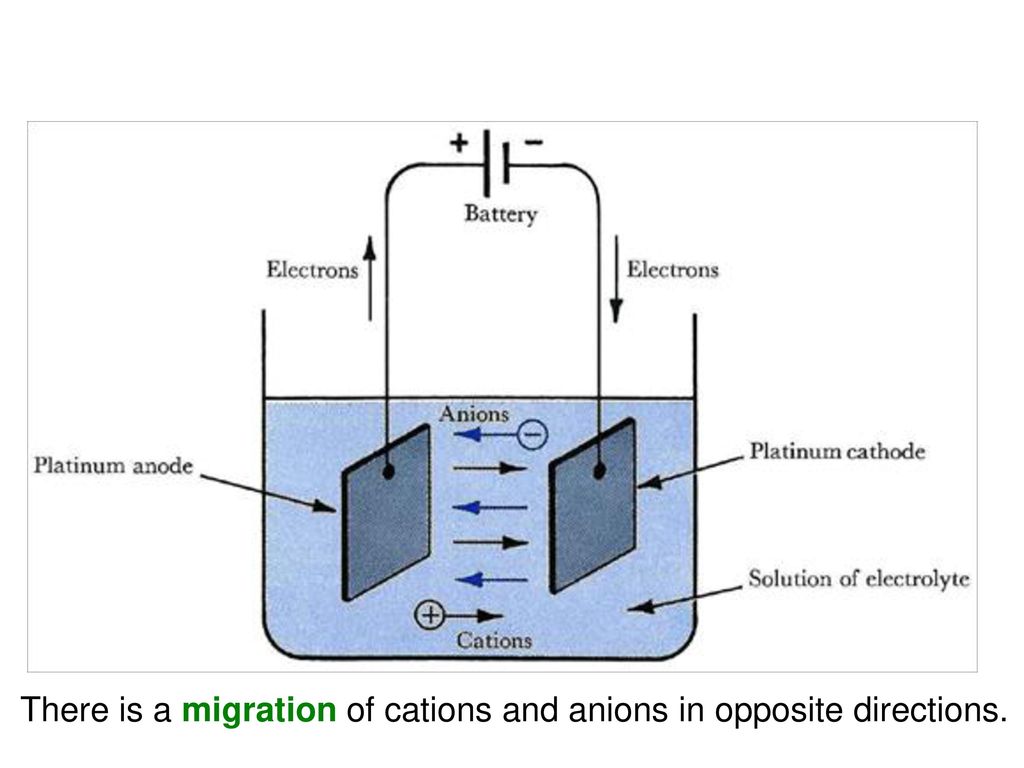
Положительным свойством катода прямого накала является его экономичность, которая достигается благодаря малому количеству тепла, излучаемого в окружающую среду вследствие малой поверхности катода. Катоды прямого накала изготовляются из вольфрамовой и никелевой проволоки. Однако большая работа выхода (W = 4,2÷4,5 в) определяет высокую рабочую температуру катода, вследствие чего катод становится неэкономичным. Для повышения экономичности катода вольфрамовую или никелевую проволоку (керн) «активируют» — покрывают пленкой другого элемента. Такие катоды называются активированными.
Если на поверхность керна нанесена электроположительная пленка (пленка из цезия, тория или бария, имеющих меньшую работу выхода, чем материал керна), то происходит поляризация пленки: валентные электроны переходят в керн, и между положительно заряженной пленкой и керном возникает разность потенциалов, ускоряющая движение электрона при выходе его из керна.
Работа выхода катода с такой мономолекулярной электроположительной пленкой оказывается меньше работы выхода электрона как из основного металла, так и из металла пленки.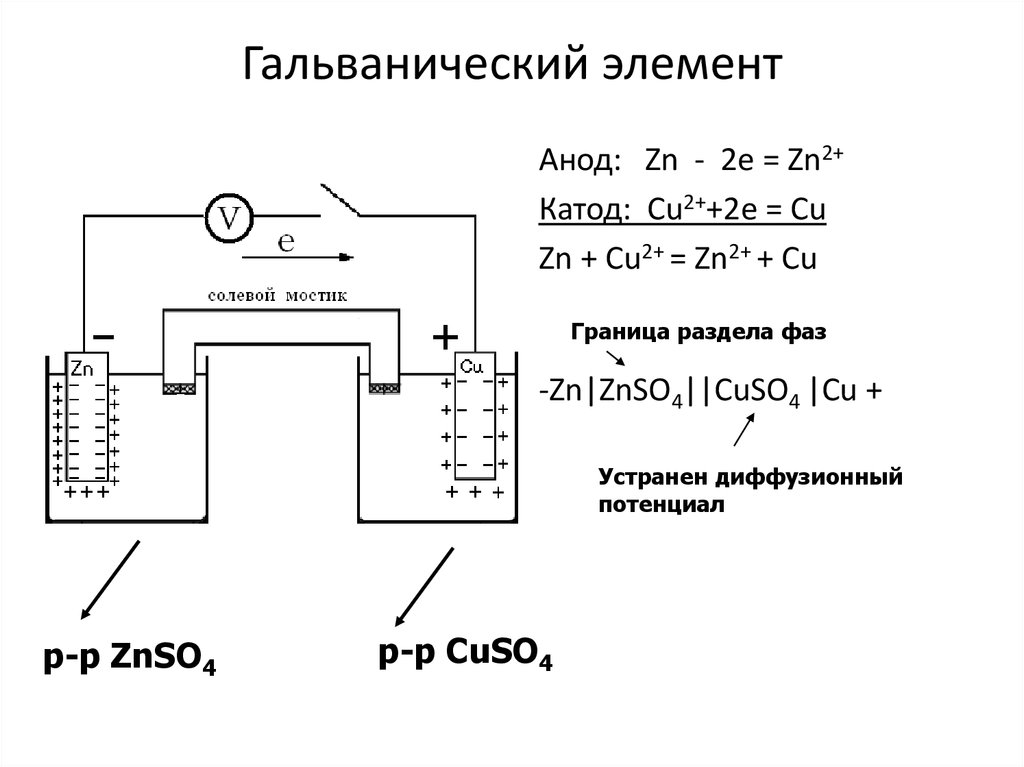 При покрытии керна электроотрицательной пленкой, например кислородом, работа выхода катода увеличивается. Подогревные катоды выполняются в виде никелевых гильз, поверхность которых покрывается активным слоем металла, имеющим малую работу выхода. Внутри катода помещается подогреватель— вольфрамовая нить или спираль, подогрев которой может осуществляться как постоянным, так и переменным
При покрытии керна электроотрицательной пленкой, например кислородом, работа выхода катода увеличивается. Подогревные катоды выполняются в виде никелевых гильз, поверхность которых покрывается активным слоем металла, имеющим малую работу выхода. Внутри катода помещается подогреватель— вольфрамовая нить или спираль, подогрев которой может осуществляться как постоянным, так и переменным
Как работает гальванизация.
током.
Для изоляции подогревателя от гильзы внутренность последней покрывается алундом (Аl2O3). Подогревные катоды, благодаря их большой тепловой инерции, обычно питают переменным током, значительная поверхность гильзы обеспечивает большой эмиссионный ток. Подогревные катоды, однако, менее экономичны и разогреваются значительно дольше, чем катоды прямого накала.
Анод на аккумуляторе, гальваническом элементе, в диоде и в других приборах. Анод при электролизе водного и иного раствора. Процессы на аноде:
Анод (др.-греч. ἄνοδος – «движение вверх») – это электрод некоторого прибора, в который втекает электрический ток (в его конвенциональном понимании как поток положительных зарядов), в противоположность катоду из которого он вытекает.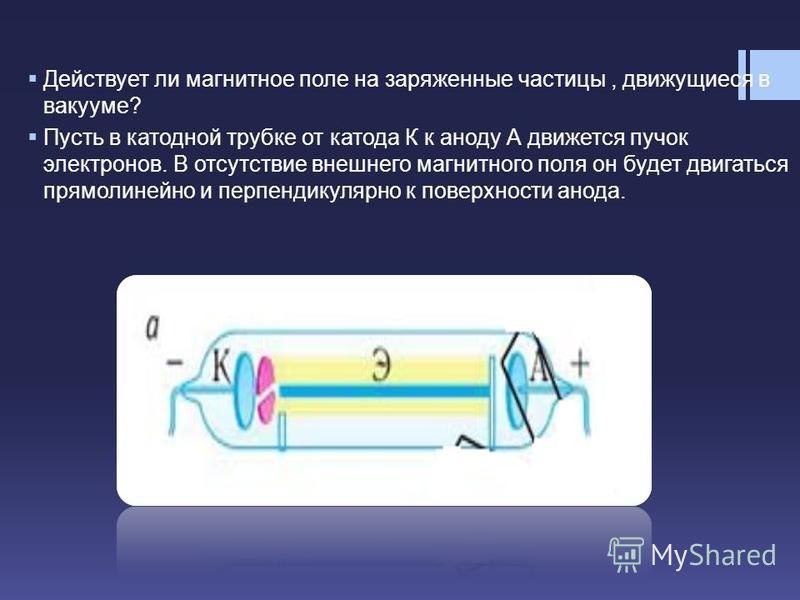
Анод в электрохимии (при электролизе) – это электрод, на котором происходят реакции окисления. Например, при электролитическом рафинировании металлов (меди, никеля, цинка и пр.) либо при нанесении на поверхность изделия слоя металла электрохимическим способом на аноде происходит разрушение (растворение) анода, в результате которого металл с примесями растворяется и осаждается в очищенном виде на катоде или на поверхности изделия, выступающего в качестве катода.
Основное распространение получили аноды из цинка, никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия, бронзы, олова, сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Анод в вакуумных электронных приборах – это электрод, который притягивает к себе летящие электроны, испущенные катодом вследствие термоэлектронной эмиссии. В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны. А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны. А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
Термоэлектронная эмиссия – это явление выхода электронов из твёрдого тела, металла или карбидов или боридов переходных металлов в свободное пространство, обычно в вакуум или разрежённый газ при нагреве его до высокой температуры. Заметная эмиссия электронов наблюдается при нагреве чистых металлов только до температур свыше 900 К.
Анод в полупроводниковом приборе (диоде, тиристоре) – это электрод, подключенный к положительному полюсу источника тока, когда при приложении прямого напряжения прибор открыт (то есть имеет маленькое сопротивление и через прибор течёт прямой ток).
Анод химического источника тока (в аккумуляторе и ином гальваническом элементе) в соответствии с ГОСТ 15596-82 «Источники тока химические. Термины и определения (с Изменением № 1)» – это электрод химического источника тока, на котором протекают окислительные процессы.
Термины и определения (с Изменением № 1)» – это электрод химического источника тока, на котором протекают окислительные процессы.
Гальванотехника
Процессы осаждения металлов в результате химической реакции под воздействием электрического тока (при электролизе) называют гальванотехникой. Таким образом мир получил посеребренные, золоченные, хромированные или покрытые другими металлами украшения и детали. Этот процесс используют как в декоративных, так и в прикладных целях – для улучшения стойкости к коррозии различных узлов и агрегатов механизмов.
Принцип действия установок для нанесения гальванического покрытия лежит в использовании растворов солей элементов, которыми будут покрывать деталь, в качестве электролита.
В гальванике анод также является электродом, к которому подключаются плюсовой вывод источника питания, соответственно катод в этом случае – это минус. При этом металл осаждается (восстанавливается) на минусовом электроде (реакция восстановления).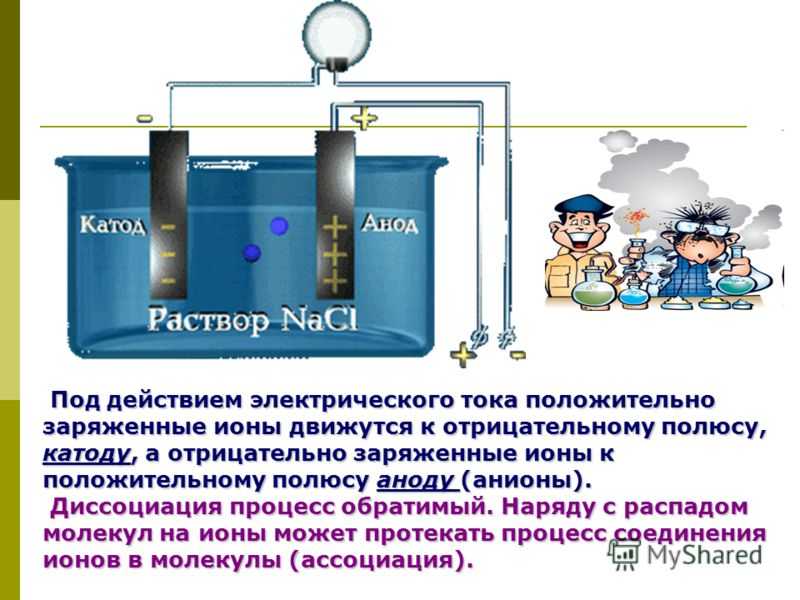 То есть если вы хотите сделать позолоченное кольцо своими руками – подключите к нему минусовой вывод блока питания и поместите в ёмкость с соответствующим раствором.
То есть если вы хотите сделать позолоченное кольцо своими руками – подключите к нему минусовой вывод блока питания и поместите в ёмкость с соответствующим раствором.
Похожие статьи
Понятие катода и анода — простое объяснение
В сложных веществах электроны между атомами в соединениях распределены неодинаково. В результате взаимодействия частицы перемещаются от атома одного вещества к атому другого. Реакция именуется окислительно-восстановительной. Потеря электронов называется окислением, элемент, отдающий электроны — восстановителем.
Присоединение электронов носит название восстановление, принимающий элемент в этом процессе — окислитель. Переход электронов от восстановителя к окислителю может протекать по внешней цепи, и тогда его можно использовать в качестве источника электрической энергии. Устройства, в которых энергия химической реакции превращается в электрическую энергию, называются гальваническими элементами.
Простейший классический пример гальванического элемента — две пластины, изготовленные из различного металла и погруженные в раствор электролита.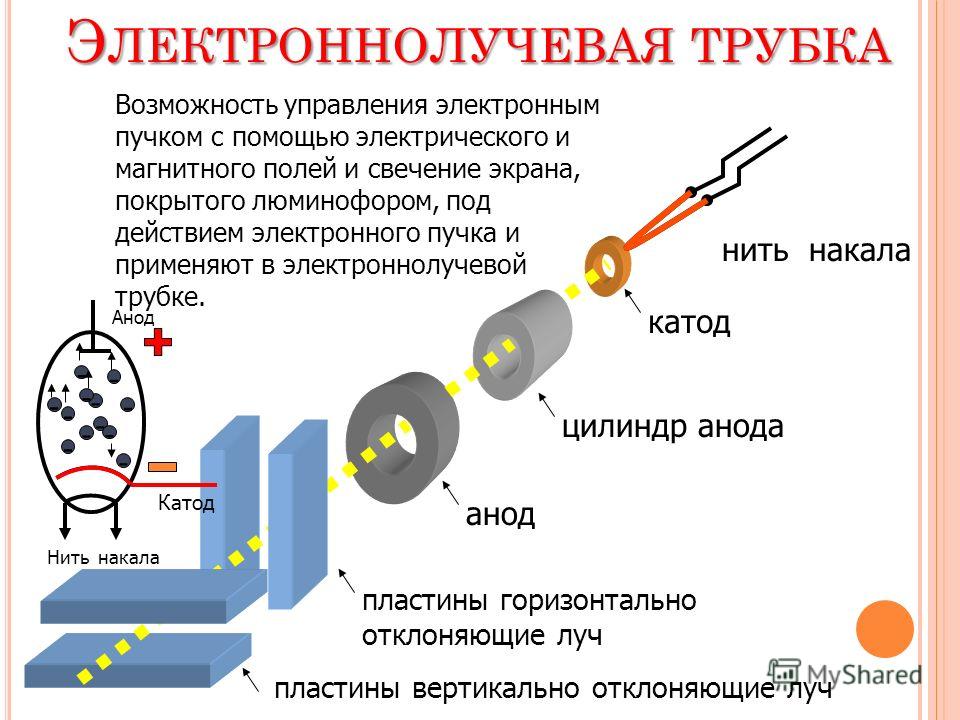 В такой системе окисление происходит на одном металле, а восстановление — на другом.
В такой системе окисление происходит на одном металле, а восстановление — на другом.
Из школьных учебников химии известен пример медно-цинкового гальванического элемента, работающего за счет энергии реакции между цинком и сульфатом меди. В устройстве Якоби — Даниэля пластина из меди помещена в раствор сульфата меди (медный электрод), цинковая пластина погружена в раствор сульфата цинка (цинковый электрод). Цинковый электрод отдает катионы в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор обедняется катионами, здесь раствор заряжен отрицательно.
Замыкание внешней цепи заставляет электроны перетекать от цинкового электрода к медному. Равновесные отношения на границах фаз прерываются. Идёт окислительно-восстановительная реакция.
Энергия самопроизвольно протекающей химической реакции превращается в электрическую.
Если химическую реакцию провоцирует внешняя энергия электрического тока, идёт процесс, называемый электролизом. Процессы, протекающие при электролизе, обратны процессам, протекающим при работе гальванического элемента.
Процессы, протекающие при электролизе, обратны процессам, протекающим при работе гальванического элемента.
Электрохимия и гальваника
В электрохимии есть два основных раздела:
- Гальванические элементы – производство электричества за счет химической реакции. К таким элементам относятся батарейки и аккумуляторы. Их часто называют химическими источниками тока.
- Электролиз – воздействие на химическую реакцию электроэнергией, простыми словами – с помощью источника питания запускается какая-то реакция.
Рассмотрим окислительно-восстановительную реакцию в гальваническом элементе, тогда какие процессы протекают на его электродах?
- Анод – электрод на котором наблюдается окислительная реакция, то есть он отдаёт электроны. Электрод, на котором происходит окислительная реакция – называется восстановителем.
- Катод – электрод на котором протекает восстановительная реакция, то есть он принимает электроны. Электрод, на котором происходит восстановительная реакция – называется окислителем.

Отсюда возникает вопрос – где плюс, а где минус у батарейки? Исходя из определения, у гальванического элемента анод отдаёт электроны.
Важно! В ГОСТ 15596-82 дано официальное определение названий выводов химических источников тока, если кратко, то плюс на катоде, а минус на аноде. В данном случае рассматривается протекание электрического тока по проводнику внешней цепи от окислителя (катода) к восстановителю (аноду)
Так как электроны в цепи текут от минуса к плюсу, а электрический ток наоборот, тогда катод – это плюс, а анод – это минус
В данном случае рассматривается протекание электрического тока по проводнику внешней цепи от окислителя (катода) к восстановителю (аноду). Так как электроны в цепи текут от минуса к плюсу, а электрический ток наоборот, тогда катод – это плюс, а анод – это минус.
Внимание: ток всегда втекает в анод!
Или то же самое на схеме:
Назначение
Ниже приводятся основные области применения диодов, на примере которых становится понятно их основное назначение:
- Диодные мосты представляют собой 4, 6 или 12 диодов, соединенных между собой, их количество зависит от типа схемы, которая может быть однофазной, трехфазной полумостовой или трехфазной полномостовой.
 Они выполняют функции выпрямителей, такой вариант чаще всего используется в автомобильных генераторах, поскольку внедрение подобных мостов, а также использование вместе с ними щеточно-коллекторных узлов, позволило в значительной степени сократить размеры данного устройства и увеличить степень его надежности. Если соединение выполнено последовательно и в одну сторону, то это повышает минимальные показатели напряжения, которое потребуется для отпирания всего диодного моста.
Они выполняют функции выпрямителей, такой вариант чаще всего используется в автомобильных генераторах, поскольку внедрение подобных мостов, а также использование вместе с ними щеточно-коллекторных узлов, позволило в значительной степени сократить размеры данного устройства и увеличить степень его надежности. Если соединение выполнено последовательно и в одну сторону, то это повышает минимальные показатели напряжения, которое потребуется для отпирания всего диодного моста. - Диодные детекторы получаются при комбинированном использовании данных приборов с конденсаторами. Это необходимо для того, чтобы было можно выделить модуляцию с низкими частотами из различных модулированных сигналов, в том числе амплитудно-модулированной разновидности радиосигнала. Такие детекторы являются частью конструкции многих бытовых потребителей, например, телевизоров или радиоприемников.
- Обеспечение защиты потребителей от неверной полярности при включении схемных входов от возникающих перегрузок или ключей от пробоя электродвижущей силой, возникающей при самоиндукции, которая происходит при отключении индуктивной нагрузки.
 Для обеспечения безопасности схем от возникающих перегрузок, применяется цепочка, состоящая из нескольких диодов, имеющих подключение к питающим шинам в обратном направлении. При этом, вход, которому обеспечивается защита, должен подключаться к середине этой цепочки. Во время обычного функционирования схемы, все диоды находятся в закрытом состоянии, но если ими было зафиксировано, что потенциал входа ушел за допустимые пределы напряжения, происходит активация одного из защитных элементов. Благодаря этому, данный допустимый потенциал получает ограничение в рамках допустимого питающего напряжения в сумме с прямым падением показателей напряжение на защитном приборе.
Для обеспечения безопасности схем от возникающих перегрузок, применяется цепочка, состоящая из нескольких диодов, имеющих подключение к питающим шинам в обратном направлении. При этом, вход, которому обеспечивается защита, должен подключаться к середине этой цепочки. Во время обычного функционирования схемы, все диоды находятся в закрытом состоянии, но если ими было зафиксировано, что потенциал входа ушел за допустимые пределы напряжения, происходит активация одного из защитных элементов. Благодаря этому, данный допустимый потенциал получает ограничение в рамках допустимого питающего напряжения в сумме с прямым падением показателей напряжение на защитном приборе. - Переключатели, созданные на основе диодов, используются для осуществления коммутации сигналов с высокими частотами. Управление такой системой осуществляется при помощи постоянного электрического тока, разделения высоких частот и подачи управляющего сигнала, которое происходит благодаря индуктивности и конденсаторам.
- Создание диодной искрозащиты.
 Используются шунт-диодные барьеры, которые обеспечивают безопасность путем ограничения напряжения в соответствующей электрической цепи. В совокупности с ними применяются токоограничительные резисторы, которые необходимы для ограничения показателей электрического тока, проходящего через сеть, и увеличения степени защиты.
Используются шунт-диодные барьеры, которые обеспечивают безопасность путем ограничения напряжения в соответствующей электрической цепи. В совокупности с ними применяются токоограничительные резисторы, которые необходимы для ограничения показателей электрического тока, проходящего через сеть, и увеличения степени защиты.
Использование диодов в электронике на сегодняшний день весьма широко, поскольку фактически ни одна современная разновидность электронного оборудования не обходится без этих элементов.
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na+ + ē → Na
На аноде окисляются анионы хлора:
Анод (+): 2Cl– – 2ē → Cl2
Суммарное уравнение электролиза расплава хлорида натрия:
2Na+Cl– → 2Na + Cl2
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
На катоде восстанавливаются катионы натрия:
Катод (–): Na+ + ē → Na
На аноде окисляются гидроксид-ионы:
Анод (+): 4OH– – 4ē → O2 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4Na+OH– → 4Na + O2+ 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например, алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100оС), чем оксид алюминия (2050оС). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
Al2O3 = Al3+ + AlO33-
На катоде восстанавливаются катионы алюминия:
Катод (–): Al3+ + 3ē → Al
На аноде окисляются алюминат-ионы:
Анод (+): 4AlO33– – 12ē → 2Al2O3 + 3O2
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2Al2О3 = 4Al + 3О2
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C + О2 = C+4O2-2
Вывод
При обычном использовании перезаряжаемой батареи потенциал положительного электрода как при разряде, так и при перезарядке остается больше, чем потенциал отрицательного электрода. С другой стороны, роль каждого электрода переключается во время цикла разрядки / зарядки.
- Во время разряда положительным является катод, отрицательным является анод.
- Во время заряда положительным является анод, отрицательным является катод.
Тексты, описывающие аккумуляторные аноды или катоды, безусловно, косвенно рассматривают случай разряда, что является неполным предсталением о процессах, происходящих внутри вторичного элемента.
Tags: анод, бра, вид, генератор, дом, е, емкость, знак, как, конденсатор, конструкция, контур, кт, лампочка, маркировка, мультиметр, напряжение, ограничитель, переменный, подключение, полярность, потенциал, провод, пуск, р, работа, размер, резистор, ряд, свет, светодиод, сеть, соединение, сопротивление, срок, схема, тен, тип, ток, ук, умный, щит, электронный
Катод и анод что это
Катод от греч.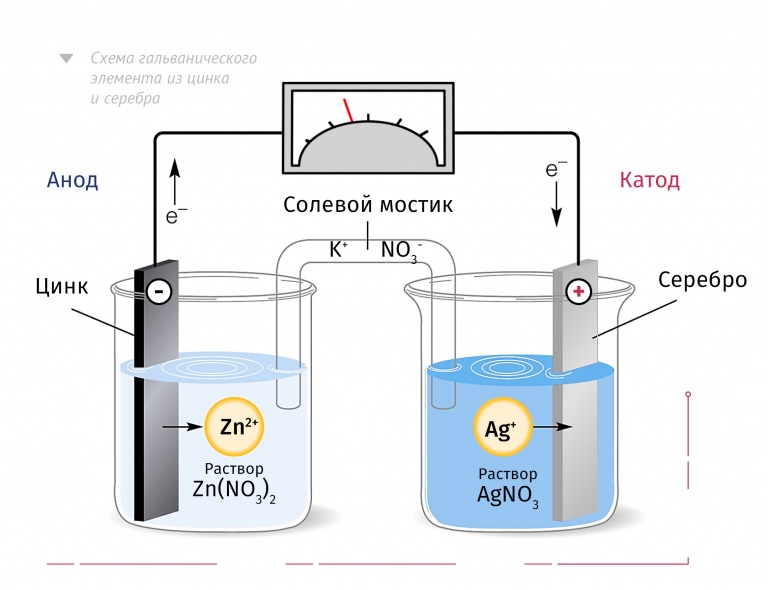 Например, при электролитическом рафинировании металлов меди , никеля и пр. Получаемый металл также именуется катодом катод медный [1] , катод никелевый, катод цинковый и т. Для сдирания готового катода с постоянной катодной основы используются катодосдирочные машины. В электронно-лучевых приборах катод входит в состав электронной пушки.
Например, при электролитическом рафинировании металлов меди , никеля и пр. Получаемый металл также именуется катодом катод медный [1] , катод никелевый, катод цинковый и т. Для сдирания готового катода с постоянной катодной основы используются катодосдирочные машины. В электронно-лучевых приборах катод входит в состав электронной пушки.
Поиск данных по Вашему запросу:
Схемы, справочники, даташиты:
Прайс-листы, цены:
Обсуждения, статьи, мануалы:
Дождитесь окончания поиска во всех базах.
По завершению появится ссылка для доступа к найденным материалам.
Содержание:
- Катод и анод — где «плюс» и «минус»
- Предложения со словом «катод»
- Значение слова «анод»
- Научный форум dxdy
- Катод и анод
- Схемотехника: Знаем ли мы, что такое АНОД? и что такое КАТОД?
- Что такое анод и катод — простое объяснение
- Из чего делают катод и анод.
Знаем ли мы, что такое анод
- Анод и катод — что это и как правильно определить?
- Энциклопедия по машиностроению XXL
ПОСМОТРИТЕ ВИДЕО ПО ТЕМЕ: Гальванические элементы
Катод и анод — где «плюс» и «минус»
Часто возникает проблема определения, какой из электродов является катодом, а какой — анодом. Для начала нужно разобраться с терминами. В сложных веществах электроны между атомами в соединениях распределены неодинаково. В результате взаимодействия частицы перемещаются от атома одного вещества к атому другого. Реакция именуется окислительно-восстановительной. Потеря электронов называется окислением, элемент, отдающий электроны — восстановителем.
Присоединение электронов носит название восстановление, принимающий элемент в этом процессе — окислитель. Переход электронов от восстановителя к окислителю может протекать по внешней цепи, и тогда его можно использовать в качестве источника электрической энергии. Устройства, в которых энергия химической реакции превращается в электрическую энергию, называются гальваническими элементами.
Простейший классический пример гальванического элемента — две пластины, изготовленные из различного металла и погруженные в раствор электролита. В такой системе окисление происходит на одном металле, а восстановление — на другом.
Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление — катодом. Из школьных учебников химии известен пример медно-цинкового гальванического элемента, работающего за счет энергии реакции между цинком и сульфатом меди. В устройстве Якоби — Даниэля пластина из меди помещена в раствор сульфата меди медный электрод , цинковая пластина погружена в раствор сульфата цинка цинковый электрод.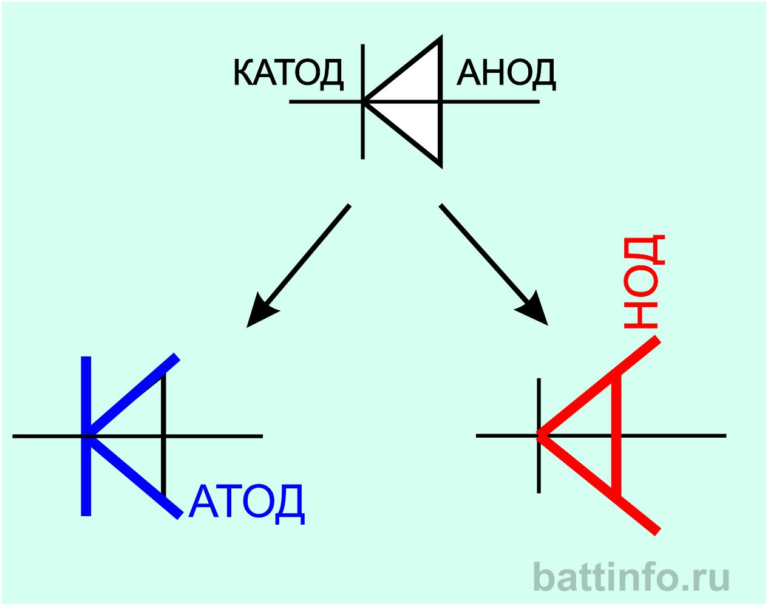 Цинковый электрод отдает катионы в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор обедняется катионами, здесь раствор заряжен отрицательно.
Цинковый электрод отдает катионы в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор обедняется катионами, здесь раствор заряжен отрицательно.
Замыкание внешней цепи заставляет электроны перетекать от цинкового электрода к медному. Равновесные отношения на границах фаз прерываются. Идёт окислительно-восстановительная реакция. Если химическую реакцию провоцирует внешняя энергия электрического тока, идёт процесс, называемый электролизом. Процессы, протекающие при электролизе, обратны процессам, протекающим при работе гальванического элемента.
Электрод, на котором происходит восстановление, также называется катодом, но при электролизе он заряжен отрицательно, а анод — положительно.
Электролизом расплавленных соединений и водных растворов получают металлы, производят очистку металлов от примесей и извлечение ценных компонентов электролитическое рафинирование. Из металла, подлежащего очистке, отливают пластины. Они помещаются в качестве анодов в электролизер.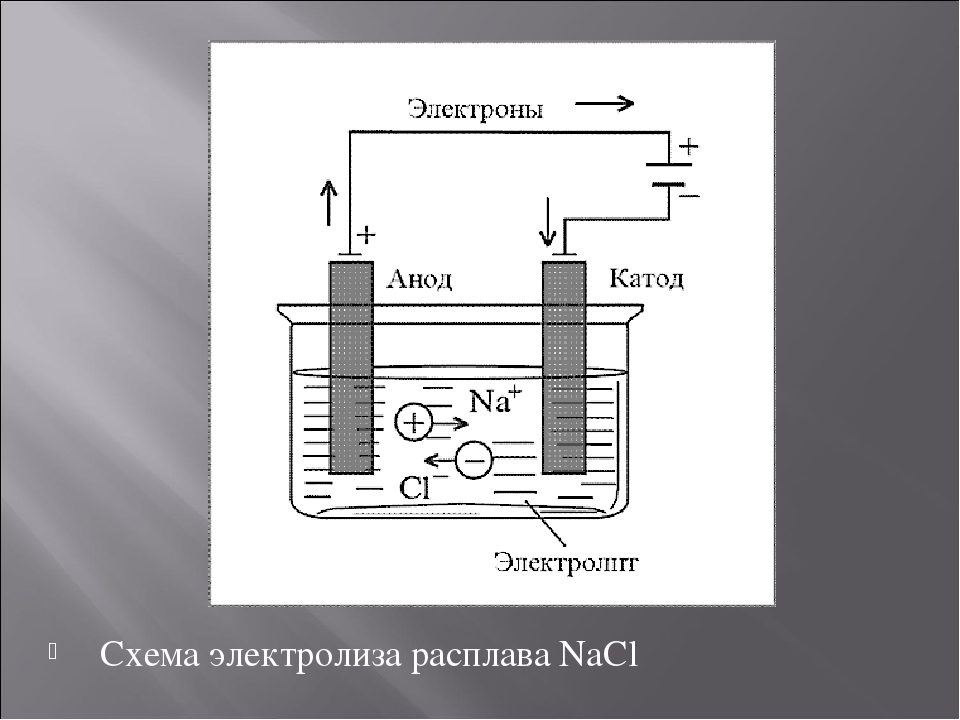
Под воздействием электрического тока металл подвергается растворению. Его катионы переходят в раствор и разряжаются на катоде, образуя осадок чистого металла. Примеси, содержащиеся в первоначальной неочищенной металлической пластине, либо остаются нерастворимыми в виде анодного шлама, либо переходят в электролите, откуда удаляются.
Электролитическому рафинированию подвергают медь, никель, свинец, золото, серебро, олово. Электроэкстракция — процесс выделения металла из раствора в ходе электролиза.
Для того чтобы металл перешёл в раствор, его обрабатывают специальными реагентами. В ходе процесса на катоде происходит выделение металла, характеризующегося высокой чистотой. Так получают цинк, медь, кадмий. Чтобы избежать коррозии, придать прочность, украсить изделие поверхность одного металла покрывают слоем другого. Этот процесс называется гальваностегией. Гальванопластика — процесс получения металлических копий с объёмных предметов электроосаждением металла. Принцип действия катода и анода в вакуумном приборе может продемонстрировать электронная лампа.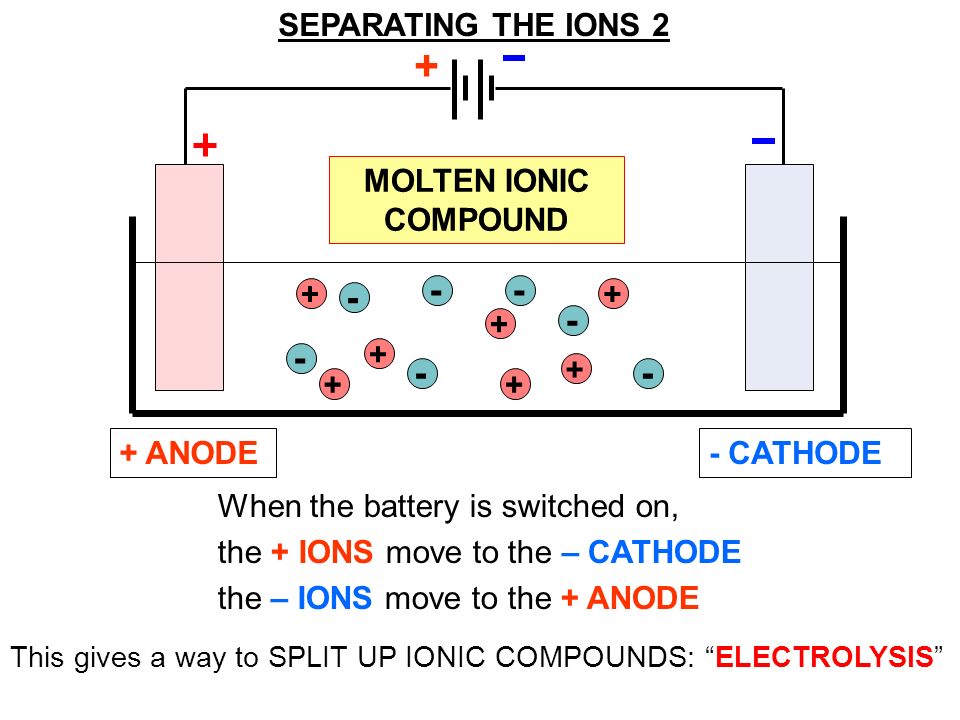
Она выглядит как герметически запаянный сосуд с металлическими деталями внутри. Прибор используется для выпрямления, генерирования и преобразования электрических сигналов.
По числу электродов выделяют:. Диод — вакуумный прибор с двумя электродами, катодом и анодом. Катод подключен к отрицательному полюсу источника питания, анод — к положительному. Предназначение катода — испускать электроны под действием нагрева электрическим током до определенной температуры. Посредством испущенных электронов создается пространственный заряд между катодом и анодом. Самые быстрые электроны устремляются к аноду, преодолевая отрицательный потенциальный барьер объемного заряда.
Анод принимает эти частицы. Создается анодный ток во внешней цепи. Электронным потоком управляют с помощью дополнительных электродов, подавая на них электрический потенциал. Посредством диодов переменный ток преобразуется в постоянный.
В электронике широко используется свойство диодов пропускать ток в прямом направлении и не пропускать в обратном.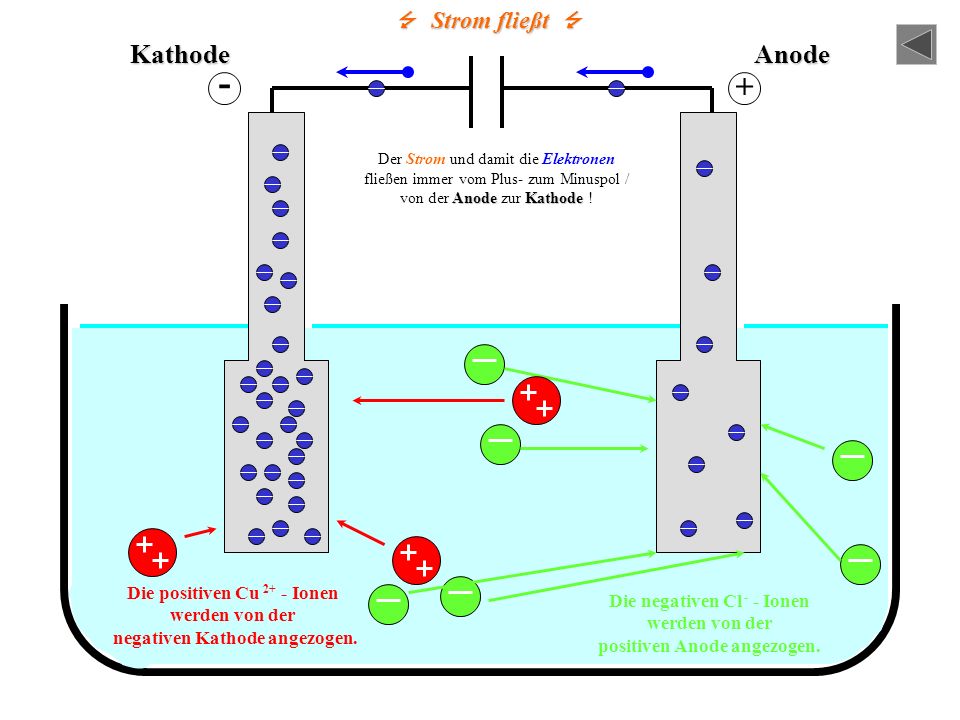 Работа светодиода основана на свойстве кристаллов полупроводников светиться при пропускании через p-n переход тока в прямом направлении.
Работа светодиода основана на свойстве кристаллов полупроводников светиться при пропускании через p-n переход тока в прямом направлении.
Химические источники электрического тока, в которых протекают обратимые реакции, называются аккумуляторами: их перезаряжают и используют многократно. При работе свинцового аккумулятора происходит окислительно-восстановительная реакция. Металлический свинец окисляется, отдает свои электроны, восстанавливая диоксид свинца, принимающего электроны.
Металлический свинец в аккумуляторе — анод, он заряжен отрицательно. Диоксид свинца — катод и заряжен положительно. По мере разряда аккумулятора расходуются вещества катода и анода и их электролита, серной кислоты. Чтобы зарядить аккумулятор, его подключают к источнику тока плюсом к плюсу, минусом к минусу. Направление тока теперь обратное тому, какое было при разряде аккумулятора. Теперь свинцовый электрод становится катодом, на нем проходит процесс восстановления, а диоксид свинца — анодом, с протекающей процедурой окисления.
В аккумуляторе вновь создаются вещества, необходимые для его работы. Проблема возникает из-за того, что определенный знак заряда не может быть прочно закреплен за анодом или катодом. Часто катодом является положительно заряженный электрод, а анодом — отрицательный.
Часто, но не всегда. Все зависит от процесса, протекающего на электроде. Деталь, которую поместили в электролит, может быть и анодом и катодом. Все зависит от цели процесса: нужно нанести на нее другой слой металла или снять его. В электрохимии анод — это электрод, на котором идут процессы окисления, катод — это электрод, где происходит восстановление.
У диода отводы называются анод и катод. У нового светодиода с необрезанными контактами анод и катод определяются визуально по длине. Катод короче. Если контакты обрезаны, поможет батарейка, приложенная к ним. Свет появится, когда полярности совпадут. В электрохимии речь правильнее вести не о знаках зарядов электродов, а о процессах, на них идущих. На катоде проходит реакция восстановления, на аноде — окисления.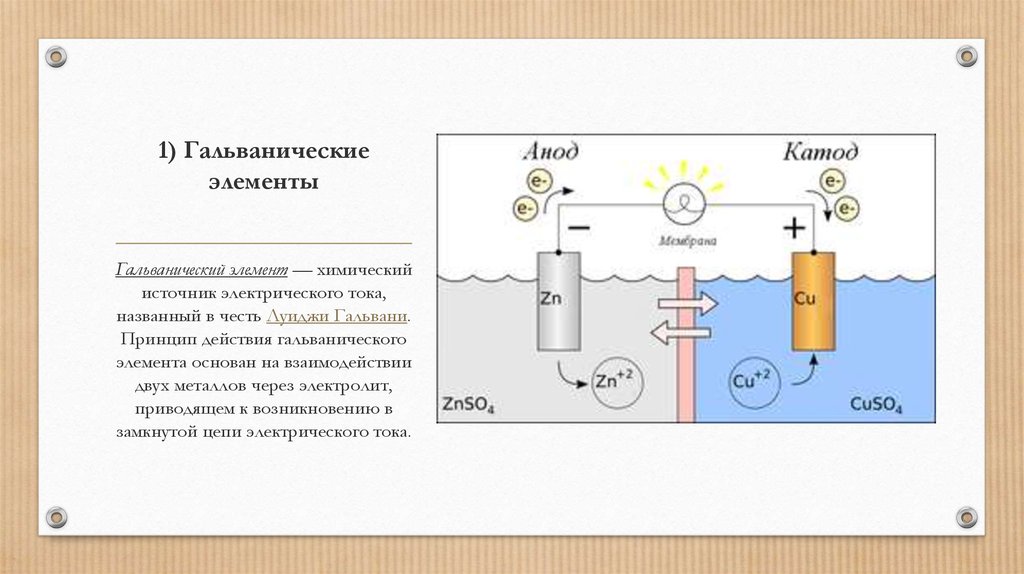
В электротехнике для протекания тока катод подключают к отрицательному полюсу источника тока, анод — к положительному. Содержание 1 Понятие катода и анода — простое объяснение 2 Применение в электрохимии 2. Термометр сопротивления — датчик для измерения температуры: что это такое, описание и виды. Что такое электроконтактный манометр, назначение, принцип работы, схема подключения и обзор популярных моделей. Чем отличаются и где используются постоянный и переменный ток.
Что такое активная и реактивная мощность переменного электрического тока? Как установить и настроить спутниковую антенну самостоятельно? Для чего нужен пирометр и как измерять температуру бесконтактным методом. Что такое нихромовая проволока, её свойства и область применения.
Что такое тензодатчик, типы тензометрических датчиков, схема подключения и их применение.
Предложения со словом «катод»
Содержание: Электрохимия и гальваника Процесс электролиза или зарядки аккумулятора Гальванотехника В электронике Заключение. Рассмотрим окислительно-восстановительную реакцию в гальваническом элементе, тогда какие процессы протекают на его электродах? Отсюда возникает вопрос — где плюс, а где минус у батарейки? Исходя из определения, у гальванического элемента анод отдаёт электроны. В ГОСТ дано официальное определение названий выводов химических источников тока, если кратко, то плюс на катоде, а минус на аноде. В данном случае рассматривается протекание электрического тока по проводнику внешней цепи от окислителя катода к восстановителю аноду. Так как электроны в цепи текут от минуса к плюсу, а электрический ток наоборот, тогда катод — это плюс, а анод — это минус.
Рассмотрим окислительно-восстановительную реакцию в гальваническом элементе, тогда какие процессы протекают на его электродах? Отсюда возникает вопрос — где плюс, а где минус у батарейки? Исходя из определения, у гальванического элемента анод отдаёт электроны. В ГОСТ дано официальное определение названий выводов химических источников тока, если кратко, то плюс на катоде, а минус на аноде. В данном случае рассматривается протекание электрического тока по проводнику внешней цепи от окислителя катода к восстановителю аноду. Так как электроны в цепи текут от минуса к плюсу, а электрический ток наоборот, тогда катод — это плюс, а анод — это минус.
Здравствуйте, помогите пожалуйста разобраться в том что такое анод и катод, где они находятся с внешней стороны пальчиковой.
Значение слова «анод»
Про анод и катод источника питания необходимо знать тем, кто занимается практической электроникой. Что и как называют? Почему именно так? Будет углублённое рассмотрение темы с точки зрения не только радиолюбительства, но и химии. Наиболее популярное объяснение звучит следующим образом: анод — это положительный электрод, а катод — отрицательный. Увы, это не всегда верно и неполно. Чтобы уметь определить анод и катод, необходимо иметь теоретическую базу и знать, что да как. Давайте рассмотрим это в рамках статьи. Обратимся к ГОСТ , который занимается химическими источниками тока.
Наиболее популярное объяснение звучит следующим образом: анод — это положительный электрод, а катод — отрицательный. Увы, это не всегда верно и неполно. Чтобы уметь определить анод и катод, необходимо иметь теоретическую базу и знать, что да как. Давайте рассмотрим это в рамках статьи. Обратимся к ГОСТ , который занимается химическими источниками тока.
Научный форум dxdy
Катод — это электрод устройства, который подключен к отрицательному полюсу источнику тока. Анод — противоположность ему. Это электрод прибора, подключенный к положительному полюсу источника тока. Обратите внимание! Чтобы легче запомнить разницу между ними, используют шпаргалку.
Катод от греч.
Катод и анод
Логин или эл. Войти или Зарегистрироваться. Авторизация Логин или эл. Теория, измерения и расчеты. Многие считают, что определение терминов анод и катод известно каждому грамотному человеку… Но не так много можно найти вещей страшнее полузнания. Нет, ложь!
Схемотехника: Знаем ли мы, что такое АНОД? и что такое КАТОД?
Последний раз редактировалось sashatgu Здравствуйте, помогите пожалуйста разобраться в том что такое анод и катод, где они находятся с внешней стороны пальчиковой батарейки и какие знаки имеют, а также где они находятся внутри пальчиковой батарейки и какие знаки имеют. Также где катод и анод у светодиода и какие знаки имеют? Я ничего не могу понять даже на уровне пальчиковой батарейки. Ну раз они с большой буквы написаны, то наверное, это имена учёных. Я подозреваю, что древнегреческих. Какие-то вопросы остались?
Также где катод и анод у светодиода и какие знаки имеют? Я ничего не могу понять даже на уровне пальчиковой батарейки. Ну раз они с большой буквы написаны, то наверное, это имена учёных. Я подозреваю, что древнегреческих. Какие-то вопросы остались?
Анод – это электрод прибора, который присоединяется к примесями полностью растворяется на аноде, а потом осаждается в чистом виде на катоде.
Что такое анод и катод — простое объяснение
Название: Электровакуумные приборы Алексеев C. Конструктивно диоды выполняются различно. Встречаются диоды с ци- линдрической и с плоской конструкцией электродов. Электроды лампы име- ют наружные выводы, проходящие сквозь стекло баллона к выводным штырькам.
Из чего делают катод и анод. Знаем ли мы, что такое анод
Часто возникает проблема определения, какой из электродов является катодом, а какой — анодом. Для начала нужно разобраться с терминами. В сложных веществах электроны между атомами в соединениях распределены неодинаково.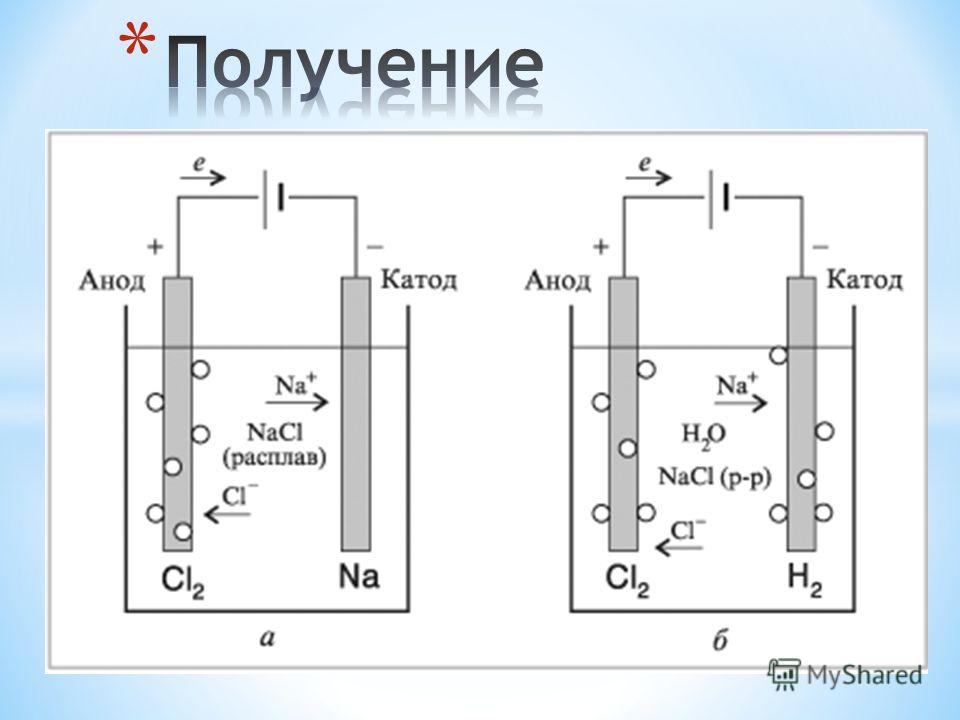 В результате взаимодействия частицы перемещаются от атома одного вещества к атому другого. Реакция именуется окислительно-восстановительной.
В результате взаимодействия частицы перемещаются от атома одного вещества к атому другого. Реакция именуется окислительно-восстановительной.
Основное распространение получили аноды из цинка бывают сферические, литые и катаные, чаще используются последние , никеля, меди среди которых отдельно выделяют медно-фосфористые, марки АМФ , кадмия применение которых сокращается из-за экологической вредности , бронзы, олова применяются при производстве печатных плат в радиоэлектронной промышленности , сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др.
Анод и катод — что это и как правильно определить?
Про анод и катод источника питания необходимо знать тем, кто занимается практической электроникой. Что и как называют? Почему именно так? Будет углублённое рассмотрение темы с точки зрения не только радиолюбительства, но и химии. Наиболее популярное объяснение звучит следующим образом: анод — это положительный электрод, а катод — отрицательный. Увы, это не всегда верно и неполно.
Увы, это не всегда верно и неполно.
Энциклопедия по машиностроению XXL
Про анод и катод источника питания необходимо знать тем, кто занимается практической электроникой. Что и как называют? Почему именно так? Будет углублённое рассмотрение темы с точки зрения не только радиолюбительства, но и химии.
Как называется положительный электрод в электролизе?
Как называется положительный электрод в электролизе? Отрицательно заряженный электрод при электролизе называется катодом. Положительно заряженные ионы движутся к катоду. Положительно заряженный электрод в электролизе называется анодом.
Какой электрод положительный в электролизере? Здесь анод отрицательный, а катод положительный электрод.
Что является положительным электродом при электролизе воды? Кислород будет собираться на положительно заряженном электроде (аноде), а водород будет собираться на отрицательно заряженном электроде (катоде).
Почему анод положительный в электролитических ячейках? 1: электролизер. Батарея перекачивает электроны от анода (делая его положительным) к катоду (делая его отрицательным). Положительный анод притягивает к себе анионы, а отрицательный катод притягивает к себе катионы. Поскольку анод может принимать электроны, на этом электроде происходит окисление.
Катод положительный электрод?
Ответ: катод — это отрицательный электрод, а анод — положительный электрод. Они так называются потому, что положительно заряженные катионы мигрируют к отрицательному катоду. Следовательно, известный как катод, в то время как анионы мигрируют к положительно заряженному аноду, и так известный как анод.
Анод отрицательный или положительный?
В батарее или другом источнике постоянного тока анодом является отрицательная клемма, а в пассивной нагрузке — положительная клемма. Например, в электронной трубке электроны от катода перемещаются по трубке к аноду, а в гальванической ячейке отрицательные ионы осаждаются на аноде.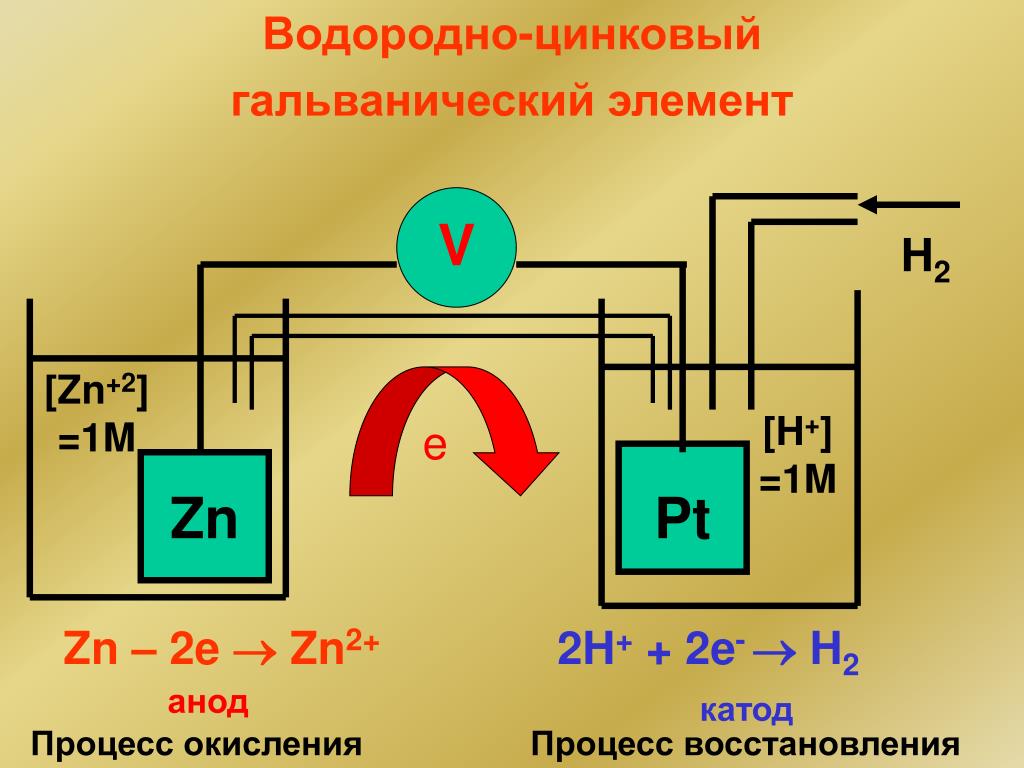
Какое напряжение лучше для электроэпиляции?
Процесс электролитического удаления ржавчины лучше всего работает с напряжением 24 В постоянного тока, подаваемым от автомобильного зарядного устройства. Напряжения выше 24 вольт на самом деле НЕ обеспечивают большей эффективности и обычно приводят к тому, что энергия теряется в виде тепла от электрических проводов и в растворе электролита.
Какой электролит лучше всего подходит для электролиза воды?
Обычно в качестве электролита для электролиза воды используется водный раствор едкого кали или соды. При равных концентрациях электропроводность раствора едкого кали выше, чем у раствора едкого натра.
Сколько кислорода образуется при электролизе воды?
Привет @subash, Путем электролиза воды мы можем получить кислород и водород (2/3 h3, 1/3 O2).
Анод теряет массу?
Анод (положительный электрод) изготовлен из нечистой меди, а катод (отрицательный электрод) — из чистой меди. Во время электролиза анод теряет массу по мере растворения меди, а катод набирает массу по мере осаждения меди.
Почему анод отрицательный?
В гальваническом элементе электроны будут двигаться к аноду. Поскольку электроны несут отрицательный заряд, то и анод заряжен отрицательно. Это потому, что протоны притягиваются к катоду, поэтому он в основном положительный и, следовательно, положительно заряжен.
Течет ли ток от анода к катоду?
Электроны всегда текут от анода к катоду, несмотря ни на что. Катод всегда находится там, где происходит восстановление, поэтому там должны быть электроны. В гальваническом элементе анод отрицательный, а катод положительный, поэтому электроны текут туда спонтанно.
Положителен ли катион?
Что такое катион? Катион имеет больше протонов, чем электронов, поэтому он имеет положительный заряд.
Почему анод отрицательный, а катод положительный?
Анод в электрохимической ячейке отрицательный, потому что он имеет отрицательный потенциал по отношению к раствору, а анод в электролитической ячейке положительный, потому что он подключен к положительной клемме батареи.
Как определить катод?
В вакуумной трубке или электронно-лучевой трубке катод является отрицательным выводом. Здесь электроны входят в устройство и продолжают движение в трубку. Из устройства вытекает положительный ток. В диоде катод обозначается заостренным концом символа стрелки.
Что происходит на положительном электроде?
Положительно заряженные ионы движутся к отрицательному электроду во время электролиза. Отрицательно заряженные ионы движутся к положительному электроду во время электролиза. Они теряют электроны и окисляются. Вещество, которое разрушается, называется электролитом.
Какая сторона клетки положительная?
Длинная линия и более короткая линия используются для рисования элемента или батареи. Положительная сторона линии длиннее. Короткая линия отрицательная.
Какой полярности анод?
Электролитический анод
В электрохимии анод — это место, где происходит окисление, и контакт положительной полярности в электролитической ячейке.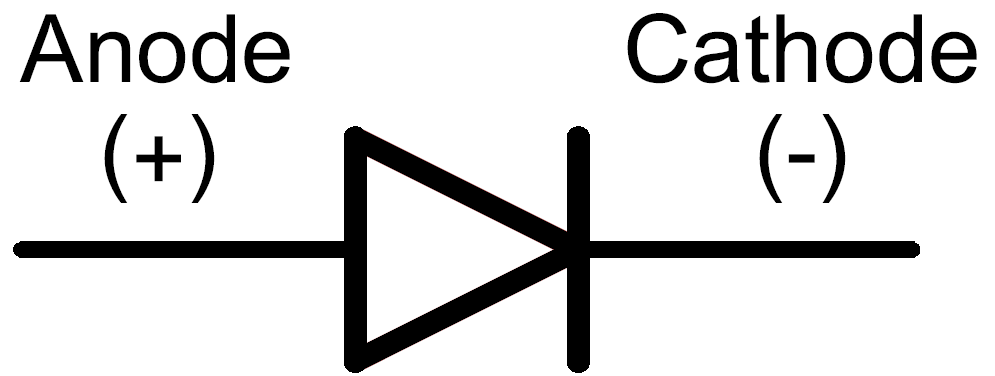 На аноде анионы (отрицательные ионы) под действием электрического потенциала вынуждены вступать в химическую реакцию и испускать электроны (окисление), которые затем текут вверх и попадают в управляющую цепь.
На аноде анионы (отрицательные ионы) под действием электрического потенциала вынуждены вступать в химическую реакцию и испускать электроны (окисление), которые затем текут вверх и попадают в управляющую цепь.
Почему анод называют анодом?
Анод — это электрод в поляризованном электрическом устройстве, через который протекает ток из внешней цепи. Катоды получили свое название от катионов (положительно заряженных ионов), а аноды от анионов (отрицательно заряженных ионов).
Как определить анод и катод?
Анод — это электрод, через который проходит электричество. Катод — это электрод, через который выдается или вытекает электричество. Анод обычно является положительной стороной. Катод — отрицательная сторона.
Как узнать, где анод, а где катод?
Анод всегда располагается с левой стороны, а катод — с правой.
Сколько стиральной соды мне нужно для электроэпиляции?
Это легко, если использовать метрические измерения: от 5 до 10 миллилитров стиральной соды на литр воды.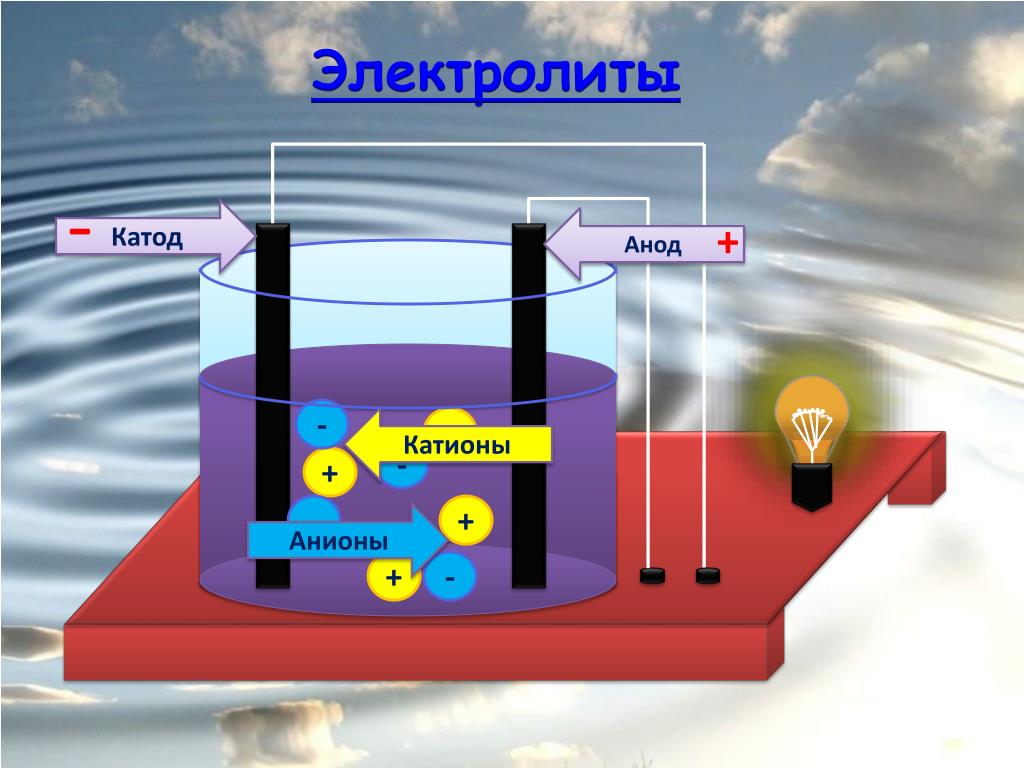 В имперских единицах это от 1 до 2 чайных ложек соды на 5 чашек воды или 1/2 чашки соды на 5 галлонов воды. Добавление стиральной соды карбоната натрия в дистиллированную воду.
В имперских единицах это от 1 до 2 чайных ложек соды на 5 чашек воды или 1/2 чашки соды на 5 галлонов воды. Добавление стиральной соды карбоната натрия в дистиллированную воду.
Почему нельзя использовать переменный ток в электролизе?
Даже если бы он был ограничен по току, переменный ток (AC) не подходил бы для электролиза. Поскольку «катод» и «анод» постоянно меняются местами, переменный ток производит взрывоопасные смеси водорода и кислорода. Постоянный ток (DC) используется для электролиза.
Работает ли соль при электролизе?
NaCl (водн.) можно надежно подвергнуть электролизу для получения водорода. На катоде будет пузыриться газообразный водород, а на аноде будет пузыриться газообразный хлор. Большая идея. При добавлении в дистиллированную воду обычной поваренной соли (NaCl) получается раствор электролита, способный проводить электричество.
Насколько эффективен электролиз воды?
Водород также можно получить с помощью электролиза воды. Грубо говоря, новый электролизный завод сегодня обеспечивает энергоэффективность около 80%.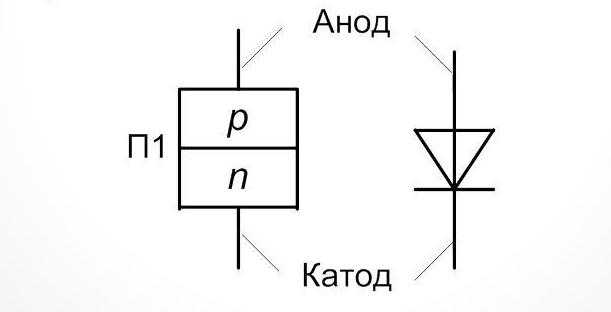 То есть энергетическая ценность произведенного водорода составляет около 80% электричества, используемого для расщепления молекулы воды. Эффективность парового риформинга составляет около 65%.
То есть энергетическая ценность произведенного водорода составляет около 80% электричества, используемого для расщепления молекулы воды. Эффективность парового риформинга составляет около 65%.
Для скачивания — Кафедра химии
- Главная
- Университет
- Для скачивания
- Кафедра химии
Лекция. Растворы неэлектролитов
Размер файла:
638.79 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Растворы неэлектролитов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 33 с.
Учебно-методическое пособие включает лекцию по теме «Растворы неэлектролитов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Окислительно-восстановительные реакции
Размер файла:
609.98 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Окислительно – восстановительные реакции. Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекцию по теме «Окислительно – восстановительные реакции» и предназначено для контролируемой самостоятельной работы студентов инженерно–технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Комплексные соединения
Размер файла:
531.46 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Лекция «Комплексные соединения» по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович.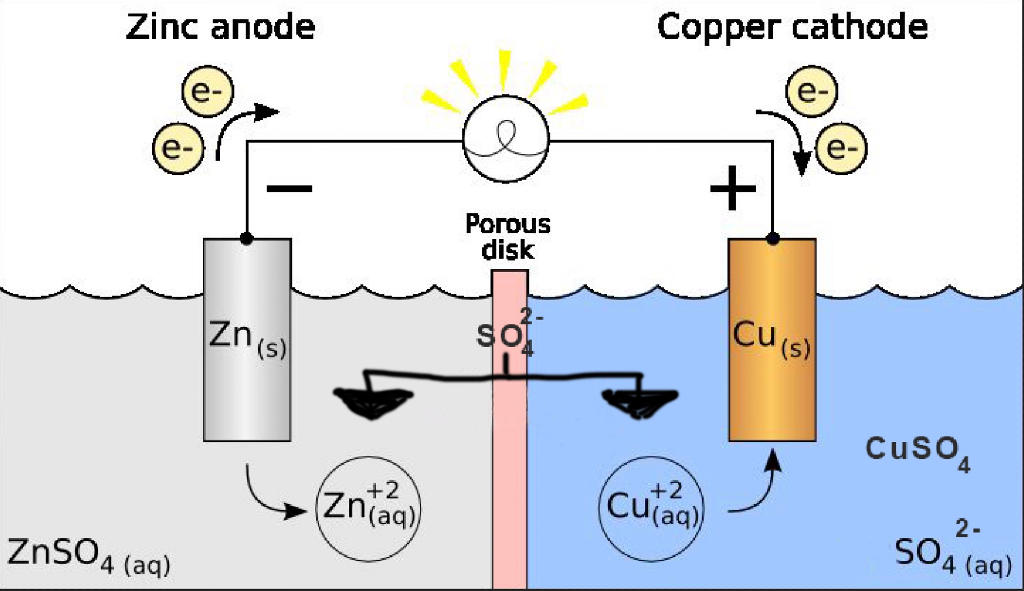 – Гродно : ГГАУ, 2016. – 26 с.
– Гродно : ГГАУ, 2016. – 26 с.
Учебно-методическое пособие включает лекцию по теме «Комплексные соединения» курса «Общая химия». Комплексные соединения играют важную роль в природе и технике, прежде всего, это ферментативные и фотохимические процессы, перенос кислорода в биологических системах, тонкая технология редких металлов, каталитические реакции и т.д. Координационные свойства проявляются всеми элементами периодической системы.
Скачать
Лекция. Кинетика химических реакций. Химическое равновесие
Размер файла:
768.32 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Кинетика химических реакций. Химическое равновесие. Лекции по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 44 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета.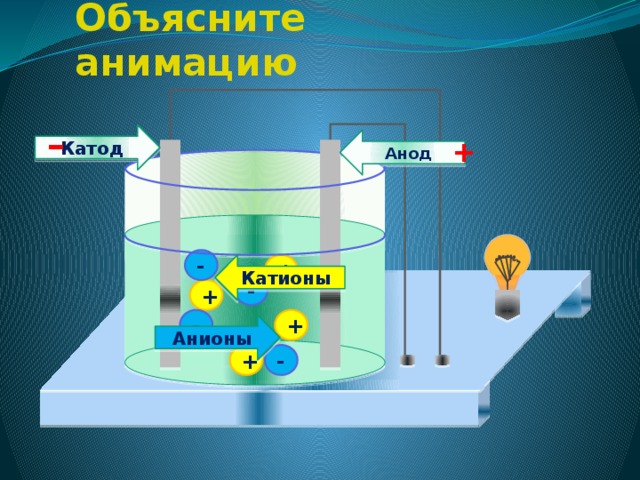 Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Предэкзаменационные тесты по органической и биологической ХИМИИ
Размер файла:
1.30 MB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
26.12.2016 12:02
Предэкзаменационные тесты по органической и биоло-гической химии для студентов биотехнологического факультета / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 205 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на биотехнологическом факультете, по предмету «Химия (органическая и биологическая)»
Скачать
Лекция. Электролиз. Коррозия металлов и методы защиты металлов от коррозии
Размер файла:
758.87 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Электролиз. Коррозия металлов и методы защиты металлов от коррозии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Энергетика химических процессов.
Размер файла:
604.00 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Энергетика химических процессов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 25 с.
Учебно-методическое пособие включает лекцию по теме «Энергетика химических процессов» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета.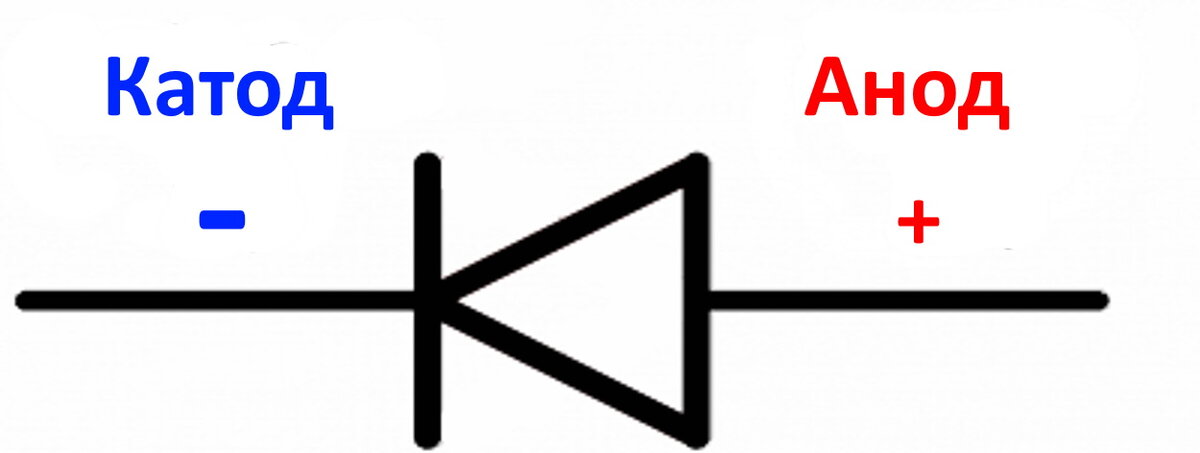 Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Строение атомов элементов
Размер файла:
789.90 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Строение атомов элементов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 23 с.
Учебно-методическое пособие включает лекцию по теме «Строение атомов элементов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Основные понятия и законы химии
Размер файла:
675.23 kB
Автор:
Апанович, З.В.
Дата:
26. 12.2016 12:03
12.2016 12:03
Основные понятия и законы химии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 30 с.
Учебно-методическое пособие включает лекцию по теме «Основные понятия и законы химии» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование студентами распечатки лекционной темы значительно сэкономит время для понимания материала, излагаемого лектором, и конспектирования.
Скачать
Предэкзаменационные тесты по химии
Размер файла:
813.02 kB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
14.11.2016 11:47
Предэкзаменационные тесты по химии для студентов, обучающихся на агробиологических специальностях / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 201 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на агробиологических специальностях, по предмету «Химия».
Скачать
Методическое пособие для лабораторных работ по аналитической химии
Размер файла:
544.41 kB
Автор:
Апанович З.В., Тараненко Т.В., Томашева Е.В., Кулеш И.В., Цветницкая Э.В.
Дата:
28.12.2015 12:22
В пособие излагается материал по аналитической химии в объеме соответствующих программ по специальностям: «Ветеринарная медицина», «Аграномия», «Биотехналогия». Содержатся методические указания по технике выполнения лабораторных работ по качественному и количественному анализу.
Скачать
Комментарии для работы с рабочими тетрадями по химии элементов
Размер файла:
655.75 kB
Дата:
28.12.2015 12:22
Комментарии для работы с рабочими тетрадями по химии элементов / З.В. Апанович, Ю.А. Лукашенко.
Учебно-методическое пособие включает лекции по отдельным темам курса «Неорганическая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета, для которых введен отдельный курс по химии элементов, а также может быть использовано студентами других факультетов.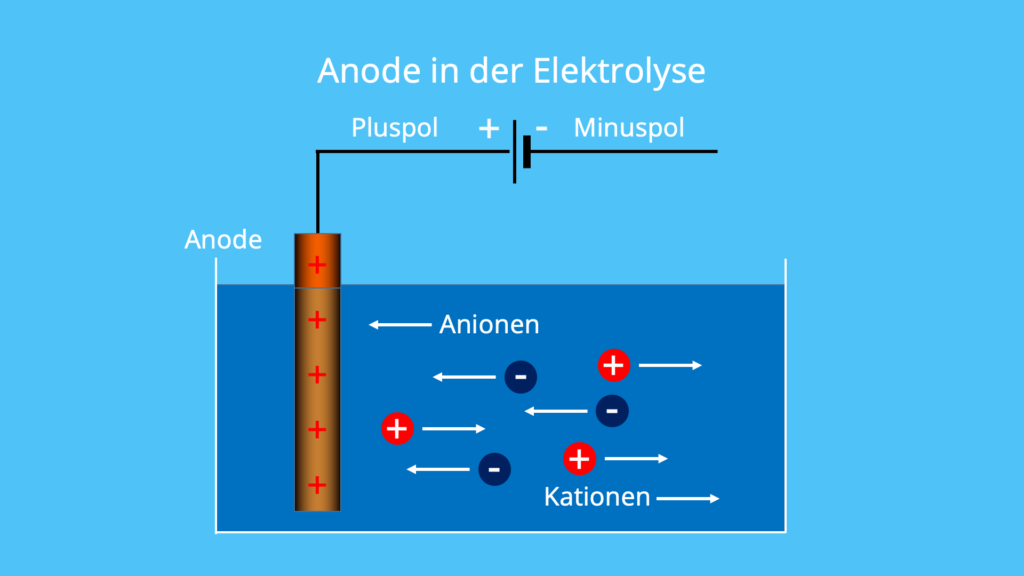
Скачать
Практикум по физической химии
Размер файла:
1.03 MB
Дата:
01.04.2013 04:24
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
Практикум по физической химии: учеб.-мет. пособие / О. И. Валентюкевич.- Гродно: ГГАУ, 2008 – 88с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Коллоидная химия
Размер файла:
834.37 kB
Дата:
01.04.2013 04:09
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
К-60 Практикум по физической химии: учеб.-мет. пособие / И. В. Кулеш, О. И. Валентюкевич.- Гродно: ГГАУ, 2013 – 94с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Курс лекций по дисциплине «Неорганическая химия»
Размер файла:
1.33 MB
Дата:
28.12.2015 12:22
Лекции по курсу «Неорганическая химия »для студентов инженерно – технологического факультета / З.В. Апанович.
Скачать
Рабочая тетрадь и методические указания по неорганической химии
Размер файла:
701.32 kB
Дата:
28.12.2015 12:23
Рабочая тетрадь и методические указания по неорганической химии. Для студентов технологических специальностей / З.В. Апанович.
Скачать
Ионные равновесия и обменные реакции в растворах электролитов
Скачать
Лабораторные работы по химии элементов для студентов технологических специальностей
Скачать
Университет
Анод обозначение. Знаем ли мы, что такое анод
Определить, какой из электродов является анодом, а какой – катодом, на первый взгляд кажется просто. Принято считать, что анод имеет отрицательный заряд, катод – положительный. Но на практике могут возникнуть путаницы в определении.
Принято считать, что анод имеет отрицательный заряд, катод – положительный. Но на практике могут возникнуть путаницы в определении.
Спонсор размещения P&G Статьи по теме «Как определить анод и катод» Как определить полярность диода Как получить напряжение 12 вольт Как определить анод диода
Инструкция
Анод – электрод, на котором протекает реакция окисления. А электрод, на котором происходит восстановление, называется катодом.
Возьмите для примера гальванический элемент Якоби-Даниэля. Он состоит из цинкового электрода, опущенного в раствор сульфата цинка, и медного электрода, находящегося в растворе сульфата меди. Растворы соприкасаются между собой, но не смешиваются – для этого между ними предусмотрена пористая перегородка.
Цинковый электрод, окисляясь, отдает свои электроны, которые по внешней цепи двигаются к медному электроду. Ионы меди из раствора СuSO4 принимают электроны и восстанавливаются на медном электроде. Таким образом, в гальваническом элементе анод заряжен отрицательно, а катод – положительно.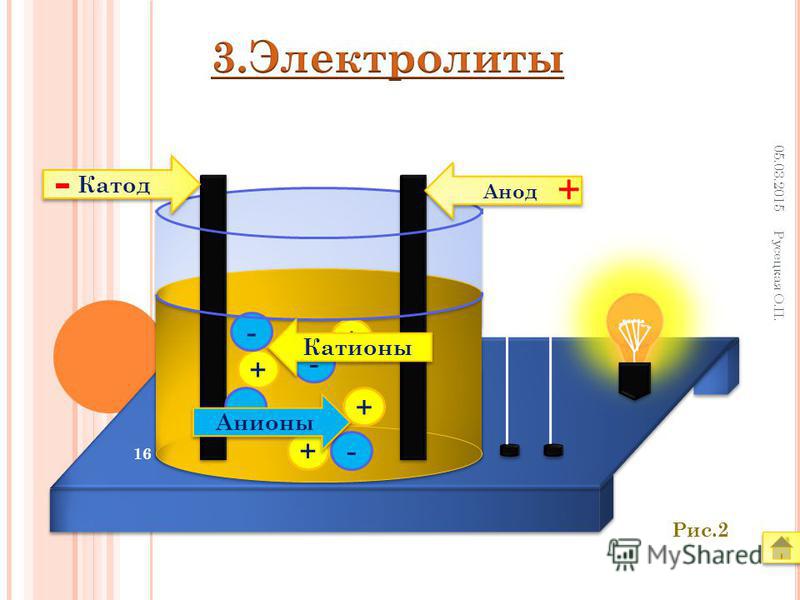
Теперь рассмотрите процесс электролиза. Установка для электролиза представляет собой сосуд с раствором или расплавом электролита, в который опущены два электрода, подключенные к источнику постоянного тока. Отрицательно заряженный электрод является катодом – на нем происходит восстановление. Анод в данном случае электрод, подключенный к положительному полюсу. На нем происходит окисление.
Например, при электролизе раствора СuCl2 на аноде происходит восстановление меди. На катоде же происходит окисление хлора. Поэтому учтите, что анод – не всегда отрицательный электрод, так же как и катод не во всех случаях имеет положительный заряд. Фактором, определяющим электрод, является протекающий на нем окислительный или восстановительный процесс. Как просто
Другие новости по теме:
Любой диод меняет свою проводимость в зависимости от полярности приложенного к нему напряжения. Расположение же электродов на его корпусе указано не всегда. Если соответствующая маркировка отсутствует, определить, какой электрод подключен к какому выводу, можно и самостоятельно.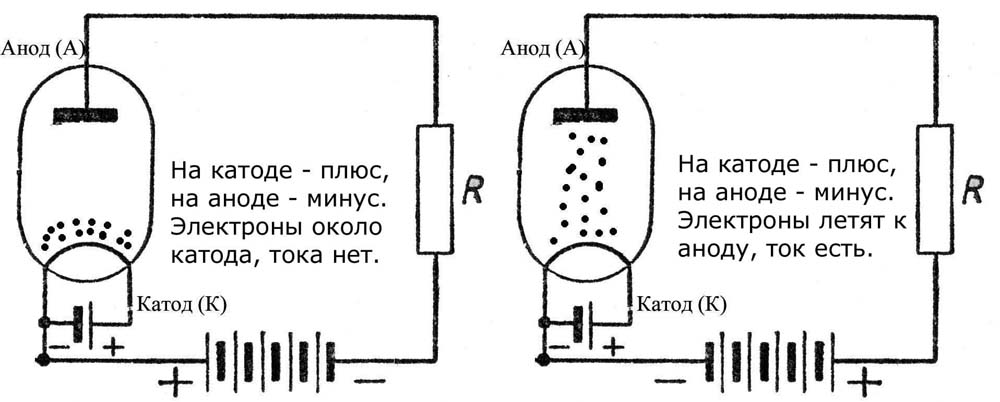 Спонсор размещения
Спонсор размещения
Тиристор представляет собой электронный компонент, который открывается при подаче напряжения на управляющий электрод, после чего остается открытым, независимо от изменения напряжения на нем. Чтобы закрыть тиристор, необходимо отключить питание управляемой цепи. Спонсор размещения P&G Статьи по теме
Чтобы подключить диод, необходимо убедиться, что его параметры соответствуют электрической цепи. Кроме того, перед подключением диод следует проверить на исправность, чтобы устройство не вышло из строя. Вам понадобится Необходимое оборудование: паяльник, отвертка, провода, нож, мультиметр. Спонсор
Вода – это одно из самых распространенных веществ на земле. При установленном порядке вещей без воды не сможет выжить ни одно живое существо. Она состоит из двух атомов водорода и одного атома кислорода. Водород — горючий газ, может использоваться как топливо. Поэтому с тех времен, как люди узнали
Конструкция из трех разных химических веществ, соединенных определенным образом, названа по имени итальянского ученого 18-го века Луиджи Гальвани.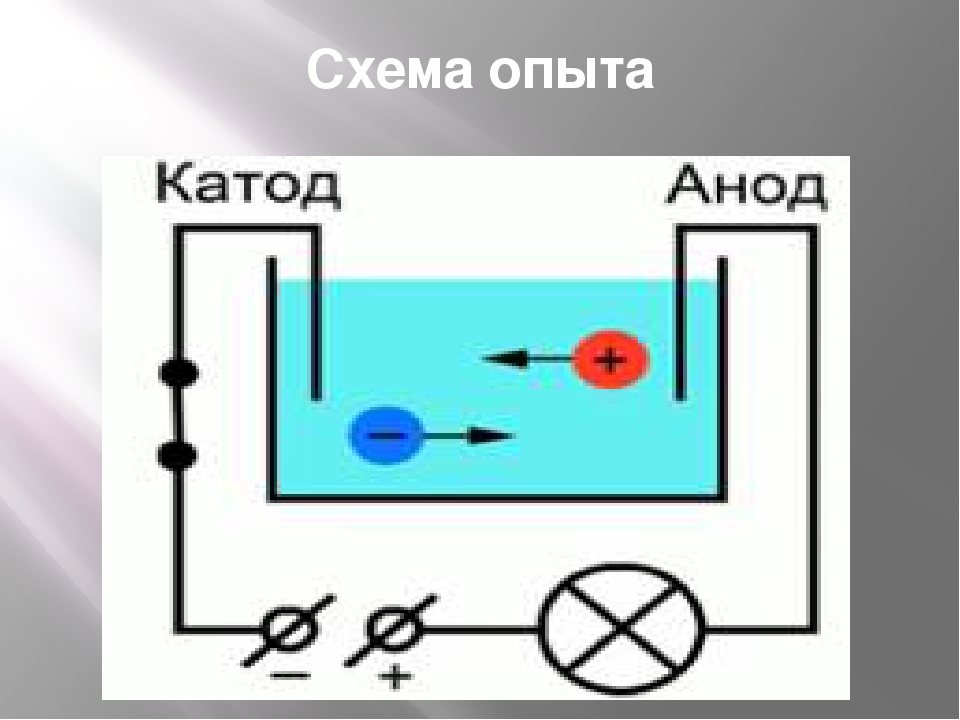 Он первым описал явление, при котором такая конструкция — гальванический элемент — вырабатывает электрический ток. А сегодня пользоваться ими любой
Он первым описал явление, при котором такая конструкция — гальванический элемент — вырабатывает электрический ток. А сегодня пользоваться ими любой
Чистый кислород в больших количествах используется в медицине, промышленности и других сферах деятельности. Для этих целей его получают из воздуха путем сжижения последнего. В лабораторных условиях этот газ можно получить из кислородосодержащих соединений, в том числе из воды. Вам понадобится —
Автор больше всего боится, что неискушённый читатель далее заголовка читать не станет. Он считает, что определение терминов анод и катод известно каждому грамотному человеку, который, разгадывая кроссворд, на вопрос о наименовании положительного электрода сразу пишет слово анод и по клеточкам всё сходится. Но не так много можно найти вещей страшнее полузнания.
Недавно в поисковой системе Google в разделе «Вопросы и ответы» я нашел даже правило, с помощью которого его авторы предлагают запомнить определение электродов.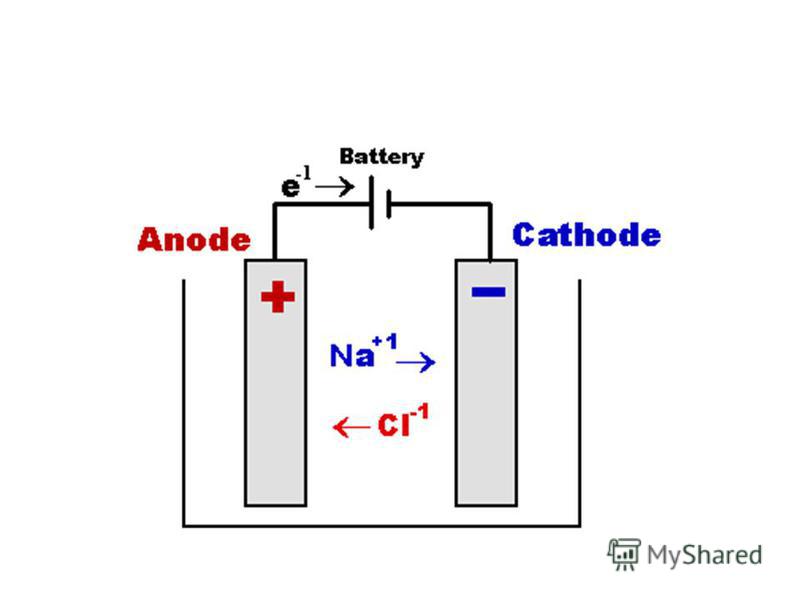 Вот оно:
Вот оно:
«Катод — отрицательный электрод, анод — положительный . А запомнить это проще всего, если посчитать буквы в словах. В катоде столько же букв, сколько в слове «минус», а в аноде соответственно столько же, сколько в термине «плюс».
Правило простое, запоминаемое, надо было бы его предложить школьникам, если бы оно было правильным. Хотя стремление педагогов вложить знания в головы учащихся с помощью мнемоники (наука о запоминании) весьма похвально. Но вернемся к нашим электродам.
Для начала возьмем очень серьезный документ, который является ЗАКОНОМ для науки, техники и, конечно, школы. Это «ГОСТ 15596-82 . ИСТОЧНИКИ ТОКА ХИМИЧЕСКИЕ. Термины и определения ». Там на странице 3 можно прочесть следующее: «Отрицательный электрод химического источника тока это электрод, который при разряде источника является анодом ». То же самое, «Положительный электрод химического источника тока это электрод, который при разряде источника является катодом ». (Термины выделены мной. БХ). Но тексты правила и ГОСТа противоречат друг-другу. В чем же дело?
(Термины выделены мной. БХ). Но тексты правила и ГОСТа противоречат друг-другу. В чем же дело?
А всё дело в том, что, например, деталь, опущенная в электролит для никелирования или для электрохимического полирования, может быть и анодом и катодом в зависимости от того наносится на нее другой слой металла или, наоборот, снимается.
Электрический аккумулятор является классическим примером возобновляемого химического источника электрического тока. Он может быть в двух режимах — зарядки и разрядки. Направление электрического тока в этих разных случаях будет в самом аккумуляторе прямо противоположным , хотя полярность электродов не меняется . В зависимости от этого назначение электродов будет разным. При зарядке положительный электрод будет принимать электрический ток, а отрицательный отпускать. При разрядке — наоборот. При отсутствии движения электрического тока разговоры об аноде и катоде бессмысленны .
«Поэтому, во избежание неясности и неопределенности, а также ради большей точности, —
записал в своих исследованиях М.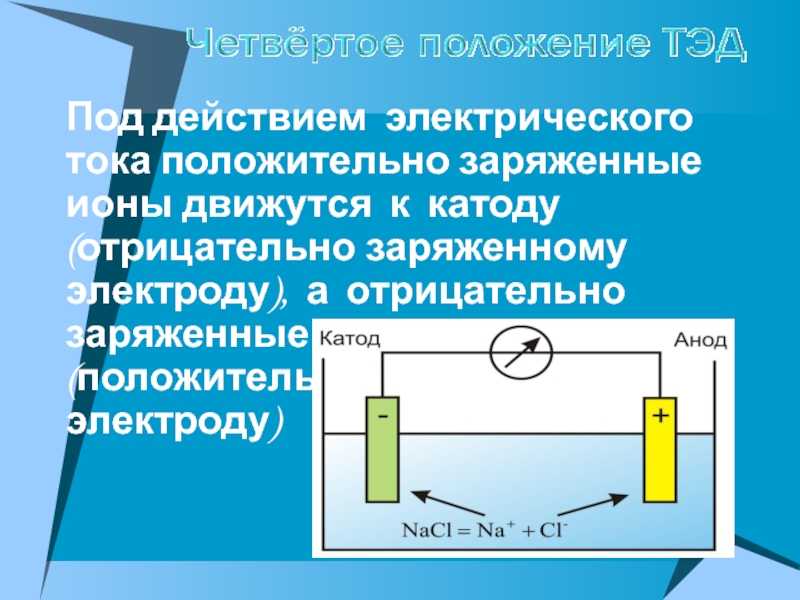 Фарадей в январе 1834г., —
я в дальнейшем предполагаю применять термины, определение которых сейчас дам».
Фарадей в январе 1834г., —
я в дальнейшем предполагаю применять термины, определение которых сейчас дам».
Каковы же причины введения новых терминов в науку Фарадеем?
А вот они: «Поверхности, у которых, согласно обычной терминологии, электрический ток входит в вещество и из него выходит, являются весьма важными местами действия и их необходимо отличать от полюсов ». (Фарадей. Подчеркнуто нами. БХ)
В те времена после открытия Т. Зеебеком явления термоэлектричества имела хождение гипотеза о том, что магнетизм Земли обусловлен разностью температур полюсов и экватора, вследствие чего возникают токи вдоль экватора. Она не подтвердилась, но послужила Фарадею в качестве «естественного указателя » при создании новых терминов. Магнетизм Земли имеет такую полярность, как если бы электрический ток шел вдоль экватора по направлению кажущегося движения солнца.
Фарадей записывает: «На основании этого представления мы предлагаем назвать ту поверхность, которая направлена на восток — анодом, а ту, которая направлена на запад — катодом».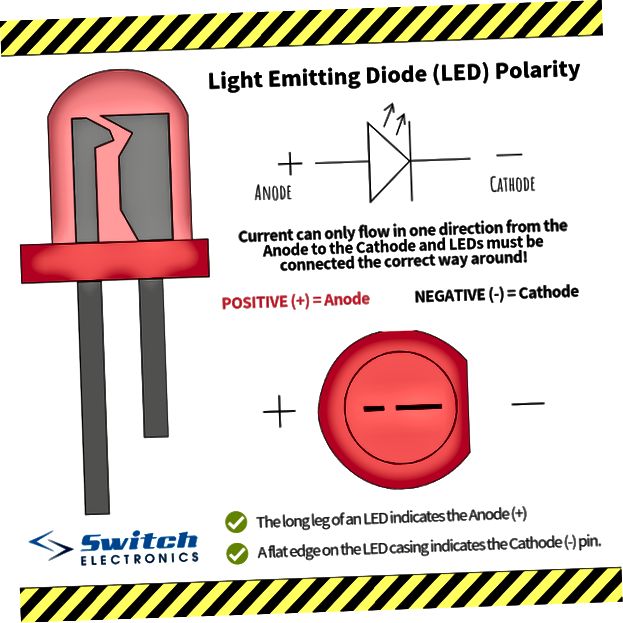 В основе новых терминов лежал древнегреческий язык и в переводе они значили: анод — путь (солнца) вверх, катод — путь (солнца) вниз. В русском языке есть прекрасные термины ВОСХОД и ЗАХОД, которые легко применить для данного случая, но почему-то переводчики Фарадея этого не сделали. Мы же рекомендуем пользоваться ими, ибо в них корнем слова является ХОД и, во всяком случае, это напомнит пользователю термина, что без движения тока термин не применим. Для желающего проверить рассуждения создателя термина с помощью других правил, например правила пробочника, сообщаем, что северный магнитный полюс Земли лежит в Антарктиде, возле Южного географического полюса.
В основе новых терминов лежал древнегреческий язык и в переводе они значили: анод — путь (солнца) вверх, катод — путь (солнца) вниз. В русском языке есть прекрасные термины ВОСХОД и ЗАХОД, которые легко применить для данного случая, но почему-то переводчики Фарадея этого не сделали. Мы же рекомендуем пользоваться ими, ибо в них корнем слова является ХОД и, во всяком случае, это напомнит пользователю термина, что без движения тока термин не применим. Для желающего проверить рассуждения создателя термина с помощью других правил, например правила пробочника, сообщаем, что северный магнитный полюс Земли лежит в Антарктиде, возле Южного географического полюса.
Ошибкам в применениях терминов АНОД и КАТОД нет числа. В том числе и в зарубежных справочниках и энциклопедиях. Поэтому в электрохимии пользуются другими определениями, более понятными читателю. У них анод — это электрод, где протекают окислительные процессы, а катод — это электрод, где протекают восстановительные процессы. В этой терминологии нет места электронным приборам, но при электротехнической терминологии указать анод радиолампы, например, легко. В него входит электрический ток. (Не путать с направлением электронов).
В этой терминологии нет места электронным приборам, но при электротехнической терминологии указать анод радиолампы, например, легко. В него входит электрический ток. (Не путать с направлением электронов).
Литература:
1. Михаил Фарадей. Экспериментальные исследования по электричеству. Том 1. Изд-во АН СССР, М. 1947. с.266-268.
2. Б.Г.Хасапов. Как определять термины «анод» и «катод». ВНИИКИ. Научно-техническая терминология. Реферативный сборник №6, Москва, 1989, с.17-20.
Некоторого прибора, присоединённый к отрицательному полюсу источника тока.
Катод в электрохимии и цветной металлургии
Катод у полупроводниковых приборов
Знак анода и катода
В литературе встречается различное обозначение знака катода — «-» или «+», что определяется, в частности, особенностями рассматриваемых процессов. В электрохимии принято считать, что «-» катод — электрод, на котором происходит процесс восстановления , а «+» анод — тот, где протекает процесс окисления .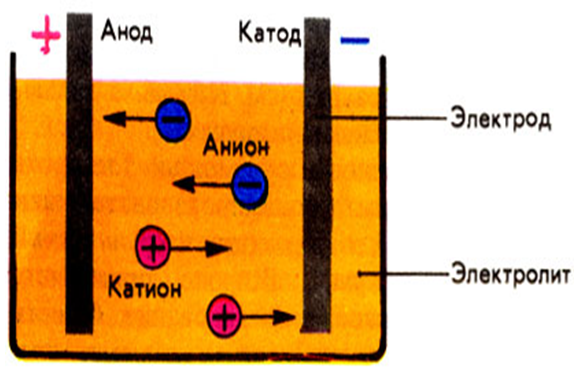 При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод. В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод. Так, на приведённой иллюстрации изображён обозначенный знаком «-» катод гальванического элемента , на котором происходит восстановление меди. В соответствии с таким толкованием, для аккумулятора знак анода и катода меняется в зависимости от направления протекания тока.
При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод. В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод. Так, на приведённой иллюстрации изображён обозначенный знаком «-» катод гальванического элемента , на котором происходит восстановление меди. В соответствии с таким толкованием, для аккумулятора знак анода и катода меняется в зависимости от направления протекания тока.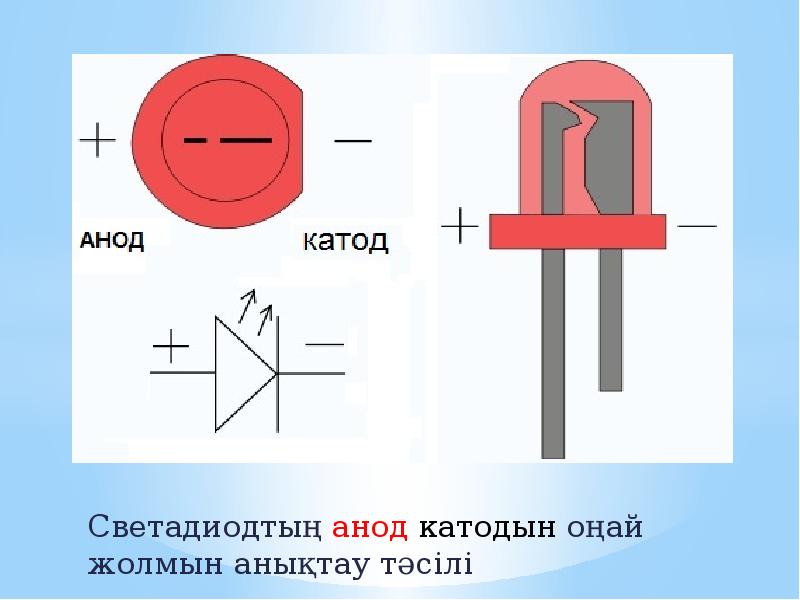 .
.
В электротехнике за направление тока принято считать направление движения положительных зарядов, отрицательный электрод «−» (
электрических полей — Почему катод гальванической батареи считается положительным полюсом?
Задавать вопрос
Спросил
Изменено 2 года, 6 месяцев назад
Просмотрено 302 раза
$\begingroup$
Я немного смущен тем, почему катодный электрод гальванической батареи обозначается как положительный полюс. Положительный означает наличие положительного заряда?
Вот то (я думаю), что я знаю, что это правда:
Анод (где происходит окисление) является источником электронов, а катод (где происходит восстановление) является стоком электронов
Заряд движется в направлении линий электрического поля
Чистый заряд системы гальванических батарей равен нулю
растворы электролитов, омывающие анодный и катодный электроды, электрически нейтральны
Для того, чтобы электроны двигались от анодного электрода к катодному электроду, явно существует какая-то сила, направляющая их туда. Единственное, что я могу придумать, что механистически объясняет это, это то, что даже в замкнутой цепи должно быть какое-то накопление отрицательного заряда на анодном электроде (т.е. анод держит, хотя и небольшой, статический отрицательный заряд).
Единственное, что я могу придумать, что механистически объясняет это, это то, что даже в замкнутой цепи должно быть какое-то накопление отрицательного заряда на анодном электроде (т.е. анод держит, хотя и небольшой, статический отрицательный заряд).
Поскольку растворы электролитов остаются электрически нейтральными (что обеспечивается солевым мостиком), я не понимаю, почему на катодном электроде должен присутствовать положительный заряд. Единственное, что я мог понять, это то, что катодный электрод делает , а не накапливают столько же отрицательного заряда, сколько анодный электрод. В таком случае дело не в том, что катодный электрод заряжен положительно… просто он менее отрицательно заряжен , чем анодный электрод. В этом сценарии электроны, безусловно, будут течь к катоду от анода.
Однако для того, чтобы это было правдой, должно быть так, что растворы электролитов на самом деле несут небольшой положительный заряд (чтобы уравновесить отрицательные заряды, удерживаемые как на анодном, так и на катодном электродах).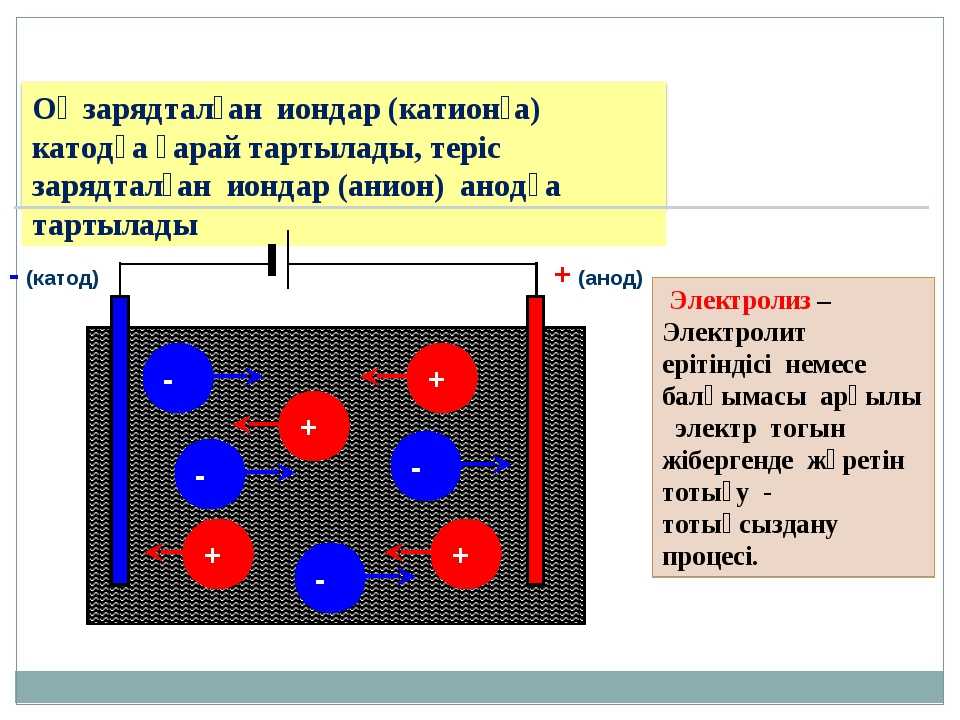 {2+}$. Концентрации будут основаны на электроотрицательности меди и цинка.
{2+}$. Концентрации будут основаны на электроотрицательности меди и цинка.
Что касается фактического количества электронов по сравнению с положительно заряженными металлами, то этот баланс определяется электростатикой. Если батарея электростатически нейтральна, по определению, если есть область со слишком большим количеством электронов, должна быть область со слишком малым количеством электронов (слишком много дырок). Тем не менее, это невероятно небольшая разница . Отрыв близкого куска скотча изменит общее количество электронов на , а далеко на больше. В то время как гальванический элемент может производить 2 В, отрыв ленты может легко создать статический заряд в сотни вольт.
Что действительно важно, так это разница. Есть ли дырки или электроны на самом деле, зависит только от точного электростатического заряда в этот момент. Пока есть разница, ток может течь.
$\endgroup$
1
Твой ответ
Зарегистрируйтесь или войдите
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
Help with Electrolytic Cells — High School Chemistry
All High School Chemistry Resources
6 диагностических тестов 143 практических теста Вопрос дня Карточки Learn by Concept
High School Chemistry Help » Электрохимия » Помощь с электролитическими элементами
Чем электролитический элемент отличается от гальванического элемента?
Возможные ответы:
В гальваническом элементе окисление происходит на аноде, а в электролитическом элементе — на катоде
В электролитическом элементе катод отмечен отрицательным
Окисление происходит на аноде в электролизере, но на катоде в гальваническом элементе
Правильный ответ:
В электролизере катод отмечен отрицательным
Объяснение:
Окисление всегда происходит на аноде, независимо от типа электрической ячейки.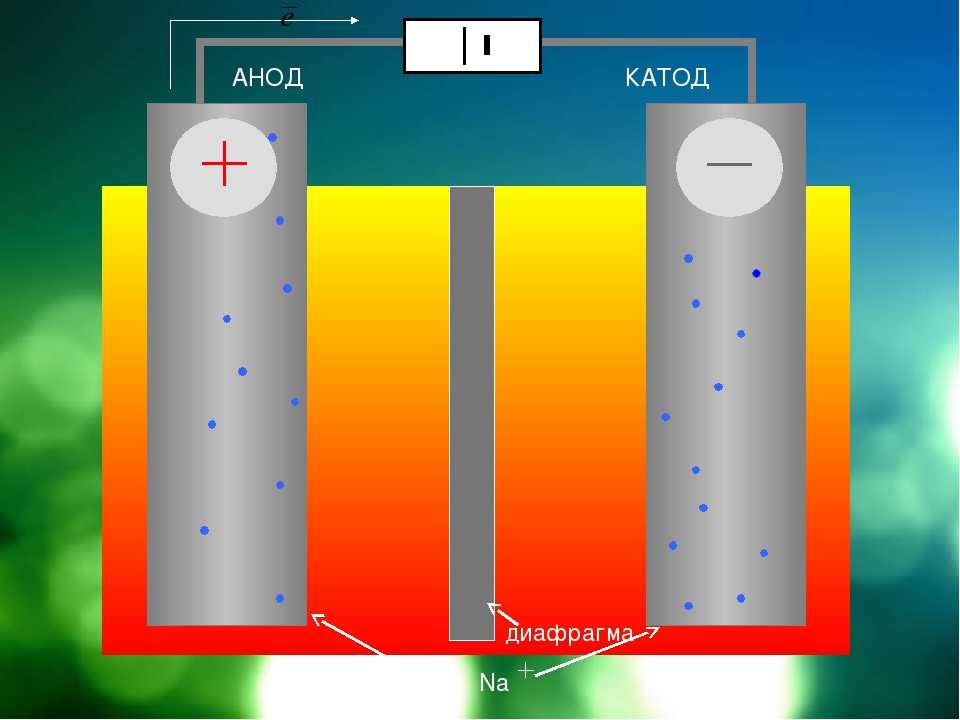 Заряды на аноде и катоде меняются местами между гальваническими и электролитическими элементами. В электролитических ячейках катоды помечены как отрицательные, а аноды — как положительные. В гальванических элементах верно обратное: катоды помечены как положительные, а аноды помечены как отрицательные.
Заряды на аноде и катоде меняются местами между гальваническими и электролитическими элементами. В электролитических ячейках катоды помечены как отрицательные, а аноды — как положительные. В гальванических элементах верно обратное: катоды помечены как положительные, а аноды помечены как отрицательные.
Сообщить об ошибке
К какому полюсу движутся электроны в электролитической ячейке?
Возможные ответы:
Требуется дополнительная информация
К положительному полюсу
Электроны не движутся; движутся только протоны
К катоду
К аноду
Правильный ответ:
К катоду
Пояснение:
Восстановление всегда происходит на катоде, а окисление всегда происходит на аноде. Поскольку восстановление — это добавление электронов, электроны должны двигаться к месту восстановления.
В электролизере отрицательный заряд находится на катоде, а положительный — на аноде. Поскольку электролитической ячейке требуется энергия для продолжения реакции, мы толкаем электроны против градиента их потенциала. Электроны, заряженные отрицательно, движутся к катоду, который также заряжен отрицательно.
Сообщить об ошибке
В гальваническом элементе происходит следующая реакция:
Элемент гальванический или гальванический?
Возможные ответы:
Ни один
Гальванический
Оба
Электролитический
Правильный ответ:
2 Гальванический3 Пояснение:
Поскольку наша общая реакция включает твердый магний в реагентах, мы должны инвертировать первое уравнение, включая знак электрического потенциала.
Эта ячейка гальваническая, потому что электрический потенциал положительный. Гальванические элементы включают спонтанные реакции и, следовательно, не нуждаются во внешнем источнике энергии для запуска реакции.
Гальванические элементы включают спонтанные реакции и, следовательно, не нуждаются во внешнем источнике энергии для запуска реакции.
Сообщить об ошибке
В электрохимической ячейке происходит следующая реакция:
Что из следующего лучше всего описывает эту ячейку?
Возможные ответы:
Гальванический
Оба
Электролитический
Ни один
Правильный ответ:
Электролитический Пояснение:
Поскольку наша общая реакция включает твердый кальций в реагентах, мы должны инвертировать второе уравнение, включая знак электрического потенциала.
Эта ячейка является электролитической, поскольку электрический потенциал отрицательный. Электролитические элементы включают неспонтанные реакции и, следовательно, должны иметь внешний источник напряжения, такой как батарея, для управления своими реакциями.
Сообщить об ошибке
Какой из следующих видов наиболее вероятно окислится, если его поместить в электрохимическую ячейку с другим веществом?
Возможные ответы:
Правильный ответ:
Объяснение:
Используя уравнение: , чтобы произошла спонтанная реакция, должно быть положительным. С твердым цинком в качестве реагента любое другое твердое вещество может действовать как продукт и все же давать положительный результат. Это потому, что вычитание отрицательного числа даст положительное значение.
В результате уравнение инвертируется, и твердый цинк становится реагентом. . Твердый цинк будет отдавать электроны и окисляться, чтобы восстановить другие ионы.
Сообщить об ошибке
Чтобы произошла следующая реакция, электрохимический элемент гальванический или гальванический?
Возможные ответы:
Galvanic
Оба
Ни
Электролитический
Правильный ответ:
Электролитический
Пояснение:
Сначала мы должны переставить восстановительные потенциалы так, чтобы при суммировании они соответствовали реакции, происходящей в электрохимической ячейке.
В общей реакции находится на стороне реагента, поэтому уравнение необходимо инвертировать.
Используйте уравнение: чтобы найти .
— продукт, а — реагент.
Ячейка должна быть электролитической, поскольку значение отрицательное. Это означает, что эта реакция не является самопроизвольной реакцией, и для ее осуществления требуется прикладной источник энергии.
Сообщить об ошибке
Чем электролизер отличается от гальванического элемента?
Возможные ответы:
Окисление происходит на аноде в гальваническом элементе, но на катоде в электролитической ячейке
Потенциал ячейки положительный в электролитической ячейке элемент, а на катоде – в гальваническом элементе
Катод в электролитической ячейке помечен как отрицательный
Правильный ответ:
Катод помечен как отрицательный в электролитической ячейке
Объяснение:
Окисление всегда происходит на аноде, независимо от типа электрической ячейки.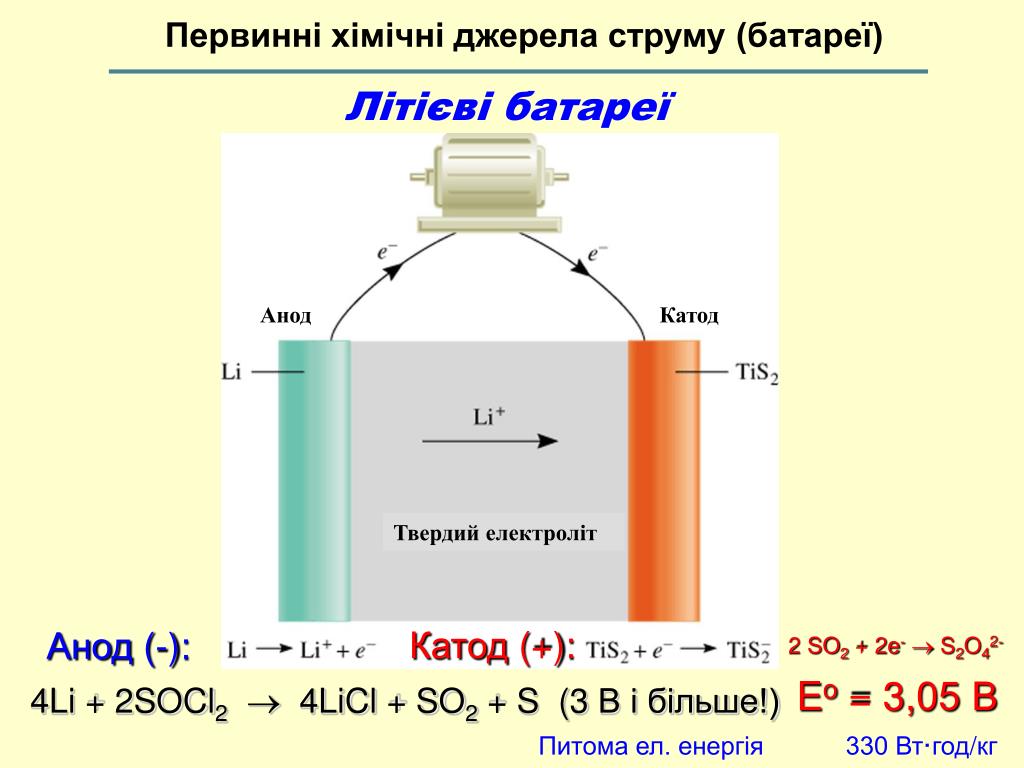 Заряды на аноде и катоде меняются местами между гальваническими и электролитическими элементами. В электролитических ячейках катоды помечены как отрицательные, а аноды — как положительные. В гальванических элементах верно обратное: катоды помечены как положительные, а аноды помечены как отрицательные.
Заряды на аноде и катоде меняются местами между гальваническими и электролитическими элементами. В электролитических ячейках катоды помечены как отрицательные, а аноды — как положительные. В гальванических элементах верно обратное: катоды помечены как положительные, а аноды помечены как отрицательные.
Сообщить об ошибке
Чем электролизер отличается от гальванического элемента?
Возможные ответы:
В электролитической ячейке окисление происходит на аноде, а в гальванической ячейке — на катоде
В электролитической ячейке катод отмечен отрицательным
Окисление происходит на аноде в гальваническом элементе, но на катоде в электролитической ячейке
Правильный ответ:
Катод в электролитической ячейке отмечен отрицательным знаком
Объяснение:
Окисление всегда происходит на аноде, независимо от типа электрической ячейки.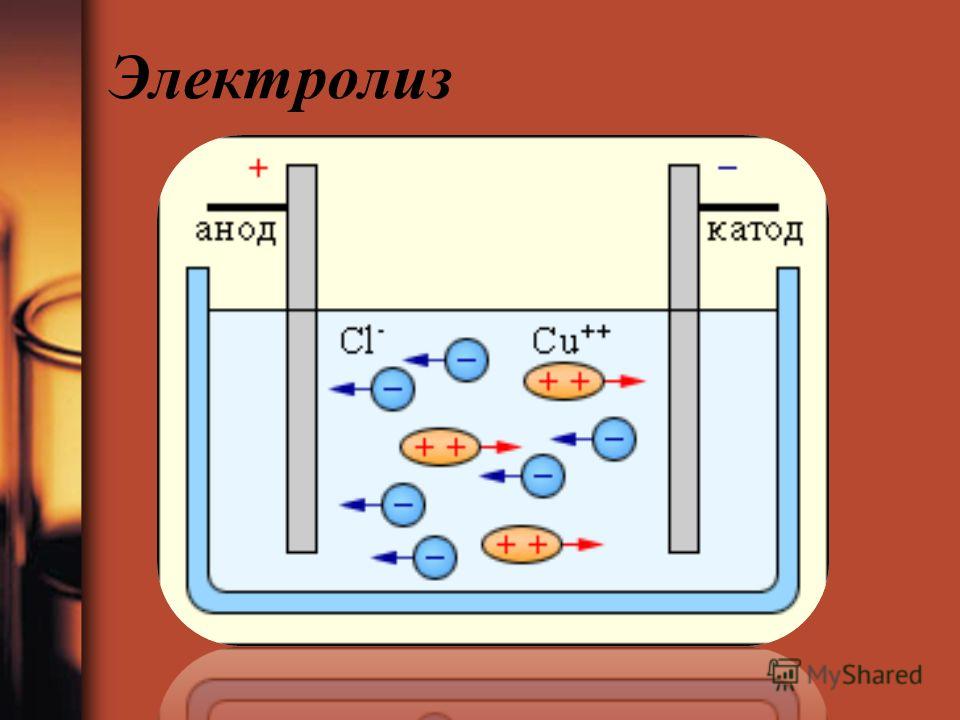 Заряды на аноде и катоде меняются местами между гальваническими и электролитическими элементами. В электролитических ячейках катоды помечены как отрицательные, а аноды — как положительные. В гальванических элементах верно обратное: катоды помечены как положительные, а аноды помечены как отрицательные.
Заряды на аноде и катоде меняются местами между гальваническими и электролитическими элементами. В электролитических ячейках катоды помечены как отрицательные, а аноды — как положительные. В гальванических элементах верно обратное: катоды помечены как положительные, а аноды помечены как отрицательные.
Сообщить об ошибке
Уведомление об авторских правах
Все ресурсы по химии для средней школы
6 Диагностические тесты 143 практических теста Вопрос дня Карточки Изучите концепцию
Что такое положительный анод? (с изображением)
`;
М. Уокер
Положительный анод является частью электрического устройства, через которое ток поступает в электрическую систему. Электрод считается положительным, когда он присутствует в электролитической ячейке или заряжающемся аккумуляторе, потому что он поставляет электроны в систему, оставляя после себя положительные катионы. Аноды могут быть изготовлены из многих материалов, начиная от традиционного цинка и меди и заканчивая современным углеродом, графитом и кремнием.
Аноды могут быть изготовлены из кремния. Хотя положительный анод чаще всего воспринимается как стереотипный анод, аноды могут быть как положительными, так и отрицательными, в зависимости от типа системы. Например, гальванические элементы или разряжающиеся батареи имеют отрицательные аноды и положительные катоды.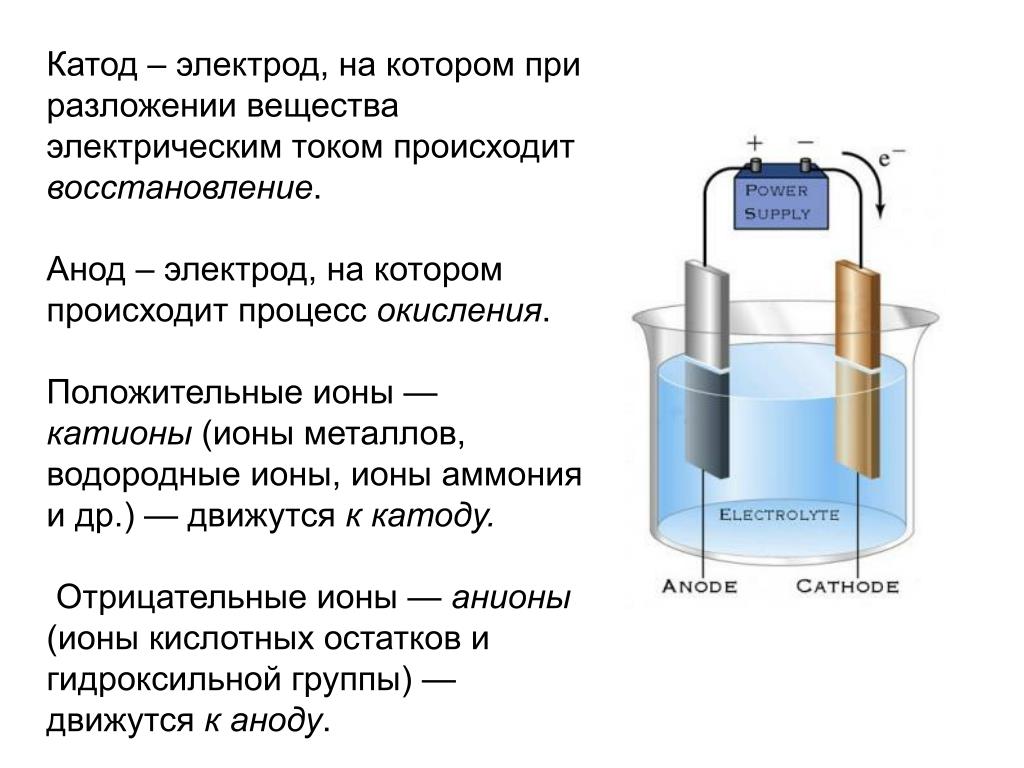 Положительные и отрицательные заряды не зависят от истинного определения анода, который является источником тока в системе.
Положительные и отрицательные заряды не зависят от истинного определения анода, который является источником тока в системе.
Электролитические элементы и зарядные батареи часто используются в качестве примеров при описании положительного анода. В этих устройствах анод представляет собой электрод, от которого удаляются катионы и к которому движутся анионы, отчасти из-за его положительного заряда. Положительный анод в электролитической ячейке устроен аналогично отрицательному аноду в гальванической ячейке, поскольку каждая базовая ячейка содержит два металла в отдельных растворах ионов электролита. Две полуклетки соединены солевым мостиком или ионопроницаемой мембраной.
Электролизер предназначен для преобразования электрической энергии в химическую.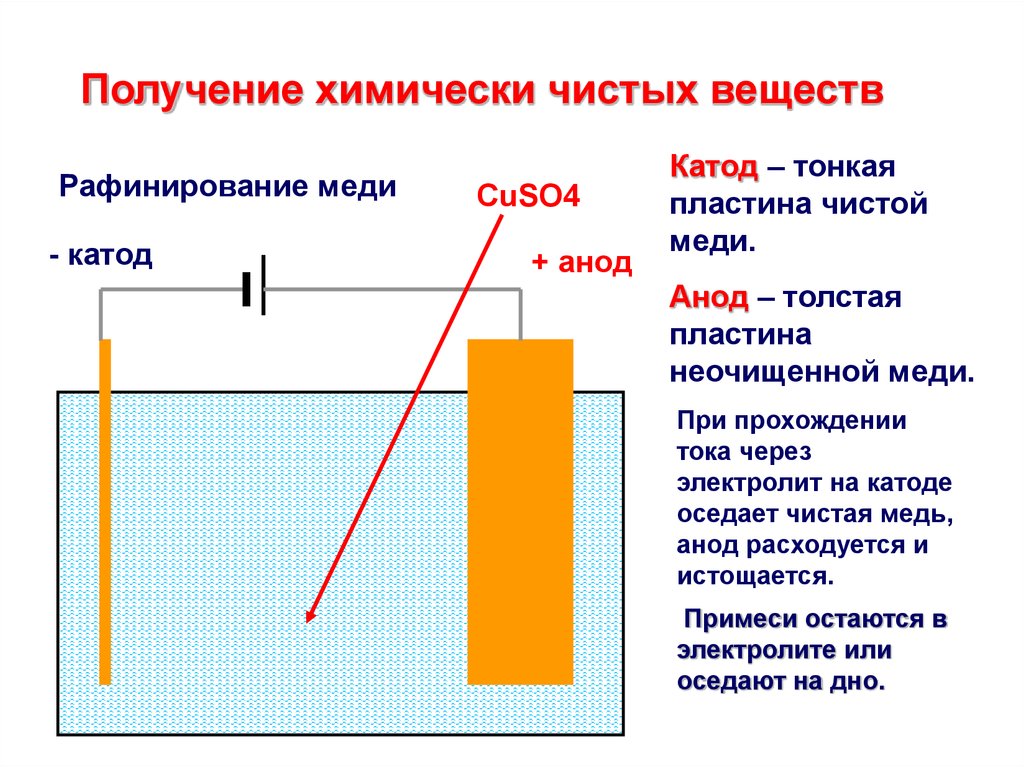 Когда анод ионизируется, он создает электроны, которые текут к катоду, а также производит катионы, которые растворяются в растворе электролита. На противоположном конце катод связывает электроны, созданные на положительном аноде, с катионами в растворе электролита. Они образуют целые атомы, которые оседают на катоде, создавая химическую энергию.
Когда анод ионизируется, он создает электроны, которые текут к катоду, а также производит катионы, которые растворяются в растворе электролита. На противоположном конце катод связывает электроны, созданные на положительном аноде, с катионами в растворе электролита. Они образуют целые атомы, которые оседают на катоде, создавая химическую энергию.
Когда атомы в аноде расщепляются, говорят, что они окисляются. В электрохимии этот процесс окисления всегда происходит на аноде, но в других процессах он может происходить и на катоде. Электронно-лучевые трубки, например, также имеют положительный анод, но анод заряжен так, что он может принимать электроны, а не испускать электроны.
Другие технологии также используют положительный анод, включая рафинирование металла. Во время этих процессов металл анода подвергается электролизу с образованием электронов и растворенных катионов металлов в типичном электролитическом процессе. Затем растворенные катионы перемещаются через раствор к катоду, где вновь собираются в виде твердого продукта. Процессы, использующие эту технологию, позволяют получать металлы высокой чистоты на катоде до 99,99%.
Во время этих процессов металл анода подвергается электролизу с образованием электронов и растворенных катионов металлов в типичном электролитическом процессе. Затем растворенные катионы перемещаются через раствор к катоду, где вновь собираются в виде твердого продукта. Процессы, использующие эту технологию, позволяют получать металлы высокой чистоты на катоде до 99,99%.
Вам также может понравиться
Рекомендуется
Что теряет заряд на аноде?
Вопрос задан: г-ном Уильямом Вилдерманом DDS
Оценка: 4,8/5 (14 голосов)
Направление потока электронов
Анод – это электрод, на котором вещества теряют электронов и окисляются.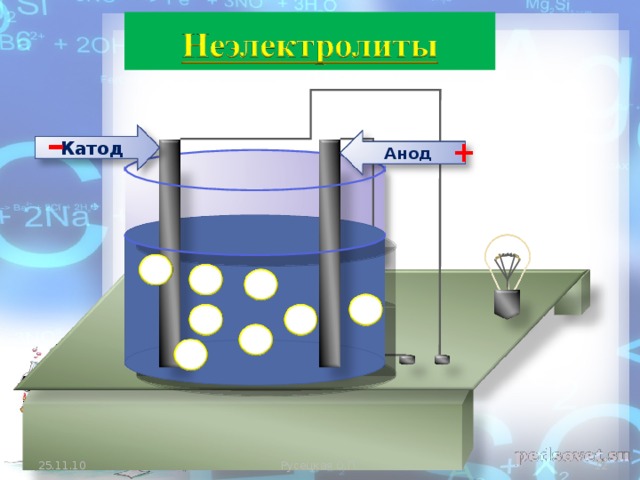 Катод – это электрод, на котором вещества приобретают электроны и восстанавливаются.
Катод – это электрод, на котором вещества приобретают электроны и восстанавливаются.
Который теряет заряд на катоде?
Электрод, у которого электронов теряется называется катод.
Какие заряды на катоде и аноде?
Каков заряд анода и катода? Анод считается отрицательным в гальваническом (гальваническом) элементе, а катод считается положительным . Это кажется уместным, потому что анод является источником электронов, а место, где текут электроны, является катодом.
Анод теряет или увеличивает массу?
Анод (положительный электрод) изготовлен из нечистой меди, а катод (отрицательный электрод) – из чистой меди. При электролизе анод теряет массу по мере растворения меди , а масса катода увеличивается по мере осаждения меди.
Какие разряды на аноде?
На аноде выделяются ионов гидроксида с образованием воды и пузырьков газообразного кислорода. Сульфат-ионы никогда не выделяются.
Что такое электролиз | Реакции | Химия | FuseSchool
Найдено 16 связанных вопросов
Является ли анод положительным или отрицательным электродом?
Анод, клемма или электрод, с которого электроны покидают систему. В батарее или другом источнике постоянного тока анодом является отрицательная клемма , а в пассивной нагрузке — положительная клемма.
Какие обозначения катода и анода?
Во время разряда плюс — катод, минус — анод . Во время заряда плюс является анодом, минус катодом.
Анод всегда слева?
Электроны всегда текут от анода к катоду или от полуэлемента окисления к полуэлементу восстановления. … Анод всегда ставится с левой стороны , а катод с правой стороны.
… Анод всегда ставится с левой стороны , а катод с правой стороны.
Анод восстановлен или окислен?
Анод определяется как электрод, на котором происходит окисление . Катод – это электрод, на котором происходит восстановление.
Увеличивается ли масса анода во время разряда?
(II) Анод набирает массу во время разряда (примечание: это означает работу ячейки.)
В чем разница между катодом и анодом?
Ответ: Катод — это отрицательный электрод, , тогда как анод — это положительный электрод, . Они так называются потому, что положительно заряженные катионы мигрируют к отрицательному катоду. Следовательно, известный как катод, в то время как анионы мигрируют к положительно заряженному аноду, и так известный как анод.
Почему анод отрицательный?
В гальваническом элементе электроны движутся к аноду. Поскольку электроны несут отрицательный заряд, то и анод заряжен отрицательно. … Это потому что протоны притягиваются к катоду , поэтому он в основном положителен и поэтому заряжен положительно.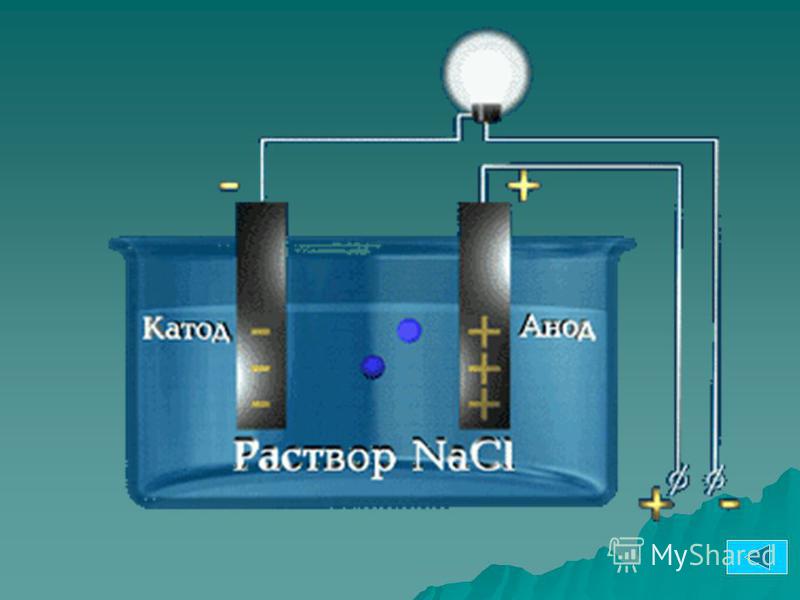
Как определить, является металл анодом или катодом?
Тот, у которого самый высокий восстановительный потенциал, будет тем, что вы хотите выбрать в качестве полуреакции восстановления и, следовательно, вашим катодом. Тот, у которого самый низкий восстановительный потенциал, будет тем, что вы хотите выбрать в качестве реакции полуокисления и, следовательно, вашим анодом.
Почему в аккумуляторе положительный катод?
С другой стороны, на катоде происходит реакция восстановления, которая потребляет электроны (оставляя положительные (металлические) ионы на электроде) и, таким образом, приводит к накоплению положительного заряда в ходе реакции пока не будет достигнуто электрохимическое равновесие. Таким образом, катод положительный.
Катоды восстановлены?
В химии под катодом понимается электрод электрохимической ячейки, на котором происходит восстановление ; полезная мнемоника, чтобы помнить, что это AnOx RedCat (окисление на аноде = восстановление на катоде).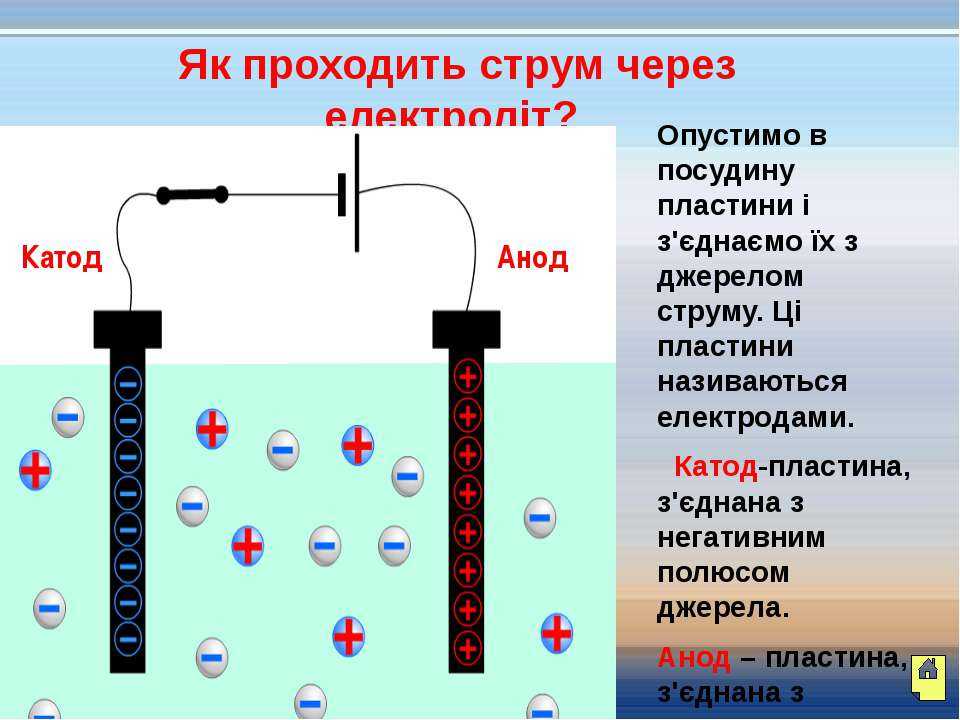 Еще одна мнемоника — отметить, что катод имеет букву «с», как и «восстановление». Следовательно, восстановление на катоде.
Еще одна мнемоника — отметить, что катод имеет букву «с», как и «восстановление». Следовательно, восстановление на катоде.
Как определить катод?
В диоде катод обозначен заостренным концом символа стрелки . Это отрицательная клемма, с которой течет ток. Несмотря на то, что ток может течь в обоих направлениях через диод, наименование всегда основывается на направлении, в котором ток течет легче всего.
Почему на аноде происходит окисление?
Окисление происходит на положительном аноде, потому что это , где отрицательные ионы теряют электроны .
Почему анод теряет массу при электролизе?
Анод представляет собой восстановитель, поскольку его поведение будет восстанавливать ионы на катоде . Масса уменьшается по мере того, как реагирующий материал анода становится водным. Эти ионы являются окислителями, потому что, принимая электроны, они вызывают окисление анода.
Что такое окисление и восстановление?
Окисление и восстановление с точки зрения переноса кислорода
Термины окисление и восстановление могут быть определены с точки зрения добавления или удаления кислорода к соединению.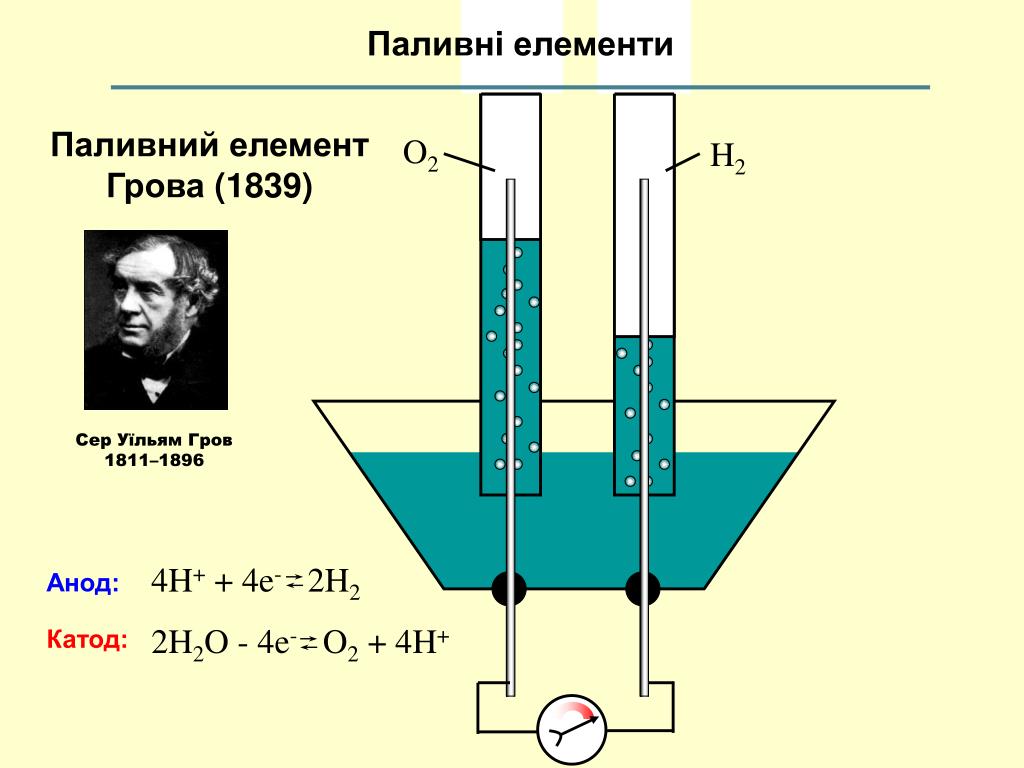 … Окисление — это присоединение кислорода. Восстановление – потеря кислорода .
… Окисление — это присоединение кислорода. Восстановление – потеря кислорода .
Как узнать, с какой стороны анод?
Полярность и обозначения диодов
Одна сторона является положительной клеммой , называемой анодом. Другая клемма является отрицательным концом, называемым катодом. Возвращаясь к нашему потоку электричества, ток может двигаться в диоде только от анода к катоду, а не наоборот.
Положительный ли анод в гальваническом элементе?
В электрохимической ячейке анод отрицательный, потому что он имеет отрицательный потенциал по отношению к раствору, в то время как в электролитической ячейке анод положительный, потому что он подключен к положительной клемме батареи. …
Почему электроны перетекают от анода к катоду?
По определению, катод — это отрицательно заряженный электрод (металлическая пластина или проволока), а анод — это положительно заряженный электрод. … Поскольку электроны отрицательны, электронная сила на них направлена против поля, или в сторону анода .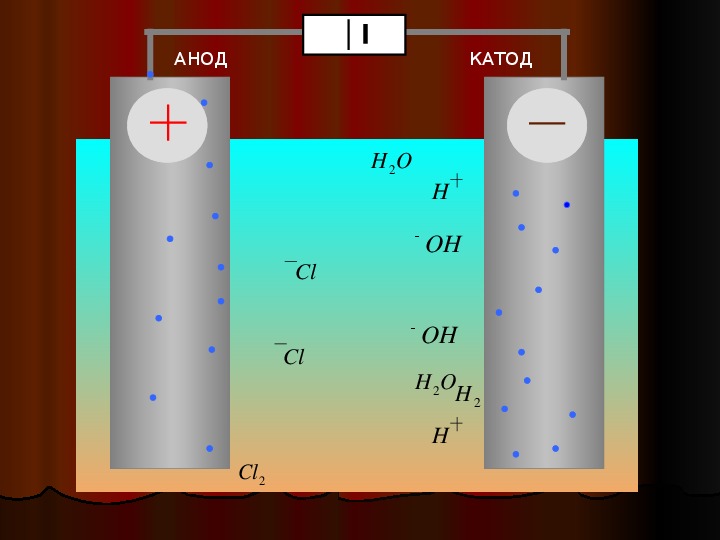 Эта сила заставляет электронный ток течь от катода к аноду.
Эта сила заставляет электронный ток течь от катода к аноду.
Что делает анод положительным?
Аналогичным образом анод выталкивает электроны наружу и прочь. Только отрицательный заряд мог бы спонтанно сделать это, поэтому анод на гальваническом элементе отрицательный (-). … Принуждение электронов к электроду сделает его отрицательным (-). ПРИНУДИТЕЛЬНОЕ УДАЛЕНИЕ электронов с другого электрода делает его положительным, а анод (+).
Какая клемма аккумулятора является катодной?
Электрод, соединенный с положительной клеммой элемента или батареи, называется анодом. Электрод, который соединен с отрицательной клеммой батареи , называется катодом.
Похожие вопросы
- 25В непрактичных шутниках кто больше всех проигрывает?
- 43Где ваше тело теряет вес в первую очередь?
- 28Орхидея теряет цветы?
- 33Как тело теряет жир в первую очередь из какой части?
- 32Когда кто-то теряет ребенка?
- 39Вычитаются ли из налогооблагаемой базы потери на фондовом рынке?
- 22Что утром теряет голову, а ночью обретает ее?
- 22Умрет ли паук, если потеряет ногу?
- 23Что делать, если у вашей собаки выпал зуб?
- 31Может ли магнит потерять свойство?
Реклама
Популярные вопросы
- 45В растениях тонопласт облегчает?
- 41Что означает слово завораживающе?
- 42Кто спроектировал гольф-клуб Хинсдейла?
- 43Где строятся лодки для морской охоты?
- 27Где дом Бетенни Франкель в Хэмптоне?
- 18Что значит просить?
- 23В школе стало тяжелее?
- 44Запрещено ли самодельное оружие?
- 19Сколько стоит цикло скин?
- 23Что означает гребля?
Катод и анод — обзор, различия, заряды, использование, заключение
Что такое анод и катод?
Что такое катод: В химии катод определяется как электрод, на котором происходит восстановление. В электрохимической ячейке. Катод отрицательный, потому что электрическая энергия, обеспечиваемая в ячейке, вызывает разложение химических соединений. Однако это может быть положительно для гальванического элемента, в котором химическая реакция производит электрическую энергию.
В электрохимической ячейке. Катод отрицательный, потому что электрическая энергия, обеспечиваемая в ячейке, вызывает разложение химических соединений. Однако это может быть положительно для гальванического элемента, в котором химическая реакция производит электрическую энергию.
Однако он может быть положительным, почти как в случае с электрическим элементом, когда химический процесс имеет тенденцию к выработке энергии. В результате того, что катод может генерировать электроны, которые обычно измеряют электрические частицы, совершающие движение, должно быть так, что катод генерирует положительный заряд, ток движется от катода и заряда анода. Это может сбивать с толку, потому что направление тока будет определяется тем, как будет двигаться заряд. просто имейте в виду, что любое движение заряженных частиц является текущим.
Also check-
- NCERT Exemplar Class 11th Chemistry Solutions
- NCERT Exemplar Class 12th Chemistry Solutions
- NCERT Exemplar Solutions for All Subjects
Anode:
What is anode: In electrochemistry , анод — это место, где процесс окисления происходит в его самой основной форме. Отрицательные ионы / анионы имеют тенденцию реагировать вместе с ним, испуская электрон на аноде из-за электрического потенциала. Затем электроны пробиваются к управляющей цепи. В гальваническом элементе анод заряжен отрицательно, и электроны имеют тенденцию течь к внешней стороне цепи.
Отрицательные ионы / анионы имеют тенденцию реагировать вместе с ним, испуская электрон на аноде из-за электрического потенциала. Затем электроны пробиваются к управляющей цепи. В гальваническом элементе анод заряжен отрицательно, и электроны имеют тенденцию течь к внешней стороне цепи.
Также прочитайте:
- NCERT Notes Class 12 Химия Глава 3 Электрохимия
- NCERT Solutions для химии 12 -й класс. Катод
Электроны могут втекать в соответствующую электрическую ячейку или систему через катодный проводник, в то время как они собираются покинуть анодный проводник заряда. Они могут изменять положение ниже предельных условий, например, подзарядку аккумулятора.
Катод может иметь сетевой заряд в электролитических элементах, как одноразовая батарея, и электрический заряд в гальванических элементах, как перезаряжаемая батарея.
 Анодный заряд электродов может нести другой.
Анодный заряд электродов может нести другой.Как только движение электронов началось в электрической ячейке (разрядка), последующие анионы будут притягиваться к концу заряда анода ячейки, тогда как катионы будут притягиваться к концу катода.
Процесс втекания электронов в катод считается восстановлением, потому что он приводит к заряду и уменьшению числа молекул. В то время как с зарядом анода мы увидим электрический заряд от действия электронов, этот метод считается окислением.
Во время зарядки, в конце катода, мы увидим создание электронов за счет окисления материала анодной шихты, тогда как электроны уменьшатся в конце заряда анода. Таким образом, возникает вопрос, является ли заряд анода положительным или отрицательным или положительным или отрицательным является катод.
Зарядка :
При зарядке анода реакция на химическую реакцию ассоциированной степени.
 Альтернативные виды потеряли бы электроны, сделав этот проводник связанным с накоплением негатронов. Таким образом, заряд анода заряжается. Но, в отличие от катода, реакция дисконта возникает везде, где восстановленные виды приобретают электроны. Следовательно, в проводнике, который предполагает катод, отсутствуют электроны, и поэтому он заряжен абсолютно.
Альтернативные виды потеряли бы электроны, сделав этот проводник связанным с накоплением негатронов. Таким образом, заряд анода заряжается. Но, в отличие от катода, реакция дисконта возникает везде, где восстановленные виды приобретают электроны. Следовательно, в проводнике, который предполагает катод, отсутствуют электроны, и поэтому он заряжен абсолютно.Использование
:Анодный заряд — это отрицательный или восстановительный проводник, который высвобождает электроны во внешнюю цепь и окисляется во время химической реакции.
Катод означает положительный или окислительный проводник, который получает электроны из внешней цепи и восстанавливается в ходе химической реакции.
Единица площади электролита, обычно рассматриваемая как жидкости, такие как вода или различные растворители, с растворенными солями, кислотами или щелочами, которые необходимы для ионной проводимости.
 Следует отметить, что несколько батарей вместе с традиционными.
Следует отметить, что несколько батарей вместе с традиционными.
NCERT Chemistry Примечания:
- NCERT Notes Class 11 Chemistry
- NCERT Notes 12 Chemistry
- NCERT Notes для всех субъектов
- 669
- NCERT Notes
Заключение :
Химическая ячейка состоит из двух серебряных электродов, погруженных в раствор(ы) электролита. Таким образом, важнейшим элементом ячейки химической науки является ионный проводник или раствор.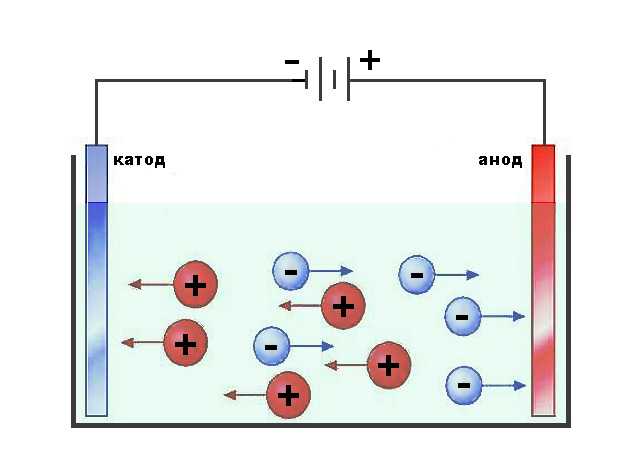 квадратная мера клеток химической науки двух разновидностей. В гальваническом элементе энергия спонтанной реакции регенерируется в ремесло, тогда как в электрическом элементе AN электричество используется для поддержания неспонтанной реакции. Обычный потенциал проводника качества} для погружения проводника в приемлемом ответе очерчен с уместностью стандартного потенциала проводника с атомным номером один проводника, принятого за ноль. Потенциал качества ячейки можно получить, различая потенциалы качества заряда катода и анода (E- = E-катод — E-заряд анода). Качественный потенциал клеток называется прямой химико-энергетической константой реакции, протекающей внутри клетки. Концентрационная зависимость потенциалов электродов, а также площади клеток определяется уравнением Вальтера Германа Нернста.
квадратная мера клеток химической науки двух разновидностей. В гальваническом элементе энергия спонтанной реакции регенерируется в ремесло, тогда как в электрическом элементе AN электричество используется для поддержания неспонтанной реакции. Обычный потенциал проводника качества} для погружения проводника в приемлемом ответе очерчен с уместностью стандартного потенциала проводника с атомным номером один проводника, принятого за ноль. Потенциал качества ячейки можно получить, различая потенциалы качества заряда катода и анода (E- = E-катод — E-заряд анода). Качественный потенциал клеток называется прямой химико-энергетической константой реакции, протекающей внутри клетки. Концентрационная зависимость потенциалов электродов, а также площади клеток определяется уравнением Вальтера Германа Нернста.
также прочитал —
- NCERT Solutions для химии класса 11
- NCERT Solutions для Chemistry
- NCERT Solutions для всех субъектов
Часто задаваемые вопросы (FAQ) — Cathode
Часто.
 Сборы, использование, заключение Вопрос: Q.1. Какова стоимость заряда анода и катода ассоциированной степени?
Сборы, использование, заключение Вопрос: Q.1. Какова стоимость заряда анода и катода ассоциированной степени?Ответ:
Анодный заряд гальванического элемента считается отрицательным, поэтому катод считается положительным. Это выглядит приемлемым, потому что заряд анода является источником электронов, и куда бы ни текли электроны, это заряд катода и анода.
Вопрос: Q.2. Как установить заряд катода и анода во время данной цепи?Ответ:
Во время работы батареи (называемой просто гальваническим элементом) заряд анода заключается в том, что проводник, из которого электроны покидают и перемещаются во внешнюю цепь. Конечно, электроны уходят с отрицательной клеммы. Следовательно, решение состоит в том, что отрицательный (-) проводник может быть обозначен как анодный заряд, тогда как положительный (+) проводник может быть указан как катод. Если на диаграмме есть какие-либо стрелки, они обозначают направление потока лептонов.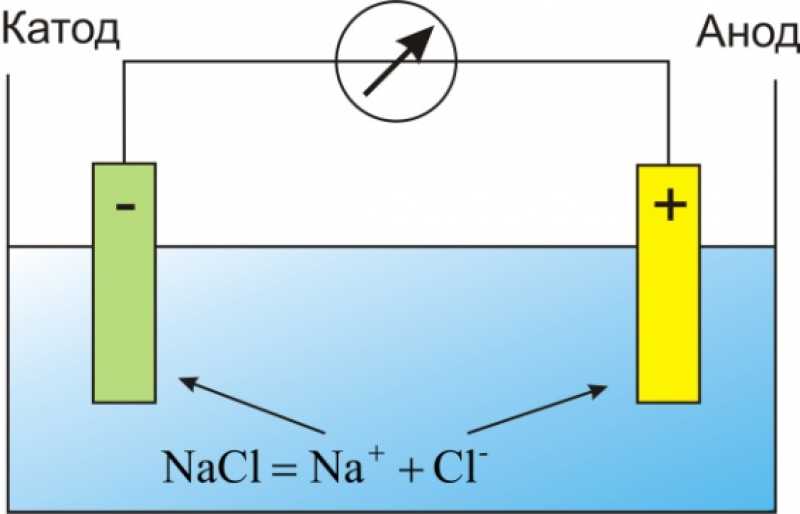 «Обычный ток», но течет в совершенно другом направлении. Анодный заряд существует везде, где стандартный ток течет в батарею.
«Обычный ток», но течет в совершенно другом направлении. Анодный заряд существует везде, где стандартный ток течет в батарею.
Ответ:
Катод может быть отрицательным проводником, тогда как заряд анода может быть положительным проводником. они сомнительны из-за того, что заряженные катионы мигрируют к отрицательному катоду. Следовательно, он называется катодом, тогда как анионы мигрируют к заряженному заряду анода, а затем называются зарядом анода. Они используются в методе гальванического покрытия везде, где заряженные ионы металла мигрируют и находят осаждение на катоде.
Вопрос: Q.4. Какой проводник: анод заряда или катод, что окислительный электрод. Почему?Ответ:
все мы знаем, что инструмент, который преобразует электричество в энергию, понимается как ассоциированная ячейка. Ячейка состоит из двух электродов, катода и анода. Один проводник заряжается, и, следовательно, заряжается другой. Эти электроды качаются разрешением раствора. Ячейка состоит из приборов с электролитическим разрешением ассоциированной степени. два металлических электрода, называемые шихтой анода и катодом, погружаются в электролитический раствор.
Один проводник заряжается, и, следовательно, заряжается другой. Эти электроды качаются разрешением раствора. Ячейка состоит из приборов с электролитическим разрешением ассоциированной степени. два металлических электрода, называемые шихтой анода и катодом, погружаются в электролитический раствор.
Катод батареи — введение, зарядка и защита_Аккумулятор Greenway
0769-27282088
Сервисный центр
Dongguan Greenway Battery Co., Ltd.
ФАКС:(+86) 769 2229 0098
粤ICP备11070025号
Эл.
Батареи представляют собой набор из одной или нескольких ячеек, чьи химические реакции в цепи генерируют поток электронов. Все батареи состоят из трех основных компонентов, и эти три компонента – это анод (сторона «-»), катод (сторона «+») и электролит (вещество, которое химически реагирует с анодом и катодом).
Если катод и анод батареи подключены к цепи, между анодом и электролитом произойдет химическая реакция. Эта реакция приводит к тому, что электроны проходят через цепь, а также возвращаются к катоду батареи, где происходит другая реакция.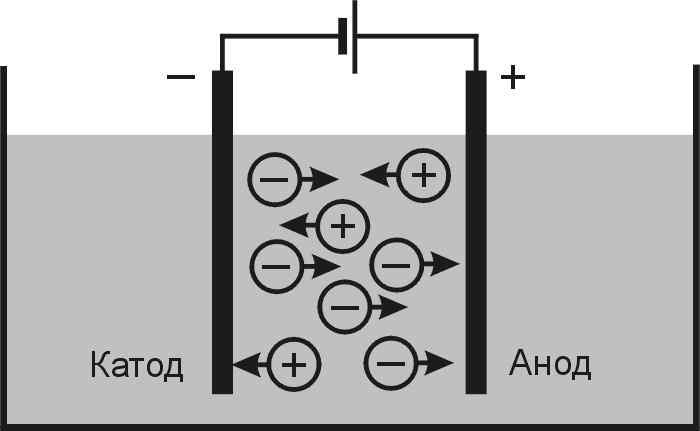 Батарея не может генерировать электричество, если вещество в катоде или аноде истощено или больше не может использоваться в реакции. В этот момент батарея считается «мертвой».
Батарея не может генерировать электричество, если вещество в катоде или аноде истощено или больше не может использоваться в реакции. В этот момент батарея считается «мертвой».
Тем не менее, вы не уверены в катоде батареи, поэтому мы сделали тяжелую работу за вас. В этой статье вы узнаете: положительный или отрицательный катод в аккумуляторе, как защитить катод аккумулятора и многое другое. Итак, мы предлагаем вам продолжить чтение и разобраться в катоде батареи.
Катод в аккумуляторе положительный или отрицательный?
Катод представляет собой отрицательно заряженный электрод. Однако, что касается анода, полярность катода может быть как отрицательной, так и положительной, и это зависит в первую очередь от функции устройства. Например, катод в перезаряжаемой батарее отрицательный. Однако в случае разрядки аккумулятора полярность катода положительная. Катод обычно представляет собой клемму, с которой ток течет из системы, а анод — это клемму, с которой ток течет внутрь извне.
Заряд на катоде в основном зависит от того, используется ли он в электрохимической ячейке или в электролитической ячейке. В гальваническом элементе (используемом для подачи тока наподобие батарей) катод заряжен положительно. Здесь положительно заряженные ионы восстанавливаются, приобретая электроны с незаряженного катода. Это приводит к тому, что катод приобретает положительный заряд. Итак, по отношению к аноду полярность катода может быть положительной или отрицательной, что полностью зависит от того, как работает устройство.?
Катод заряжен отрицательно?
Поток тока описывает катод. Как правило, ток относится к движению электрического заряда. Тем не менее, вы всегда должны помнить о том, что направление тока — это то, куда будет двигаться положительный заряд. Итак, если электроны действительно движутся в ячейке, то ток будет течь в противоположном направлении.
Катод обычно представляет собой отрицательно заряженный электрод, который притягивает положительный заряд или катионы.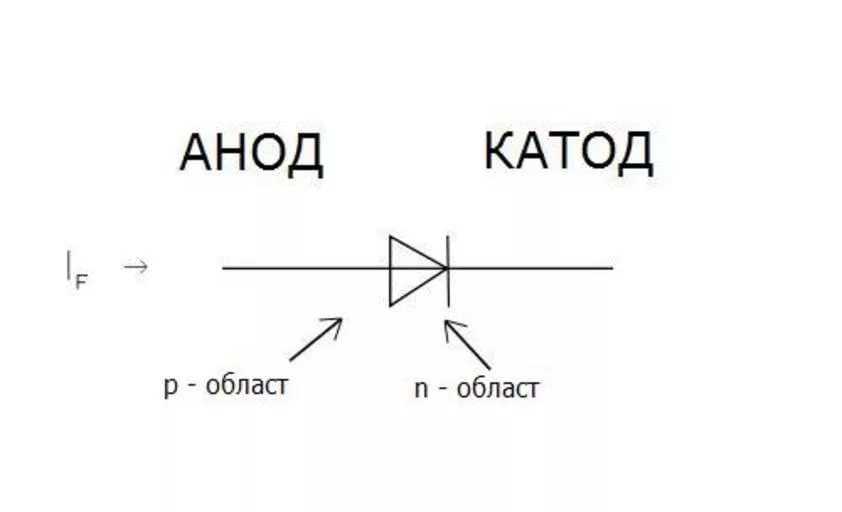 Это также источник электронов или доноров электронов, которые могут принимать положительный заряд. Поскольку катод способен генерировать электроны, можно сказать, что катоды генерируют заряд.
Это также источник электронов или доноров электронов, которые могут принимать положительный заряд. Поскольку катод способен генерировать электроны, можно сказать, что катоды генерируют заряд.
Обратите внимание, что заряд может течь как от положительного к отрицательному, так и от отрицательного к положительному! По этой причине катод может быть заряжен положительно или отрицательно. То же самое относится и к аноду.
Как защитить катод аккумулятора?
Вы ищете способы защиты катода батареи? Если да, то этот раздел поможет вам. Катодная защита является одним из самых основных и распространенных методов, который используется для защиты катода аккумулятора. Прежде чем углубляться в способы, давайте сначала разберемся, что такое катодная защита?
?Это способ защиты от коррозии подводных и подземных металлических конструкций. Многочисленные устройства, такие как транспортные средства, подводные поплавки, подводное оборудование, гавани, трубы, резервуары, практически все подводные или заглубленные металлические конструкции обычно покрываются катодной защитой.
Основные принципы катодной защиты
Процесс основан на преобразовании активных участков поверхности металла в пассивные. При подаче тока потенциал металла снижается, коррозионное воздействие прекращается, и таким образом осуществляется катодная защита. Катодную защиту можно получить одним из следующих способов:
● Катодная защита с расходным анодом
● Катодная защита с импульсным током
Давайте подробно и точно рассмотрим оба этих метода:-
Катодная защита с расходным анодом
который должен быть защищен другим более легко подвергающимся коррозии металлом, который будет служить анодом. Цинк, алюминий и магний — это металлы, которые чаще всего используются в качестве анодов.
Более активный металл становится анодом для других (который также является наименее благородным), он жертвует собой, чтобы защитить катод, подвергаясь коррозии (отказу от металла). Поэтому здесь используется термин расходуемый анод.
Поскольку управляющее напряжение расходуемых анодов ниже, чем у анодов с подаваемым током, расходуемые аноды должны быть хорошо рассредоточены и размещены ближе к защищаемой области. ?
?
Из-за разности потенциалов между катодной и анодной областью положительно заряженные ионы металла покидают поверхность анода, а электроны, наоборот, покидают поверхность катода.
Катодная защита импульсным током (ICCP)
Для катодной защиты в системах ICCP используется внешняя форма электропитания, которая также называется панелью управления. Панель управления предлагает ток, необходимый для поляризации защищаемой поверхности.
Защитный ток передается через специально разработанные инертные аноды, обычно представляющие собой форму проводящего материала, который не растворяется легко в металлические ионы, а скорее поддерживает альтернативные анодные реакции.
Последние несколько слов:
Вот и все на катоде аккумулятора – зарядка и защита. Как видите, катод батареи может быть довольно запутанным для понимания. Не так ли? Мы надеемся, что благодаря этой подробной и исчерпывающей статье вы лучше поняли катод аккумулятора, его защиту и многое другое.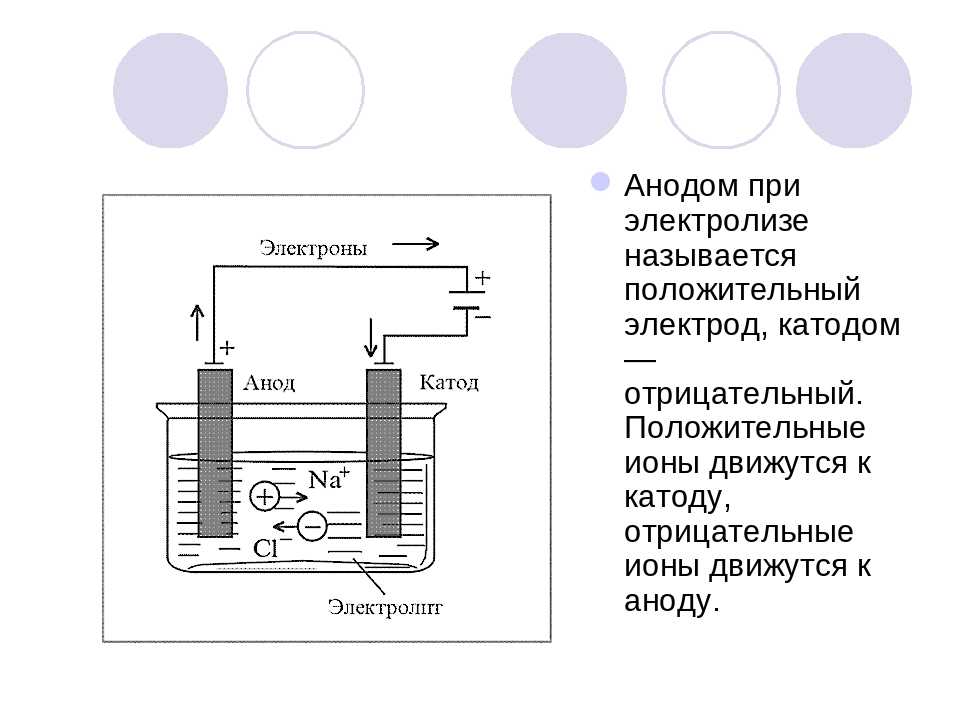


 И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.
И. Теоретическая электрохимия : Учеб. для хим.-технолог. спец. вузов. — 4-е изд., перераб. и доп. — М. : Высш. шк., 1984. — С. 13.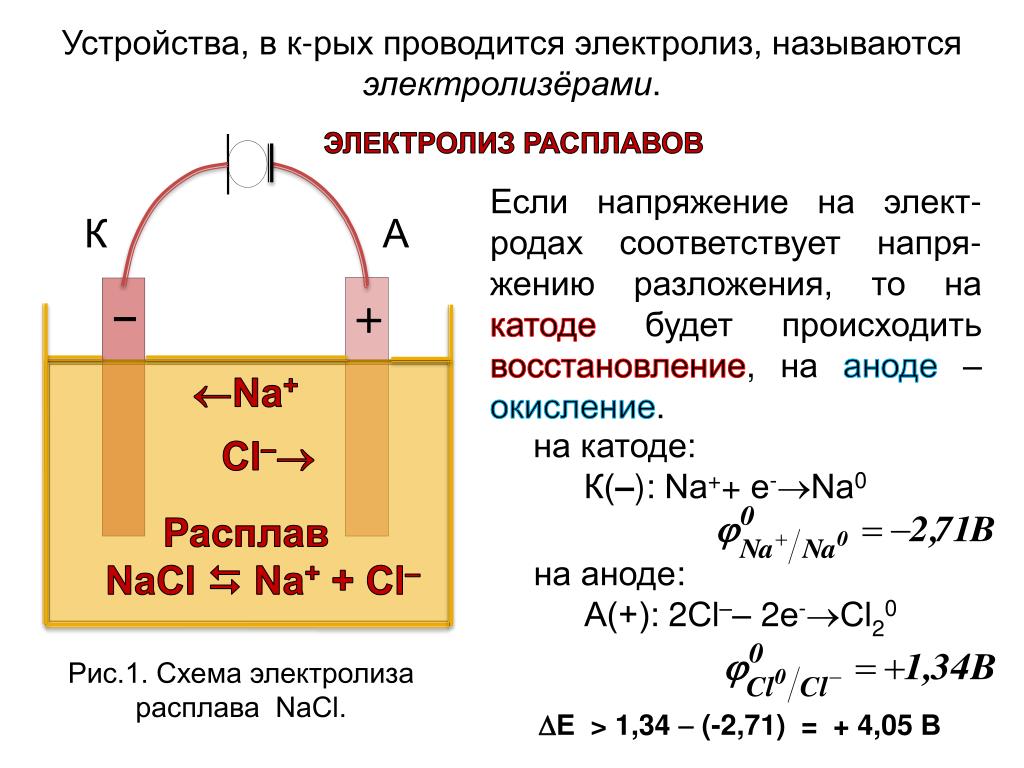 Электролит
Электролит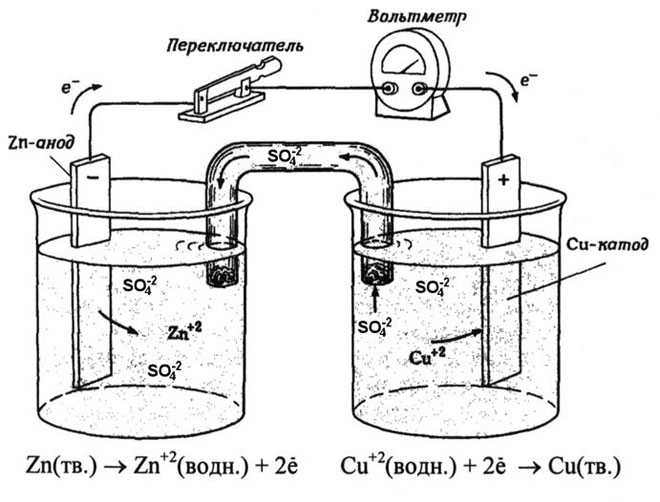 ) + E — -> Li (s)
) + E — -> Li (s) В гальваническом элементе анод — это электрод, на котором происходит реакция окисления. Анод — это также проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство».Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь. В гальваническом элементе анод — это электрод, на котором происходит реакция окисления. Анод — это также проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду.
В гальваническом элементе анод — это электрод, на котором происходит реакция окисления. Анод — это также проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство».Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь. В гальваническом элементе анод — это электрод, на котором происходит реакция окисления. Анод — это также проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство.Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь. В гальваническом элементе анод — это электрод, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд.Следовательно, анионы будут стремиться двигаться к аноду. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство.
Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство.Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь. В гальваническом элементе анод — это электрод, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд.Следовательно, анионы будут стремиться двигаться к аноду. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство.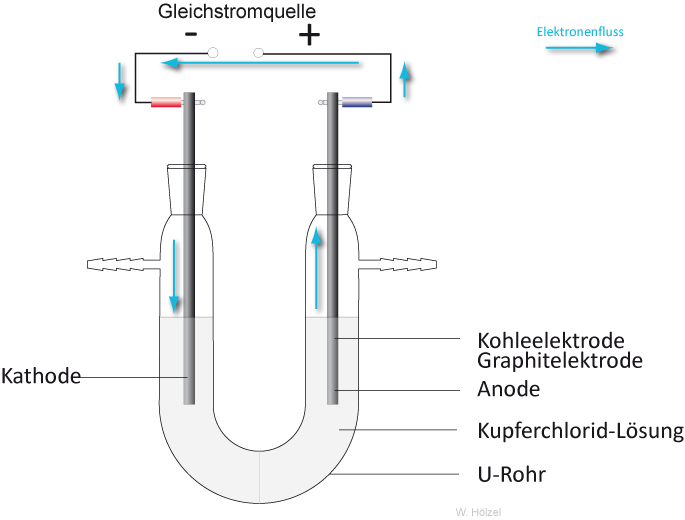 Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь.В гальваническом элементе анод — это электрод, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство.Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь.
Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь.В гальваническом элементе анод — это электрод, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство.Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь.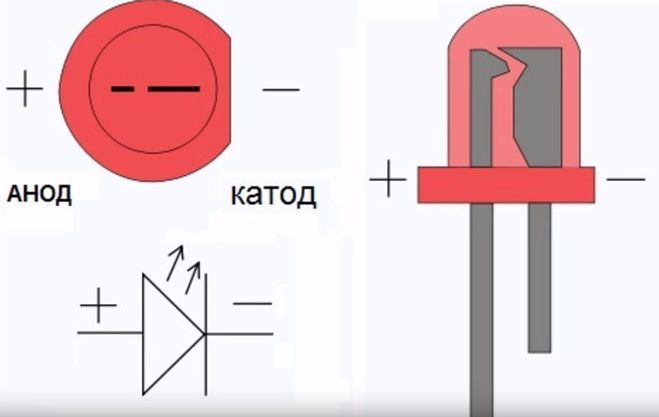 В электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению.Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь.Как в гальванической ячейке, так и в электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд.
В электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению.Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь.Как в гальванической ячейке, так и в электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство.Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь. Как в гальванической ячейке, так и в электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению.Исторически анод также был известен как цинкод.
Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство.Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю цепь. Как в гальванической ячейке, так и в электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению.Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю / внешнюю цепь, подключенную к элементу.Как в гальванической ячейке, так и в электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство.
Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство. Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю / внешнюю цепь, подключенную к элементу.Как в гальванической ячейке, так и в электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд. Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению. Исторически анод также был известен как цинкод. Анод — это электрод, через который обычный ток поступает в поляризованное электрическое устройство. Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство.Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю или внешнюю цепь, подключенную к элементу. Как в гальванической ячейке, так и в электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд.Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению. Исторически анод также был известен как цинкод.
Это контрастирует с катодом, электродом, через который обычный ток покидает электрическое устройство.Распространенным мнемоническим символом является КИСЛОТА, что означает «ток анода в устройство». Направление обычного тока (поток положительных зарядов) в цепи противоположно направлению потока электронов, поэтому (отрицательно заряженные) электроны вытекают из анода гальванического элемента во внешнюю или внешнюю цепь, подключенную к элементу. Как в гальванической ячейке, так и в электролитической ячейке анод является электродом, на котором происходит реакция окисления. В электролитической ячейке анод — это проволока или пластина, имеющая избыточный положительный заряд.Следовательно, анионы будут стремиться двигаться к аноду, где они могут подвергнуться окислению. Исторически анод также был известен как цинкод.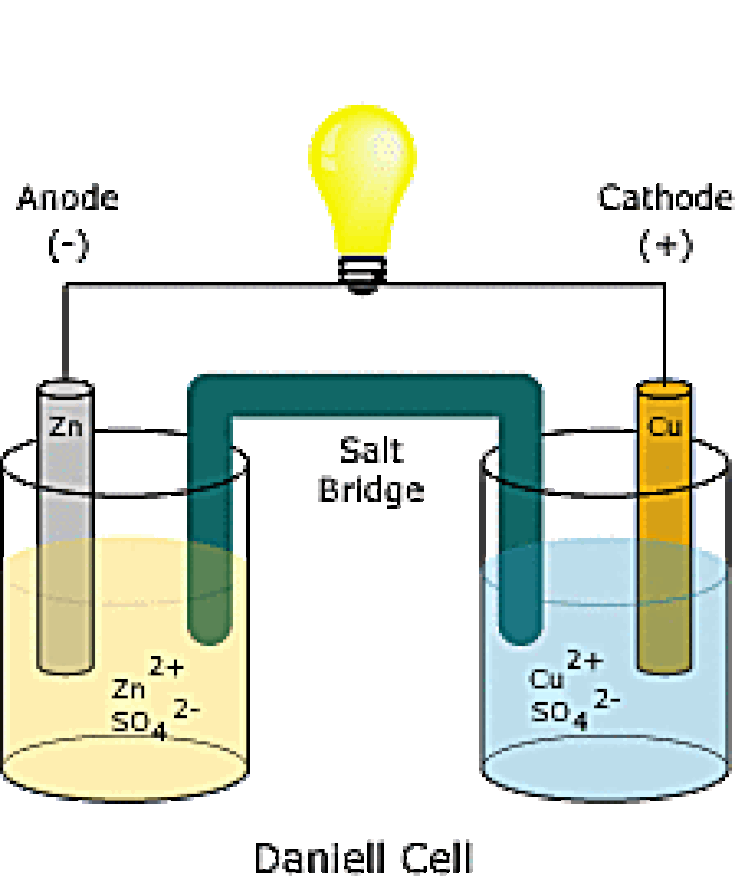 eere.energy.gov/solar/solar_glossary.html
eere.energy.gov/solar/solar_glossary.html
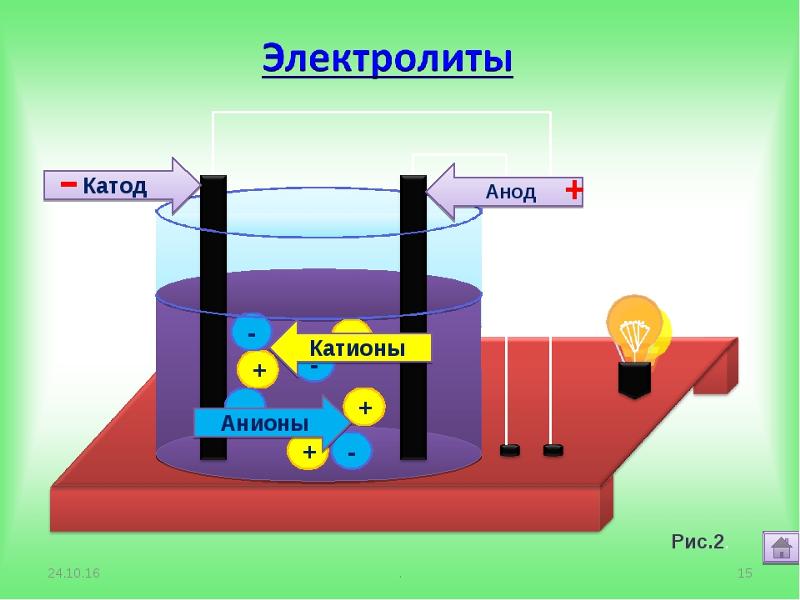 Если ионы неподвижны, как в твердой соли, то электролиз не может происходить.
Если ионы неподвижны, как в твердой соли, то электролиз не может происходить.
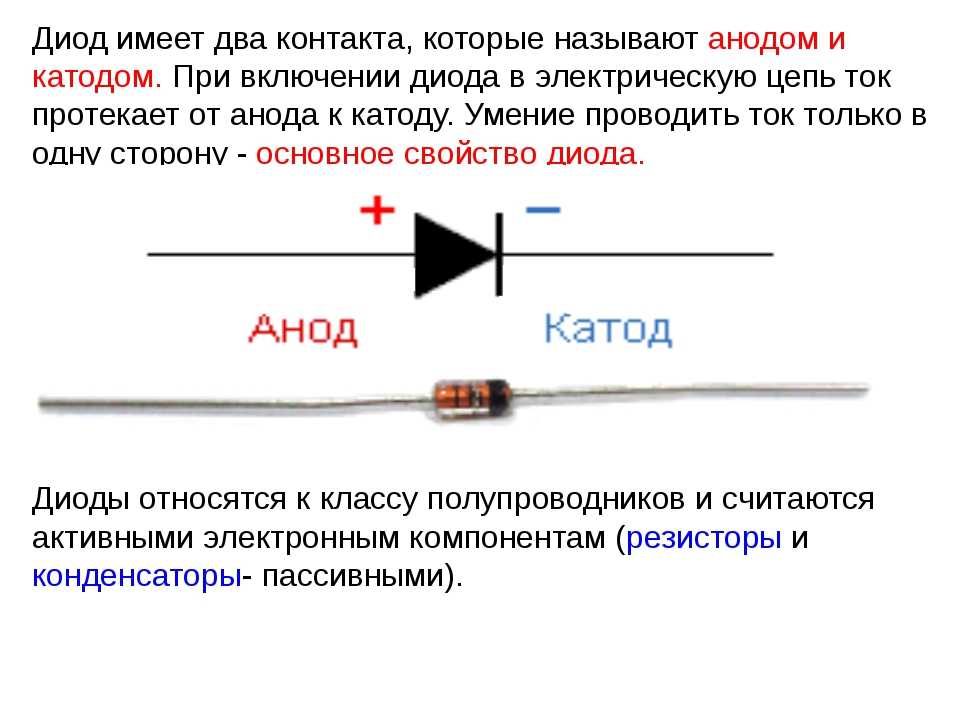
 -} = 1184 \ \ text {Coulombs} [/ latex]
-} = 1184 \ \ text {Coulombs} [/ latex]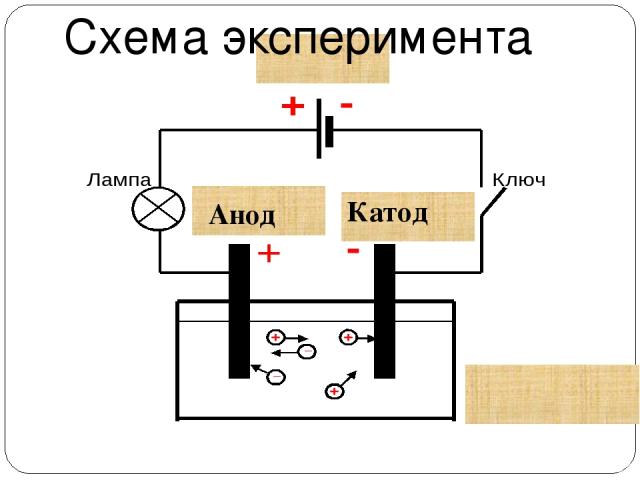 org.
org. д. — относится ваша жалоба;
д. — относится ваша жалоба; Если на то пошло, почему он крутится?
Если на то пошло, почему он крутится?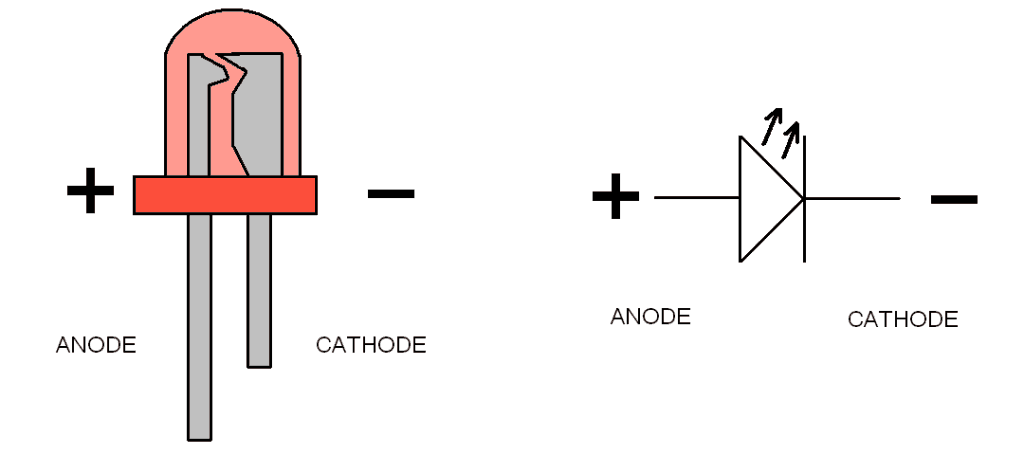 «An» означает, что отрицательно заряженные и отрицательно заряженные частицы направляются к аноду. Это означает, что катод заряжен отрицательно, а анод — положительно.
«An» означает, что отрицательно заряженные и отрицательно заряженные частицы направляются к аноду. Это означает, что катод заряжен отрицательно, а анод — положительно.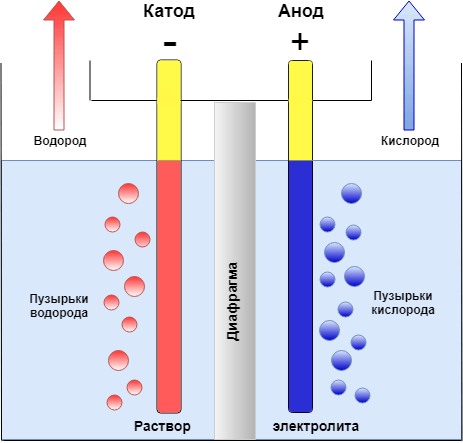
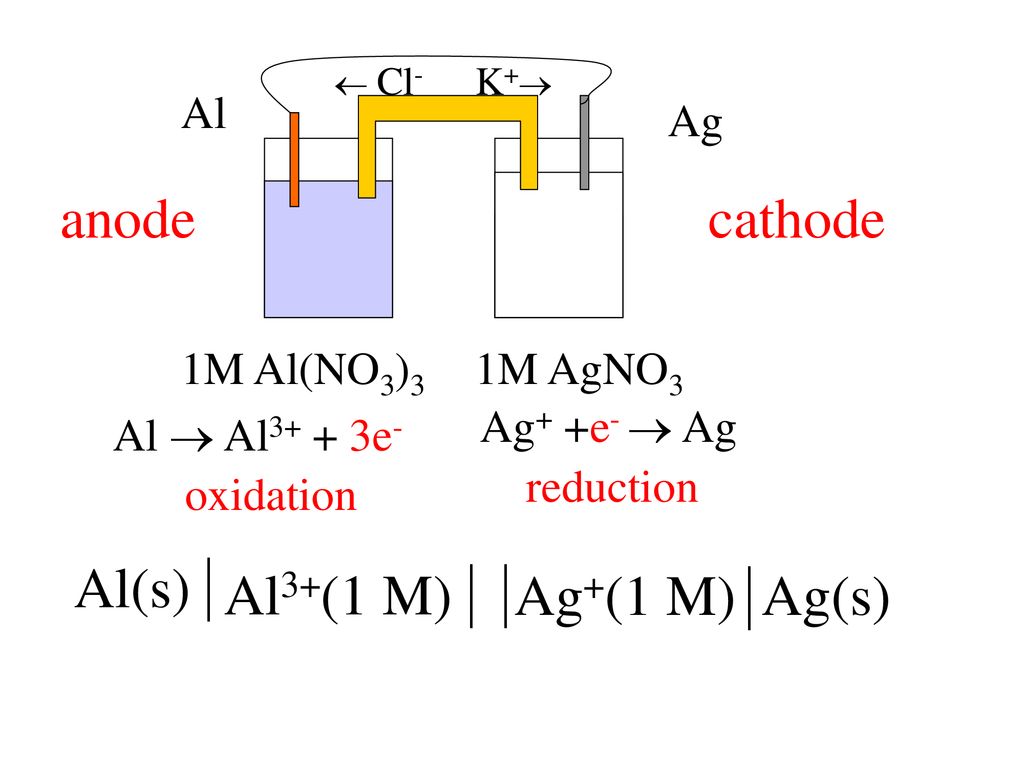 На самом деле это еще не все, но без фотографий я не могу вам показать.
На самом деле это еще не все, но без фотографий я не могу вам показать. Мы не можем контролировать направление полученных фотонов, поэтому они будут способствовать запотеванию пленки, а не первичному лучу.Мы бы хотели убрать их из поля зрения (без каламбура). Встраивание мишени в графит с низким числом Z помогает гарантировать, что полученные в результате расфокусированные фотоны имеют низкую энергию и будут поглощены корпусом трубки задолго до того, как они увидят пленку ниже.
Мы не можем контролировать направление полученных фотонов, поэтому они будут способствовать запотеванию пленки, а не первичному лучу.Мы бы хотели убрать их из поля зрения (без каламбура). Встраивание мишени в графит с низким числом Z помогает гарантировать, что полученные в результате расфокусированные фотоны имеют низкую энергию и будут поглощены корпусом трубки задолго до того, как они увидят пленку ниже.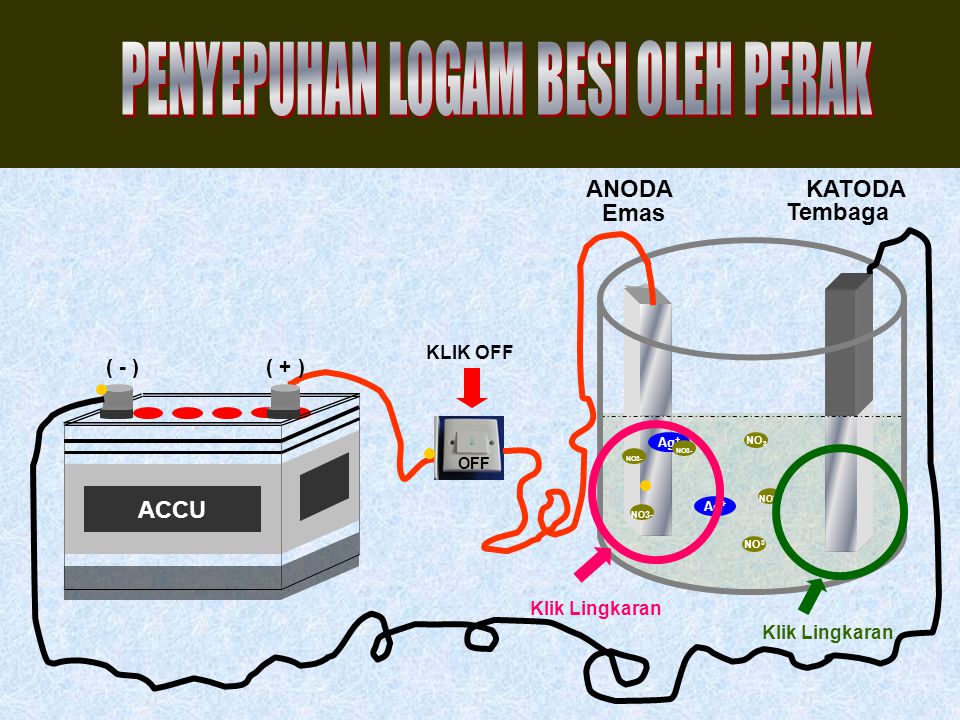 Следующая наиболее вероятная причина неисправности — это перегретые анодные подшипники. Жужжание анода просто звучит забавно или вообще не звучит. Без вращения поверхность анода будет ямиться, и луч не будет надежно соответствовать настройкам kvp.
Следующая наиболее вероятная причина неисправности — это перегретые анодные подшипники. Жужжание анода просто звучит забавно или вообще не звучит. Без вращения поверхность анода будет ямиться, и луч не будет надежно соответствовать настройкам kvp.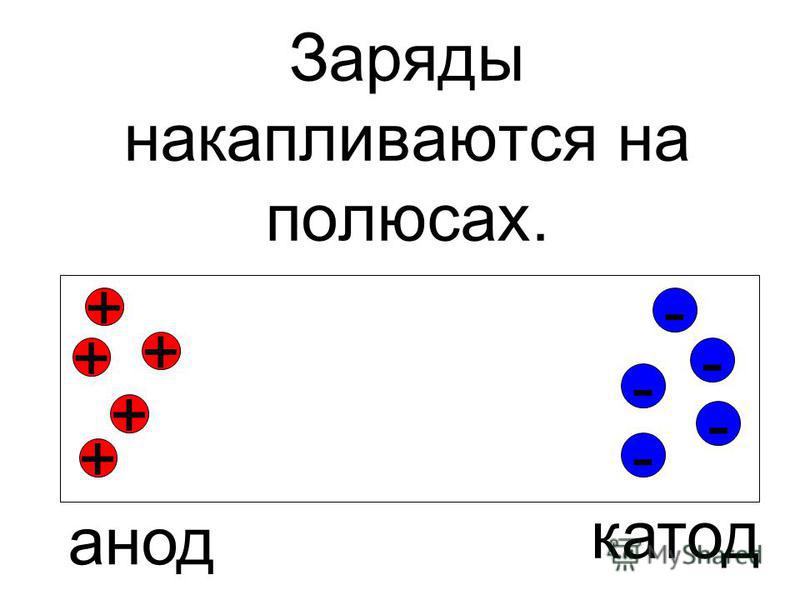

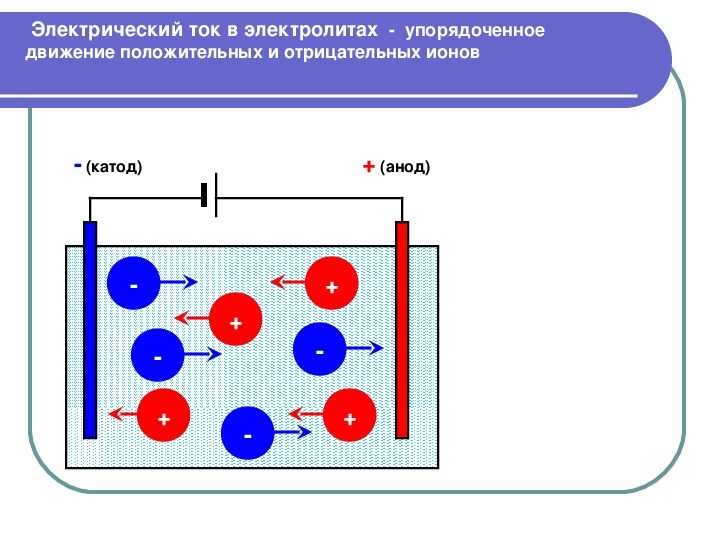
 Они выполняют функции выпрямителей, такой вариант чаще всего используется в автомобильных генераторах, поскольку внедрение подобных мостов, а также использование вместе с ними щеточно-коллекторных узлов, позволило в значительной степени сократить размеры данного устройства и увеличить степень его надежности. Если соединение выполнено последовательно и в одну сторону, то это повышает минимальные показатели напряжения, которое потребуется для отпирания всего диодного моста.
Они выполняют функции выпрямителей, такой вариант чаще всего используется в автомобильных генераторах, поскольку внедрение подобных мостов, а также использование вместе с ними щеточно-коллекторных узлов, позволило в значительной степени сократить размеры данного устройства и увеличить степень его надежности. Если соединение выполнено последовательно и в одну сторону, то это повышает минимальные показатели напряжения, которое потребуется для отпирания всего диодного моста. Для обеспечения безопасности схем от возникающих перегрузок, применяется цепочка, состоящая из нескольких диодов, имеющих подключение к питающим шинам в обратном направлении. При этом, вход, которому обеспечивается защита, должен подключаться к середине этой цепочки. Во время обычного функционирования схемы, все диоды находятся в закрытом состоянии, но если ими было зафиксировано, что потенциал входа ушел за допустимые пределы напряжения, происходит активация одного из защитных элементов. Благодаря этому, данный допустимый потенциал получает ограничение в рамках допустимого питающего напряжения в сумме с прямым падением показателей напряжение на защитном приборе.
Для обеспечения безопасности схем от возникающих перегрузок, применяется цепочка, состоящая из нескольких диодов, имеющих подключение к питающим шинам в обратном направлении. При этом, вход, которому обеспечивается защита, должен подключаться к середине этой цепочки. Во время обычного функционирования схемы, все диоды находятся в закрытом состоянии, но если ими было зафиксировано, что потенциал входа ушел за допустимые пределы напряжения, происходит активация одного из защитных элементов. Благодаря этому, данный допустимый потенциал получает ограничение в рамках допустимого питающего напряжения в сумме с прямым падением показателей напряжение на защитном приборе.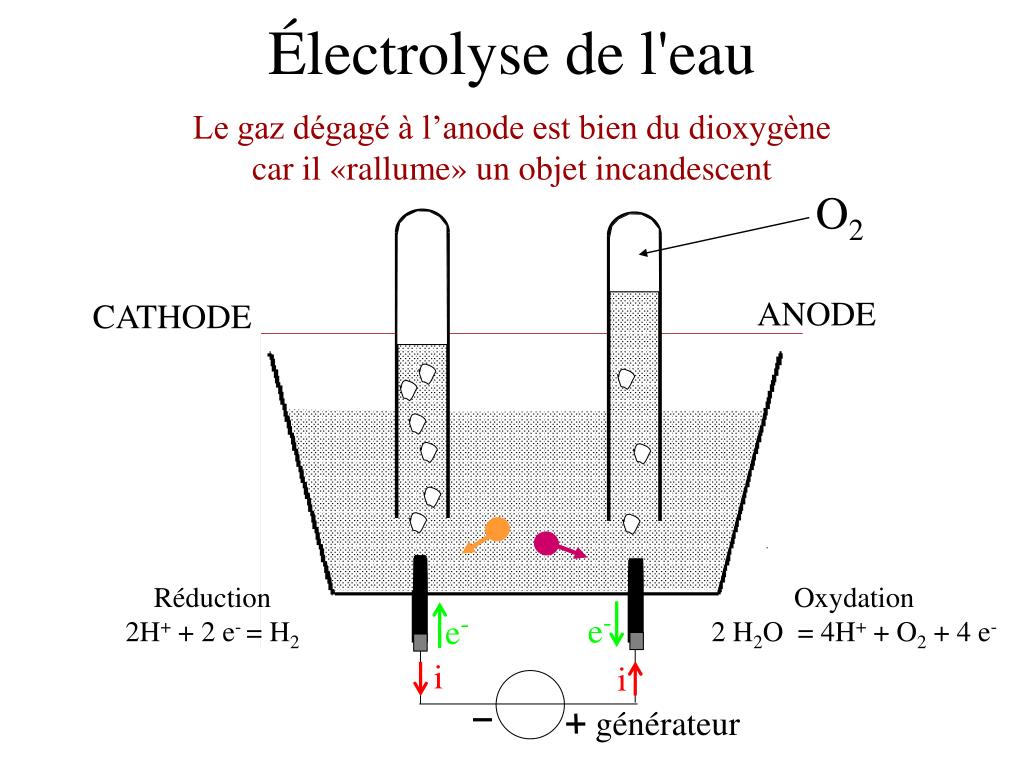 Используются шунт-диодные барьеры, которые обеспечивают безопасность путем ограничения напряжения в соответствующей электрической цепи. В совокупности с ними применяются токоограничительные резисторы, которые необходимы для ограничения показателей электрического тока, проходящего через сеть, и увеличения степени защиты.
Используются шунт-диодные барьеры, которые обеспечивают безопасность путем ограничения напряжения в соответствующей электрической цепи. В совокупности с ними применяются токоограничительные резисторы, которые необходимы для ограничения показателей электрического тока, проходящего через сеть, и увеличения степени защиты. Знаем ли мы, что такое анод
Знаем ли мы, что такое анод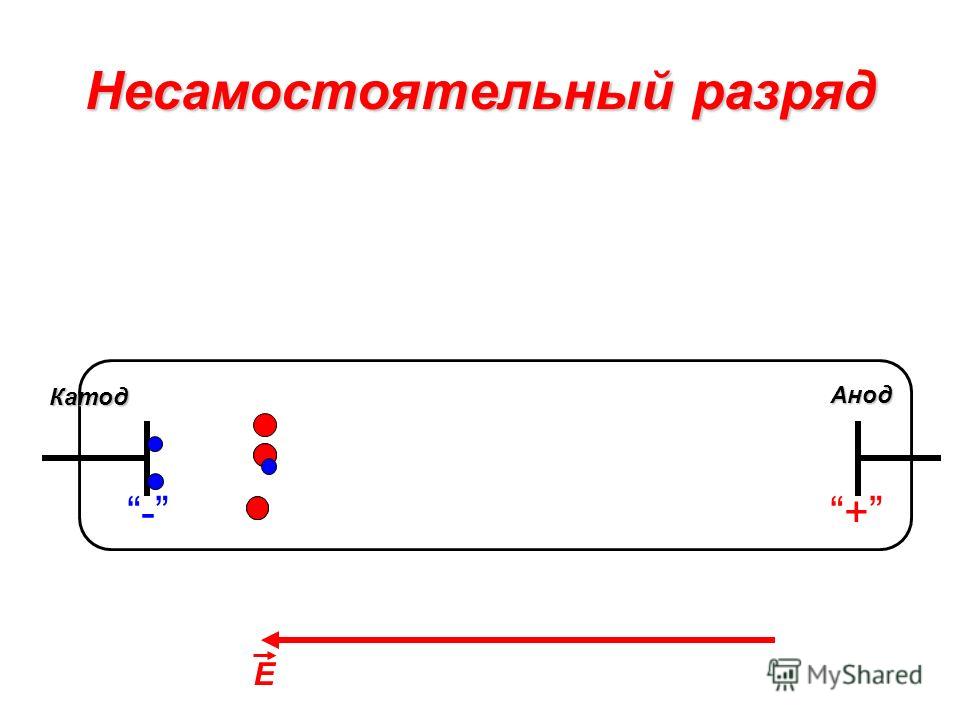 Анодный заряд электродов может нести другой.
Анодный заряд электродов может нести другой. Альтернативные виды потеряли бы электроны, сделав этот проводник связанным с накоплением негатронов. Таким образом, заряд анода заряжается. Но, в отличие от катода, реакция дисконта возникает везде, где восстановленные виды приобретают электроны. Следовательно, в проводнике, который предполагает катод, отсутствуют электроны, и поэтому он заряжен абсолютно.
Альтернативные виды потеряли бы электроны, сделав этот проводник связанным с накоплением негатронов. Таким образом, заряд анода заряжается. Но, в отличие от катода, реакция дисконта возникает везде, где восстановленные виды приобретают электроны. Следовательно, в проводнике, который предполагает катод, отсутствуют электроны, и поэтому он заряжен абсолютно.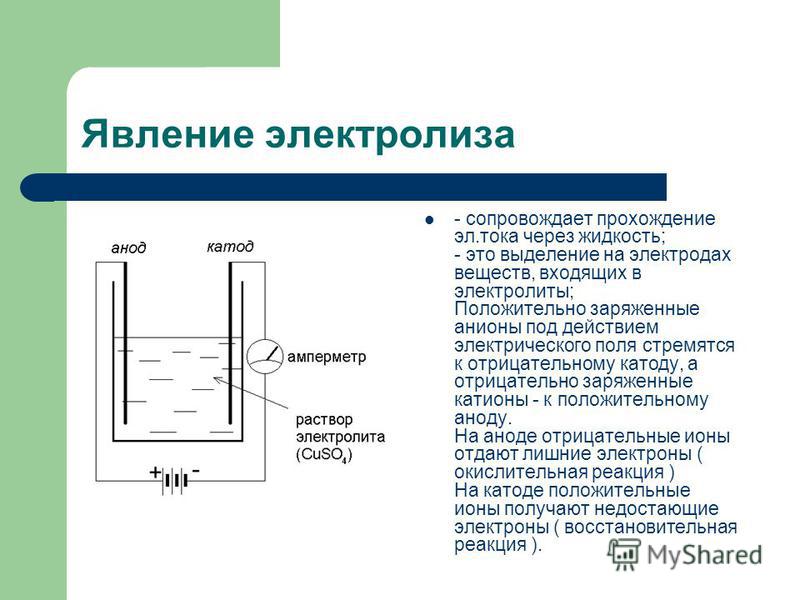 Следует отметить, что несколько батарей вместе с традиционными.
Следует отметить, что несколько батарей вместе с традиционными.