Где у аккумулятора анод и где катод? На плюсе или на минусе?
Где у аккумулятора анод и где катод — на плюсе или на минусе?
И в сети, и в литературе, и в головах достаточно путаницы с терминами анод и катод применительно к аккумуляторам. В различных описаниях химических процессов аккумулятора положительный и отрицательный электроды называют то анодом, то катодом. В чём тут дело?
Первое, что приходит в голову — мнемоническое правило из школьного курса: анод — плюс (оба слова из 4 букв), катод — минус (оба слова из 5 букв).
Плюсовая и минусовая клеммы на аккумуляторе обозначены чётко. Вот, казалось бы, и простой ответ: анод – положительная клемма, катод – отрицательная.
Но, как говорится, в действительности все иначе, чем на самом деле😊.
Попробуем разложить все по полочкам.
Сначала разберемся с тем, что проще — со знаками плюс и минус.Аккумулятор имеет 2 электрода в виде пластин и присоединенных к ним клемм. Потенциал одного электрода выше, другого ниже. ЭДС и напряжение аккумулятора как раз и обусловлено разностью этих потенциалов.
Потенциал одного электрода выше, другого ниже. ЭДС и напряжение аккумулятора как раз и обусловлено разностью этих потенциалов.
При разряде разность потенциалов уменьшается, при заряде – увеличивается. Потенциалы электродов меняют в определенных пределах свою величину. Величину, но не знак — плюс и минус выгравированы на батарее насовсем. Да электроды и физически отличаются, активная масса пластин состоит из разных материалов. Отрицательные пластины сделаны из свинца, а положительные – из оксида свинца.
Полярность, т.е. расположение клемм относительно корпуса – один из важных параметров выбора аккумуляторной батареи.
Справедливости ради отметим, что в аккумуляторном мире есть понятие «переполюсовка». Но эта отдельная тема сильно выходит за рамки обычной эксплуатации в область экспериментов и шаманства. В обычном цикле зарядов-разрядов аккумулятора даже у очень невнимательного автолюбителя никакой переполюсовки не произойдёт.
Итак, расположение плюса и минуса на аккумуляторе фиксировано.
В электрохимии анод — это электрод, на котором происходит окисление, т.е. отдача электронов. Сам анод при этом называется восстановителем.
На катоде происходит восстановление, поглощение электронов, а сам он является окислителем.
Анод отдает электроны, а катод принимает.
То есть понятия анод и катод, вопреки мнемоническим правилам, не связаны напрямую со знаком, с положительным или отрицательным потенциалом!
Идем дальше. Аккумулятор работает в одном из двух режимов: разряда (является источником тока) или заряда (потребляет ток). При изменении режима направление тока меняется на противоположное. Соответственно, каждый электрод то отдает электроны, то принимает.
У аккумулятора анод и катод меняются местами в зависимости от режима работы (заряд или разряд).
Теперь понятно, почему понятия анода и катода в электрохимии и электротехнике несколько различаются.
У полупроводниковых приборов типа диода и транзистора, в отличие от аккумулятора, анод и катод имеют фиксированное раз и навсегда положение. С ними действительно можно использовать правила запоминания.
Каков общий вывод?
При разряде аккумулятора положительный электрод является катодом, отрицательный – анодом.При заряде – наоборот.Во избежание недоразумений, для аккумуляторных батарей лучше использовать термины положительная и отрицательная пластина (клемма, электрод).
Понятия анод и катод надо применять с указанием режима аккумулятора. Делайте это аккуратно, только если решили копнуть поглубже и блеснуть теоретическими познаниями 😊.
Напоследок – выдержка из нормативного документа.
ГОСТ 15596-82. Источники тока химические. Термины и определения| 15. Анод химического источника тока | Электрод химического источника тока, на котором протекают окислительные процессы |
16. Катод химического источника тока Катод химического источника тока | Электрод химического источника тока, на котором протекают восстановительные процессы |
| 17. Отрицательный электрод химического источника тока | Электрод, который при разряде химического источника тока является анодом |
| 18. Положительный электрод химического источника тока | Электрод, который при разряде химического источника тока является катодом |
Композиционный материал из графена и дисульфида ванадия повысит емкость и скорость заряда литий-ионных батарей — Русский
Композиционный материал из графена и дисульфида ванадия повысит емкость и скорость заряда литий-ионных батарей Ученые из Института физики им. Л.В. Киренского ФИЦ КНЦ СО РАН совместно с коллегами из СФУ и Национального исследовательского технологического университета «МИСиС» предложили использовать соединение графена с монослоем дисульфидом ванадия в качестве анодного материала для литий-ионных батарей.
Ученые из Института физики им. Л.В. Киренского ФИЦ КНЦ СО РАН совместно с коллегами из СФУ и Национального исследовательского технологического университета «МИСиС» предложили использовать соединение графена с монослоем дисульфидом ванадия в качестве анодного материала для литий-ионных батарей. Благодаря этому повысятся емкость, максимальная скорость заряда-разряда элементов питания.
Сегодня литий-ионные аккумуляторы – это наиболее популярный источник питания для многих устройств, начиная от мобильных телефонов и заканчивая электромобилями.
Физическая основа литий-ионного аккумулятора – два электрода, анод (плюс) и катод (минус), разделенные пористым полимерным материалом. Во время зарядки, электрический ток перемещает ионы лития от катода к аноду, а во время работы батареи, ионы движутся обратно. Когда батарея «умирает», возможность для перемещения ионов лития между электродами снижается. Именно поэтому спустя несколько месяцев после покупки смартфон необходимо заряжать гораздо чаще, чем первоначально.
Оказывается, продлить срок службы элемента питания возможно с помощью графена – это уникальный двумерный материал, за открытие которого в 2010 году была вручена Нобелевская премия. Он обладает высокой удельной поверхностью, хорошей электропроводностью и упругостью. Предполагается, что графен может найти широкое применение в разных областях промышленности, в том числе в устройствах, сохраняющих энергию.
Предполагается, что графен может найти широкое применение в разных областях промышленности, в том числе в устройствах, сохраняющих энергию.
Исследователи из Красноярска и Москвы предложили использовать в качестве анодного материала для литий-ионных батарей двухслойную гетероструктуру состоящую из монослоев дисульфида ванадия и графена.
«Предложенный композит представляет собой двухмерную структуру из двух разнородных слоев – графена и дисульфида ванадия. Толщина такой пластины составляет порядка одного нанометра. Мы показали, что ионы лития могу связываться не только на поверхности такого материала, но и в межслоевом пространстве, что в конечном итоге приводит к его высокой удельной емкости», — пояснил младший научный сотрудник лаборатории физики магнитных явлений Института физики им. Л.В. Киренского ФИЦ КНЦ СО РАН Максим Высотин
Ученые подсчитали, что возможная емкость такого композита составит 569 мАч на один грамм анодного материала, это почти в два раза выше, чем у графита – наиболее часто используемого анода в современных литий-ионных батареях. Теоретические расчеты показали – соединение графена и ванадия обеспечивает как хороший перенос электронов, так и механическое упрочнение материала.
Теоретические расчеты показали – соединение графена и ванадия обеспечивает как хороший перенос электронов, так и механическое упрочнение материала.
«Ключевой особенностью композита, помимо емкости, является высокая подвижность ионов лития внутри. Это позволяет быстро заряжать аккумулятор или питать от него устройства повышенной мощности. Также, высокая подвижности ионов позволяет надеяться на хорошую работу аккумуляторов при низкой температуре
В ходе работы, исследователи обнаружили еще одну важную особенность – сохранение уникальных электронных свойств графена в композите, даже после заполнения его литием. Возможно, этот эффект откроет новые возможности для управления свойствами наноматериалов на основе графена, предполагают ученые.
Исследование посвящено памяти кандидата физико-математических наук Кузубова Александра Александровича (1974-2016).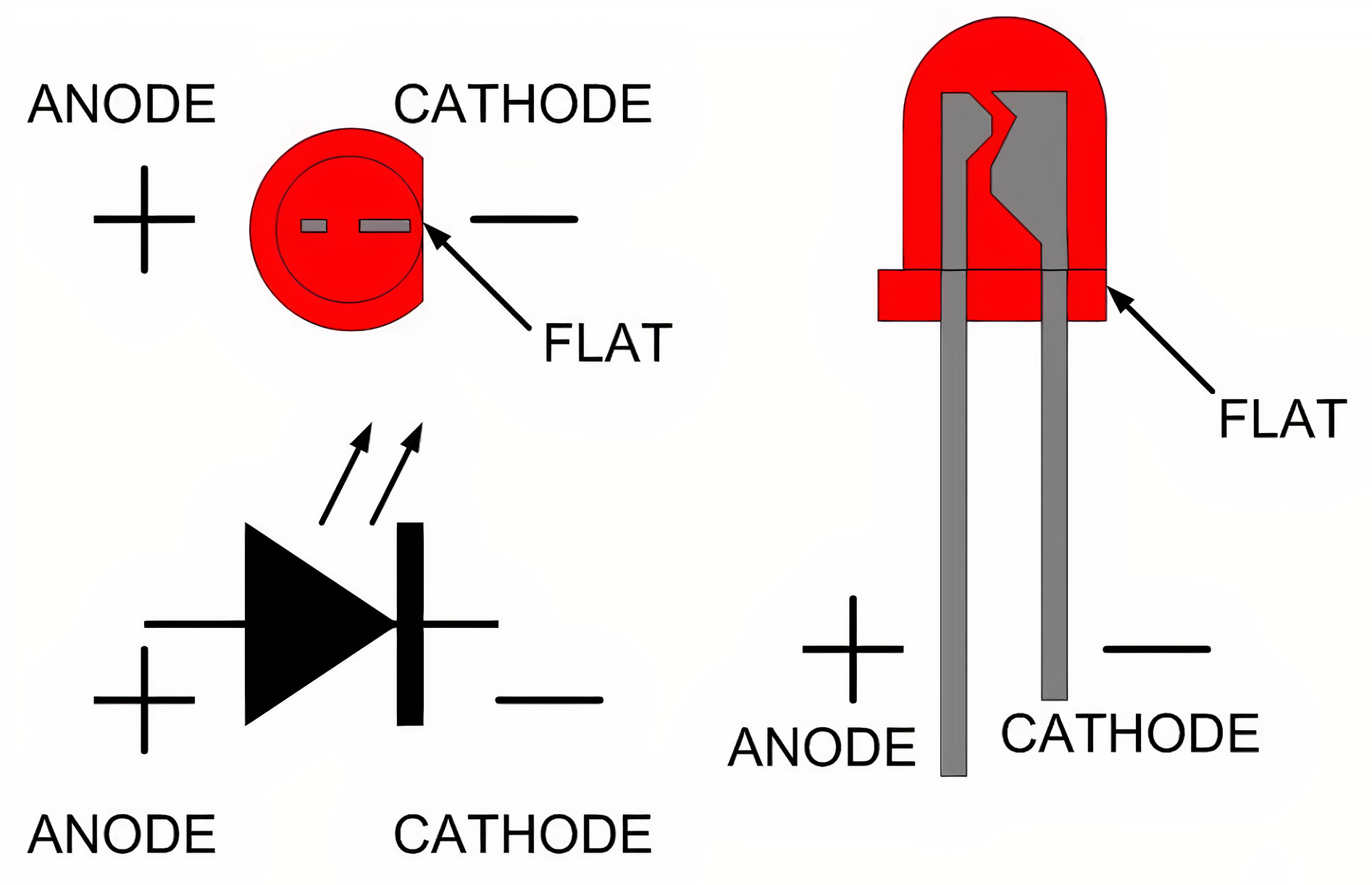
Автор публикации Екатерина Бурчевская
электрохимия — действительно ли анод всегда отрицателен?
$\begingroup$Отказ от ответственности: этот вопрос задан студентом-физиком.
Я изучал электростатику и мне было интересно, как зарядить проводник в домашних условиях без всяких навороченных мехов и т.д. И тут мне пришла идея: взять батарейку, коснуться, например, минусовой клеммы проводником, а затем снять ее. Так как минусовая клемма аккумулятора находится под отрицательным потенциалом, а проводник ранее был заземлен ($V = 0$), то поскольку их потенциалы должны сравняться, это означает, что электроны будут течь от клеммы аккумулятора к проводнику в течение короткого промежутка времени. . После этого я отсоединяю проводник, и электроны остаются в нем «в ловушке», поэтому проводник теперь заряжен отрицательно. 9Ионы {2+}$ переходят в раствор, но в тот же момент остальные электроны покидают анод.
Когда подключены электроды , а не , я не уверен, что будут происходить окислительно-восстановительные реакции. В моем понимании, $Zn$ окисляется, потому что $Cu$ с другой стороны имеет большее сродство к электрону, но $Zn$ должен был бы каким-то образом «почувствовать» $Cu$ с другой стороны, иначе реакция окисления все равно произойдет для короткое время, пока не достигнет некоторой точки равновесия. Это то, что я думаю, на самом деле происходит, и поэтому анод на самом деле будет отрицательным, пока не будет подключен к катоду.
В моем понимании, $Zn$ окисляется, потому что $Cu$ с другой стороны имеет большее сродство к электрону, но $Zn$ должен был бы каким-то образом «почувствовать» $Cu$ с другой стороны, иначе реакция окисления все равно произойдет для короткое время, пока не достигнет некоторой точки равновесия. Это то, что я думаю, на самом деле происходит, и поэтому анод на самом деле будет отрицательным, пока не будет подключен к катоду.
Значит, я на правильном пути и, в конце концов, увенчается ли успехом моя попытка немного зарядить проводник?
- электрохимия
- редокс
Это очень хороший вопрос от студента, который, кажется, глубоко задумался. Я думал написать на эту тему последние 7-8 лет. Короче говоря, полюса батарей заряжены электростатически, и этот заряд действительно можно «ощутить» с помощью чувствительных электроскопов, которые были известны во времена Вольта.
Метка анода или катода не определяется по отношению к электростатическому знаку, как объяснено в сообщении Мориса.
Представьте себе большой параллельный конденсатор. Подсоедините одну клемму пластины к одной положительной клемме, а другую к отрицательной клемме. Пластины конденсатора будут иметь электростатический заряд.
Во что бы то ни стало, используя одну-единственную ячейку, вы не сможете обнаружить электростатический заряд, как заряженную расческу. Это могут почувствовать только специализированные электроскопы. 9Ионы {2+}$: Медь является анодом.
При сравнении одного и того же химического уравнения, работающего в гальваническом элементе или в электролизе, $Zn$ равно всегда отрицательному полюсу, а $Cu$ равно всегда положительному полюсу. Знаки ПЛЮС (+) или МИНУС (-) могут быть напечатаны на табличках. Но Zn является анодом в гальваническом элементе и становится катодом в системе электролиза.
Итак, вы видите, что анод не всегда отрицательный. Анод — это отрицательный полюс (Zn) гальванического элемента. Анод является положительным полюсом (Cu) в электролизе.
Анод — это отрицательный полюс (Zn) гальванического элемента. Анод является положительным полюсом (Cu) в электролизе.
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google Зарегистрироваться через Facebook Зарегистрируйтесь, используя электронную почту и парольОпубликовать как гость
Электронная почтаТребуется, но никогда не отображается
Опубликовать как гость
Электронная почтаТребуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
физическая химия — Полуэлементы: разница между E(элемент) = E(катод}-E(анод) и E(элемент) = E(окисление) + E(восстановление)
Во-первых, запомните следующие правила:
| тип ячейки | пример | Где происходит окисление? | Где происходит редукция? |
|---|---|---|---|
| гальванический элемент | аккумулятор | минусовой полюс, анод | плюс полюс, катод |
| электролизер | электролиз воды | плюс полюс, анод | минусовой полюс, катод |
Свободная энергия Гиббса
Начнем с термодинамики: изменение свободной энергии Гиббса $\Delta G$ химической реакции говорит вам, может ли реакция протекать без использования внешней энергии:
- Если $\ Дельта G < 0$, химическая реакция является экзэргонической , что означает, что она может протекать, не требуя внешней энергии (она высвобождает энергию в систему вокруг себя) 9{2+}//Cu} = — 2\cdot 96485 \frac{\rm C}{\rm mol} \cdot (+ 0,34\{\rm V}) \приблизительно -65,6 \frac{\rm кДж}{ \rm mol} < 0\rm\ (экзэргонический)$
Обратите внимание, что минус, умноженный на минус, дает плюс, а кулон ($\rm A \cdot s$), умноженный на единицу вольта $\rm V$, дает энергию в единица джоуль ($\rm J$).



