Катод или анод — в чем разница и как они функционируют?
В современном электротехническом оборудовании катоды и аноды играют существенную роль при передаче, хранении и использовании электроэнергии. Каждый из этих элементов имеет свои уникальные свойства и функциональные особенности, которые важны понимать для технической эксплуатации и правильной настройки механизмов.
Краткое объяснение различий между катодом и анодом заключается в их электрических свойствах. Катод — это отрицательно заряженный электрод, который принимает электроны от внешнего источника электрического тока. Анод, напротив, — это положительно заряженный электрод, который отдает электрический заряд во внешнюю среду. Именно поэтому режимы работы катода и анода могут достаточно сильно различаться в зависимости от его применения в технической конструкции.
Для понимания функционирования и применения каждого из этих электродов в электрических схемах и цепях необходимо во всем детали разобраться в их характеристиках. В данной статье мы рассмотрим основные принципы работы катодов и анодов в электроэнергетике и электротехнике, а также узнаем, как рассчитывать и выбирать оптимальные параметры для конкретного типа работы.
В данной статье мы рассмотрим основные принципы работы катодов и анодов в электроэнергетике и электротехнике, а также узнаем, как рассчитывать и выбирать оптимальные параметры для конкретного типа работы.
Содержание
- Катод и анод: определение, различия и работа
- Определение катода и анода
- Работа катода и анода
- Различия между катодом и анодом
- Процесс электролиза
- Основные принципы электролиза
- Как функционируют электроды в электролизе
- Использование электролиза в промышленности
- Катод и анод в батареях
- Катод и анод в электролитических конденсаторах
- Катод и анод в электрохимических коррозиях
- Коррозия и ее причины
- Катод и анод в электрохимических коррозиях
- Пример
- Катод и анод в гальванических элементах
- Что такое гальванический элемент?
- Что такое анод и катод?
- Как работают катод и анод в гальванических элементах?
- Применение катода и анода в промышленности
- Катод в промышленности
- Анод в промышленности
Катод и анод: определение, различия и работа
Определение катода и анода
Катод и анод — основные понятия, используемые в электрохимии и электронике. Катодом называют электрод, на который поступает положительный заряд, а анод — электрод, на который приходит отрицательный заряд.
Катодом называют электрод, на который поступает положительный заряд, а анод — электрод, на который приходит отрицательный заряд.
Кроме того, на катоде происходит редукция (восстановление) веществ, в то время как на аноде — окисление. Перемещение электронов между электродами обеспечивает электрический ток.
Отличие катода и анода проявляется также в их заряде: катод всегда имеет отрицательный заряд, а анод — положительный.
Работа катода и анода
Работа катода и анода связана с обменом электронами между ними. Электроны, движущиеся от анода к катоду, создают электрический ток, который может быть использован для питания устройств.
Катод обеспечивает восстановление веществ, при этом он сам окисляется, передавая свои электроны аноду. Например, в аккумуляторе на катоде происходит редукция свинца, а на аноде — окисление гидроксида свинца.
Анод же участвует в окислительных реакциях, передавая электроны к катоду и сам при этом восстанавливается. Например, в аккумуляторе на аноде окисляется свинец, а на катоде — восстанавливается гидроксид свинца.
Таким образом, катод и анод играют важную роль в работе различных приборов и устройств, обеспечивая эффективную передачу электронов между ними.
Различия между катодом и анодом
Катод и анод — два понятия, которые тесно связаны с электрическим током. Их различие заключается в том, что катод является электродом, на который направляются электроны, тогда как анод является электродом, который направляет электроны в направлении катода.
Катод и анод также различаются по зарядности: катод обладает отрицательным зарядом, тогда как анод имеет положительный заряд. Это обусловлено тем, что электроны движутся от катода к аноду, образуя электрический ток.
Функция катода заключается в том, чтобы принимать электроны и, в отдельных случаях, в окислительно-восстановительных реакциях, передавать их другим веществам. С другой стороны, функция анода заключается в том, чтобы отдавать электроны для принятия катодом.
Различия между катодом и анодом важны для понимания различных электрических процессов, включая гальванические элементы, аккумуляторы и электролиз. Изучение этих процессов позволяет улучшить понимание работы электрических цепей и их применение в повседневной жизни.
Процесс электролиза
Основные принципы электролиза
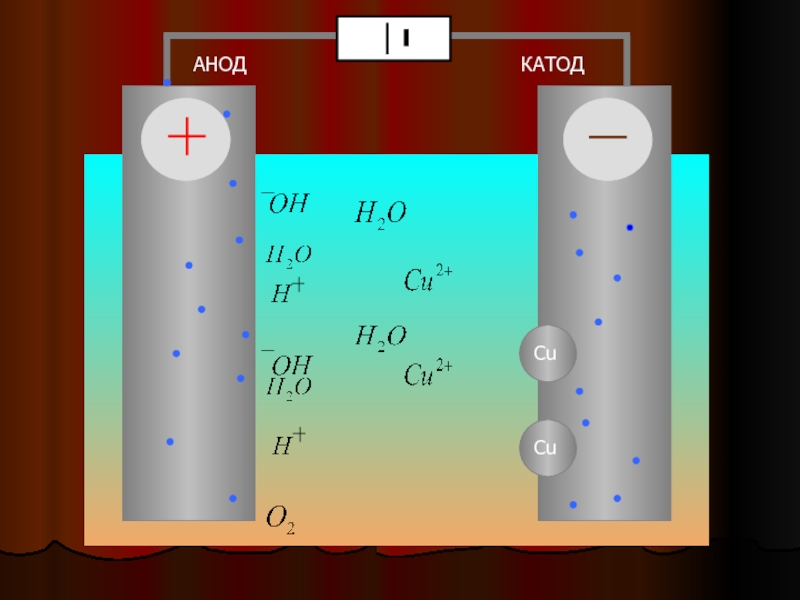
Электролиз – это процесс разложения вещества под действием электрического тока. Он происходит в электролитической ячейке, где наличие двух электродов (катода и анода) позволяет производить превращения ионов в реакционной среде.
Основным принципом этого процесса является электролитическое действие постоянного электрического тока на ионы растворенных солей, кислот, щелочей и других электролитов.
Как функционируют электроды в электролизе
В электролитической ячейке катод и анод являются местами, где происходят превращения ионов в растворе. Катод представляет собой отрицательный электрод, на который в процессе электролиза перемещаются катионы.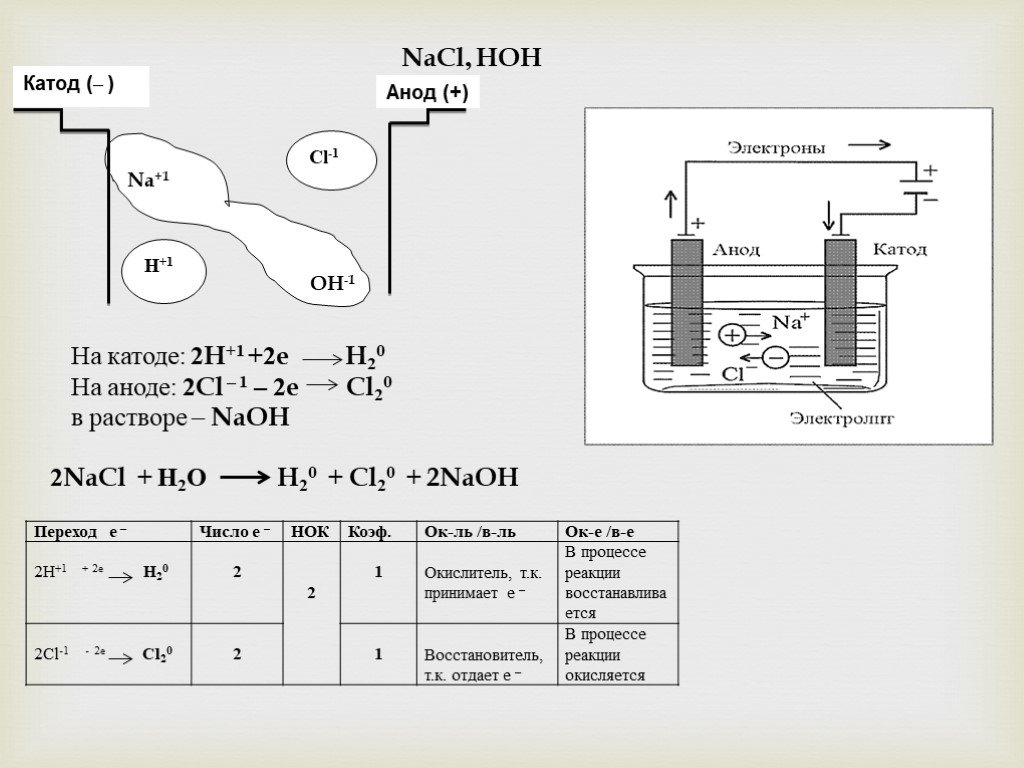 Анод – положительный электрод, на который перемещаются в процессе электролиза анионы.
Анод – положительный электрод, на который перемещаются в процессе электролиза анионы.
На катоде происходит восстановление катионов с помощью электронов. Анод, напротив, является местом окисления анионов при потере электронов.
Использование электролиза в промышленности
Электролиз используется в промышленности для получения большого числа веществ, в том числе металлов, летучих жидкостей и газов. Он также используется в производстве металлических покрытий и очистке токсичных веществ из отходов.
При этом электроды выбирают в зависимости от типа вещества, с которым они работают. Например, для получения газов используют специальные электролиты и соответствующие электроды с имеющейся поверхностью различной степени химической активности.
Катод и анод в батареях
Батарея – это источник электрической энергии, который обычно используется в маловольтных устройствах. Составляющие электрочитаемой части батареи, а именно катод и анод, играют важную роль в функционировании батареи.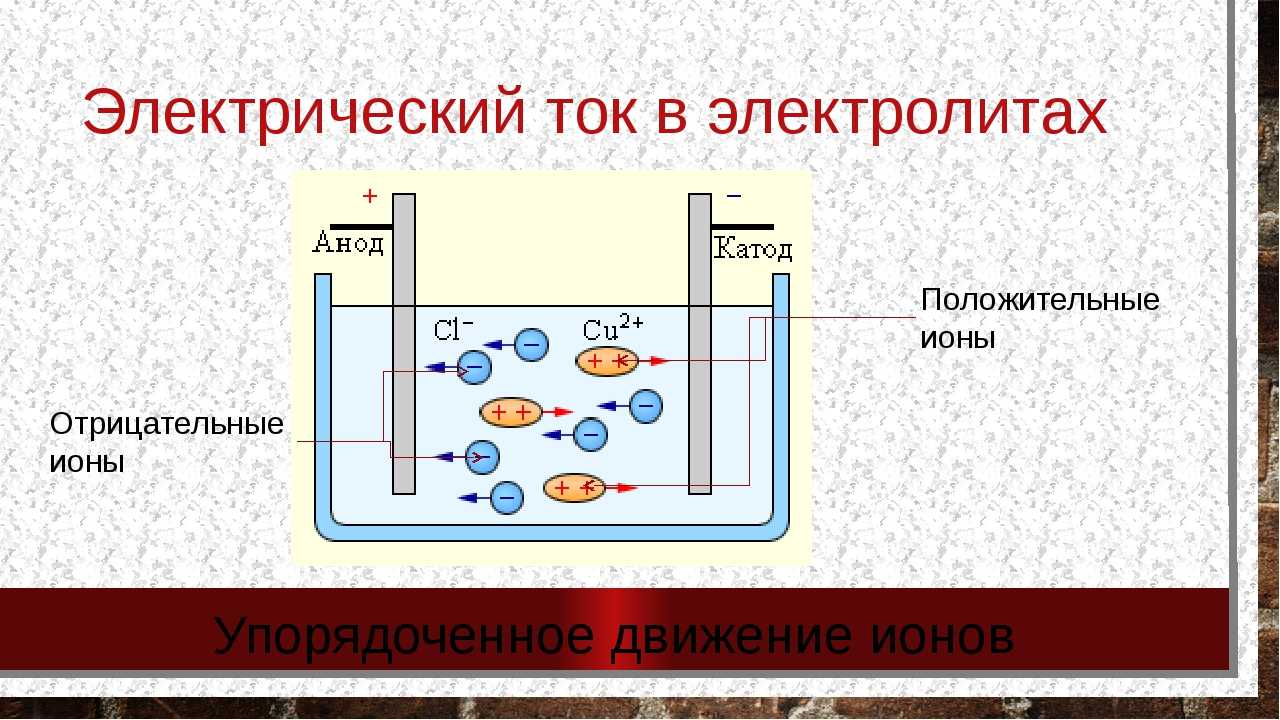
Катод – это отрицательный электрод в батарее, который обычно изготавливается из металлического оксида. Электроны передаются с катода на анод через электролит – раствор или гель, который находится между катодом и анодом.
Анод – это положительный электрод в батарее, который обычно изготавливается из металла. Электроны движутся с катода на анод, что приводит к химической реакции в электролите и создает электрический заряд.
Катод и анод являются ключевыми компонентами батареи, управляющими электрическим током. Большинство батарей имеют маркировку + и – для определения положительного и отрицательного электрода (анода и катода). Правильное подключение этих компонентов в качестве источника питания для устройства позволяет батарее работать эффективно и продолжительное время.
Катод и анод в электролитических конденсаторах
Электролитические конденсаторы – это устройства, которые используются для хранения заряда. Они состоят из двух основных элементов: катода и анода.
Катод – это отрицательный электрод в электролитическом конденсаторе. Он является местом сбора электронов и снижает напряжение. Катод изготавливается из сплава алюминия и меди.
Анод – это положительный электрод в электролитическом конденсаторе. Он участвует в процессе зарядки, позволяя электронам перемещаться к катоду. Анод изготавливается из металлической фольги.
Кроме того, в электролитических конденсаторах используется электролит – специальная жидкость или гель, которая улучшает проводимость и стабильность работы устройства.
Важно отметить, что катод и анод являются неотъемлемыми элементами электролитического конденсатора и должны быть подключены к цепи с правильной полярностью. Неправильное подключение может привести к серьезным последствиям, таким как перегрев или даже взрыв.
Катод и анод в электрохимических коррозиях
Коррозия и ее причины
Коррозия – процесс разрушения металла в окружающей среде (наличия воды, кислорода и других агрессивных веществ). При этом происходит превращение металла в ионы и образование соединений, которые несут в себе необходимый заряд. Коррозия может возникать как внутри металлических сооружений (например, трубопроводов), так и на их поверхности. Разрушение металла происходит в результате двух противоположных процессов на аноде и катоде.
При этом происходит превращение металла в ионы и образование соединений, которые несут в себе необходимый заряд. Коррозия может возникать как внутри металлических сооружений (например, трубопроводов), так и на их поверхности. Разрушение металла происходит в результате двух противоположных процессов на аноде и катоде.
Катод и анод в электрохимических коррозиях
Катод – это место процесса восстановления в электрохимической ячейке. Анод – место окисления. В результате окисления на аноде образуются ионы металла, которые переносятся к катоду, где происходит процесс восстановления. Катод защищает металл от разрушения, а анод наоборот, ускоряет процесс коррозии.
Пример
Ситуацию можно проиллюстрировать на примере трубопровода, который проходит по влажной земле. Вода и кислород воздействуют на поверхность трубы, создавая электрическую разность между анодом и катодом. Анод (металлическая поверхность трубы) окисляется и превращается в ионы, которые передаются на катод (который создается трещинами на поверхности). В результате катод остается целым, а анод разрушается. Чтобы предотвратить коррозию, следует использовать методы электрохимической защиты металла.
В результате катод остается целым, а анод разрушается. Чтобы предотвратить коррозию, следует использовать методы электрохимической защиты металла.
Катод и анод в гальванических элементах
Что такое гальванический элемент?
Гальванический элемент — это устройство, способное преобразовывать химическую энергию в электрическую. Такие элементы используются, например, в батарейках для питания электронных устройств.
Что такое анод и катод?
Анод и катод — это электроды, которые находятся в электролите (растворе или пленке проводящего вещества) в гальваническом элементе.
Анод — это электрод, на котором происходит окисление (потеря электронов). Катод — это электрод, на котором происходит восстановление (получение электронов).
- Анод — место окисления, то есть потеря электронов.
- Катод — место восстановления, то есть получение электронов.
Как работают катод и анод в гальванических элементах?
Катод и анод в гальваническом элементе связаны между собой проводом.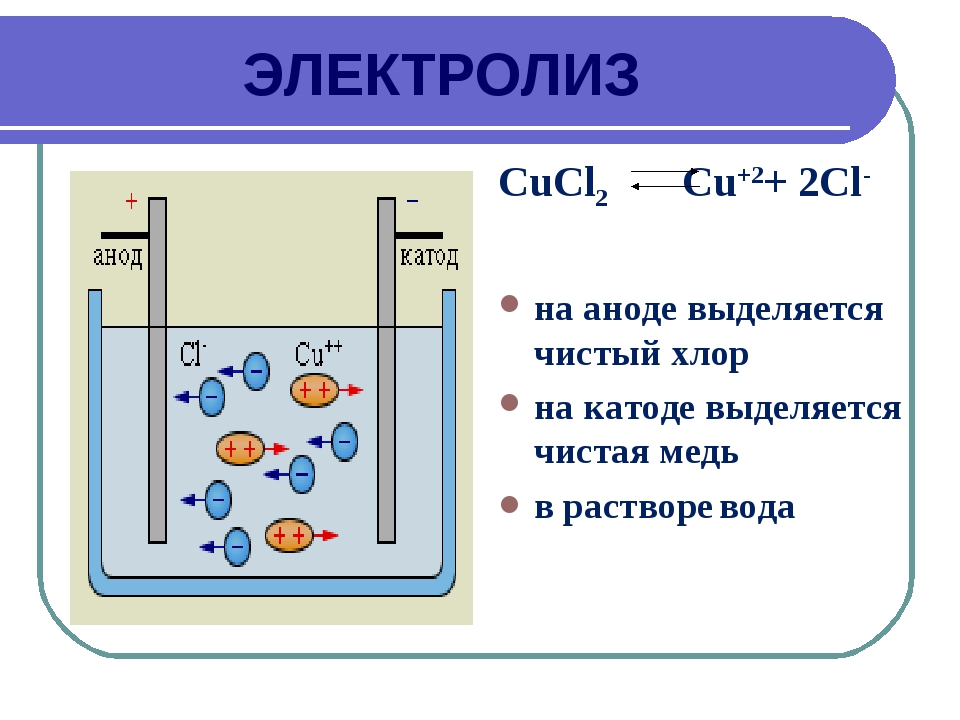 Когда провод подключён, на аноде происходит окисление, а на катоде — восстановление.
Когда провод подключён, на аноде происходит окисление, а на катоде — восстановление.
Анод отдаёт электроны в провод и электролит, в результате чего образуется положительный заряд. Катод получает электроны из провода и электролита, в результате чего образуется отрицательный заряд.
Также в гальваническом элементе присутствует электролит, который направляет поток электронов между анодом и катодом и сохраняет электрический баланс.
| Электроды в гальваническом элементе | Процессы на аноде | Процессы на катоде |
|---|---|---|
| Анод | Окисление (потеря электронов) | |
| Катод | Восстановление (получение электронов) |
Применение катода и анода в промышленности
Катод в промышленности
Катод используется в промышленности для обработки металлических поверхностей методом электрохимического осаждения. Этот процесс позволяет улучшить качество поверхностей изделий, устранить поверхностные дефекты и увеличить их срок службы.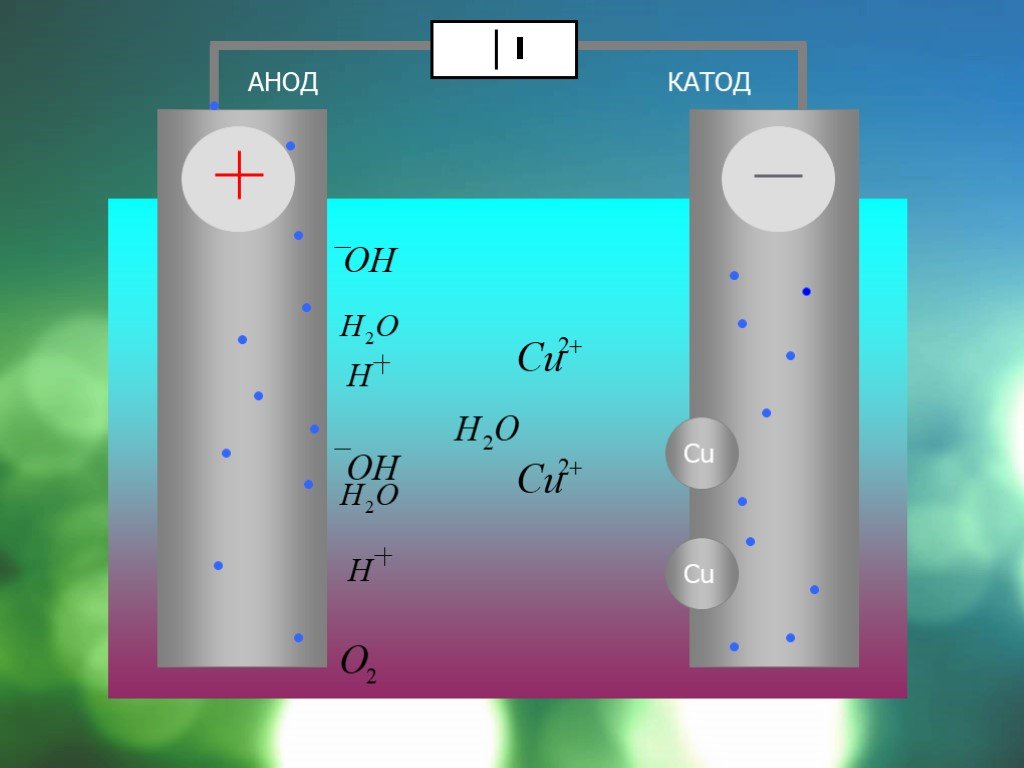 Такой метод широко применяется в производстве электроники, автомобилей, летательных и космических аппаратов, обуви и мебели.
Такой метод широко применяется в производстве электроники, автомобилей, летательных и космических аппаратов, обуви и мебели.
В производстве паровых турбин катод используется для коррозионной защиты металлических деталей. Он связывает с собой агрессивные ионы, которые могут привести к быстрому износу деталей. Это позволяет увеличить период между профилактическими обслуживаниями и значительно экономит время и деньги на ремонте оборудования.
Анод в промышленности
Анод используется в промышленности для процесса электролиза. Этот процесс предполагает растворение анода в растворе и осаждение металлов на катоде. Такой метод широко применяется в производстве алюминия, меди и других металлов. Аноды в таких производствах обычно изготавливают из углерода или графита, так как они обладают высокой прочностью и ёмкостью в процессе производства.
Анод также используется в производстве различных видов батарей, включая литиевые, ионные и другие. Он обеспечивает перенос электронов из положительно заряженного электрода в отрицательно заряженный, что позволяет батарее вырабатывать электричество и использоваться в самых различных целях.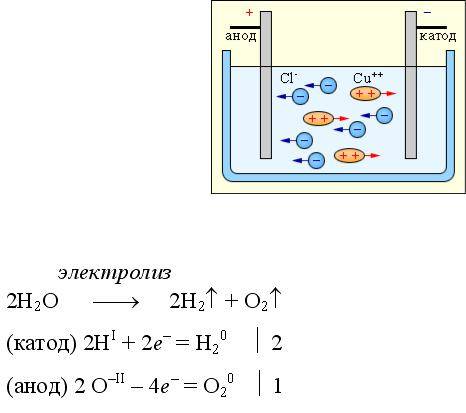
Анод и катод в литий-ионной батарее — работа, химические реакции и материалы-battery-knowledge
Лучший литиевый аккумулятор 18650
Цилиндрическая литий-ионная батарея
Лучшее руководство по литиево-ионной батарее
Лучшее руководство по LiPo батареям
Лучшее руководство по батарее Lifepo4
Руководство по литиевой батарее 12 В
Литий-ионный аккумулятор 48 В
Лучшая литий-ионная батарея 26650
Aug 11, 2020 Вид страницы:1342
В этот быстрорастущий век технологий, окруженный электронными приборами и оборудованием, батареи стали очень важными. Эти батареи контролируют почти все аспекты нашей повседневной жизни, и их роли играют разные типы. Батареи — это электрохимические устройства, в которых используется химия для выработки электроэнергии. Батареи состоят из двух частей: катода и анода. Катод — это оксид металла, а анод — из углерода или графита. Катод и анод играют важную роль в химических реакциях, производящих электрическую энергию.
Эти батареи контролируют почти все аспекты нашей повседневной жизни, и их роли играют разные типы. Батареи — это электрохимические устройства, в которых используется химия для выработки электроэнергии. Батареи состоят из двух частей: катода и анода. Катод — это оксид металла, а анод — из углерода или графита. Катод и анод играют важную роль в химических реакциях, производящих электрическую энергию.
Как работают анод и катод в литий-ионных батареях
Как и любая другая электролитическая реакция, реакция внутри литий-ионного аккумулятора такая же. Обмен ионами происходит между анодом и катодом с помощью промежуточного материала, электролита.
Во время разряда батареи ионы лития перемещаются от анода (отрицательный электрод) к катоду (положительный электрод) через электролит. В то время как во время процесса зарядки литий-ионного аккумулятора ионы перемещаются от катода (положительный электрод) к аноду (отрицательный электрод).
Катод литий-ионных аккумуляторов состоит из интерполированного литиевого соединения, диоксида лития-марганца.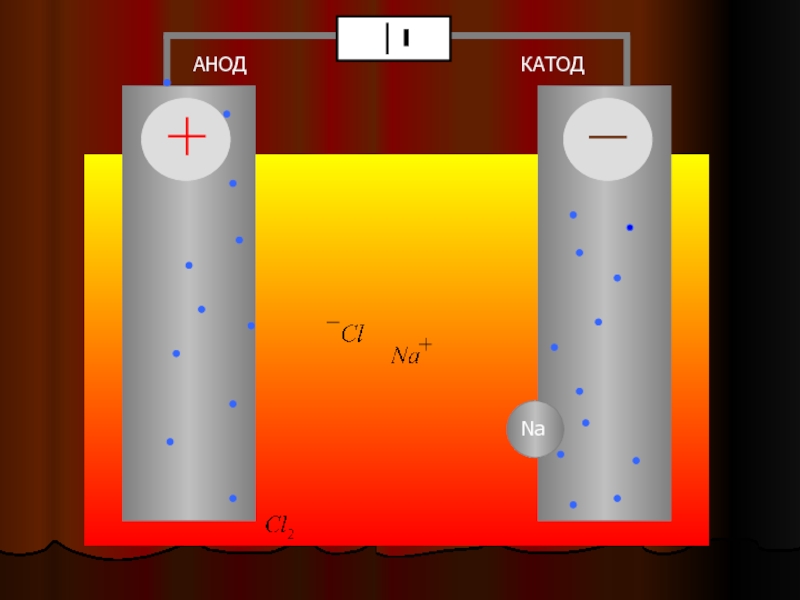 Анод, как правило, состоит из углерода. Во время фазы разряда батареи на аноде происходит реакция окисления, которая производит ионы лития (положительные), электроны (отрицательные) и некоторые побочные продукты на аноде. Ионы лития и электроны проходят через электролиты, которые затем воссоединяются на катоде в реакции восстановления.
Анод, как правило, состоит из углерода. Во время фазы разряда батареи на аноде происходит реакция окисления, которая производит ионы лития (положительные), электроны (отрицательные) и некоторые побочные продукты на аноде. Ионы лития и электроны проходят через электролиты, которые затем воссоединяются на катоде в реакции восстановления.
ЧИТАТЬ ДАЛЕЕ
Электролит литий-ионного аккумулятора представляет собой комбинацию солей лития. Внешний контур обеспечивает проводящий путь для ионов лития и электронов, образующихся во время реакции. Электролит сам по себе не участвует в реакциях аккумулятора. Реакции, происходящие во время процесса разряда, снижают химическую мощность элемента, который, в свою очередь, передает электрическую энергию любой нагрузке, подключенной к нему через внешнюю схему.
Какова химическая реакция в литий-ионных батареях
1. полуклеточные реакции
А. Реакция узла (при разряде батареи):
На аноде литий окисляется от Li до Li +. Означает, что степень окисления изменяется от 0 до +1. Продолжающаяся химическая реакция на литий-графитовом аноде символически представлена как:
LiC6 C6 + Li + + e–
б) Катодная реакция (при разряде батареи):
Эти ионы лития от анода мигрируют в среду к катоду через электролит. Здесь они включаются в оксид лития-кобальта. А здесь он снижает степень окисления кобальта с +4 до +3. Вся эта реакция, протекающая на катоде, символически представлена как:
CoO2 + Li + + e- LiCoO2 (т)
2.Общая реакция (при разрядке аккумулятора)
Эти химические реакции происходят при разряде аккумулятора. Общая химическая реакция символически представлена как:
Общая химическая реакция символически представлена как:
LiC6 + CoO2 C6 + LiCoO2
3. химическая реакция (при перезарядке аккумулятора):
При перезарядке аккумулятора или элемента все эти реакции происходят в обратном порядке. Это означает, что ионы лития уходят, и связь на катоде из оксида лития-кобальта разрывается. Эти ионы лития снова возвращаются на анод. Здесь они снова сокращаются и интегрируются в графитовую систему.
ЧИТАТЬ ДАЛЕЕ
Какие материалы анода и катода подходят для литий-ионных батарей
Анод и катод образуют основные части элемента, которые вызывают реакции, которые помогают батареям выполнять свою основную функцию, обеспечивая электрическую энергию. Чтобы поддерживать оптимальные и эффективные характеристики батареи без каких-либо химических или электрических опасностей, до сих пор в коммерчески доступных элементах использовались следующие материалы.
Катодные материалы
Катодные материалы обычно изготавливаются из LiCoO2 или LiMn2O4.
Материалы на основе кобальта
Материал на основе кобальта имеет псевдотетраэдрическую структуру, которая обеспечивает двумерную диффузию ионов лития. Катоды на основе кобальта идеальны из-за их высокой теоретической удельной теплоемкости, большой объемной емкости, низкого саморазряда, высокого напряжения разряда и хороших циклических характеристик.
Материалы на основе марганца
Материалы на основе марганца имеют систему кубической кристаллической решетки, которая обеспечивает трехмерную диффузию ионов лития. Марганцевые катоды привлекательны, потому что марганец дешевле и потому, что теоретически его можно использовать для создания более эффективных и долговечных батарей, если можно будет преодолеть его ограничения. LiFePO4 также является кандидатом для крупномасштабного производства литий-ионных аккумуляторов, например, для электромобилей, из-за его низкой стоимости, превосходной безопасности и высокой долговечности.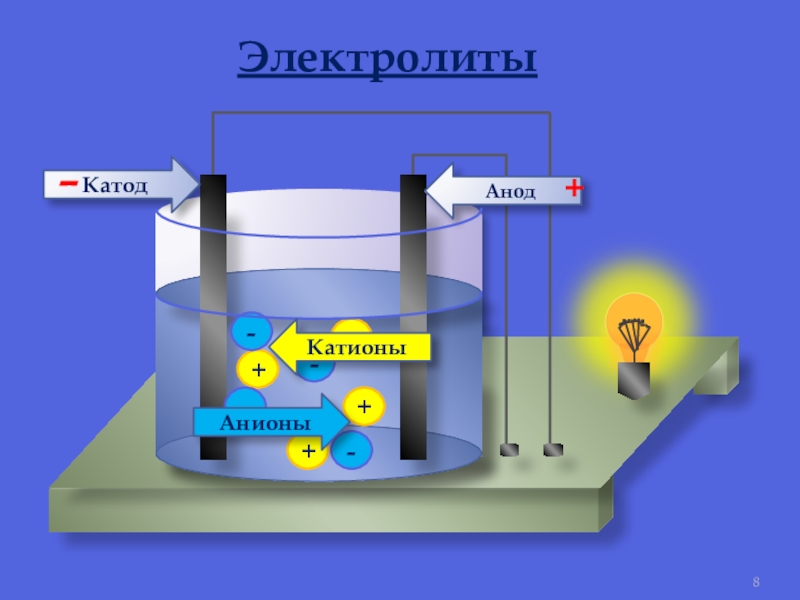
Анодные материалы
В настоящее время для изготовления анодов используются три наиболее распространенных материала:
Аноды на углеродной основе
Графит — наиболее распространенная форма углерода, используемая в конструкции анодов на основе углерода. Эти аноды состоят из листов шестиугольной и ромбоэдрической формы. Когда литий-ионный элемент соприкасается с анодом, графитовые листы меняются местами. Аноды на основе углерода экономичны и легко доступны. Они также обладают наиболее подходящими электрохимическими свойствами, необходимыми для литий-ионных аккумуляторов.
Неграфитовые аноды
Поскольку литий-ионные аккумуляторы подвергаются исследованиям и постоянным разработкам, прогресс в использовании современного графитового углерода был сделан. Ученые сообщили, что использование измененных графитовых форм помогает улучшить электрохимические характеристики. Эти нечистые формы графита не обладают свойством графита перестраиваться в слои. Неграфитовые аноды эффективно работают в сочетании с твердыми электролитами и могут работать в паре с оксидом лития-марганца.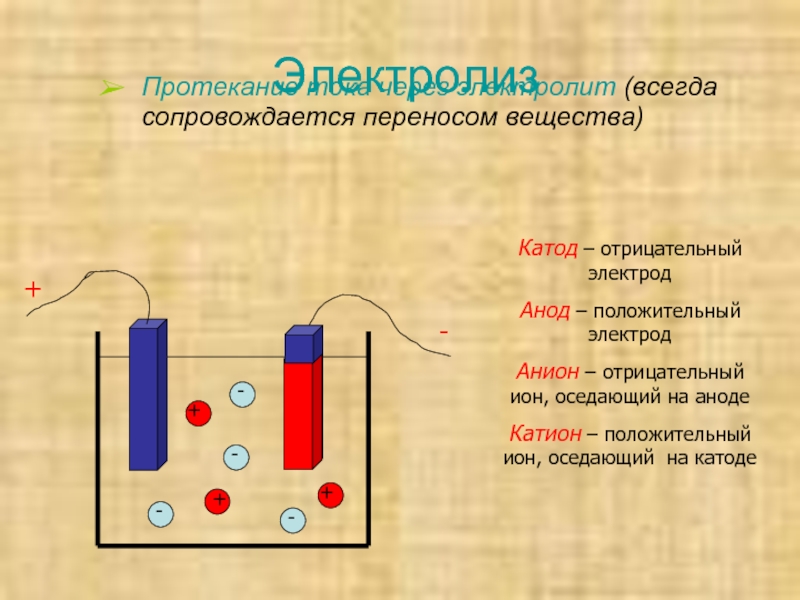
Литий-сплавные аноды
Литий-сплавные аноды — одно из многих недавних дополнений к технологии литий-ионных аккумуляторов. Литий-алюминиевый, Li-Al, анод — это первый анод из литиевого сплава, разработанный в этой категории. Эти аноды из сплава предлагают большие преимущества в переработке литиевых батарей. Литий-титановый оксид — еще один анод из сплава, разработанный для замены традиционных углеродных анодов. Эти аноды предлагают дополнительные преимущества, поскольку они предлагают улучшенные циклы из-за отсутствия объемных изменений, которые происходят во время процесса добавления и удаления лития. Проблема с этими анодами заключается в том, что они не могут производить выходную энергию с высокой плотностью из-за высокого уровня рабочего напряжения.
- Предыдущая статья: Как подзаряжать аккумуляторы — способы и необходимость
- Следующая статья: Литиевая батарея 18650 или 16340 — преимущества и ограничения
Самые популярные категории
Индивидуальные решения
-
Схема конструкции аккумулятора 11,1 В, 6600 мАч портативного сверхзвукового диагностического набора B
-
Схема резервного питания 7,4 В 10 Ач медицинского инфузионного насоса
-
Решения для литий-ионных аккумуляторов AGV 25,6 В, 38,4 Ач
Что такое материалы анода и катода батареи?
По мере того, как мир ускоряется в направлении электрификации и быстро внедряет экологически чистые энергетические технологии, спрос на эффективные и устойчивые решения для хранения энергии становится все более важным. Литий-ионные батареи находятся в авангарде этой революции, и есть два основных компонента, которые определяют характеристики и производительность батареи — анод и катод.
Литий-ионные батареи находятся в авангарде этой революции, и есть два основных компонента, которые определяют характеристики и производительность батареи — анод и катод.
В этом выпуске «Рециклопедии аккумуляторов» кратко описаны катоды и аноды аккумуляторов, материалы, из которых они сделаны, способы их изготовления, важность включения переработанного содержимого и их значение для продвижения электрификации и чистой энергии.
Что такое аноды и катоды аккумуляторов?
Катод и анод — это два электрода в батарее или гальваническом элементе, которые облегчают поток электрического заряда. Катод — это положительный электрод, на котором происходит восстановление (приток электронов), а анод — это отрицательный электрод, на котором происходит окисление (потеря электронов).
В процессе зарядки батареи электроны перетекают от катода к аноду, накапливая энергию, которая впоследствии может быть использована для питания устройств
Какие материалы используются в анодах и катодах?
Активные катодные материалы (КАМ) обычно состоят из оксидов металлов.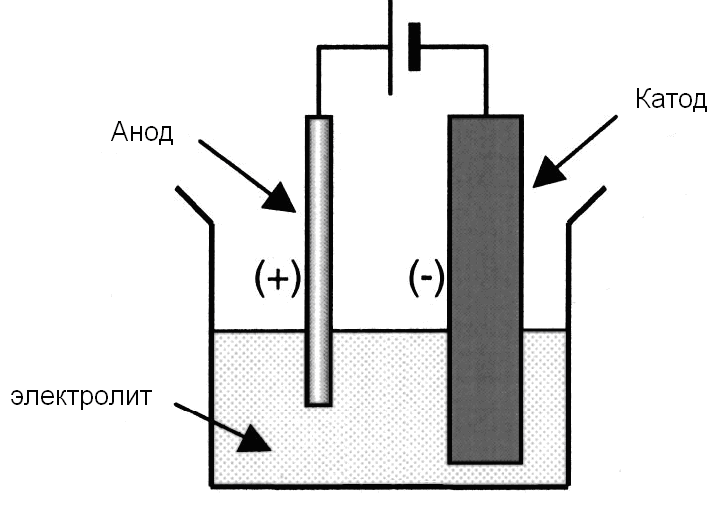 Наиболее распространенные катодные материалы, используемые в литий-ионных батареях, включают оксид лития-кобальта (LiCoO2), оксид лития-марганца (LiMn2O4), фосфат лития-железа (LiFePO4 или LFP) и оксид лития-никель-марганца-кобальта (LiNiMnCoO2 или NMC). Каждый из этих материалов предлагает различные уровни плотности энергии, термической стабильности и экономической эффективности.
Наиболее распространенные катодные материалы, используемые в литий-ионных батареях, включают оксид лития-кобальта (LiCoO2), оксид лития-марганца (LiMn2O4), фосфат лития-железа (LiFePO4 или LFP) и оксид лития-никель-марганца-кобальта (LiNiMnCoO2 или NMC). Каждый из этих материалов предлагает различные уровни плотности энергии, термической стабильности и экономической эффективности.
Анодные активные материалы (ААМ), с другой стороны, обычно изготавливаются из материалов на основе углерода, таких как графит, кремний или их комбинация. Графит является наиболее часто используемым анодным материалом из-за его высокой электропроводности, низкой стоимости и стабильной структуры. Кремниевые аноды обеспечивают более высокую плотность энергии, но сталкиваются с проблемами, связанными с увеличением объема и более коротким сроком службы. Некоторые итерации анодов также будут «легировать» графитовые аноды небольшим количеством кремния для улучшения рабочих характеристик и плотности энергии.
Материалы и металлы, используемые в производстве катодов, могут составлять 30-40% стоимости элемента литиевой батареи, тогда как анодные материалы обычно составляют около 10-15% от общей стоимости
Производство анодов и катодов
Несмотря на то, что у каждого производителя есть свой собственный процесс и часто свой собственный рецепт, производство анодов и катодов обычно включает несколько этапов.
Сначала необходимые катодные и анодные материалы будут синтезированы в желаемые соединения для создания электрода. Эта смесь соединений называется активными катодными материалами (КАМ) и активными анодными материалами (ААМ) соответственно.
Эти синтезированные материалы затем измельчают в мелкий порошок и смешивают со связующими веществами и растворителями для создания «суспензии», готовой к дальнейшей обработке.
Затем шламовые смеси наносят на металлическую фольгу – обычно алюминиевую фольгу для анода и медную фольгу для катода – и сушат в печи, чтобы прикрепить материал к фольге и удалить оставшиеся растворители.
После сушки фольга подвергается процессу «каландрирования», при котором ее пропускают через ряд роликов для уплотнения и разглаживания покрытия, обеспечивая равномерную толщину и надлежащую адгезию.
Полученные анодная и катодная фольги с покрытием затем готовы для резки по размеру и объединения с другими компонентами для создания элемента литий-ионной батареи.
Переработанное содержимое катодных и анодных материалов
Несмотря на то, что производительность батареи со временем будет медленно ухудшаться, металлы и ценные материалы, входящие в состав батареи, на самом деле не истощаются.
По мере роста спроса на литий-ионные аккумуляторы растет потребность в устойчивых и экономичных материалах, и одним из способов достижения этого является увеличение использования переработанного содержимого в процессе производства катодных и анодных материалов. Содержимое для переработки может быть получено из батарей с истекшим сроком службы или из производственных отходов.
Использование переработанных материалов в производстве аккумуляторов имеет ряд преимуществ:
Сохранение ресурсов: Переработка снижает потребность в добыче и добыче сырья, сохраняя природные ресурсы и сводя к минимуму воздействие на окружающую среду.
Уменьшенный углеродный след: Процесс переработки может потребовать меньше энергии, чем добыча и переработка сырья, что приводит к снижению выбросов парниковых газов.
Минимизация отходов: По мере увеличения количества аккумуляторов с истекшим сроком службы переработка может помочь свести к минимуму накопление опасных отходов на свалках.
Рентабельность: Использование переработанных материалов может быть более рентабельным, чем закупка сырья, что дает производителям аккумуляторов экономический стимул для внедрения устойчивых методов.
Целостность цепочки поставок: Работа с переработанными материалами обеспечивает надежную поставку минералов и металлов, используемых для изготовления катодов и анодов, на внутреннем рынке. Компании также могут гарантировать, что сырье получено с соблюдением этических норм.
Компании также могут гарантировать, что сырье получено с соблюдением этических норм.
Переработанные материалы для аккумуляторов: путь к электрификации и чистой энергии
Включение переработанных материалов в производство катодных и анодных материалов является жизненно важным шагом на пути к достижению целей электрификации и чистой энергии в глобальном масштабе. Повторно используя ценные материалы из аккумуляторов с истекшим сроком службы и производственных отходов, мы можем сохранить природные ресурсы, сократить количество отходов и свести к минимуму воздействие добычи и переработки сырья на окружающую среду.
Использование таких устойчивых и ответственных методов производства аккумуляторов может привести к созданию более экологичной и эффективной отрасли хранения энергии, что в конечном итоге поддержит переход на возобновляемые источники энергии и электрический транспорт.
Электрохимия — Химия для старших классов
Все ресурсы по химии для старших классов
6 диагностических тестов 143 практических теста Вопрос дня Карточки Учитесь по концепции
← Предыдущая 1 2 3 Следующая →
Химия в средней школе Справка » Электрохимия
Какое утверждение верно для гальванического элемента?
Возможные ответы:Электроны движутся от анода к катоду, на катоде происходит восстановление, анод является отрицательным электродом, реакция идет самопроизвольно
Электроны движутся от анода к катоду, на катоде происходит окисление, катод является отрицательным электродом, и реакция идет самопроизвольно
Электроны перемещаются от катода к аноду, окисление происходит на аноде, анод является отрицательным электродом, и реакция идет самопроизвольно
Электроны перемещаются от катода к аноду, восстановление происходит на аноде, катод является отрицательным электродом, и реакция несамопроизвольная
Электроны перемещаются от анода к катоду, восстановление происходит на катоде, анод является отрицательным электродом, реакция идет самопроизвольно
Правильный ответ:Электроны перемещаются от анода к катоду, восстановление происходит на катоде, анод является отрицательным электродом, реакция идет самопроизвольно
Пояснение: В гальванических элементах всегда происходят спонтанные окислительно-восстановительные реакции. В любой электрохимической ячейке электроны всегда движутся от анода к катоду. Кроме того, анод всегда является местом окисления, а катод всегда является местом восстановления. Поскольку реакция является самопроизвольной (чистое высвобождение свободной энергии), она вызывает движение электронов от анода к катоду. Помните, окисление — это потеря электронов, а восстановление — это приобретение электронов. Поскольку окисление всегда происходит на аноде, у нас остается избыток электронов, что делает его отрицательным электродом. Логично, что дополнительные электроны с анода спонтанно перемещаются к катоду (положительному электроду).
В любой электрохимической ячейке электроны всегда движутся от анода к катоду. Кроме того, анод всегда является местом окисления, а катод всегда является местом восстановления. Поскольку реакция является самопроизвольной (чистое высвобождение свободной энергии), она вызывает движение электронов от анода к катоду. Помните, окисление — это потеря электронов, а восстановление — это приобретение электронов. Поскольку окисление всегда происходит на аноде, у нас остается избыток электронов, что делает его отрицательным электродом. Логично, что дополнительные электроны с анода спонтанно перемещаются к катоду (положительному электроду).
Чтобы лучше запомнить процессы окисления-восстановления, рассмотрите мнемонические обозначения «НЕФТЯНАЯ ВЫШИНА» и «Бык, рыжий кот». OIL RIG расшифровывается как «окисление — это потеря, восстановление — это усиление» по отношению к электронам. Бык, Рыжий Кот говорит нам, что анод — это место окисления, а катод — место восстановления.
Сообщить об ошибке
Какое из следующих различий между гальваническими и электролитическими элементами неверно?
Возможные ответы:Электролизеры имеют положительную свободную энергию Гибба
Электролизеры самопроизвольные
Электролизеры имеют отрицательное напряжение
Электролизеры имеют окисление на катоде
Правильный ответ:Электролизеры имеют окисление на катоде
Пояснение: В электролитических ячейках используются неспонтанные реакции, для протекания которых требуется внешний источник питания. Значения между гальваническими и электролитическими элементами противоположны друг другу. Гальванические элементы имеют положительный потенциал напряжения, а электролитический потенциал напряжения отрицательный. Однако в обоих типах элементов окисление происходит на катоде, а восстановление происходит на аноде.
Значения между гальваническими и электролитическими элементами противоположны друг другу. Гальванические элементы имеют положительный потенциал напряжения, а электролитический потенциал напряжения отрицательный. Однако в обоих типах элементов окисление происходит на катоде, а восстановление происходит на аноде.
Сообщить об ошибке
Чтобы произошла следующая реакция, электрохимический элемент гальванический или гальванический?
Возможные ответы:Электролитический
Ни один
Гальванический
Оба
Правильный ответ: 9009 6Гальванический
Пояснение:Сначала мы должны переставить восстановительные потенциалы так, чтобы при суммировании они соответствовали реакции, происходящей в электрохимической ячейке.
В общей реакции находится на стороне реагента, поэтому уравнение нужно инвертировать.
Используйте уравнение: чтобы найти .
— продукт, а — реагент.
Ячейка должна быть гальванической, поскольку значение положительное. Это означает, что данная реакция является самопроизвольной реакцией, происходящей без внешнего источника энергии.
Сообщить об ошибке
Чем электролизер отличается от гальванического элемента?
Возможные ответы:В гальваническом элементе окисление происходит на аноде, а в электролитическом элементе — на катоде
В электролитическом элементе потенциал элемента положительный
В электролитическом элементе катод отмечен отрицательным
Окисление происходит на аноде в электролизере, но на катоде в гальваническом элементе
Правильный ответ:В электролизере катод отмечен отрицательным
Пояснение: Окисление всегда происходит на аноде, независимо от типа электрической ячейки. Заряды на аноде и катоде меняются местами между гальваническими и электролитическими элементами. В электролитических ячейках катоды помечены как отрицательные, а аноды — как положительные. В гальванических элементах верно обратное: катоды помечены как положительные, а аноды помечены как отрицательные.
В электролитических ячейках катоды помечены как отрицательные, а аноды — как положительные. В гальванических элементах верно обратное: катоды помечены как положительные, а аноды помечены как отрицательные.
Сообщить об ошибке
К какому полюсу движутся электроны в электролитической ячейке?
Возможные ответы:К положительному полюсу
К аноду
К катоду
Электроны не движутся; путешествуют только протоны
Требуется дополнительная информация
Правильный ответ:К катоду
Пояснение:Восстановление всегда происходит на катоде, а окисление всегда происходит на аноде. Поскольку восстановление — это добавление электронов, электроны должны двигаться к месту восстановления.
В электролитической ячейке отрицательный заряд находится на катоде, а положительный — на аноде. Поскольку электролитической ячейке требуется энергия для продолжения реакции, мы толкаем электроны против градиента их потенциала.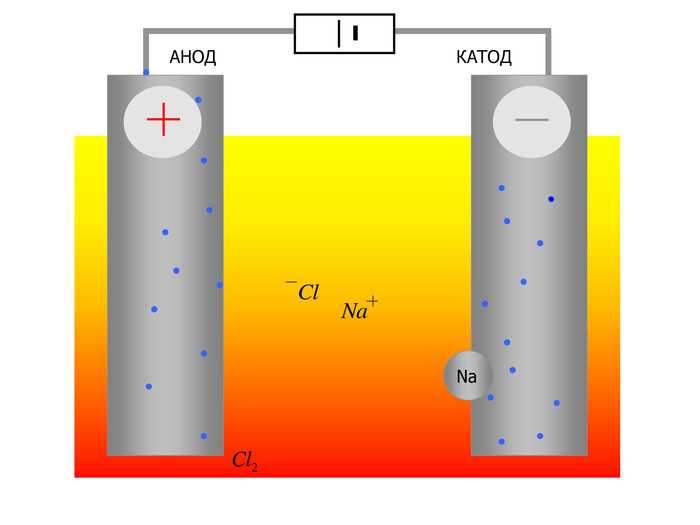 Электроны, заряженные отрицательно, движутся к катоду, который также заряжен отрицательно.
Электроны, заряженные отрицательно, движутся к катоду, который также заряжен отрицательно.
Сообщить об ошибке
В гальваническом элементе происходит следующая реакция:
Элемент гальванический или гальванический?
Возможные ответы:Электролитический
Гальванический
Оба
Ни один
Правильный ответ:Гал ваник
Пояснение:
Поскольку наша общая реакция включает твердый магний в реагентах, мы должны инвертировать первое уравнение, включая знак электрического потенциала.
Эта ячейка гальваническая, потому что электрический потенциал положительный. Гальванические элементы включают спонтанные реакции и, следовательно, не нуждаются во внешнем источнике энергии для запуска реакции.
Сообщить об ошибке
В электрохимической ячейке происходит следующая реакция:
Что из следующего лучше всего описывает эту ячейку?
Возможные ответы:Гальванический
Ни один
Электролитический
Оба
Правильный ответ: 9000 2 Электролитические Пояснение:
Поскольку наша общая реакция включает твердый кальций в реагентах, мы должны инвертировать второе уравнение, включая знак электрического потенциала.
Эта ячейка является электролитической, поскольку электрический потенциал отрицательный. Электролитические элементы включают неспонтанные реакции и, следовательно, должны иметь внешний источник напряжения, такой как батарея, для управления своими реакциями.
Сообщить об ошибке
Какой из следующих видов наиболее вероятно окислится, если его поместить в электрохимическую ячейку с другим веществом?
Возможные ответы: Правильный ответ: Объяснение:Используя уравнение: , чтобы произошла спонтанная реакция, должно быть положительным. С твердым цинком в качестве реагента любое другое твердое вещество может действовать как продукт и все же давать положительный результат. Это потому, что вычитание отрицательного числа даст положительное значение.
В результате уравнение инвертируется, и твердый цинк становится реагентом. . Твердый цинк будет отдавать электроны и окисляться, чтобы восстановить другие ионы.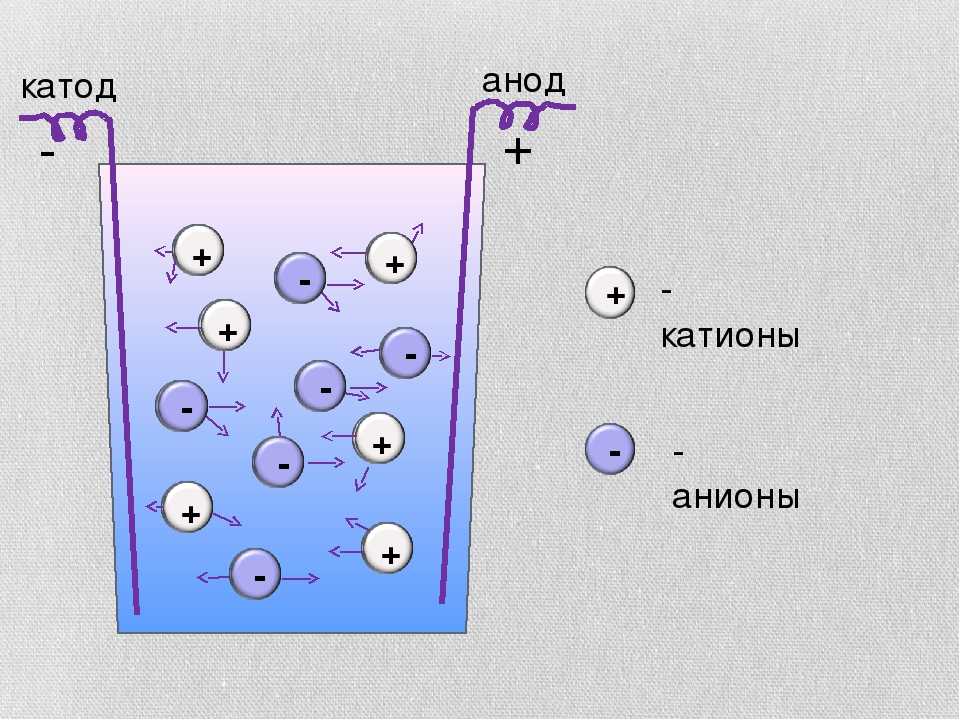
Сообщить об ошибке
Чтобы произошла следующая реакция, электрохимический элемент гальванический или гальванический?
Возможные ответы:Электролитический
Оба
Гальванический
Ни один
Правильный ответ: 900 96Электролитический
Пояснение:Сначала мы должны переставить восстановительные потенциалы так, чтобы при суммировании они соответствовали реакции, происходящей в электрохимической ячейке.
В общей реакции находится на стороне реагента, поэтому уравнение нужно инвертировать.
Используйте уравнение: чтобы найти .
— продукт, а — реагент.
Ячейка должна быть электролитической, поскольку значение отрицательное. Это означает, что эта реакция не является самопроизвольной реакцией, и для ее осуществления требуется прикладной источник энергии.
Сообщить об ошибке
Чем электролизер отличается от гальванического элемента?
Возможные ответы:В гальваническом элементе окисление происходит на аноде, а в электролитическом элементе — на катоде
В электролитическом элементе катод отмечен отрицательным
Окисление происходит на аноде в электролизере, но на катоде в гальваническом элементе
Правильный ответ:В электролизере катод отмечен отрицательным
Пояснение: Окисление всегда происходит на аноде, независимо от типа электрической ячейки.