Протяженные гибкие аноды (ПГА)
Протяженные гибкие аноды (ПГА) — изделия, изготавливаемые в соответствии с требованиями заказчика. Соединение анода с дренажным кабелем происходит непосредственно на производстве, изделие поставляется готовым к монтажу и эксплуатации. ПГА представляют собой токоотдающий кабель, наружная часть изготавливается из материалов на основе каучука.
Протяженные аноды выпускаются в нескольких конфигурациях:
- ПГА-7 — модульное исполнение, состоят из нескольких (количество зависит от специфики проекта электрохимзащиты) электродов. Коммутация электродов производится за счет подключения изделия к дренажному кабелю КГН достаточной длины в заводских условиях.
- ПГА-6 — гибкий протяженный анод, используемый в сейсмоопасных условиях. Защищен от механических повреждений.
- ПГА-5 — специально предназначенное для глубинного расположения изделие.
- ПГА-3, ПГА-4 — «ГИРЛЯНДА». Комплекс из нескольких соединенных последовательно или параллельно электродов, используется для создания единой системы защиты протяженных участков магистральных трубопроводов.

В зависимости от марки электрода различается сфера их применения, технические характеристики, условия эксплуатации. Подробная информация о характеристиках представлена в таблицах ниже.
Основные технические характеристики ПГА-7:
| Наименование показателя | Значение |
|---|---|
| Диаметр отрезка токоотдающего провода, мм, не менее | 36 |
| Рабочая длина отрезка токоотдающего провода, м | по проекту |
| Материал токоввода | жила медная из меди марки ММ (ТУ 16. К71-087) сечением 10 — 25 мм |
| Количество отрезков, шт | по проекту |
| Длина соединительного кабеля, м | по проекту |
| Сопротивление изоляции соединительной муфты, Ом, не менее | 1010 |
| Диапазон рабочих температур**, оС, в статике | минус 60 — плюс 60 |
| Срок службы в номинальном токовом режиме, лет, не менее | 15 |
| Гарантийный срок хранения | 12 мес.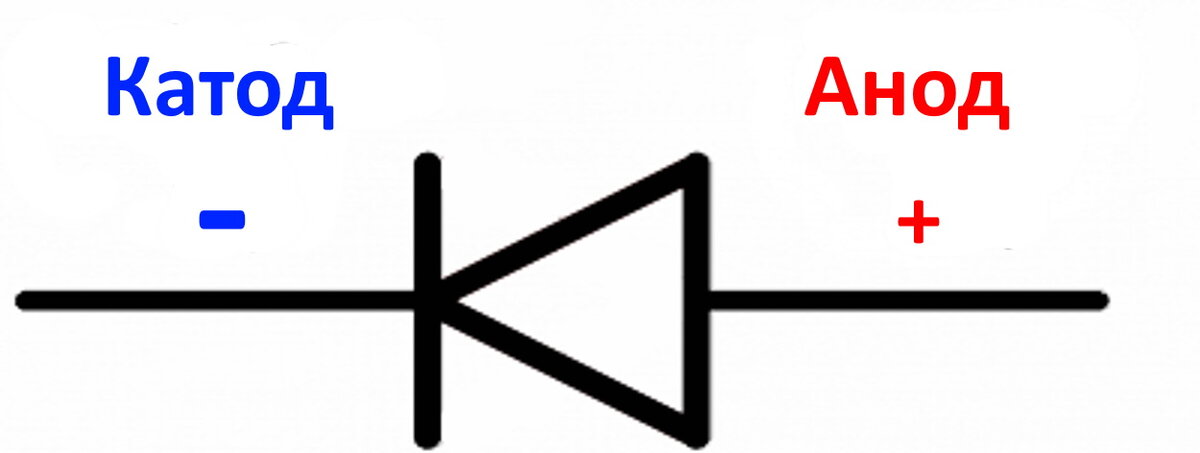 с даты выпуска с даты выпуска |
Основные технические характеристики ПГА-6:
| Наименование показателя | Значение |
|---|---|
| Диаметр электрода, мм, не менее | 36 |
| Рабочая длина, м | по проекту |
| Рабочий материал | электропроводная резина (ТУ 16.К71-018) |
| Удельное объемное электросопротивление резины, Ом×м, не более | 1,0 |
| Материал токоввода | жила медная из меди марки ММ (ТУ 16. К71-087) сечением 16 — 35 мм2 . Разрывное усилие, не менее 50 Н на 1 мм |
| Удельная токовая нагрузка, А/п.м, не более | 0,05 |
| Потенциал поляризации, Н, не более | 0,4 |
| Диапазон рабочих температур**, оС, в статике | минус 60 — плюс 60 |
| Срок службы в номинальном токовом режиме, лет, не менее | 15 |
| Гарантийный срок хранения | 12 мес. с даты выпуска с даты выпуска |
Основные технические характеристики ПГА-5:
| Значение | |
|---|---|
| Диаметр электрода, мм, не менее | 50 |
| Рабочая длина, м | по проекту |
| Рабочий материал | электропроводная резина (ТУ 16.К71-018) |
| Удельное объемное электросопротивление резины, Ом×м, не более | 1,0 |
| Материал токоввода | жила медная из меди марки ММ (ТУ 16. К71-087) сечением 25-50 мм2 . |
| Удельная токовая нагрузка, А/п.м, не более | до 0,2 |
| Рабочая температура, оС | минус 60 — плюс 90 |
| Срок службы в номинальном токовом режиме, лет, не менее | 15 |
| Гарантийный срок хранения | 12 мес.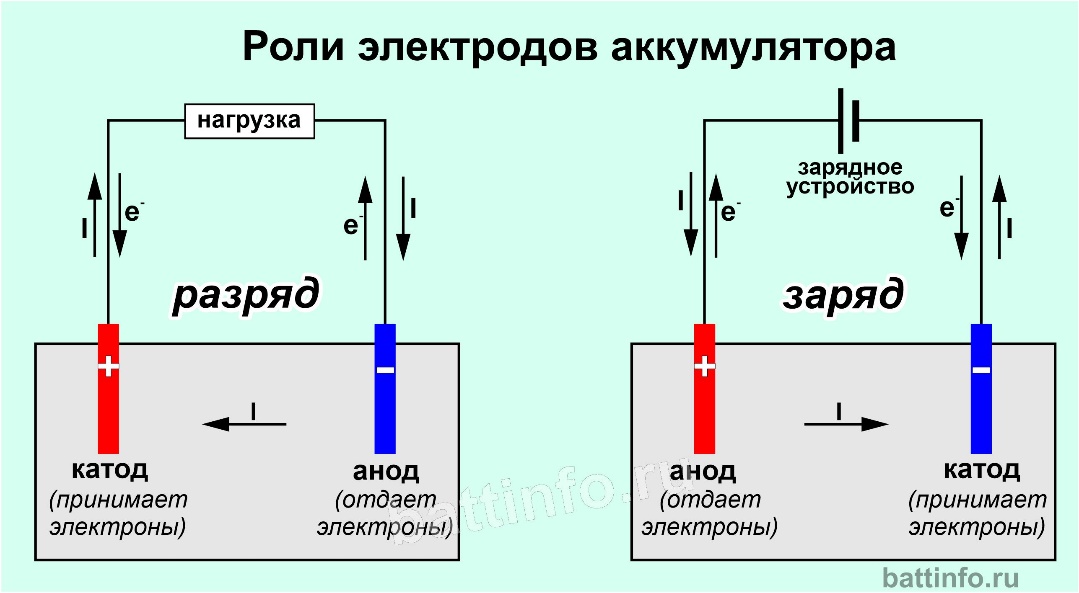 с даты выпуска с даты выпуска |
Основные технические характеристики ПГА-4:
| Наименование показателя | Значение |
|---|---|
| Диаметр отрезка токоотдающего провода а, не менее | 50 |
| Рабочая длина отрезка токоотдающего провода, м | по проекту |
| Количество отрезков, шт | по проекту, но не менее четырех |
| Материал токоввода | |
| Номинальная токовая нагрузка, А | по проекту |
| Диапазон рабочих температур**, оС, в статике | минус 60 — плюс 60 |
| Срок службы в номинальном токовом режиме, лет, не менее | 15 |
| Гарантийный срок хранения | 12 мес. с даты выпуска |
Главные ошибки при оцинковке кузова автомобиля своими силами — Лайфхак
- Лайфхак
- Эксплуатация
Фото vesta-site.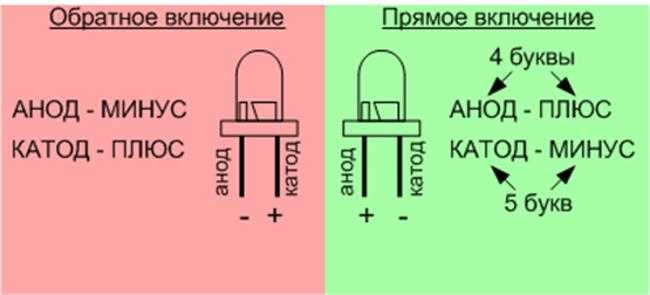 ru
ru
Оцинковка кузова автомобиля — самая результативная технология борьбы с коррозией, позволяющая практически без последствий эксплуатировать авто в самых неблагоприятных условиях. Правда, весьма дорогостоящая. Не мудрено поэтому, что владельцы подержанных авто, особенно тех, что уже «зацвели», предпочитают проводить эту процедуру самостоятельно. Но, как правило, без особого успеха. Почему, и как правильно цинковать машину в домашних условиях, разобрался портал «АвтоВзгляд».
Дмитрий Цыпкин
При самостоятельном кузовном ремонте заботливый водитель предпочитает покрыть чем-нибудь голый металл перед покраской. И выбор, как правило, падает на «что-нибудь с цинком». Однако мло кто знает, что на рынке сегодня ничтожно мало специальных составов для настоящего цинкования. В магазинах автовладельцу чаще всего впаривают грунты с, якобы, цинком, и невероятными преобразователями ржавчины в цинк. Все это мало относится к настоящему цинкованию.
НАПРАСНЫЕ СЛОВА…
Итак, на вашем автомобиле появился расползающийся «жучок» ржавчины.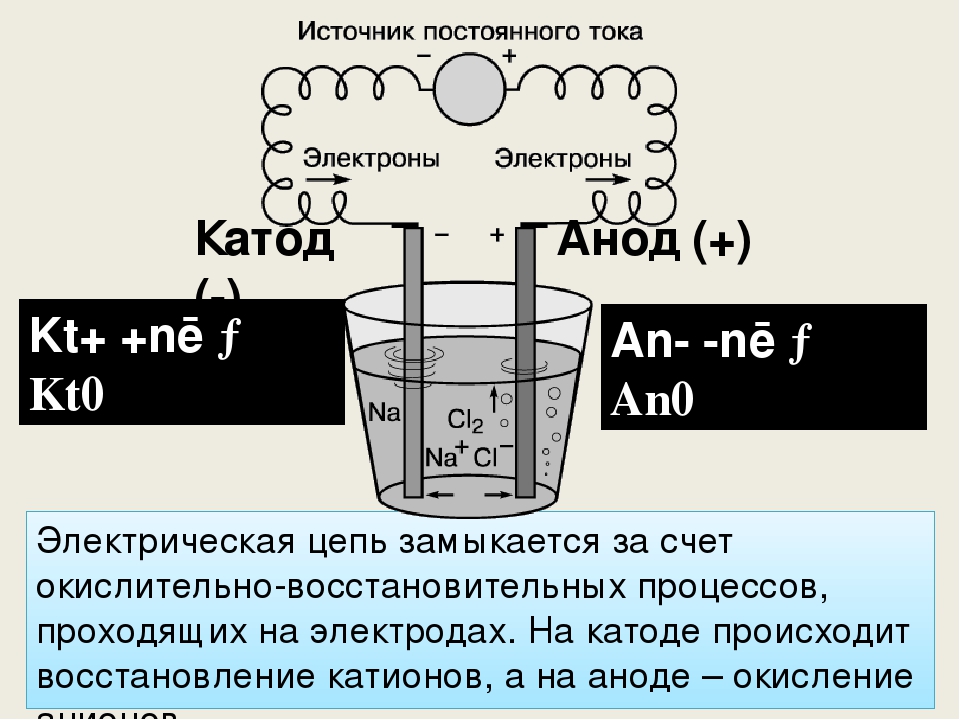 В случае с подержанными авто — ситуация частая, особенно в районе порогов и колесных арок. Обычно эти места просто зачищают от рыхлой ржавчины, смачивают каким-нибудь преобразователем, наносят грунт и краску. Какое-то время все нормально, а потом ржа вылезает вновь. Как же так? Ведь при подготовке использовали преобразователь ржавчины в цинк! По крайней мере, что-то такое было написано на этикетке.
В случае с подержанными авто — ситуация частая, особенно в районе порогов и колесных арок. Обычно эти места просто зачищают от рыхлой ржавчины, смачивают каким-нибудь преобразователем, наносят грунт и краску. Какое-то время все нормально, а потом ржа вылезает вновь. Как же так? Ведь при подготовке использовали преобразователь ржавчины в цинк! По крайней мере, что-то такое было написано на этикетке.
На самом деле все подобные препарата сделаны на основе ортофосфорной кислоты и максимум, что может подобный состав — фосфатировать поверхность, причем это будет пористое фосфатирование, которое в дальнейшем заржавеет. Получившаяся пленка не может использоваться как самостоятельная защита — только лишь под покраску. Соответственно, если краска некачественная, либо просто слезла — этот слой не защитит от коррозии.
Фото a.d-cd.net
ЧТО ВЫБРАТЬ?
На полках наших магазинов есть и реальные составы для самостоятельного цинкования, причем двух видов — для холодного цинкования (это процесс еще называют цинкирование) и для гальванического (в комплекте обычно идут и электролит, и анод), но стоят они на порядок дороже преобразователей. Холодное цинкование в расчет не берем, его изначально придумали для покрытия металлоконструкций, оно неустойчиво к органическим растворителям и механическим повреждениям. Нас интересует гальванической способ нанесения цинка, при этом все необходимое для этого процесса можно сделать дома. Итак, понадобится для того, чтобы оцинковать участок кузова?
Холодное цинкование в расчет не берем, его изначально придумали для покрытия металлоконструкций, оно неустойчиво к органическим растворителям и механическим повреждениям. Нас интересует гальванической способ нанесения цинка, при этом все необходимое для этого процесса можно сделать дома. Итак, понадобится для того, чтобы оцинковать участок кузова?
Прежде чем приступить — следует помнить про соблюдение техники безопасности при работе с реактивами: использовать респираторную маска, резиновые перчатки, защитные очки, а все манипуляции проводить на открытом воздухе или в хорошо проветриваемом помещении.
ПЛЮС КИПЯТОК
Этап первый. Подготовка металла. Поверхность стали должна быть полностью зачищена от ржавчины и краски. Цинк на ржавчину не ложится, на краску — тем более. Используем наждачную бумагу или специальные насадки на дрель. Малогабаритную деталь проще всего прокипятить в 10-процентном (100 грамм кислоты на 900 мл воды) растворе лимонной кислоты до полного уничтожения ржавчины. Затем поверхность обезжирить.
Затем поверхность обезжирить.
Этап второй. Подготовка электролита и анода. Гальванический процесс цинкования таков. В растворе электролита (электролит служит проводником вещества) цинковый анод (то есть плюс) передает цинк на катод (то есть минус). В Сети бродит множество рецептов электролита. Самый простой — использовать соляную кислоту, в которой растворяют цинк.
Фото vash-avtomaster.narod.ru
Кислоту можно купить в магазине химических реактивов, либо в хозяйственном. Цинк — в том же магазине химреактивов, либо приобрести обычные солевые батарейки и извлечь из них корпус — он сделан из цинка. Цинк нужно растворять до тех пор, пока он не перестанет реагировать. При этом выделяется газ, так что все манипуляции, повторимся, нужно проводить на улице или в хорошо проветриваемом помещении.
Электролит посложнее делается таким образом — в 62 миллилитрах воды растворяем 12 граммов хлористого цинка, 23 грамма хлористого калия и 3 грамма борной кислоты. Если нужно больше электролита, ингредиенты нужно увеличивать пропорционально.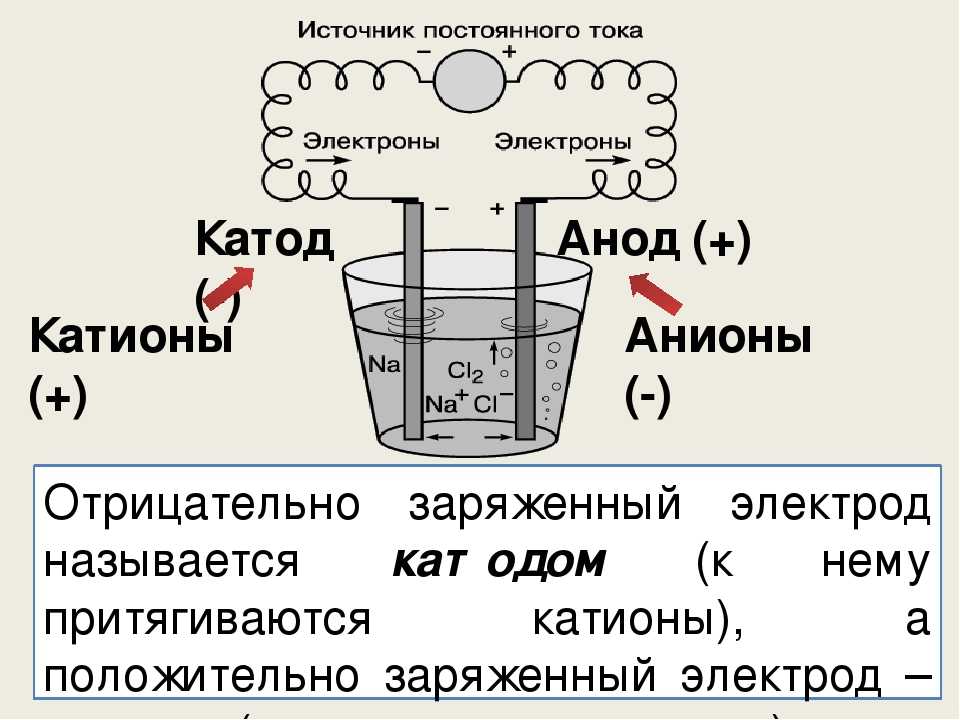 Подобные реактивы проще всего взять в специальном магазине.
Подобные реактивы проще всего взять в специальном магазине.
МЕДЛЕННО И ПЕЧАЛЬНО
Этап третий. У нас есть полностью подготовленная поверхность — очищенный и обезжиренный металл, анод в виде цинкового корпуса от батарейки, электролит. Обернем анод ватным диском, либо ватой, либо сложенной в несколько слоев марлей. Подключим анод к плюсу автомобильного аккумулятора через провод подходящей длины, а минус к кузову автомобиля. Обмакнем вату на аноде в электролит так, чтобы она пропиталась. Теперь медленными движениями начинаем водить по голому металлу. На нем должно появиться серое покрытие.
Фото mir-auto24.ru
В ЧЕМ ОШИБКА?
Если покрытие темное (а следовательно — хрупкое и пористое) — значит либо вы медленно водите анодом, либо слишком высокая плотность тока (в этом случае минус от аккумулятора отведите подальше), либо на вате подсох электролит. Равномерный серый налет не должен счищаться ногтем. Регулировать толщину покрытия придется на глаз. Таким образом можно нанести до 15—20 мкм покрытия. Скорость его разрушения примерно по 6 мкм в год при контакте с внешней средой.
Скорость его разрушения примерно по 6 мкм в год при контакте с внешней средой.
В случае с деталью, ей нужно приготовить ванну (пластиковую или стеклянную) с электролитом. Процесс такой же — плюс на цинковый анод, минус на запчасть. Анод и запчасть следует поместить в электролит так, чтобы они не касались друг друга. Затем просто следите за осаждением цинка.
После того, как вы нанесли цинк, необходимо хорошо промыть место цинкования водой, чтобы убрать весь электролит. Не лишним будет перед покраской еще раз обезжирить поверхность. Таким образом детали или кузову можно продлить жизнь. Даже при разрушении внешнего слоя краски и грунта цинк не даст быстро заржаветь обработанному металлу.
160466
- ГАИ
- Коррупция
Как вразумить нечестного стража порядка
401660
- ГАИ
- Коррупция
Как вразумить нечестного стража порядка
401660
Подпишитесь на канал «Автовзгляд»:
- Telegram
- Яндекс.
 Дзен
Дзен
подержанные авто, автосервис, ремонт, техническое обслуживание, автохимия
электрохимия — действительно ли анод всегда отрицательный?
спросил
Изменено 6 месяцев назад
Просмотрено 934 раза
$\begingroup$
Отказ от ответственности: этот вопрос задан студентом-физиком.
Я изучал электростатику и мне было интересно, как зарядить проводник в домашних условиях без всяких навороченных мехов и т.д. И тут мне пришла идея: взять батарейку, коснуться, например, минусовой клеммы проводником, а затем снять ее. Так как минусовая клемма аккумулятора находится под отрицательным потенциалом, а проводник ранее был заземлен ($V = 0$), то поскольку их потенциалы должны сравняться, это означает, что электроны будут течь от клеммы аккумулятора к проводнику в течение короткого промежутка времени.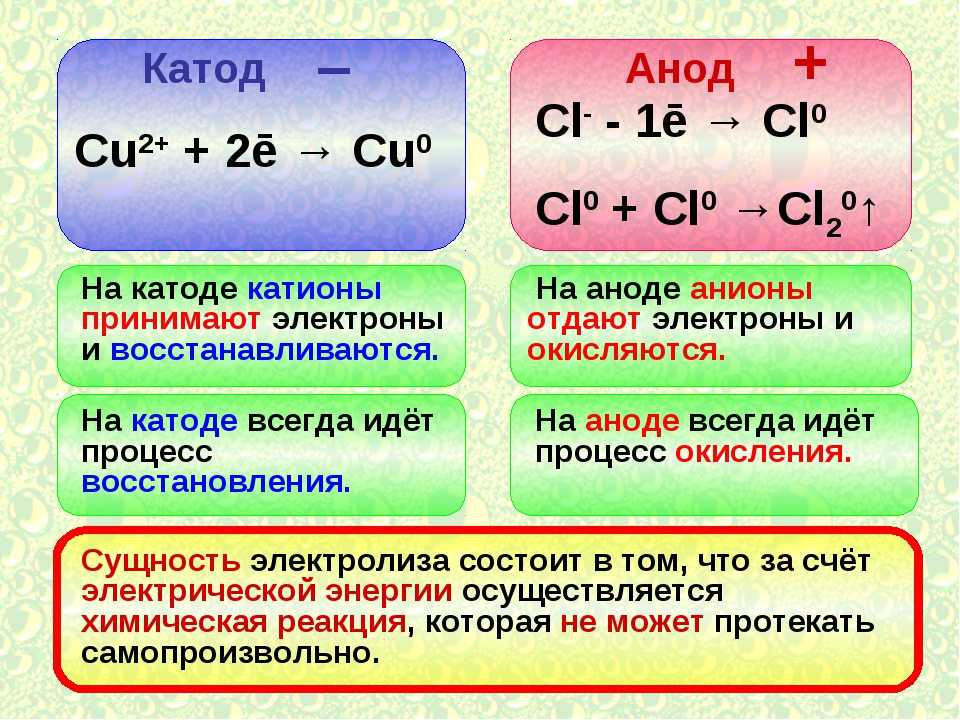
Когда электроды , а не подключены, я не уверен, что окислительно-восстановительные реакции будут происходить. В моем понимании, $Zn$ окисляется, потому что $Cu$ на другой стороне имеет большее сродство к электрону, но $Zn$ должен был бы каким-то образом «почувствовать» $Cu$ на другой стороне, иначе реакция окисления все равно произойдет для короткое время, пока не достигнет некоторой точки равновесия. Это то, что я думаю, на самом деле происходит, и поэтому анод на самом деле будет отрицательным, пока не будет подключен к катоду.
Значит, я на правильном пути и, в конце концов, увенчается ли успехом моя попытка немного зарядить проводник?
- электрохимия
- редокс
$\endgroup$
4
$\begingroup$
Это очень хороший вопрос от студента, который, кажется, глубоко задумался.
Метка анода или катода не определяется по отношению к электростатическому знаку, как объяснено в сообщении Мориса.
Представьте большой параллельный конденсатор. Подсоедините одну клемму пластины к одной положительной клемме, а другую к отрицательной клемме. Пластины конденсатора будут иметь электростатический заряд.
Во что бы то ни стало, используя одну-единственную ячейку, вы не сможете обнаружить электростатический заряд, как заряженную расческу. Это могут почувствовать только специализированные электроскопы. 9Ионы {2+}$: Медь является анодом.
При сравнении одного и того же химического уравнения, работающего в гальваническом элементе или в электролизе, $Zn$ — это , всегда — отрицательный полюс, а $Cu$ — , всегда — положительный полюс. Знаки ПЛЮС (+) или МИНУС (-) могут быть напечатаны на табличках. Но Zn является анодом в гальваническом элементе и становится катодом в системе электролиза.
Знаки ПЛЮС (+) или МИНУС (-) могут быть напечатаны на табличках. Но Zn является анодом в гальваническом элементе и становится катодом в системе электролиза.
Итак, вы видите, что анод не всегда отрицательный. Анод — это отрицательный полюс (Zn) в гальваническом элементе. Анод является положительным полюсом (Cu) в электролизе.
$\endgroup$
2
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
физическая химия — Полуэлементы: разница между E(элемент) = E(катод}-E(анод) и E(элемент) = E(окисление) + E(восстановление)
спросил
Изменено 4 года, 2 месяца назад
Просмотрено 41к раз
$\begingroup$
Когда я могу использовать каждое из вышеперечисленных средств? Если я использую один или другой, они дают мне разные результаты. 9\circ_\text{восстановление} $$
Катод фактически является стадией восстановления, а анод — стадией окисления.
Полезная мнемоника, которую я узнал от своего профессора химии: рыжий кот и бык. Интересно, катоды красные и положительные.



 Дзен
Дзен