На этот раз по-настоящему: открыто новое свойство воды
- Технологии
- Алексей Алексенко Автор
Злополучные штудии на тему «молекулярной памяти воды» и других шарлатанских материй приучили просвещенную публику игнорировать научные новости, где сообщается об открытии у воды еще каких-то неизвестных науке свойств. Между тем оказалось, что настоящая наука по-прежнему на такое способна. Речь идет о транспорте ионов — свойстве воды, которое делает ее универсальным растворителем и основой жизни на планете.
Между тем оказалось, что настоящая наука по-прежнему на такое способна. Речь идет о транспорте ионов — свойстве воды, которое делает ее универсальным растворителем и основой жизни на планете.
Одно из уникальных свойств воды — способность ее молекул распадаться на ионы водорода и гидроксила. Это качество делает воду уникальным ресурсом для получения энергии. На нем основана технология топливных ячеек, и это же свойство лежит в основе энергетики живой клетки. Ионы водорода и гидроксила не существуют в воде изолированно, на самом деле их окружает паутина целых молекул, которые взаимодействуют друг с другом и с ионами посредством водородных связей. На протяжении последнего столетия считалось установленным, что водородные связи взаимодействуют с протоном и гидроксилом абсолютно симметричным образом («с точностью до наоборот»). Однако последние теоретические модели предсказывали, что это, возможно, не так. Но если водород и гидроксил действительно переносятся водой по-разному, эта асимметрия открывает широкие возможности для разработки процессов, где один из ионов будет иметь преимущество перед другим.
Профессор Алексей Ершов из Нью-Йоркского университета и его коллеги поставили перед собой задачу экспериментально доказать существование такой асимметрии. Разработанная ими установка помогла достичь этой цели, о чем они и сообщают в своей статье.
Теоретически ожидалось, что свойство будет ярче всего проявляться в условиях «максимальной плотности» — при плюс четырех градусах по Цельсию, когда вода даже плотнее, чем лед. Благодаря этому качеству земные водоемы зимой покрываются льдом сверху, а не со дна, в противном случае жизнь в них не смогла бы развиться. При этой температуре с помощью метода ядерного магнитного резонанса исследователи измерили время существования ионов водорода и гидроксила. Разница в этом времени определяет различие в скорости транспорта двух ионов.
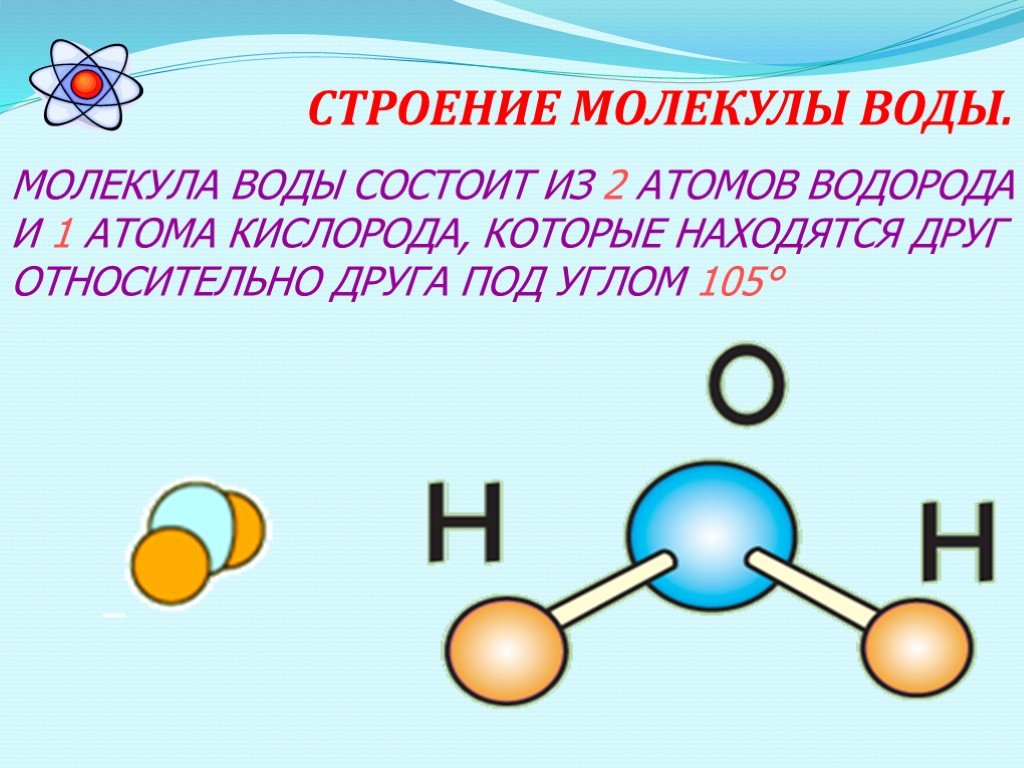
Наглядное описание процесса таково. Молекула воды Н2О состоит из атома кислорода и двух атомов водорода. Атом водорода способен прыгать с одной молекулы на другую. Эти прыжки и составляют основу движения «иона водорода» Н+ или, что то же самое, «иона гидроксония» H3O+. Так же движется и ион гидроксила ОН– (молекула воды с оторванным от нее водородом), хотя направление его движения противоположно направлению прыжка. Прыжки атомов зависят от рисунка водородных связей вокруг молекулы, и именно при одной конкретной конфигурации водородных связей ион гидроксила движется заметно медленнее, чем водород. Эта конфигурация наиболее вероятна при температуре максимальной плотности. Исследователи действительно отмечали, что наблюдаемый ими эффект скачкообразно меняется при +4
Молекула воды Н2О состоит из атома кислорода и двух атомов водорода. Атом водорода способен прыгать с одной молекулы на другую. Эти прыжки и составляют основу движения «иона водорода» Н+ или, что то же самое, «иона гидроксония» H3O+. Так же движется и ион гидроксила ОН– (молекула воды с оторванным от нее водородом), хотя направление его движения противоположно направлению прыжка. Прыжки атомов зависят от рисунка водородных связей вокруг молекулы, и именно при одной конкретной конфигурации водородных связей ион гидроксила движется заметно медленнее, чем водород. Эта конфигурация наиболее вероятна при температуре максимальной плотности. Исследователи действительно отмечали, что наблюдаемый ими эффект скачкообразно меняется при +4
Марк Такерман, соавтор работы и тот самый теоретик, который ранее предсказал асимметрию в поведении ионов, считает, что открытый эффект открывает дорогу для создания новых материалов, которые будут применяться в альтернативной «чистой» энергетике.
Научное исследование и описание структурированной воды
Суть новизны заключается в перестройке самой структуры воды.
Молекула воды Н2О состоит из двух атомов водорода и атома кислорода. Это очень устойчивая структура. Силы взаимодействия молекул и атомов сводятся к кулоновскому притяжению и отталкиванию положительно заряженных атомных ядер и отрицательных электронов. К ним относятся химические или валентные силы; собственно за счет этих сил и образуется устойчивая молекула воды Н2О. В общем случае, два атома водорода, входящие в молекулу, различные: один атом
Каждая из молекул воды образует до 4 водородных связей — 2 из них образует атом кислорода и 2 — атомы водорода. Количество водородных связей и их разветвленная структура во многом определяются соотношением ортоводорода и параводорода в молекулах воды. Меняя это соотношение, меняется структура воды. Водородные связи могут образовывать как право-, так и левовинтовую последовательности, подобно тому, как кристаллы кварца бывают правой и левой азимутальной кристаллической формы. Так как каждый такой
Меняя это соотношение, меняется структура воды. Водородные связи могут образовывать как право-, так и левовинтовую последовательности, подобно тому, как кристаллы кварца бывают правой и левой азимутальной кристаллической формы. Так как каждый такой
Сейчас наукой установлено, что особенности физических свойств воды и многочисленные короткоживущие водородные связи между соседними атомами водорода и кислорода в молекуле воды создают благоприятные возможности для образования особых структур-
Непосредственной причиной образования водяных кластеров являются водородные связи между молекулами воды. Они возникают между ядрами водорода одних молекул и «сгущениями» электронной плотности у ядер кислорода других молекул воды. Водородные связи легко разрушаются под действием тепловых колебаний молекул и быстро восстанавливаются вновь, что делает структуру воды исключительно изменчивой. Именно благодаря этим связям в отдельных микрообъемах воды непрерывно возникают структурные элементы —
х • Н2О ‹—› (Н2О)Х
Благодаря Рамановой электроскопии в 2005 г. коллектив учёных из университета Беркли, США — Гейслер, Сейкапи и Смит, показали, что связи водорода между молекулами воды находятся в постоянном движении, постоянно разрываются и меняются. При каждом значении температуры в воде устанавливается свое динамическое равновесие в этом процессе. При нагревании воды часть теплоты затрачивается на разрыв водородных связей в кластерах.
Протоны, как и электроны, обладают спином 1/2 (В единицах h), Поэтому полная волновая функция системы, состоящей из этих частиц, должна быть антисимметрична относительно перестановки двух протонов. Спиновый магнитный момент протона примерно в 657,5 раза меньше, чем у электрона. Поэтому еще с большим основанием, чем для электронов, можно сказать, что в молекуле водорода полная протонная волновая функция может быть представлена в виде произведения пространственной волновой функции на спиновую. Такие же рассуждения, какие были проведены для двух электронов, показывают, что в молекуле водорода могут реализоваться только следующие два состояния:
- Состояние, на котором спиновая волновая функция протонов антисимметрична, а следовательно, пространственная функция
симметрична. В этом случае водород называется параводородом. Образно можно сказать, что в молекуле параводорода спины протонов антипараллельны. - Состояние, в котором спиновая волновая функция протонов симметрична, а следовательно, пространственная антисимметрична.
 На образном языке это означает, что в этом случае спины протонов параллельны. Такой водород называется ортоводородом.
На образном языке это означает, что в этом случае спины протонов параллельны. Такой водород называется ортоводородом.
Так как в молекуле водорода электронные спины всегда взаимно компенсируются, то ее спин I обусловлен только спинами ядер. Для молекулы параводорода I = 0, для молекулы ортоводорода I = 1. [Сивухин Д.В.
Общий курс физики Том 5. Часть 1. Атомная физика. §51].
Существует несколько способов превращения параводорода в ортоводород и
обратно (с помощью катализатора) для чего требуется переориентировать
спины ядер, что мы умеем делать на своей установке. Этот процесс
проводимый дает возможность получить практически чистый параводород,
если же не равновесную смесь на длительное время предоставить самому
себе, то ее состав будет меняться.
Лиганд — (от Лат. Ligare «связывать») в комплексных соединениях молекулы или ионы или радикалы связанные с центральным атомом (комплексообразователем). Таким образом трансформированная вода с помощью лиганда приобретает доменную устойчивую структуру и по физико-химическим свойствам сильно отличается от обычной природной воды.
Таким образом трансформированная вода с помощью лиганда приобретает доменную устойчивую структуру и по физико-химическим свойствам сильно отличается от обычной природной воды.
Эта технология позволяет многократно усилить природные свойства воды и в сочетании с целебными свойствами растений становится чудодейственным эликсиром для восстановления и укрепления здоровья. Это подтверждают врачи и многочисленные пациенты:
2.2 Вода – Биология 2e
Цели обучения
К концу этого раздела вы сможете делать следующее:
- Описывать свойства воды, которые имеют решающее значение для поддержания жизни
- Объясните, почему вода является отличным растворителем
- Приведите примеры когезионных и адгезивных свойств воды
- Обсудите роль кислот, оснований и буферов в гомеостазе
Почему ученые тратят время на поиски воды на других планетах? Почему вода так важна? Это потому, что вода необходима для жизни, какой мы ее знаем. Вода — одна из самых распространенных молекул и наиболее важная для жизни на Земле. Вода составляет примерно 60–70 процентов человеческого тела. Без него жизнь, какой мы ее знаем, просто не существовала бы.
Вода — одна из самых распространенных молекул и наиболее важная для жизни на Земле. Вода составляет примерно 60–70 процентов человеческого тела. Без него жизнь, какой мы ее знаем, просто не существовала бы.
Полярность молекулы воды и образовавшаяся в результате водородная связь делают воду уникальным веществом с особыми свойствами, тесно связанными с жизненными процессами. Первоначально жизнь развивалась в водной среде, и большая часть клеточной химии и метаболизма организма происходит внутри водянистого содержимого цитоплазмы клетки. Особыми свойствами воды являются ее высокая теплоемкость и теплота парообразования, ее способность растворять полярные молекулы, ее когезионные и адгезивные свойства, а также ее диссоциация на ионы, что приводит к образованию рН. Понимание этих характеристик воды помогает понять ее важность для поддержания жизни.
Полярность воды
Одним из важных свойств воды является то, что она состоит из полярных молекул: водород и кислород внутри молекул воды (H 2 O) образуют полярные ковалентные связи. В то время как у молекулы воды нет чистого заряда, полярность воды создает слегка положительный заряд на водороде и слегка отрицательный заряд на кислороде, способствуя свойствам притяжения воды. Вода генерирует заряды, потому что кислород более электроотрицательный, чем водород, что делает более вероятным, что общий электрон будет находиться рядом с ядром кислорода, чем ядро водорода, таким образом создавая частичный отрицательный заряд рядом с кислородом.
В то время как у молекулы воды нет чистого заряда, полярность воды создает слегка положительный заряд на водороде и слегка отрицательный заряд на кислороде, способствуя свойствам притяжения воды. Вода генерирует заряды, потому что кислород более электроотрицательный, чем водород, что делает более вероятным, что общий электрон будет находиться рядом с ядром кислорода, чем ядро водорода, таким образом создавая частичный отрицательный заряд рядом с кислородом.
В результате полярности воды каждая молекула воды притягивает другие молекулы воды из-за противоположных зарядов между молекулами воды, образуя водородные связи. Вода также притягивает или притягивается к другим полярным молекулам и ионам. Мы называем полярное вещество, легко взаимодействующее с водой или растворяющееся в ней, гидрофильным (гидро- = «вода»; -philic = «любящий»). Напротив, неполярные молекулы, такие как масла и жиры, плохо взаимодействуют с водой, как показано на рис. 2.13. Хорошим примером этого является заправка для салата из уксуса и масла (кислый водный раствор). Мы называем такие неполярные соединения гидрофобными (гидро- = «вода»; -фоб = «боязнь»).
Мы называем такие неполярные соединения гидрофобными (гидро- = «вода»; -фоб = «боязнь»).
Рисунок 2.13 Полярность воды. Полярность воды обусловлена различной электроотрицательностью водорода и кислорода. В результате водородные связи образуются при слегка отрицательный кислород одной молекулы воды притягивается слегка положительным водородом другой молекулы воды. Авторы и права: Рао А., Флетчер С., Райан К., Таг, А. и Хокинс, А. Факультет биологии, Техасский университет A&M
Состояния воды: газ, жидкость и твердое тело
Образование водородных связей является важным качеством жидкой воды, которое имеет решающее значение для жизни, какой мы ее знаем. Поскольку молекулы воды образуют водородные связи друг с другом, вода приобретает некоторые уникальные химические характеристики по сравнению с другими жидкостями, и, поскольку живые существа имеют высокое содержание воды, понимание этих химических свойств является ключом к пониманию жизни. В жидкой воде водородные связи постоянно образуются и разрываются, когда молекулы воды скользят друг относительно друга. Движение молекул воды (кинетическая энергия) вызывает разрыв связей за счет тепла, содержащегося в системе. Когда тепло повышается при кипении воды, более высокая кинетическая энергия молекул воды приводит к полному разрыву водородных связей и позволяет молекулам воды выходить в воздух в виде газа (пара или водяного пара). В качестве альтернативы, когда температура воды снижается и вода замерзает, молекулы воды образуют кристаллическую структуру, поддерживаемую водородными связями (энергии недостаточно для разрыва водородных связей), что делает лед менее плотным, чем жидкая вода, явление, которое мы не наблюдаем, когда другие жидкости затвердевают.
В жидкой воде водородные связи постоянно образуются и разрываются, когда молекулы воды скользят друг относительно друга. Движение молекул воды (кинетическая энергия) вызывает разрыв связей за счет тепла, содержащегося в системе. Когда тепло повышается при кипении воды, более высокая кинетическая энергия молекул воды приводит к полному разрыву водородных связей и позволяет молекулам воды выходить в воздух в виде газа (пара или водяного пара). В качестве альтернативы, когда температура воды снижается и вода замерзает, молекулы воды образуют кристаллическую структуру, поддерживаемую водородными связями (энергии недостаточно для разрыва водородных связей), что делает лед менее плотным, чем жидкая вода, явление, которое мы не наблюдаем, когда другие жидкости затвердевают.
Меньшая плотность воды в твердом состоянии обусловлена тем, как ориентируются водородные связи при замерзании: молекулы воды расходятся дальше друг от друга по сравнению с жидкой водой. Для большинства других жидкостей затвердевание при падении температуры включает снижение кинетической энергии между молекулами, что позволяет им упаковываться даже более плотно, чем в жидкой форме, и придает твердому телу большую плотность, чем жидкость.
Низкая плотность льда, как показано на рис. 2.14, аномалия заставляет его плавать на поверхности жидкой воды, например, в айсберге или кубиках льда в стакане воды. В озерах и прудах на поверхности воды образуется лед, создающий изолирующий барьер, защищающий животных и растения в пруду от замерзания. Без этого изолирующего слоя льда растения и животные, живущие в пруду, замерзли бы в сплошной глыбе льда и не смогли бы выжить. Расширение льда относительно жидкой воды вызывает губительное действие замерзания на живые организмы. Кристаллы льда, образующиеся при замораживании, разрывают тонкие мембраны, необходимые для функционирования живых клеток, необратимо повреждая их. Клетки могут пережить замораживание только в том случае, если другая жидкость, такая как глицерин, временно заменит воду в них.
Рисунок
2.14
Водородная связь делает лед менее плотным, чем жидкая вода. (а) решетчатая структура льда делает его менее плотным, чем свободно текущие молекулы жидкой воды, что позволяет ему (б) плавать на поверхности воды. (кредит а: модификация работы Джейн Уитни, изображение создано с использованием программного обеспечения Visual Molecular Dynamics (VMD) 1 ; кредит б: модификация работы Карлоса Понте)
(кредит а: модификация работы Джейн Уитни, изображение создано с использованием программного обеспечения Visual Molecular Dynamics (VMD) 1 ; кредит б: модификация работы Карлоса Понте)
Ссылка на обучение
Ссылка на обучение
Щелкните здесь, чтобы увидеть трехмерную анимацию структуры ледяной решетки.
Высокая теплоемкость воды
Высокая теплоемкость воды — это свойство, которое вызывается водородными связями между молекулами воды. Вода обладает наибольшей удельной теплоемкостью среди всех жидкостей. Мы определяем удельную теплоемкость как количество тепла, которое должен поглотить или отдать один грамм вещества, чтобы изменить его температуру на один градус Цельсия. Для воды это количество составляет одну калорию. Поэтому вода долго нагревается и долго охлаждается. На самом деле удельная теплоемкость воды примерно в пять раз больше, чем у песка. Это объясняет, почему суша остывает быстрее, чем море. Благодаря высокой теплоемкости теплокровные животные используют воду для более равномерного распределения тепла в своем теле: она действует аналогично системе охлаждения автомобиля, перенося тепло из теплых мест в холодные, заставляя тело поддерживать более равномерную температуру. температура.
Это объясняет, почему суша остывает быстрее, чем море. Благодаря высокой теплоемкости теплокровные животные используют воду для более равномерного распределения тепла в своем теле: она действует аналогично системе охлаждения автомобиля, перенося тепло из теплых мест в холодные, заставляя тело поддерживать более равномерную температуру. температура.
Теплота испарения воды
Вода также имеет высокую теплоту парообразования, количество энергии, необходимое для превращения одного грамма жидкого вещества в газ. Для осуществления этого превращения воды требуется значительное количество тепловой энергии (586 кал). Этот процесс происходит на поверхности воды. Когда жидкая вода нагревается, водородные связи затрудняют отделение молекул жидкой воды друг от друга, что необходимо для ее перехода в газообразную фазу (пар). В результате вода действует как поглотитель или резервуар тепла, и для ее кипения требуется гораздо больше тепла, чем для такой жидкости, как этанол (зерновой спирт), водородная связь которого с другими молекулами этанола слабее, чем водородная связь воды. В конце концов, когда вода достигает точки кипения 100 ° по Цельсию (212 ° по Фаренгейту), тепло может разорвать водородные связи между молекулами воды, а кинетическая энергия (движение) между молекулами воды позволяет им покинуть жидкость. как газ. Даже когда температура ниже точки кипения, отдельные молекулы воды получают достаточно энергии от других молекул воды, так что некоторые молекулы воды с поверхности могут ускользнуть и испариться: мы называем этот процесс испарением.
В конце концов, когда вода достигает точки кипения 100 ° по Цельсию (212 ° по Фаренгейту), тепло может разорвать водородные связи между молекулами воды, а кинетическая энергия (движение) между молекулами воды позволяет им покинуть жидкость. как газ. Даже когда температура ниже точки кипения, отдельные молекулы воды получают достаточно энергии от других молекул воды, так что некоторые молекулы воды с поверхности могут ускользнуть и испариться: мы называем этот процесс испарением.
Тот факт, что водородные связи должны быть разорваны, чтобы вода испарилась, означает, что связи используют в процессе значительное количество энергии. Когда вода испаряется, процесс потребляет энергию, охлаждая окружающую среду, в которой происходит испарение. У многих живых организмов, в том числе и у человека, испарение пота, состоящего на 90% из воды, позволяет организму охлаждаться, чтобы поддерживать гомеостаз температуры тела.
Растворяющие свойства воды
Поскольку вода представляет собой полярную молекулу со слегка положительным и слегка отрицательным зарядом, ионы и полярные молекулы могут легко растворяться в ней. Поэтому мы называем воду растворителем, веществом, способным растворять другие полярные молекулы и ионные соединения. Заряды, связанные с этими молекулами, будут образовывать водородные связи с водой, окружая частицу молекулами воды. Мы называем это сферой гидратации или гидратной оболочкой, как показано на рис. 2.15, и она служит для разделения или диспергирования частиц в воде.
Поэтому мы называем воду растворителем, веществом, способным растворять другие полярные молекулы и ионные соединения. Заряды, связанные с этими молекулами, будут образовывать водородные связи с водой, окружая частицу молекулами воды. Мы называем это сферой гидратации или гидратной оболочкой, как показано на рис. 2.15, и она служит для разделения или диспергирования частиц в воде.
Когда мы добавляем в воду ионные соединения, отдельные ионы реагируют с полярными областями молекул воды, и их ионные связи разрываются в процессе диссоциации. Диссоциация происходит, когда атомы или группы атомов отрываются от молекул и образуют ионы. Рассмотрим поваренную соль (NaCl или хлорид натрия): когда мы добавляем кристаллы NaCl в воду, молекулы NaCl диссоциируют на ионы Na + и Cl – , и вокруг ионов образуются сферы гидратации, как показано на рис. 2.15. Частично отрицательный заряд кислорода молекулы воды окружает положительно заряженный ион натрия. Частично положительный заряд водорода на молекуле воды окружает отрицательно заряженный ион хлорида.
Рисунок 2,15 Когда мы смешиваем поваренную соль (NaCl) с водой, она образует вокруг ионов гидратированные сферы.
Когезионные и адгезионные свойства воды
Вы когда-нибудь наполняли стакан водой до самого верха, а затем медленно добавляли еще несколько капель? Прежде чем перелиться через край, вода образует куполообразную форму над краем стакана. Эта вода может оставаться над стеклом благодаря свойству когезии. При когезии молекулы воды притягиваются друг к другу (из-за водородных связей), удерживая молекулы вместе на границе раздела жидкость-газ (вода-воздух), хотя в стекле больше нет места.
Когезия учитывает поверхностное натяжение, способность вещества выдерживать разрыв при напряжении или напряжении. По этой же причине вода образует капли на сухой поверхности, а не сплющивается под действием силы тяжести. Когда мы кладем небольшой клочок бумаги на каплю воды, бумага всплывает на поверхность, даже несмотря на то, что бумага плотнее (тяжелее), чем вода. Когезия и поверхностное натяжение сохраняют водородные связи молекул воды неповрежденными и поддерживают плавание предмета на поверхности. Иголку можно даже «поплавать» над стаканом с водой, если положить ее осторожно, не нарушая поверхностного натяжения, как показано на рис. 2.16.
Когезия и поверхностное натяжение сохраняют водородные связи молекул воды неповрежденными и поддерживают плавание предмета на поверхности. Иголку можно даже «поплавать» над стаканом с водой, если положить ее осторожно, не нарушая поверхностного натяжения, как показано на рис. 2.16.
Рисунок 2.16 Вес иглы тянет поверхность вниз. В то же время поверхностное натяжение тянет его вверх, удерживая на поверхности воды, не давая ему утонуть. Обратите внимание на углубление в воде вокруг иглы. (кредит: Кори Занкер)
Эти когезионные силы связаны со свойством воды прилипать или притяжением между молекулами воды и другими молекулами. Это притяжение иногда сильнее, чем силы сцепления воды, особенно когда вода подвергается воздействию заряженных поверхностей, например, внутри тонких стеклянных трубок, известных как капиллярные трубки. Мы наблюдаем адгезию, когда вода «поднимается» вверх по трубке, помещенной в стакан с водой: обратите внимание, что вода кажется выше по бокам трубки, чем в середине. Это связано с тем, что молекулы воды притягиваются к заряженным стеклянным стенкам капилляра больше, чем друг к другу, и поэтому прилипают к нему. Мы называем этот тип адгезии капиллярным действием, как показано на рис. 2.17.
Это связано с тем, что молекулы воды притягиваются к заряженным стеклянным стенкам капилляра больше, чем друг к другу, и поэтому прилипают к нему. Мы называем этот тип адгезии капиллярным действием, как показано на рис. 2.17.
Рисунок 2.17 Силы сцепления, создаваемые внутренней поверхностью стекла, превышающие силы сцепления между самими молекулами воды, вызывают капиллярное действие в стеклянной трубке. (кредит: модификация работы Пирсона-Скотта Форесмана, переданная в дар Фонду Викимедиа)
Почему когезионные и адгезионные силы важны для жизни? Когезионные и адгезионные силы важны для транспортировки воды от корней к листьям растений. Эти силы создают «притяжение» к толще воды. Это притяжение возникает из-за тенденции молекул воды, испаряющихся на поверхности растения, оставаться связанными с молекулами воды под ними, и поэтому они притягиваются. Растения используют это природное явление, чтобы переносить воду от корней к листьям. Без этих свойств воды растения не смогли бы получать воду и растворенные минералы, которые им необходимы. В другом примере насекомые, такие как водомерка, как показано на рис. 2.18, используют поверхностное натяжение воды, чтобы оставаться на плаву в поверхностном слое воды и даже спариваться там.
В другом примере насекомые, такие как водомерка, как показано на рис. 2.18, используют поверхностное натяжение воды, чтобы оставаться на плаву в поверхностном слое воды и даже спариваться там.
Рисунок 2.18 Когезионные и липкие свойства воды позволяют этому водомеру ( Gerris sp.) оставаться на плаву. (кредит: Тим Викерс)
рН, буферы, кислоты и основания
pH раствора указывает на его кислотность или щелочность.
h3O(I)↔H+(водн.)+OH-(водн.)h3O(I)↔H+(водн.)+OH-(водн.)
Возможно, вы использовали лакмусовую или pH-бумагу, фильтровальную бумагу, обработанную натуральной водой. растворимый краситель для использования в качестве индикатора рН. Он проверяет, сколько кислоты (кислотность) или основания (основность) существует в растворе. Возможно, вы даже использовали некоторые из них, чтобы проверить, правильно ли очищается вода в бассейне. В обоих случаях тест pH измеряет концентрацию ионов водорода в данном растворе.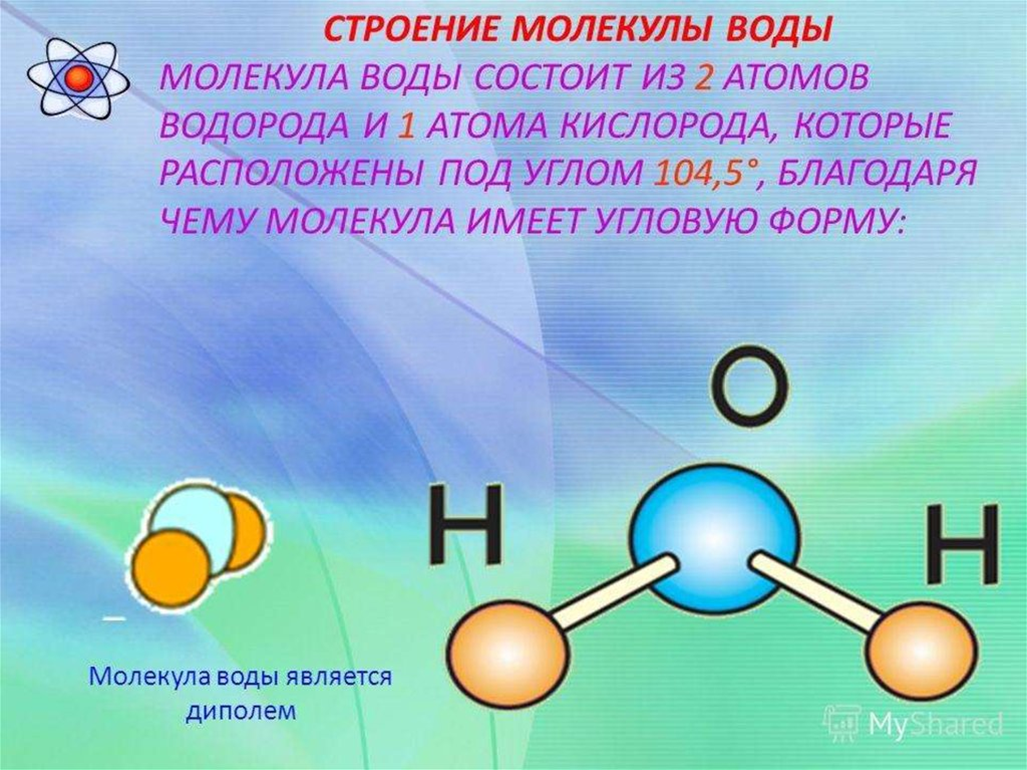
Ионы водорода спонтанно образуются в чистой воде путем диссоциации (ионизации) небольшого процента молекул воды на равное количество ионов водорода (H + ) и ионов гидроксида (OH — ). В то время как ионы гидроксида удерживаются в растворе за счет водородных связей с другими молекулами воды, ионы водорода, состоящие из голых протонов, немедленно притягиваются к неионизированным молекулам воды, образуя ионы гидроксония (H 3 O + ). Тем не менее, условно ученые относятся к ионам водорода и их концентрации так, как если бы они находились в этом состоянии в жидкой воде в свободном состоянии.
Концентрация ионов водорода, диссоциирующих из чистой воды, составляет 1×10 -7 молей H + ионов на литр воды. Моли (моль) — это способ выражения количества вещества (которым могут быть атомы, молекулы, ионы и т. д.). Один моль представляет собой атомный вес вещества, выраженный в граммах, который равен количеству вещества, содержащему столько единиц, сколько атомов содержится в 12 граммах 12 C.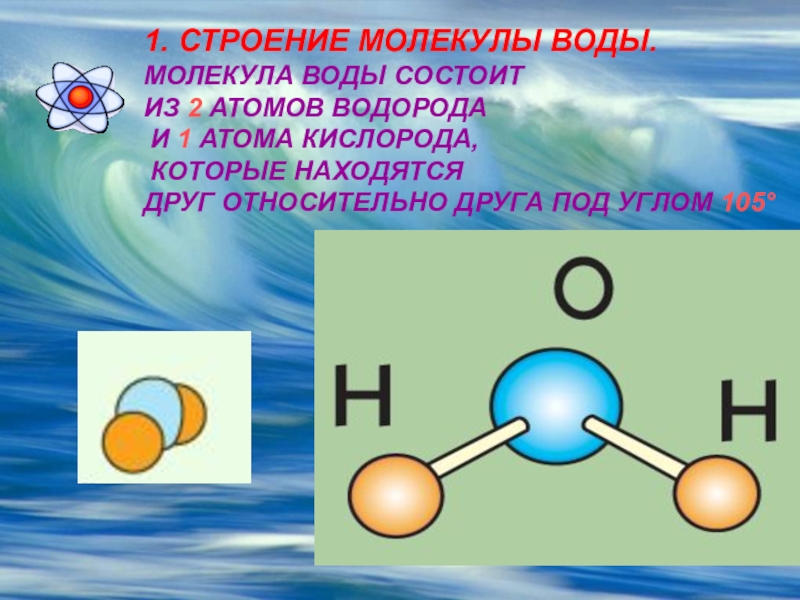 Математически один моль равен 6,02 × 10 23 частиц вещества. Следовательно, 1 моль воды равен 6,02 × 10 23 молекул воды. Мы рассчитываем pH как отрицательную величину логарифма по основанию 10 этой концентрации. Log10 1 × 10 -7 равен -7,0, и отрицательное значение этого числа (обозначаемое буквой «p» в «pH») дает значение pH 7,0, что также является нейтральным значением pH. pH внутри человеческих клеток и крови являются примерами двух областей тела, где поддерживается почти нейтральный pH.
Математически один моль равен 6,02 × 10 23 частиц вещества. Следовательно, 1 моль воды равен 6,02 × 10 23 молекул воды. Мы рассчитываем pH как отрицательную величину логарифма по основанию 10 этой концентрации. Log10 1 × 10 -7 равен -7,0, и отрицательное значение этого числа (обозначаемое буквой «p» в «pH») дает значение pH 7,0, что также является нейтральным значением pH. pH внутри человеческих клеток и крови являются примерами двух областей тела, где поддерживается почти нейтральный pH.
Ненейтральные значения рН возникают в результате растворения кислот или оснований в воде. Используя отрицательный логарифм для получения положительных целых чисел, высокие концентрации ионов водорода дают низкое значение pH; тогда как низкие уровни ионов водорода приводят к высокому pH. Кислота — это вещество, которое увеличивает количество ионов водорода (H + ) концентрации в растворе, обычно за счет диссоциации одного из его атомов водорода. Основание обеспечивает либо гидроксид-ионы (OH — ), либо другие отрицательно заряженные ионы, которые соединяются с ионами водорода, уменьшая их концентрацию в растворе и тем самым повышая pH. В тех случаях, когда основание высвобождает ионы гидроксида, эти ионы связываются со свободными ионами водорода, образуя новые молекулы воды.
Основание обеспечивает либо гидроксид-ионы (OH — ), либо другие отрицательно заряженные ионы, которые соединяются с ионами водорода, уменьшая их концентрацию в растворе и тем самым повышая pH. В тех случаях, когда основание высвобождает ионы гидроксида, эти ионы связываются со свободными ионами водорода, образуя новые молекулы воды.
Чем сильнее кислота, тем легче она отдает H + . Например, соляная кислота (HCl) полностью диссоциирует на ионы водорода и хлорида и является очень кислой; тогда как кислоты в томатном соке или уксусе полностью не диссоциируют и являются слабыми кислотами. И наоборот, сильные основания — это те вещества, которые легко отдают ОН – или поглощают ионы водорода. Гидроксид натрия (NaOH) и многие бытовые чистящие средства сильно щелочные и быстро выделяют OH – , когда мы помещаем их в воду, тем самым повышая pH. Примером слабощелочного раствора является морская вода с pH около 8,0. Это достаточно близко к нейтральному pH, к которому морские организмы приспособились, чтобы жить и процветать в соленой среде.
Шкала рН, как мы упоминали ранее, является обратным логарифмом и колеблется от 0 до 14 (рис. 2.19).). Все, что ниже 7,0 (от 0,0 до 6,9), является кислотным, а все, что выше 7,0 (от 7,1 до 14,0), является щелочным. Экстремальные значения pH в любом направлении от 7,0 обычно неблагоприятны для жизни. pH внутри клеток (6,8) и pH крови (7,4) очень близки к нейтральному. Однако среда в желудке очень кислая, с рН от 1 до 2. В результате, как клетки желудка выживают в такой кислой среде? Как они гомеостатически поддерживают внутри себя близкий к нейтральному рН? Ответ в том, что они не могут этого сделать и постоянно умирают. Желудок постоянно производит новые клетки для замены мертвых, которые перевариваются желудочными кислотами. Ученые подсчитали, что человеческое тело полностью заменяет слизистую оболочку желудка каждые семь-десять дней.
Рисунок 2.19 Шкала pH измеряет концентрацию ионов водорода (H + ) в растворе. (кредит: модификация работы Эдварда Стивенса)
Ссылка на обучение
Ссылка на обучение
Посмотрите это видео, чтобы получить простое объяснение pH и его логарифмической шкалы.
Как могут организмы, чьим телам требуется рН, близкий к нейтральному, поглощать кислые и щелочные вещества (например, человек, пьющий апельсиновый сок) и выживать? Буферы — это ключ. Буферы легко поглощают избыток H + или OH – , тщательно поддерживая pH тела в узком диапазоне, необходимом для выживания. Поддержание постоянного рН крови имеет решающее значение для благополучия человека. Буфер, поддерживающий pH крови человека, включает угольную кислоту (H 2 CO 3 ), ион бикарбоната (HCO 3 – ) и диоксид углерода (CO 2 ). Когда ионы бикарбоната объединяются со свободными ионами водорода и становятся угольной кислотой, они удаляются из ионов водорода и смягчают изменения рН. Точно так же, как показано на рис. 2.20, избыток углекислоты может превращаться в углекислый газ, который мы выдыхаем через легкие. Это предотвращает накопление слишком большого количества свободных ионов водорода в крови и опасное снижение pH крови. Аналогично, если слишком много OH – попадает в систему, угольная кислота соединяется с ним, образуя бикарбонат, снижая рН. Без этой буферной системы рН тела колебался бы достаточно, чтобы поставить под угрозу выживание.
Аналогично, если слишком много OH – попадает в систему, угольная кислота соединяется с ним, образуя бикарбонат, снижая рН. Без этой буферной системы рН тела колебался бы достаточно, чтобы поставить под угрозу выживание.
Рисунок 2.20 На этой диаграмме показана буферизация организмом уровней pH крови. Синие стрелки показывают процесс повышения pH по мере производства большего количества CO 2 . Фиолетовые стрелки указывают на обратный процесс: понижение pH по мере образования большего количества бикарбоната.
Другими примерами буферов являются антациды, которые некоторые люди используют для борьбы с избытком желудочной кислоты. Многие из этих безрецептурных лекарств действуют так же, как буферы крови, обычно по крайней мере с одним ионом, способным поглощать водород и снижать рН, принося облегчение тем, кто страдает от «изжоги» после еды. Уникальные свойства воды, которые способствуют этой способности уравновешивать pH, а также другие характеристики воды, необходимы для поддержания жизни на Земле.
SCIRP Открытый доступ
Издательство научных исследований
Журналы от A до Z
Журналы по темам
- Биомедицинские и биологические науки.
- Бизнес и экономика
- Химия и материаловедение.
- Информатика. и общ.
- Науки о Земле и окружающей среде.
- Машиностроение
- Медицина и здравоохранение
- Физика и математика
- Социальные науки. и гуманитарные науки
Журналы по тематике
- Биомедицина и науки о жизни
- Бизнес и экономика
- Химия и материаловедение
- Информатика и связь
- Науки о Земле и окружающей среде
- Машиностроение
- Медицина и здравоохранение
- Физика и математика
- Социальные и гуманитарные науки
Публикация у нас
- Подача статьи
- Информация для авторов
- Ресурсы для экспертной оценки
- Открытые специальные выпуски
- Заявление об открытом доступе
- Часто задаваемые вопросы
Публикуйте у нас
- Представление статьи
- Информация для авторов
- Ресурсы для экспертной оценки
- Открытые специальные выпуски
- Заявление об открытом доступе
- Часто задаваемые вопросы
Подпишитесь на SCIRP
Свяжитесь с нами
клиент@scirp. org org | |
| +86 18163351462 (WhatsApp) | |
| 1655362766 | |
| Публикация бумаги WeChat |
| Недавно опубликованные статьи |
| Недавно опубликованные статьи |
Подпишитесь на SCIRP
Свяжитесь с нами
клиент@scirp.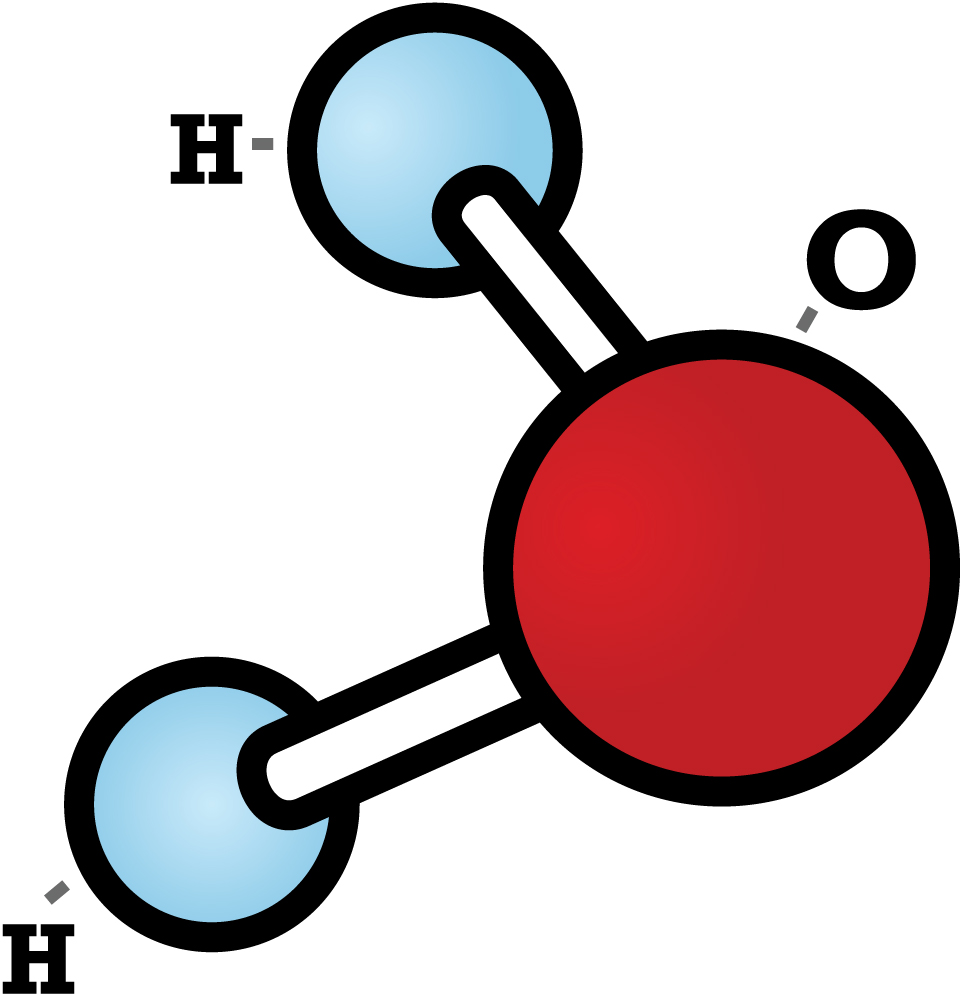 |


 На образном языке это означает, что в этом случае спины протонов параллельны. Такой водород называется ортоводородом.
На образном языке это означает, что в этом случае спины протонов параллельны. Такой водород называется ортоводородом.