Строение атома лития (Li), схема и примеры
Общие сведения о строении атома лития
Порядковый номер равен 3. Заряд ядра равен +3. Атомный вес – 6,941а.е.м.
Электронное строение атома лития
Поскольку литий расположен во втором периоде, он имеет две оболочки, одна из которых носит название внешней. Электроны, расположенные на внешней оболочке, называются валентными и участвуют в образовании химических связей. Атом лития имеет положительно заряженное ядро (+3), в котором имеется 3 протона и 4 нейтрона (разница между атомным весом и порядковым номером). По орбитам вокруг ядра движутся 3 электрона.
Рис. 1. Схематичное изображение строения атома лития.
Электронную конфигурацию атома лития можно записать двояко:
+3 Li)2)1;
1s22s1.
Литий, так же, как и водород и гелий относится к семейству s-элементов. Энергетическая диаграмма атома лития (на ней изображаются только валентные электроны) имеет вид:
В результате химического взаимодействия литий теряет свой валентный электрон, т.е. является его донором, и превращается в положительно заряженный ион (Li
Li0 –e → Li+;
В соединениях литий проявляет степень окисления +1.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Литий — Википедия
Материал из Википедии — свободной энциклопедии
| Литий | |
|---|---|
| ← Гелий | Бериллий → | |
| Очень лёгкий, очень мягкий металл серебристо-белого цвета | |
Литий | |
| Название, символ, номер | ли́тий / Lithium (Li), 3 |
| Атомная масса (молярная масса) | [6,938; 6,997][комм 1][1] а. е. м. (г/моль) |
| Электронная конфигурация | [He] 2s1 |
| Радиус атома | 145[2]пм |
| Ковалентный радиус | 134[2] пм |
| Радиус иона | 76 (+1e)[3] пм |
| Электроотрицательность | 0,98 (шкала Полинга) |
| Электродный потенциал | -3,06В |
| Степени окисления | +1 |
| Энергия ионизации (первый электрон) | 519,9 (5,39) кДж/моль (эВ) |
| Плотность (при н. у.) | 0,534 г/см³ |
| Температура плавления | 453,69 K (180,54 °C, 356,97 °F) |
| Температура кипения | 1613 K (1339,85 °C, 2443,73 °F) |
| Уд. теплота плавления | 2,89 кДж/моль |
| Уд. теплота испарения | 148 кДж/моль |
| Молярная теплоёмкость | 24,86[4] Дж/(K·моль) |
| Молярный объём | 13,1 см³/моль |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 3,490 Å |
| Температура Дебая | 400 K |
| Теплопроводность | (300 K) 84,8 Вт/(м·К) |
| Номер CAS | 7439-93-2 |
 | |
Ли́тий (Li, лат. lithium) — химический элемент первой группы, второго периода периодической системы с атомным номером 3. Как простое вещество представляет собой мягкий щелочной металл серебристо-белого цвета.
Литий был открыт в 1817 году шведским химиком и минералогом Иоганном Арфведсоном сначала в минерале петалите (Li,Na)[Si
Своё название литий получил из-за того, что был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион», современное название было предложено Берцелиусом.
Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
При комнатной температуре металлический литий имеет кубическую объёмноцентрированную решётку (координационное число 8), пространственная группа
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды). Вследствие своей низкой плотности литий всплывает не только в воде, но и, например, в керосине
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Литий ☑️ электронное строение атома, формула, степень окисления металла, химические и физические свойства, получение и применение, с какими соединениями взаимодействует

История открытия элемента
В 1817 году шведский химик Иоганн Арфведсон открыл вещество в минерале петалите, а затем — в пероксине сподуме и слюде лепидолите. А в 1818 году Гемфри Дэви получил его в виде металла в процессе разложения расплава гидроксида лития. Когда Леопольд Гмелин экспериментировал с солями, содержащими это вещество, он увидел, что

Впервые литий был найден среди твёрдых горных пород, поэтому он получил наименование литион, что в переводе с греческого означает «камень». Современное название металлу дал Берцелиус.
Крупные месторождения лития были найдены в США, Боливии, Чили, Бразилии, Конго и Китае. В России почти 50% запасов природного ископаемого можно найти в Мурманской области. Вещество обнаружили в составе онгонитов и в сильносолёных озёрах, которые назвали рассолами.
Физические свойства
В периодической системе литий (Li) имеет атомный номер 3. Химический элемент расположен во втором периоде первой подгруппы. Он относится к классу щелочных металлов и характеризуется светло-серебристым оттенком. Его свойства обусловлены электронным строением атома. Литий относится к семейству s-элементов. Его валентность равна +1. Атом характеризуется наличием двух оболочек. На внешнем слое расположены валентные электроны, участвующие в формировании химических связей. Ядро атома имеет положительный заряд. В нём находятся 3 протона и 4 нейтрона. Вокруг ядра по орбитам движутся 3 электрона.

Основные характеристики лития:
- температура плавления — 180 °C;
- температура кипения — 1340 °C;
- плотность при комнатной температуре — 0,533 г/см³;
- атомная и молекулярная масса вещества — 6,941;
- удельный вес — 0,539;
- твёрдость по Моосу — 0,6.
Литий — самый лёгкий металл. Он способен воспламеняться при температуре выше 200 °C. На воздухе он покрывается оксидно-нитридной плёнкой. При комнатной температуре вещество обладает кубической объёмноцентрированной кристаллической решёткой. Пластичный металл мягче свинца и твёрже натрия. Он хорошо обрабатывается прокаткой и прессованием.
Особые физические свойства лития обусловлены небольшим размером его атома. С натрием он соединяется при температуре не выше 380 °C. С ним не смешиваются расплавленный калий, рубидий или цезий.
Химические особенности
Вещество реагирует с водой, аммиаком, кислотами и неметаллами, в чём проявляются типичные химические свойства лития. В металлической форме он обжигает слизистые оболочки и увлажнённую поверхность кожного покрова.

В соединениях степень окисления лития равна +1. Этот металл нельзя хранить в керосине, что нехарактерно для щелочных видов. При комнатной температуре он не взаимодействует с сухим воздухом или кислородом. Элемент вступает в медленные реакции с другими газами во влажном воздухе, образуя гидроксид, нитрид и карбонат. Поэтому вещество хранят в газолине, парафине или минеральном масле. Для этого используют герметично закрытые жестяные банки.
При нагревании в кислороде литий горит, превращаясь в оксид. Протекающая химическая реакция с уравнением и формулой:
4Li+O2 → 2Li2O
Одна из главных особенностей металла в том, что при 100−300°C на нём образуется плотная оксидная плёнка, после чего он не окисляется. Основным признаком для определения химического элемента служит тёмно-красное пламя во время горения его солей. При взаимодействии с водой, при котором не происходит взрыва или возгорания, образует гидроксид и простое вещество водород. Также реагирует с этиловым спиртом.
Происхождение в природе
Существует 2 природных стабильных и 7 искусственных изотопов лития. Кроме того, металл имеет два возбуждённых изомерных состояния некоторых его нуклеидов. Основная часть изотопов возникла при первичном нуклеосинтезе, а другая — в звёздном.
Вещество относится к группе крупноионных литофильных элементов. Он содержится в верхней материковой коре и морской воде. Литий образует такие самостоятельные минералы, как лепидолит и сподумен. Он выступает изоморфным заместителем калия в распространённых породообразующих ископаемых.

Большой объём элемента обнаружен в красном гиганте, который был открыт астрономами в 1982 году. Также высокое содержание металла отмечено в некоторых других крупных звёздах.
Специалисты используют минеральные формы или солевые растворы из соляных озёр для получения необходимого вещества. Из каждого вида сырья сначала извлекают карбонат металла. Сподумен перерабатывают путём спекания его с сульфатом калия. В результате реакции получается раствор сульфата лития, а затем при взаимодействии с карбонатом натрия получается карбонат лития. Металлическая форма вещества образуется путём электролиза расплава солей.
Биологическое значение
Элемент был обнаружен в числе постоянных компонентов в живых организмах. У растений он повышает стойкость к различным заболеваниям. Вещество усиливает фотохимическую активность хлоропластов в листве томатов и синтез никотина в табаке.
В человеческом организме литий образуется преимущественно в почках, но также находится в щитовидной железе, печени, сердце, лёгких и кишечнике. Этот элемент участвует в важных процессах жизнедеятельности организма человека:
- нормализует обмены жиров и углеводов;
- укрепляет иммунную систему;
- не даёт развиться аллергическим реакциям;
- снижает нервную возбудимость.
В большом количестве вещество снижает уровень серотонина в мозге. При высоком содержании натрия в организме препараты с литием назначают с осторожностью, поскольку лекарства могут быть опасны для здоровья и ухудшить состояние почек.
Сферы применения
Литий обладает уникальными свойствами и имеет много преимуществ перед другими металлами. Люди используют его в разных областях:

- Сульфид лития и меди выступает отличным полупроводником, предназначенным для создания термоэлектрических материалов.
- Металл, который даёт возможность получить тёмно-красное пламя, применяется при производстве пиротехники.
- Фторид вещества широко используется в изготовлении лазеров и оптики.
- В современной электронике применяют щелочные аккумуляторы с гидроксидом лития для получения максимальной мощности и продления срока службы средств.
- Вещество используется в качестве наполнителя для металлогалогенных ламп.
- Сплавы лития применяют в авиации и космонавтике.
- В металлургии материал используют как вспомогательное средство при выплавке алюминия. Полезное ископаемое повышает степень прочности и пластичности у разных сплавов.
- Из-за высокой удельной теплоёмкости металл распространён в производстве ядерных реакторов.
- В силикатной промышленности он необходим при создании определённых видов стекла и для покрытия изделий из фарфора.
- Гидроксид лития применяется для очистки помещений от углекислого газа.
- Соединения с этим веществом используют в текстильной промышленности для отбеливания тканей.

Различные соединения лития находят применение и в других областях. Поскольку его соли характеризуются целебными свойствами, вещество широко используется в сфере медицины. Лекарственные препараты с этим компонентом помогают в лечении аффективных расстройств и дерматологических заболеваний.
Литий-ионный аккумулятор (Li-ion) | Принцип работы
В настоящее время литий-ионный аккумулятор используется абсолютно во всей домашней и портативной электронике.
 li-on аккумуляторы в гаджетах и устройствах
li-on аккумуляторы в гаджетах и устройствахМожно без преувеличения сказать: без портативных источников питания, мир современной техники был бы намного беднее. Все разнообразие карманных электронных гаджетов, приборов, смартфонов, гироскутеров, электромобилей наконец, стало возможным благодаря литий-ионным аккумуляторам.
Принцип работы литий-ионного аккумулятора
Давайте рассмотрим литий-ионный аккумулятор. Как видите, он состоит из нескольких слоев с различным химическим составом.
 состав литий-ионного аккумулятора
состав литий-ионного аккумулятораВ основе работы литий-ионного аккумулятора лежит, так называемый, электрохимический потенциал. Суть его в том, что металлы стремятся «отдавать» свои электроны. Как видно на рисунке ниже, наибольшая способность к отдаче электронов – у лития, а наименьшая – у фтора. Если такой атом отдает свой электрон, то он становится положительным ионом.
 электрохимический ряд элементов
электрохимический ряд элементов
Первая в истории электрическая батарейка, созданная более 200 лет назад Алессандро Вольтой, работала как раз на принципе электрохимического потенциала. Вольта взял два металла с разными электрохимическими потенциалами (цинк и серебро) и получил электрический ток. В честь его открытия такую “батарейку” назвали Вольтовым столбом.
 Вольтов столб
Вольтов столб
В 1991 г. Sony выпустила первый коммерчески успешный литий-ионный аккумулятор.
 первый литий-ионный аккумулятор
первый литий-ионный аккумуляторВ литий-ионных элементах используется металл с наибольшей способностью отдавать электроны – литий. У лития всего один электрон на внешней орбите, и он постоянно стремится его «потерять».
 атом лития
атом литияИз-за этого литий считается чрезвычайно химически активным металлом. Он реагирует даже с водой и воздухом. Но активен только чистый литий, а вот его оксид, напротив, очень стабилен.
 оксид лития
оксид литияЭто свойство лития как раз используется при создании литий-ионных аккумуляторов.
Допустим, мы каким-то образом отделили атом лития от оксида. Этот атом будет крайне нестабилен и сразу превратится в положительный ион, потеряв электрон.
 положительный ион
положительный ионОднако в составе оксида литий гораздо более стабилен, чем одинокий атом лития. Если мы сможем каким-то образом обеспечить движение по двум отдельным путям для электрона и для положительного иона лития, то ион самостоятельно достигнет оксида и встанет там на свое место. При этом мы получим электрический ток благодаря движению электрона.

Итак, можно получить электрический ток из оксида лития, если сначала отделить атомы лития от оксида и затем направить потерянные ими электроны по внешней цепи. Рассмотрим, как эти две задачи решаются в литий-ионных элементах.
Строение литий-ионного аккумулятора
Помимо оксида лития, элементы содержат также электролит и графит. В графите связь между слоями гораздо слабее, чем между атомами внутри слоев, поэтому графит имеет слоистую структуру.
 строение литий-ионного аккумулятора
строение литий-ионного аккумулятораЭлектролит, помещенный между оксидом лития и графитом, служит барьером, пропускающим сквозь себя только ионы лития. Электроны же не могут проникать сквозь электролит и отскакивают от него, как теннисный мячик об стенку. В качестве электролита используется органическая соль лития, которая наносится на слой разделителя (о разделителе ниже в статье).
 электролит пропускает ионы и не пропускает электроны
электролит пропускает ионы и не пропускает электроныПроцесс заряда и разряда литий-ионного аккумулятора
Итак, у нас есть разряженный аккумулятор
 литий-ионный аккумулятор разряженный
литий-ионный аккумулятор разряженныйДавайте же его зарядим. Для этого нам нужен какой-либо источник питания. Что произойдет в этот момент на самом литий-ионном аккумуляторе? Положительный полюс начнет притягивать электроны, «вытаскивая» их из оксида лития.
 процесс зарядки литий-ионного аккумулятора
процесс зарядки литий-ионного аккумулятораПоскольку электроны не могут проникать через электролит, то они движутся по внешней цепи через источник питания.

и в конце концов достигают графита

где очень удобно располагаются в слоях графита.

В этот же самый момент положительные ионы лития притягиваются отрицательным полюсом, проходя сквозь электролит и также попадают в графит, размещаясь между его слоями.

Когда все ионы лития достигнут графита и будут «захвачены» его слоями, батарея будет полностью заряжена.

Такое состояние батареи неустойчивое. Это можно представить как шар, который находится на самой верхушке холма и в любой момент может скатиться.

Вот мы и достигли первой цели: электроны и ионы лития отделены от оксида. Теперь надо как-то сделать так, чтобы электроны и ионы двигались разными путями. Как только мы подключим какую-либо нагрузку к нашему заряженному литий-ионному аккумулятору, то начнется обратный процесс. В этом случае ионы лития через электролит пожелают вернуться в свое изначальное состояние.

Поэтому они начнут двигаться обратно сквозь электролит, а электроны побегут через внешнюю цепь, то есть через нагрузку.
 генерация электрического тока в литий-ионном аккумуляторе
генерация электрического тока в литий-ионном аккумулятореТак как электрический ток – это не что иное, как упорядоченное движение заряженных частиц, то в цепи лампочки накаливания возникнет электрический ток, который заставит эту самую лампочку светиться.

Как только все электроны “убегут” из графита, то батарея полностью разрядится. Чтобы ее снова зарядить, достаточно поставить аккумулятор “на зарядку”.
 разряженный литий-ионный аккумулятор
разряженный литий-ионный аккумуляторПри этом графит сам по себе не участвует в химических реакциях – он лишь служит «складом» для ионов и электронов лития.
Слой разделителя в литий-ионном аккумуляторе
Если внутренняя температура элемента по какой-то причине начнет расти, жидкий электролит высохнет, и произойдет короткое замыкание между анодом и катодом. В результате элемент может загореться или даже взорваться.

Чтобы этого не произошло, между электродами помещается дополнительный изолирующий слой, называемый разделителем. Разделитель проницаем для ионов лития благодаря наличию микропор. Электроны он не пропускает.
 разделитель в литий-ионном аккумуляторе
разделитель в литий-ионном аккумулятореИз чего делают литий-ионный аккумулятор
В реальных литий-ионных аккумуляторах графит и оксид лития наносятся в виде покрытия на медную и алюминиевую фольгу. Ниже на рисунке мы видим, что на тонком листе меди у нас располагается графит, а на тонком листе алюминия – оксид лития.

Минус аккумулятора снимается с медной фольги, а плюс – с алюминиевой.

ну а между ними располагается еще разделитель, пропитанный электролитом

Для того, чтобы уменьшить объем, все эти три слоя сворачивают в “рулончик”.

 цилиндрический аккумулятор строение
цилиндрический аккумулятор строениеобразуя при этом всем нам знакомую литий-ионную цилиндрическую батарейку

Литий-ионные аккумуляторы в автомобиле Tesla
Вообразите мир, в котором все машины оснащены электродвигателями, а не двигателями внутреннего сгорания. Электромоторы превосходят ДВС практически по всем техническим показателям, да к тому же намного дешевле и надежнее. У ДВС есть существенный недостаток: он выдает достаточный крутящий момент лишь в узком диапазоне скоростей. В общем, электродвигатель – однозначно лучший выбор для автомобиля. Об этом мы писали еще в статье про автомобиль Тесла.
 Сравнение электромобилей и автомобилей с ДВС
Сравнение электромобилей и автомобилей с ДВСНо есть одно «узкое место», из-за которого электрическая революция в автопроме постоянно откладывается – это источники питания. Долгое время громоздкие, тяжелые, недолговечные и ненадежные аккумуляторы электромобилей никак не могли составить конкуренцию полному баку бензина. Но все изменилось, когда на рынок вышел производитель электромобилей Тесла.
Именно литий-ионные аккумуляторы использует компания Тесла для своих электрокаров.

Стандартный элемент выдает напряжение 3,7 – 4,2 В. Множество таких элементов, соединенных последовательно и параллельно, образуют модуль.
 батарейный модуль Тесла
батарейный модуль ТеслаЛитий-ионные элементы при работе выделяют много тепла. При этом высокая температура снижает срок службы и эффективность самих элементов. Для контроля температуры, а также их уровня заряда, защиты от перезаряда и общего состояния элементов питания, служит специальная система управления батареями (Battery management system, сокращенно BMS). В батареях Tesla используется спиртовая система охлаждения. BMS регулирует скорость движения спирта в системе, поддерживая оптимальную температуру батарей.
 радиатор для аккумуляторов Тесла
радиатор для аккумуляторов ТеслаЕще одна важнейшая функция BMS – защита от перезаряда. Допустим, есть три элемента с разной емкостью. Во время зарядки элемент с большей емкостью зарядится сильнее двух остальных. Чтобы этого не допустить, BMS использует так называемое выравнивание заряда элементов (cell balancing). При этом все элементы заряжаются и разряжаются равномерно и защищены от чрезмерного или недостаточного заряда.
 равномерный заряд аккумуляторов , благодаря технологии BMS
равномерный заряд аккумуляторов , благодаря технологии BMSИ в этом преимущество Tesla над технологией аккумуляторов Nissan. У Nissan Leaf серьезная проблема с охлаждением аккумулятора из-за большого размера элементов и отсутствия системы активного охлаждения.
 батарея Nissan Leaf и Tesla
батарея Nissan Leaf и TeslaУ конструкции с множеством маленьких цилиндрических элементов есть и еще одно преимущество: при большом расходе энергии нагрузка распределяется равномерно между всеми элементами. Если бы вместо множества маленьких элементов был один огромный элемент, из-за постоянных нагрузок он очень быстро бы пришел в негодность. Tesla сделала ставку на маленькие цилиндрические элементы, технология производства которых уже хорошо отработана. Более подробно про батарейный модуль Тесла читайте в этой статье.
Защитный SEI-слой
Во время первой зарядки внутри литий-ионного элемента происходит одно замечательное явление, спасающее элемент от скорой «смерти». Неожиданной проблемой оказались электроны, находящиеся в слое графита. При контакте с электролитом они начинают разрушать его. Но одно случайное открытие позволило не допустить контакт электронов с электролитом. При первой зарядке элемента, как мы уже говорили, ионы лития движутся сквозь электролит. В процессе этого движения молекулы растворенного в электролите вещества покрывают ионы. Достигнув графитового слоя, ионы лития вместе с молекулами раствора электролита реагируют с графитом, образуя так называемая промежуточную фаза твердого электролита (solid electrolyte interphase, или SEI-слой). Этот слой предотвращает контакт электронов с электролитом, предохраняя электролит от разрушения.
 защитный SEI-слой
защитный SEI-слойВот так проблема случайным образом решилась сама собой. Хотя эффект SEI был открыт случайно, в последующие два десятилетия ученые целенаправленно улучшали процесс, подбирая наиболее эффективную толщину и химический состав.
Заключение
Сегодня уже удивительно, что еще два десятка лет назад в электронных гаджетах не применялись литий-ионные аккумуляторы. Индустрия литий-ионных аккумуляторов развивается с фантастической скоростью: ожидается, что в ближайшие несколько лет их рынок достигнет 90 млрд. долларов. Современные литий-ионные батареи способны выдержать примерно 3000 циклов зарядки-разрядки – это уже приличный показатель, но еще есть, куда расти. Лучшие умы во всем мире трудятся над тем, чтобы повысить их долговечность до 10 000 циклов. В этом случае аккумулятор электромобиля не придется заменять целых 25 лет. Миллионы долларов вкладываются в исследования, которые позволят заменить графит на кремний в качестве «хранилища» в литий-ионных элементах. Если это удастся сделать, их емкость возрастет более чем в пять раз! В настоящее время мир переходит уже на литий-полимерные аккумуляторы, которые показали себя чуточку лучше, чем литий-ионные.
Материал подготовлен по статье
Литий электронное строение — Справочник химика 21
Если сопоставить электронное строение атомов, то можно заметить, что структура внешних энергетических уровней периодически повторяется (сравним литий и натрий Зл бериллий 2. и магний 3 , бор 25 2р и алюминий и т. д.). Такая [c.52]Если сопоставить электронное строение атомов, то можно заметить, что структура внешних энергетических уровней периодически повторяется (сравним литий 2 и натрий 3 бериллий 2 и магний 3 , бор 2 2p и алюминий 3 3р и т. д.). Такая закономерность будет соблюдаться и в последующих периодах. Именно этим объясняется периодическая повторяемость свойств элементов в периодах. В этом сущность и причина периодичности, обнаруженной Д. И. Менделеевым, который не располагал сведениями о строении атома. Итак, теория строения атома подтвердила истинность менделеевского открытия, подвела под него мощную базу. [c.44]
Электронное строение атома бериллия в газообразном состоянии — 15 25% Увеличение заряда ядра атома бериллия по сравнению с зарядом ядра атома лития наряду с тем, что 25-электроны только частично экранируют друг друга, приводит к двум эффектам 1) атом Ве имеет металлический радиус только 0,89 А, значительно меньше, чем в случае лития (1,22 А) 2) потенциалы ионизации Ве, 9,32 и 18,21 эв, гораздо большие, чем у Ы (5,39 эе), делают Ве значительно менее электроположительным, если рассматривать его хилшческие свойства в сравнении со свойствами Действительно, не существует никаких кристаллических соединений или растворов, в которых ионы Ве + существовали бы как таковые. Все соединения, строение которых было определено, даже соединения с наиболее электроотрицательными элементами, такие, как ВеО и ВеР.,, по крайней мере частично обладают ковалентным характером связи. Электронное строение атомов других элементов II группы (Mg, Са, 5г, Ва и Ка) подобно строению атома Ве. Однако больший размер этих ато.мов уменьшает влияние заряда ядра на валентные электроны. Так, их потенциалы ионизации ниже, чем у Ве они в основном более электроположительны, а ионная природа их соединений законо-.мерно возрастает в группе сверху вниз. [c.67]
Рассмотрим теперь взаимодействие двух атомов Li. Электронное строение атома лития (ls 2s) выражается схемой [c.157]
Таким образом, третий период, подобно второму, начинается с двух s-элементов, за которыми следует шесть р-элементов. Структура внешнего электронного слоя соответствующих элементов второго п третьего периодов оказывается, следовательно, аналогичной. Так, у атомов лития и натрия во внешнем электронном слое находится по одному s-электрону, у атомов азота и фосфора — по два S- и по три р-электрона и т. д. Иначе говоря, с увеличением заряда ядра электронная структура внешних электронных слоев атомов периодически повторяется. Ниже мы увидим, что это справедливо и для элементов последующих периодов. Отсюда следует, что расположение элементов в периодической системе соответствует электронно.пу строению их атомов. Но электронное строение атомов определяется зарядом их ядер и, в свою очередь, определяет свойства элементов п lix соединений. В этом и состоит сущность периодической зависимости свойств элементов от заряда ядра их атомов, выражаемой периодическим законом. [c.92]
Все щелочные металлы — очень сильные восстановители, их стандартные электродные потенциалы (E ) отрицательные. Наиболее отрицателен Е° лития (см. табл. 6.1). Это связано с особенностями электронного строения атома лития (ls 2s ), наименьшим его радиу- [c.252]
Сопоставление рис. ХП.2 и ХП.З показывает, что электронное строение внешней оболочки атомов элементов следующих за неоном в точности повторяет строение атомов, предшествующих ему, т. е. второго периода. Так, натрий имеет во внешнем слое один электрон подобно литию. Химические свойства этих элементов сходны они являются активными одновалентными металла- [c.150]
Не составляет труда записать волновое уравнение Шрёдингера для атома лития, состоящего из ядра и трех электронов, или атома урана, состоящего из ядра и 92 электронов. Однако, к сожалению, эти дифференциальные уравнения невозможно решить. Нет ничего утешительного в том, что строение атома урана в принципе может быть найдено путем расчетов, если математические (хотя отнюдь не физические) трудности препятствуют получению этого решения. Правда, физики и физикохимики разработали для решения уравнения Шрёдингера множество приближенных методов, основанных на догадках и последовательных приближениях. Проведение последовательных приближений существенно облегчается использованием электронно-вычислительных машин. Однако главное достоинство применения теории Шрёдингера к атому водорода заключается в том, что она позволяет получить ясную качественную картину электронного строения многоэлектронных атомов без проведения дополнительных расчетов. Теория Бора оказалась слишком упрошенной и не смогла дать таких результатов, даже после ее усовершенствования Зом-мерфельдом. [c.374]
Для описания электронного строения атомов в основном состоянии часто применяется условное обозначение их электронной конфигурации группами символов п/, где п—главное квантовое число, указывающее энергетический уровень электрона, /—орбитальное квантовое число подуровня (вместо него обычно указывается соответствующий символ 5, р, 4 или а X — число электронов на данном подуровне. Например, электронное строение атома лития описывается конфигурацией 1.5 25 . Приведем еще не- [c.82]
Рассматривая электронное строение атомов различных элементов в порядке возрастания их порядкового номера, мы убедились (с. 28), что атом водорода (1в ) одновалентен, тогда как валентность атома гелия (1з ) равна нулю. Валентность атома лития (ls 2s ) во всех соединениях равна единице, тогда как бериллий (18 2в ) становится двухвалентным благодаря переходу атома в возбужденное состояние (18 28 2р ). Это объясняется тем, что энергия, затрачиваемая на возбуждение атома, с избытком компенсируется при образовании [c.42]
Эта энергетическая стабильность молекулы Lia связана с электронным строением атома лития Li(ls 2s ) или Li (K2s ) (здесь К—атомный остов, не принимающий участия в образовании МО). Образование молекулы можно в первом приближении схематически изобразить так [c.294]
Таким образом, электронную структуру всех рассмотренных элементов можно записать общей формулой п— 1)5 р /г5, которая не описывает электронное строение лишь атома лития, имеющего формулу п—1)52/15. Разница заключается в том, что, в отличие от всех других рассмотренных элементов, на предыдущем электронном слое атома лития находится два, а ие восемь электронов. На внешнем же электронном уровне число и характер электронов одни и те же — один электрон на 5-орбитали.&ensp
Цены и новости на рынке химии
Новости и события
Исследователи из Университета Монаша находятся на пороге коммерциализации самой эффективной в мире литиево-серной (Li-S) батареи, которая может превзойти нынешних лидеров рынка более чем в четыр…
Литий-ионные аккумуляторы сегодня используются повсеместно – от сотовых телефонов и до электрических автомобилей. Они отлично справляются с удержанием заряда и имеют высокую плотность энер…
Профессор материаловедения и инженерии Кристофер Эванс и аспирант Брайан Цзин разработали твердый самовосстанавливающийся электролит батареи, пригодный для вторичной переработки.
…
Он приурочен к 150-летию Периодической системы химических элементов
Компания Google в честь 150-летия Периодической системы химических элементов запустила образовательный проект. …
Портал Wikileaks опубликовал электронное письмо, направленное членом миссии ОЗХО своему начальству
Фейковые обвинения — как повод к войне. Сайт WikiLeaks обнародовал сенсационную инфо…
Австралийские учёные утверждают, что сумели создать литий-ионный аккумулятор удвоенной ёмкости, в котором вместе жидкого электролита используется обычный промышленный полимер. Об этом сообщает N…
Информация
Австралийский университет представил батарею с 1000 км потенциала для электродвигателя
Ученые создали “неубиваемую” батарею
Новый полимерный материал может сделать батареи самовосстанавливающимися и пригодными для вторичной переработки
Австралийский университет представил батарею с 1000 км потенциала для электродвигателя
Ученые создали “неубиваемую” батарею
Новый полимерный материал может сделать батареи самовосстанавливающимися и пригодными для вторичной переработки
Каталог организаций и предприятий
Компания «Поставка метрологии» предлагает: Весовое и измерительное электронное оборудование для металлопродукции, строительных материалов, сельхозпродукции, продуктов питания. Весы крановые, автомоби…
ТН ВЭД, законодательство, декларантские программы, учет товаров и транспортных средств на СВХ и таможенном складе, транспортные документы, электронное декларирование (ЭД2), расчет таможенных платежей…
…
…
…
…
Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева

Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. В центре атома находится положительно заряженное ядро. Оно занимает ничтожную часть пространства внутри атома, в нём сосредоточены весь положительный заряд и почти вся масса атома.
Ядро состоит из элементарных частиц — протона и нейтрона; вокруг атомного ядра по замкнутым орбиталям движутся электроны.
Протон (р) — элементарная частица с относительной массой 1,00728 атомной единицы массы и зарядом +1 условную единицу. Число протонов в атомном ядре равно порядковому номеру элемента в Периодической системе Д.И. Менделеева.
Нейтрон (n) — элементарная нейтральная частица с относительной массой 1,00866 атомной единицы массы (а. е. м.).
Число нейтронов в ядре N определяют по формуле:


где А — массовое число, Z — заряд ядра, равный числу протонов (порядковому номеру).
Обычно параметры ядра атома записывают следующим образом: слева внизу от символа элемента ставят заряд ядра, а вверху — массовое число, например:


Эта запись показывает, что заряд ядра (следовательно, и число протонов) для атома фосфора равен 15, массовое число равно 31, а число нейтронов равно 31 – 15 = 16. Так как массы протона и нейтрона очень мало отличаются друг от друга, то массовое число приблизительно равно относительной атомной массе ядра.
Электрон ( е–) — элементарная частица с массой 0,00055 а. е. м. и условным зарядом –1. Число электронов в атоме равно заряду ядра атома (порядковому номеру элемента в Периодической системе Д.И. Менделеева).
Электроны движутся вокруг ядра по строго определённым орбиталям, образуя так называемое электронное облако.
Область пространства вокруг атомного ядра, где наиболее (90 и более %) вероятно нахождение электрона, определяет форму электронного облака.
Электронное облако s-электрона имеет сферическую форму; на s-энергетическом подуровне может максимально находиться два электрона.
Электронное облако p-электрона имеет гантелеобразную форму; на трёх p-орбиталях максимально может находиться шесть электронов.
Орбитали изображают в виде квадрата, сверху или снизу которого пишут значения главного и побочного квантовых чисел, описывающих данную орбиталь. Такую запись называют графической электронной формулой, например:
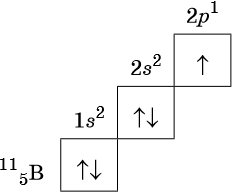

В этой формуле стрелками обозначают электрон, а направление стрелки соответствует направлению спина — собственного магнитного момента электрона. Электроны с противоположными спинами ↑↓ называют спаренными.
Электронные конфигурации атомов элементов можно представить в виде электронных формул, в которых указывают символы подуровня, коэффициент перед символом подуровня показывает его принадлежность к данному уровню, а степень у символа — число электронов данного подуровня.
В таблице 1 приведено строение электронных оболочек атомов первых 20 элементов Периодической системы химических элементов Д.И. Менделеева.
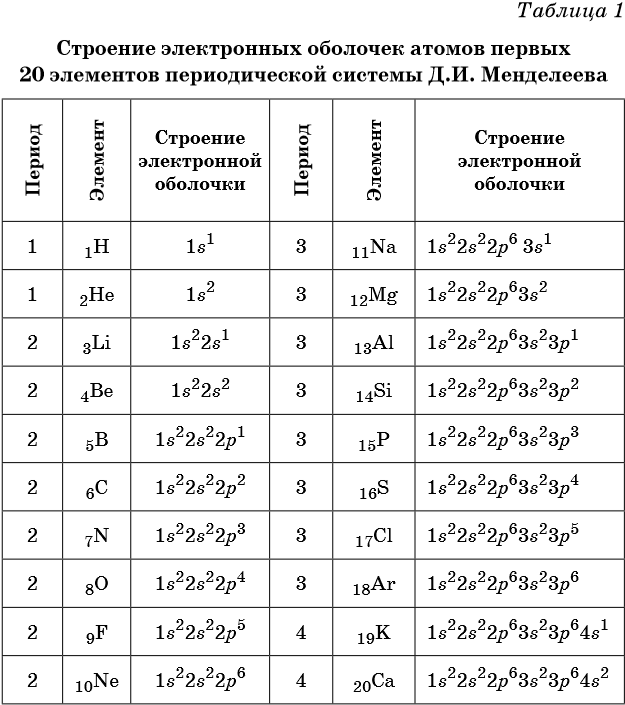

Химические элементы, в атомах которых s-подуровень внешнего уровня пополняется одним или двумя электронами, называют s-элементами. Химические элементы, в атомах которых заполняется p-подуровень (от одного до шести электронов), называют p-элементами.
Число электронных слоёв в атоме химического элемента равно номеру периода.
В соответствии с правилом Хунда электроны располагаются на однотипных орбиталях одного энергетического уровня таким образом, чтобы суммарный спин был максимален. Следовательно, при заполнении энергетического подуровня каждый электрон прежде всего занимает отдельную ячейку, а только после этого начинается их спаривание. Например, у атома азота все p-электроны будут находиться в отдельных ячейках, а у кислорода начнётся их спаривание, которое полностью закончится у неона.
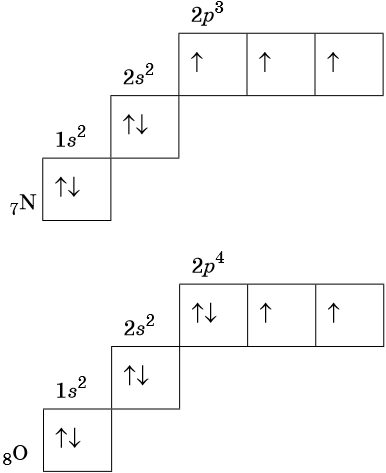

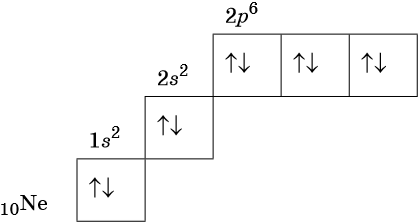

Изотопами называют атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов.
Изотопы известны для всех элементов. Поэтому атомные массы элементов в периодической системе являются средним значением из массовых чисел природных смесей изотопов и отличаются от целочисленных значений. Таким образом, атомная масса природной смеси изотопов не может служить главной характеристикой атома, а следовательно, и элемента. Такой характеристикой атома является заряд ядра, определяющий число электронов в электронной оболочке атома и её строение.
Рассмотрим несколько типовых заданий по этому разделу.
Пример 1. Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p64s1?
- Li
- Na
- K
- Cl
На внешнем энергетическом уровне у данного элемента находится один 4s-электрон. Следовательно, этот химический элемент находится в четвёртом периоде первой группе главной подгруппе. Этот элемент — калий.
К этому ответу можно прийти по-другому. Сложив общее количество всех электронов, получим 19. Общее число электронов равно порядковому номеру элемента. Под номером 19 в периодической системе находится калий.
Пример 2. Химическому элементу соответствует высший оксид RO2. Электронной конфигурации внешнего энергетического уровня атома этого элемента соответствует электронная формула:
- ns2np4
- ns2np2
- ns2np3
- ns2np6
По формуле высшего оксида (смотрите на формулы высших оксидов в Периодической системе) устанавливаем, что этот химический элемент находится в четвёртой группе главной подгруппы. У этих элементов на внешнем энергетическом уровне находятся четыре электрона — два s и два p. Следовательно, правильный ответ 2.
Тренировочные задания
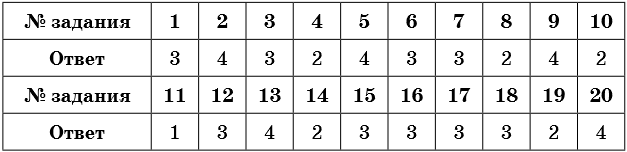
1. Общее число s-электронов в атоме кальция равно
1) 20
2) 40
3) 8
4) 6
2. Число спаренных p-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
3. Число неспаренных s-электронов в атоме азота равно
1) 7
2) 14
3) 3
4) 4
4. Число электронов на внешнем энергетическом уровне атома аргона равно
1) 18
2) 6
3) 4
4) 8
5. Число протонов, нейтронов и электронов в атоме 94Be равно
1) 9, 4, 5
2) 4, 5, 4
3) 4, 4, 5
4) 9, 5, 9
6. Распределение электронов по электронным слоям 2; 8; 4 — соответствует атому, расположенному в(во)
1) 3-м периоде, IА группе
2) 2-м периоде, IVА группе
3) 3-м периоде, IVА группе
4) 3-м периоде, VА группе
7. Химическому элементу, расположенному в 3-м периоде VA группе соответствует схема электронного строения атома
1) 2, 8, 6
2) 2, 6, 4
3) 2, 8, 5
4) 2, 8, 2
8. Химический элемент с электронной конфигурацией 1s22s22p4 образует летучее водородное соединение, формула которого
1) ЭН
2) ЭН2
3) ЭН3
4) ЭН4
9. Число электронных слоёв в атоме химического элемента равно
1) его порядковому номеру
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
10. Число внешних электронов в атомах химических элементов главных подгрупп равно
1) порядковому номеру элемента
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
11. Два электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) He, Be, Ba
2) Mg, Si, O
3) C, Mg, Ca
4) Ba, Sr, B
12. Химический элемент, электронная формула которого 1s22s22p63s23p64s1, образует оксид состава
1) Li2O
2) MgO
3) K2O
4) Na2O
13. Число электронных слоев и число p-электронов в атоме серы равно
1) 2, 6
2) 3, 4
3) 3, 16
4) 3, 10
14. Электронная конфигурация ns2np4 соответствует атому
1) хлора
2) серы
3) магния
4) кремния
15. Валентные электроны атома натрия в основном состоянии находятся на энергетическом подуровне
1) 2s
2) 2p
3) 3s
4) 3p
16. Атомы азота и фосфора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковую конфигурацию внешнего электронного слоя
4) одинаковое число электронов
17. Одинаковое число валентных электронов имеют атомы кальция и
1) калия
2) алюминия
3) бериллия
4) бора
18. Атомы углерода и фтора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковое число электронных слоёв
4) одинаковое число электронов
19. У атома углерода в основном состоянии число неспаренных электронов равно
1) 1
3) 3
2) 2
4) 4
20. В атоме кислорода в основном состоянии число спаренных электронов равно
1) 2
3) 4
2) 8
4) 6
Ответы