Литий, свойства атома, химические и физические свойства
Литий, свойства атома, химические и физические свойства.
Поделиться в:
Li 3 Литий
6,938-6,997* 1s2 2s1
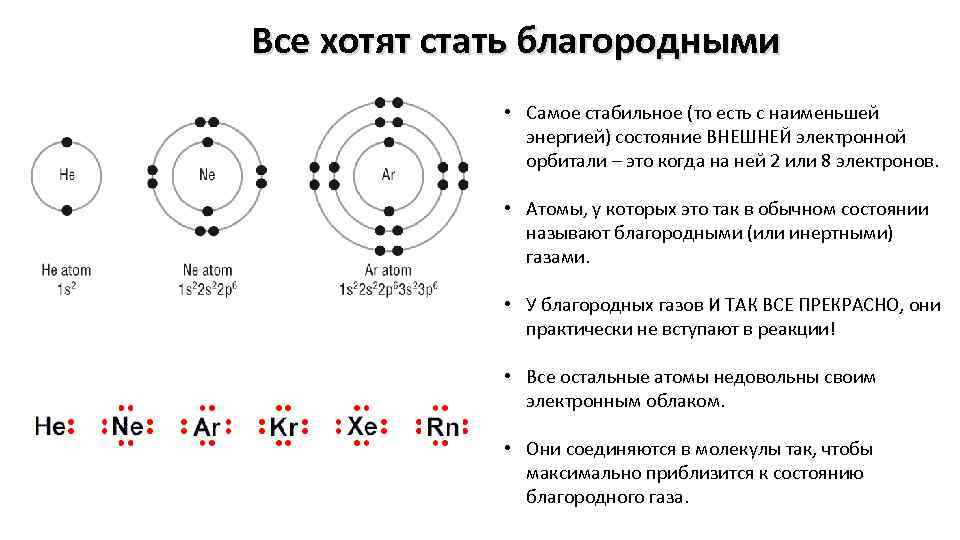
Литий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 3. Расположен в 1-й группе (по старой классификации — главной подгруппе первой группы), втором периоде периодической системы.
Атом и молекула лития. Формула лития. Строение атома лития
Изотопы и модификации лития
Свойства лития (таблица): температура, плотность и пр.
Физические свойства лития
Химические свойства лития. Взаимодействие лития. Химические реакции с литием
Получение лития
Применение лития
Таблица химических элементов Д.И. Менделеева
Атом и молекула лития. Формула лития. Строение атома лития:
Литий (Li, лат. lithium, c греч. λίθος – «камень») – химический элемент 1 группы короткой формы (по старой классификации – главной подгруппы первой группы) периодической системы химических элементов второго периода системы химических элементов Д. И. Менделеева, с атомным номером 3.
lithium, c греч. λίθος – «камень») – химический элемент 1 группы короткой формы (по старой классификации – главной подгруппы первой группы) периодической системы химических элементов второго периода системы химических элементов Д. И. Менделеева, с атомным номером 3.
Литий возглавляет группу щелочных металлов в периодической таблицы химических элементов Д. И. Менделеева.
Относится к группе редких, лёгких, цветных металлов.
Литий обозначается символом Li.
Как простое вещество литий при нормальных условиях представляет собой мягкий щелочной металл серебристо-белого цвета.
Молекула лития одноатомна.
Химическая формула лития Li.
Электронная конфигурация атома лития 1s2 2s1. Потенциал ионизации (первый электрон) атома лития равен 520,22 кДж/моль (5,39171495(4) эВ).
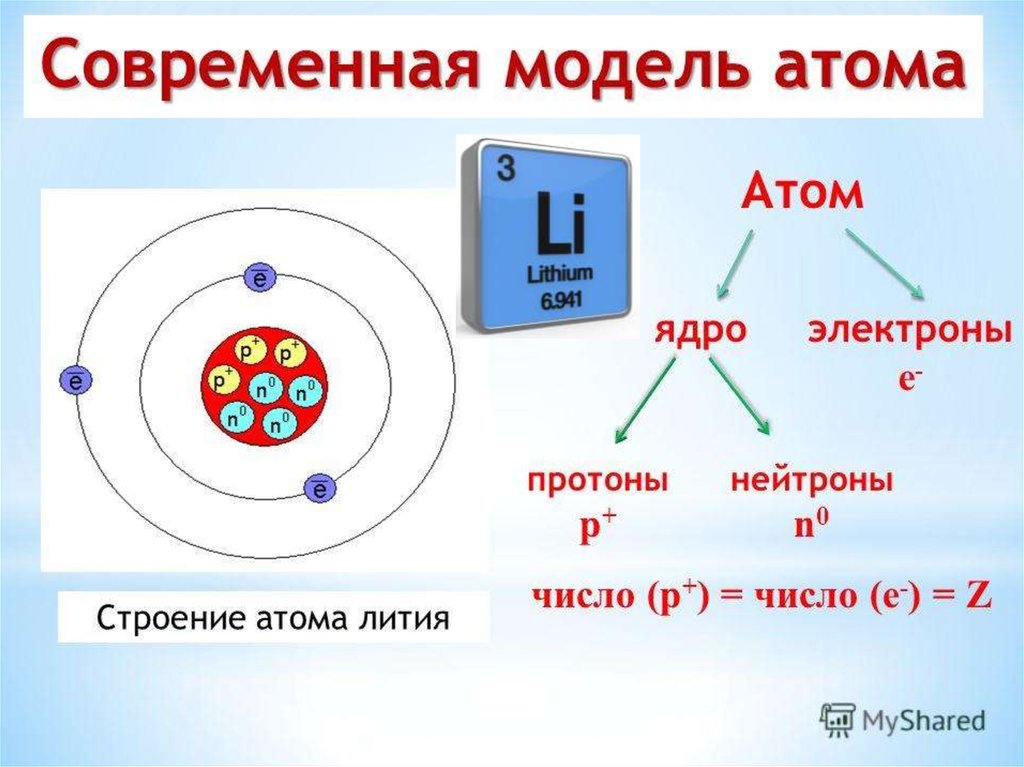
Строение атома лития. Атом лития состоит из положительно заряженного ядра (+3), вокруг которого по атомным оболочкам (двум s-орбиталям) движутся три электрона. Поскольку литий расположен во втором периоде, оболочки всего две, одна из которых является внешней. При этом 2 электрона находятся на внутреннем уровне, а 1 электрон – на внешнем. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома лития на 2s-орбитали находятся один неспаренный электрон. Электроны, расположенные на внешней оболочке, называются валентными и участвуют в образовании химических связей. В свою очередь ядро атома лития состоит из трех протонов и четырех нейтронов. Литий относится к элементам s-семейства.
Радиус атома лития (вычисленный) составляет 167 пм.
Атомная масса атома лития составляет 6,938-6,997 а. е. м. (г/моль).
Литий, свойства атома, химические и физические свойства
Изотопы и модификации лития:
Свойства лития (таблица): температура, плотность и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Литий |
| 102 | Прежнее название | |
| 103 | Латинское название | Lithium |
| 104 | Английское название | Lithium |
| 105 | Символ | Li |
| 106 | Атомный номер (номер в таблице) | 3 |
| 107 | Тип | Металл |
| 108 | Группа | Щелочной, редкий, лёгкий, цветной металл |
| 109 | Открыт | Иоганн Аугуст Арфведсон, Швеция, 1817 г. |
| 110 | Год открытия | 1817 г. |
| 111 | Внешний вид и пр. | Очень лёгкий, очень мягкий металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | 3 аллотропные модификации: – литий c кубической объёмно-центрированной кристаллической решёткой, – литий с гексагональной плотноупакованной кристаллической решёткой, – литий с ромбоэдрической (тригональной) кристаллической решёткой |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| Конденсат Бозе-Эйнштейна | 7Li | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0017 % |
| 120 | Содержание в морях и океанах (по массе) | 0,000018 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 6,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | 6,0·10-9 % |
| 123 | Содержание в метеоритах (по массе) | 0,00017 % |
| 124 | Содержание в организме человека (по массе) | 3,0·10-6 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса)* | 6,938-6,997 а.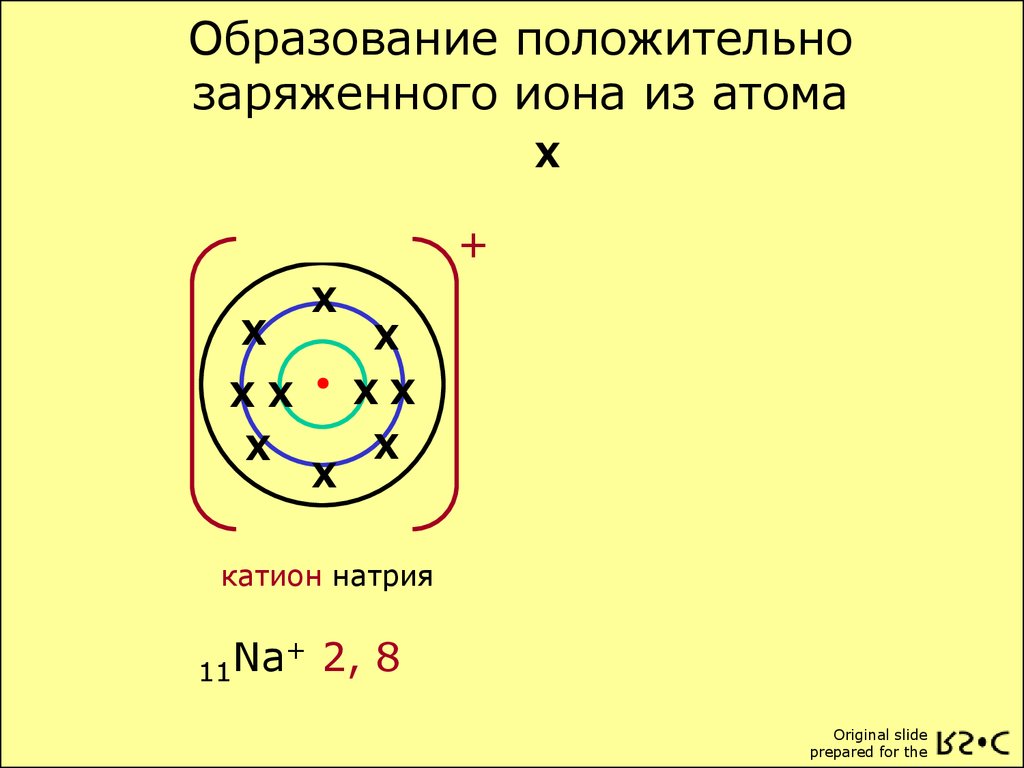 е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s1 |
| 203 | Электронная оболочка | K2 L1 M0 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 167 пм |
| 205 | Эмпирический радиус атома* | 145 пм |
| 206 | Ковалентный радиус* | 128 пм |
| 207 | Радиус иона (кристаллический) | Li+ 73 (4) пм, (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 182 пм |
| 209 | Электроны, Протоны, Нейтроны | 3 электрона, 3 протона, 4 нейтрона |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | |
| 212 | Группа в периодической таблице | 1-ая группа (по старой классификации – главная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | 0, +1 |
| 302 | Валентность | I |
| 303 | Электроотрицательность | 0,98 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 520,22 кДж/моль (5,39171495(4) эВ) |
| 305 | Электродный потенциал | Li+ + e– → Li, E |
| 306 | Энергия сродства атома к электрону | 59,6326(21) кДж/моль (0,618049(22) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность | 0,534 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 0,512 г/см3 (при температуре плавления 180,50 °C и иных стандартных условиях, состояние вещества – жидкость), 0,507 г/см3 (при 200 °C и иных стандартных условиях, состояние вещества – жидкость), 0,49 г/см3 (при 400 °C и иных стандартных условиях 0,474 г/см3 (при 600 °C и иных стандартных условиях, состояние вещества – жидкость), 0,457 г/см3 (при 800 °C и иных стандартных условиях, состояние вещества – жидкость), 0,441 г/см3 (при 1000 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 180,50 °C (453,65 K, 356,90 °F) |
| 403 | Температура кипения* | 1330 °C (1603 K, 2426 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 3,00 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 136 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 3,4122 Дж/г·K (при 25°C) |
| 410 | Молярная теплоёмкость | 24,86 Дж/(K·моль) |
| 411 | Молярный объём | 12,97383 см³/моль |
| 412 | Теплопроводность | 84,8 Вт/(м·К) (при 84,8 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 3,510 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 400 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 521 | Кристаллическая решётка #2 | |
| 522 | Структура решётки | Гексагональная плотноупакованная
|
| 523 | Параметры решётки | a = 3,111 Å, c = 5,093 Å |
| 524 | Отношение c/a | 1,637 |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | P63/mmc |
| 527 | Номер пространственной группы симметрии | 194 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-93-2 |
Примечание:
201* Указан диапазон значений атомной массы в связи с различной распространённостью изотопов данного элемента в природе.
205* Эмпирический радиус атома лития [1] составляет 152 пм.
206* Ковалентный радиус лития согласно [1] и [3] составляет 128±7 пм и 134 пм соответственно.
402* Температура плавления лития согласно [3] составляет 180,54 °C (453,69 K, 356,97 °F).
403* Температура кипения лития согласно [3] составляет 1339,85 °C (613 K, 2443,73 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) лития согласно [3] и [4] составляет 2,89 кДж/моль и 4,2 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) лития согласно [3] и [4] составляет 148 кДж/моль и 138 кДж/моль соответственно.
Физические свойства лития:
Литий представляет собой серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. В связи с ем его можно обрабатывать прессованием и прокаткой.
При комнатной температуре металлический литий имеет кубическую объёмноцентрированную решётку (координационное число 8), пространственная группа I m3m, параметры ячейки a = 0,35021 нм, Z = 2.
Однако ниже 78 К устойчивой кристаллической формой является гексагональная плотноупакованная структура, в которой каждый атом лития имеет 12 ближайших соседних атома, расположенных в вершинах кубооктаэдра. Кристаллическая решётка относится к пространственной группе P 63/mmc, параметры a = 0,3111 нм, c = 0,5093 нм, Z = 2.
Литий – очень легкий металл.
Литий имеет самую низкую плотность при комнатной температуре среди всех металлов (0,534 г/см³, почти в два раза меньше плотности воды). Вследствие своей низкой плотности литий всплывает не только в воде, но и, например, в керосине.
Литий не растворяется в воде, но реагирует с ней. Литий плохо растворяется в органических растворителях, ртути. Растворяется в жидком аммиаке с образованием синего раствора с металлической проводимостью. Растворяется в расплавленном алюминии.
Расплавленный литий растворяет металлы и обезуглероживает стали, что приводит к изменению прочности конструкционных материалов. Расплавленный литий не растворяет инертные газы.
Расплавленный литий не растворяет инертные газы.
Пары лития имеют ярко-красный цвет.
Температура плавления лития (Li) составляет 180,54 °C.
Температура кипения лития (Li) составляет 1330 °C.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1339,85 °C, соответственно).
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие пары щелочных металлов смешиваются друг с другом в любых соотношениях.
Теплопроводность лития при 300 K составляет 84,8 Вт/(м·К).
Химические свойства лития. Взаимодействие лития. Химические реакции с литием:
1. Реакция взаимодействия лития и кислорода:
4Li + O2 → 2Li2O (t > 200 °C).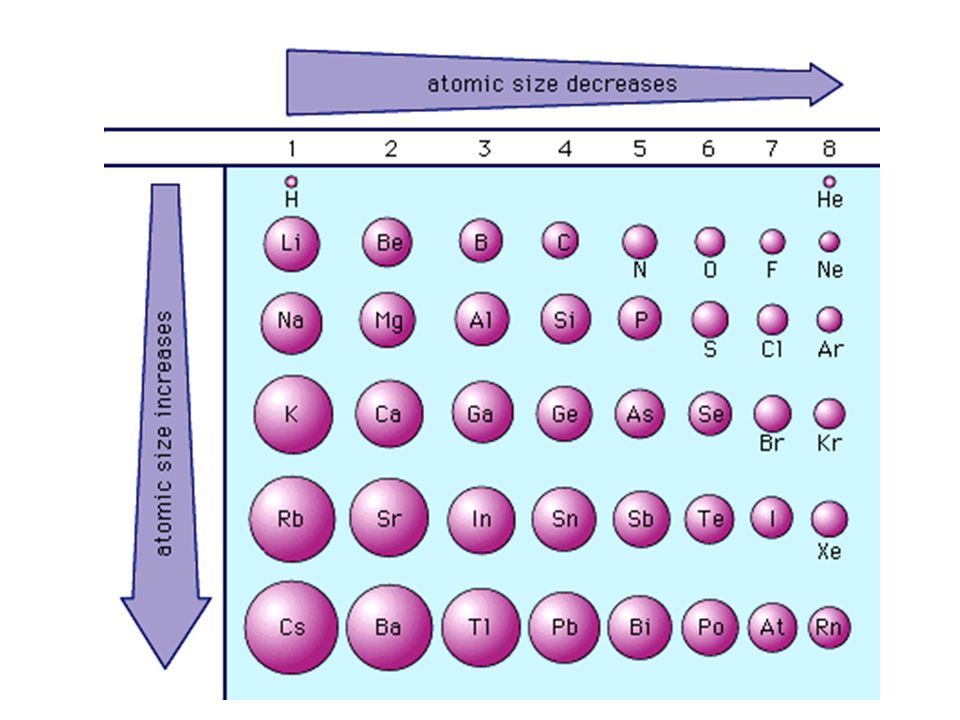
Реакция взаимодействия лития и кислорода происходит с образованием оксида лития. В ходе реакции также образуется примесь – пероксид лития Li2O2.
2. Реакция взаимодействия лития и углерода:
2Li + 2C → Li2C2 (t°).
Реакция взаимодействия лития и углерода происходит с образованием ацетиленида лития.
3. Реакция взаимодействия лития и кремния:
4Li + Si → Li4Si (t = 600-700 °C).
Реакция взаимодействия кремния и лития происходит с образованием силицида лития.
4. Реакция взаимодействия лития и хлора:
2Li + Cl2 → 2LiCl.
Реакция взаимодействия лития и хлора происходит с образованием хлорида лития. Реакция протекает при комнатной температуре.
5. Реакция взаимодействия лития и водорода:
2Li + H2 → 2LiH (t = 500-700 °C).
Реакция взаимодействия лития и водорода происходит с образованием гидрида лития.
6. Реакция взаимодействия лития и брома:
2Li + Br2 → 2LiBr.
Реакция взаимодействия лития и брома происходит с образованием бромида лития. Реакция протекает при комнатной температуре.
7. Реакция взаимодействия лития и йода:
2Li + I2 → 2LiI (t > 200 °C).
Реакция взаимодействия йода и лития происходит с образованием йодида лития.
8. Реакция взаимодействия лития и фтора:
2Li + F2 → 2LiF.
Реакция взаимодействия фтора и лития происходит с образованием фторида лития. Реакция протекает при комнатной температуре.
Аналогичным образом литий вступает в реакции и с другими неметаллами: мышьяком, серой, азотом.
9. Реакция взаимодействия лития и сурьмы:
Sb + 3Li → Li3Sb (t°).
Реакция взаимодействия лития и сурьмы происходит с образованием стибида лития. Реакция протекает при сплавлении реакционной смеси.
10. Реакция взаимодействия лития, оксида азота (II) и оксида азота (IV):
Li2O + NO2 + NO → 2LiNO2 (t = 300 °C).
Реакция взаимодействия лития, оксида азота (II) и оксида азота (IV) происходит с образованием нитрита лития.
11. Реакция взаимодействия лития и воды:
2Li + 2H2O → 2LiOH + H2.
Реакция взаимодействия лития и воды происходит с образованием гидроксида лития и водорода. Реакция протекает бурно.
12. Реакция взаимодействия лития и оксида фосфора (V):
3P4O10 + 16Li → 10LiPO3 + 2Li3P (t = 300-400 °C).
Реакция взаимодействия оксида фосфора (V) и лития происходит с образованием метафосфата лития и фосфида лития.
13. Реакция взаимодействия лития и азотной кислоты:
Li + 2HNO3 → LiNO3 + NO2 + H2O,
3Li + 4HNO3 → 3LiNO3 + NO + 2H2O.
Реакция взаимодействия лития и азотной кислоты происходит с образованием в первом случае – нитрата лития, оксида азота (IV) и воды, во втором случае – нитрата лития, оксида азота (II) и воды. В ходе первой реакции используется концентрированный раствор азотной кислоты, в ходе второй – разбавленный раствор.
Аналогичные реакции протекают и с другими минеральными кислотами.
14. Реакция взаимодействия лития и сероводорода:
2Li + H2S → Li2S + H2.
Реакция взаимодействия лития и сероводорода происходит с образованием сульфида лития и водорода.
Аналогичные реакции протекают и с другими водородосодержащими соединениями: хлороводородом.
15. Реакция взаимодействия лития и этанола:
2Li + 2C2H5OH → 2C2H5OLi + H2.
Реакция взаимодействия лития и этанола происходит с образованием этанолята лития и водорода.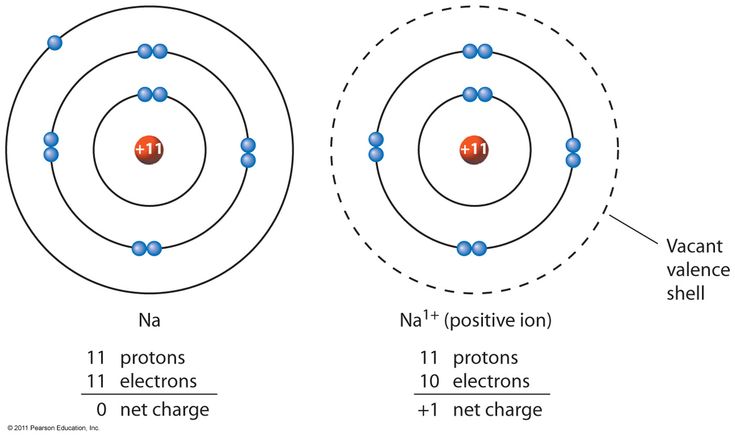
Получение лития:
Применение лития:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30.
 Цинк
Цинк - 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64.
 Гадолиний
Гадолиний - 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97.
 Берклий
Берклий - 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Lithium
- https://de.wikipedia.org/wiki/Lithium
- https://ru.wikipedia.org/wiki/Литий
- http://chemister.ru/Database/properties.php?dbid=1&id=213
- https://chemicalstudy.
 ru/litiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
ru/litiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
литий атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле лития
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 2 810
Задание №19 ЕГЭ по физике
атом, атомное ядро, ядерные реакции
Первичный бал: 1 Сложность (от 1 до 3): 1 Среднее время выполнения: 1 мин.
Для решения заданий № 19 требуется понимание структуры атома по Резерфорду, а также сущности процессов, происходящих при ядерных реакциях, например, при α-распаде.
Задание EF17569Опыты Э. Резерфорда по рассеянию α-частиц показали, что
А. почти вся масса атома сосредоточена в ядре.
Б. ядро имеет положительный заряд.
Какое(-ие) из утверждений правильно(-ы)?
Ответ:
- только А
- только Б
- и А, и Б
- ни А, ни Б
Алгоритм решения
- Кратко описать суть и результаты опыта, проведенного Резерфордом.
- Установить, какие выводы позволил сделать этот опыт.
Решение
Резерфорд направил пучок радиоактивного излучения на золотую фольгу. Альфа-частицы, проходя сквозь нее, попадали на экран и оставляли след. Если без фольги след представлял собой более менее четко ограниченный круг, то в случае с фольгой, четких границ круга не было. Когда Резерфорд окружил установку фольгой, он обнаружил, что часть альфа-частиц изменила траекторию движения после столкновения с фольгой в обратном направлении. Но это было бы невозможно, если бы заряд был распределен в атомах равномерно по всему объему. Наблюдать такую картинку возможно только при условии, что заряд атома концентрируется в небольшом пространстве — ядре. Причем этот заряд положительный, поскольку он не притягивает, а отталкивает альфа-частицы. Поэтому оба утверждения являются верными.
Когда Резерфорд окружил установку фольгой, он обнаружил, что часть альфа-частиц изменила траекторию движения после столкновения с фольгой в обратном направлении. Но это было бы невозможно, если бы заряд был распределен в атомах равномерно по всему объему. Наблюдать такую картинку возможно только при условии, что заряд атома концентрируется в небольшом пространстве — ядре. Причем этот заряд положительный, поскольку он не притягивает, а отталкивает альфа-частицы. Поэтому оба утверждения являются верными.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18183На рисунке изображены схемы четырёх атомов, соответствующие модели атома Резерфорда. Чёрными точками обозначены электроны. Атому 63Li соответствует схема:
Алгоритм решения
- Описать планетарную модель атома.
- Установить, какой рисунок подходит для данного химического элемента.

Решение
Планетарная модель атома подразумевает наличие положительно заряженного ядра, вокруг которого вращаются по орбитам электроны. Причем количество протонов равно количеству электронов. Зарядовое число у лития равно 3. Следовательно, на орбитах вокруг ядра должно вращаться 3 электрона — как на рисунке «в».
Ответ: вpазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18691Ядро атома содержит 3 нейтрона и 4 протона, вокруг ядра обращаются 2 электрона. Эта система частиц является
Ответ:
а) нейтральным атомом углерода96C б) ионом бериллия 74Be в) ионом лития 93Li г) нейтральным атомом бериллия 74B
Алгоритм решения
- Установить, будет ли атом нейтральным.
- Выбрать подходящий ответ.
Решение
Согласно условию, содержится 4 протона и всего 2 электрона.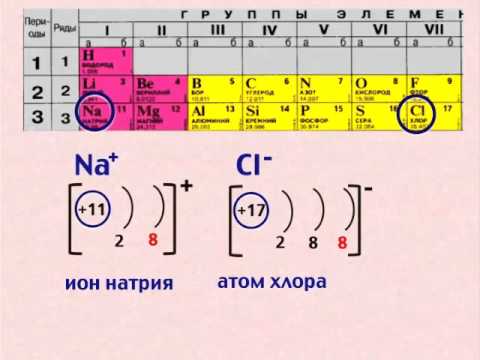 Это значит, что речь будет идти о положительно заряженном ионе. Массовое число будет равно 7 (4 протона + 3 нейтрона), а зарядовое число — 4 (4 протона). Этому соответствует ион бериллия.
Это значит, что речь будет идти о положительно заряженном ионе. Массовое число будет равно 7 (4 протона + 3 нейтрона), а зарядовое число — 4 (4 протона). Этому соответствует ион бериллия.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17709Какая из строчек таблицы правильно отражает структуру ядра 49115 In?
Алгоритм решения
- Установить, чем определяются количество протонов и нейтронов.
- Определить, сколько содержится в атоме протонов.
- Определить, сколько содержится в атоме нейтронов.
Решение
Протоны и нейтроны — нуклоны. Общее их количество является массовым числом A, которое указывается слева от обозначения химического элемента в верхнем индексе. В данном случае A = 115.
Зарядовое число — порядковый номер химического элемента в периодической системе Менделеева.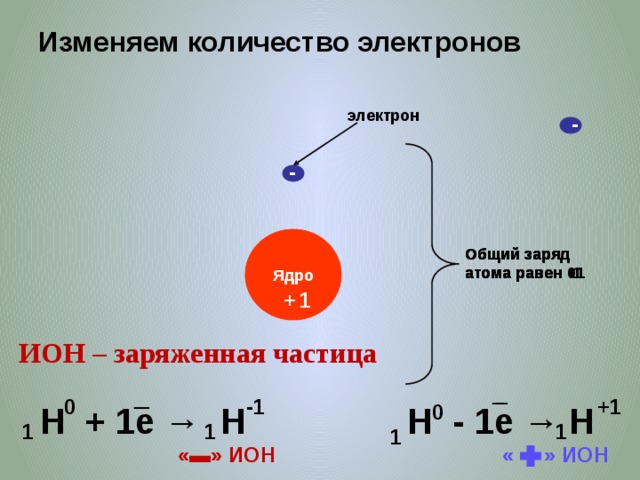 Оно обозначается Z и равно количеству протонов в ядре. В нашем случае Z = 49. Значит, протонов 49.
Оно обозначается Z и равно количеству протонов в ядре. В нашем случае Z = 49. Значит, протонов 49.
Чтобы посчитать количество нейтронов, нужно из массового числа вычесть зарядовое число: 115 – 49 = 66. Значит, нейтронов 66. Строка 1 подходит.
Ответ: 1pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17974Связанная система элементарных частиц содержит 14 нейтронов, 13 протонов и 10 электронов. Эта система частиц является
Ответ:
а) ионом алюминия 1327Al
б) нейтральным атомом кремния 1427Si
в) ионом кремния 1427Si
г) нейтральным атомом алюминия 1327Al
Алгоритм решения
- Определить, перед нами ион или нейтральный атом.
- Установить зарядовое число.
- Установить массовое число.

- Выбрать подходящий ответ.
Решение
Согласно условию задачи, в связанной системе элементарных частиц содержится 14 нейтронов, 13 протонов и 10 электронов. В нейтральном атоме количество электронов равно количеству протонов. В нашем случае электронов на 3 меньше. Значит, перед нами ион.
Зарядовое число соответствует количеству протонов. Их 13.
Массовое число равно сумме количества протонов и электронов: 14 + 13 = 27.
Выходит, перед нами ион алюминия.
Ответ: аpазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18942На рисунке представлен фрагмент Периодической системы элементов Д.И. Менделеева. Под названием каждого элемента приведены массовые числа его основных стабильных изотопов. При этом нижний индекс около массового числа указывает (в процентах) распространённость изотопа в природе.
Укажите число протонов и число нейтронов в ядре наименее распространённого из указанных стабильных изотопов меди.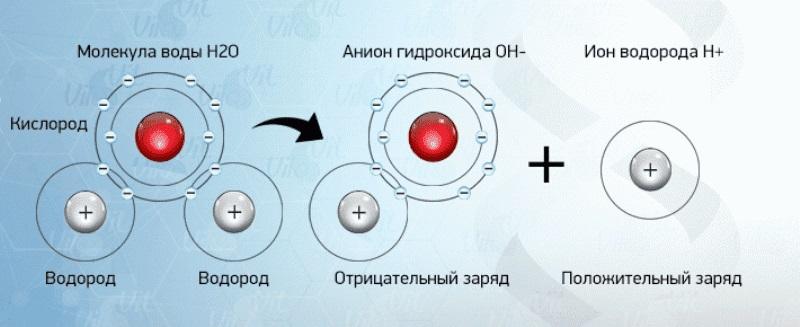
Алгоритм решения
- Найти наименее распространенный изотоп меди.
- Выписать для него массовые и зарядовые числа.
- Найти число протонов и нейтронов.
Решения
Наименее распространен изотоп меди Cu-65, поскольку возле его массового числа стоит меньший индекс — 31.
Массовое число этого изотопа — 65. Зарядовое число соответствует порядковому номеру — 29.
Количество протонов соответствует зарядовому числу. Их 29.
Количество нейтронов есть разность массового и зарядовых чисел: 65 – 29 = 36.
Эти числа запишем последовательно: 2936.
Ответ: 2936pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF17710 Каково массовое число ядра Х в реакции 95241 Am + 24 He→ X + 2 01 n?Алгоритм решения
- Записать правило сохранения нуклонов до и после реакции.

- Составить уравнение и вычислить искомое массовое число.
Решение
Количество нуклонов до и после реакции постоянно. Поэтому сумма массовых чисел до реакции и после нее не изменится. Составим уравнение, используя только массовые числа ядер и частиц:
241 + 4 = A + 2
A = 243
Ответ: 243pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18442Определите массовое и зарядовое число частицы, которая вызывает ядерную реакцию37 Li + … → 48 Вe + 01 n?
Алгоритм решения
- Записать правило сохранения нуклонов до и после реакции.
- Составить уравнение и вычислить искомое массовое число.
- Составить уравнение и вычислить искомое зарядовое число.
Решение
Количество нуклонов до и после реакции постоянно. Поэтому сумма массовых чисел до реакции и после нее не изменится. Составим уравнение, используя только массовые числа ядер и частиц:
Поэтому сумма массовых чисел до реакции и после нее не изменится. Составим уравнение, используя только массовые числа ядер и частиц:
7 + А = 8 + 1
A = 2
Составим уравнение, используя только массовые числа ядер и частиц:
3 + Z = 4 + 0
Z = 1
Ответ: 21pазбирался: Алиса Никитина | обсудить разбор | оценить
Задание EF18660Закону сохранения электрического заряда не противоречит реакция:
Алгоритм решения
- Записать правило сохранения нуклонов до и после реакции.
- Проверить, где выполняется это правило.
Решение
Количество нуклонов до и после реакции постоянно. Поэтому сумма массовых и зарядовых чисел до реакции и после нее не изменится. Проверим правильность реакций.
Реакция «а»:
7 + 1 = 8
4 + 0 < 5
Реакция «б»:
13 = 1 + 12
8 = 1 + 7
Реакция «в»:
7 + 1 > 6
3 + 0 > 2
Реакция «г»:
12 > 7 + 4
7 > 4 + 2
Подходит только реакция «б».
pазбирался: Алиса Никитина | обсудить разбор | оценить
👀 7.1k |
Сколько протонов, нейтронов и электронов содержится в ионе лития (Li+)?
Обогатите свои знания с помощью наших информативных блогов
- Забронировать демонстрационный класс
Атомный номер лития в периодической таблице равен 3.
Атомный номер в основном представляет собой общее количество протонов в атоме.
Таким образом, общее число протонов в литии равно 3.
При определении атомной массы элемента обычно используется число нейтронов и протонов элемента.
Как указано в периодической таблице, атомная масса лития равна 7.
Следовательно, число протонов в литии = 3
Атомная масса лития = 7
Атомная масса элемента = число протонов + Количество нейтронов
Количество нейтронов = Атомная масса элемента – Количество протонов элемента
Количество нейтронов = 7 – 3
Это означает, что количество нейтронов = 4
Забронируйте 60-минутный бесплатный пробный урок СЕЙЧАС!
Теперь, что касается числа электронов лития, поскольку атом имеет нейтральный заряд, число положительно заряженных протонов равно числу отрицательно заряженных электронов.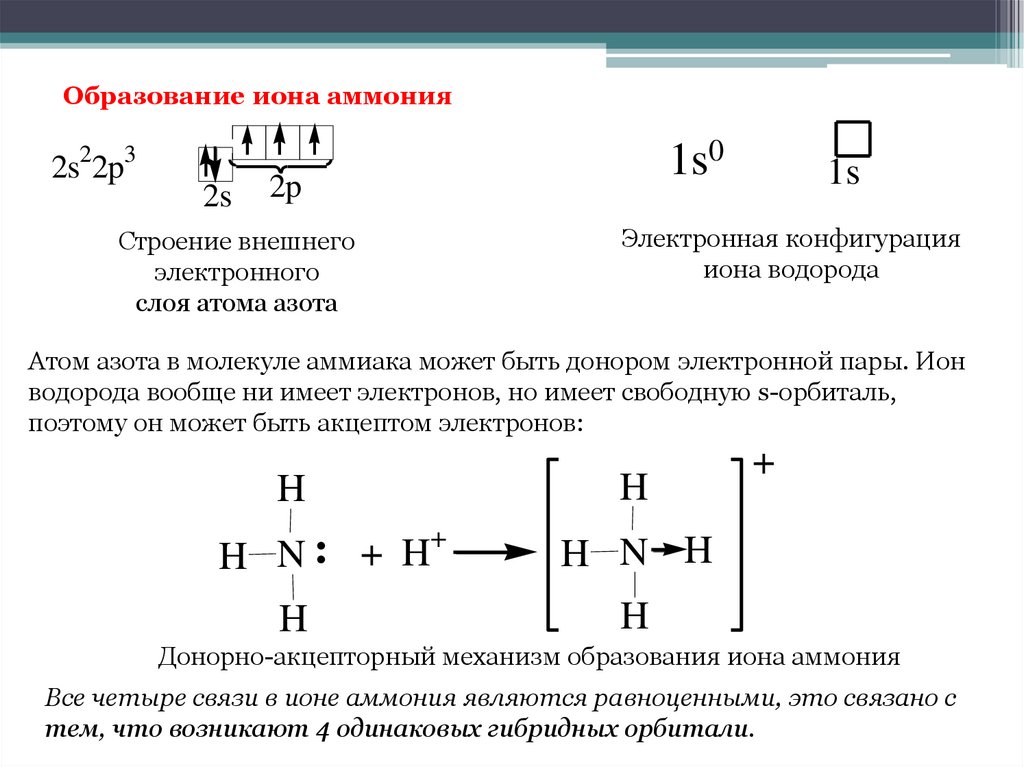
Следовательно, электронов в ионе лития должно быть 3, но литий как металл отдает электрон.
Таким образом, чтобы иметь заряд +1, литий должен потерять ион.
Следовательно, количество электронов в литии равно 2.
Итог!
Мы можем заключить, что литий-ион имеет
Атомный номер = 3
Атомная масса = 7
Количество протонов = 3
Количество нейтронов = 4
Количество электронов = 1
3
2 Вопросы по химии Подробнее – Полезные ссылки для развития вашего ребенка
Узнайте точную логику реакций!
Получите более глубокое понимание всех возможных взаимодействий между атомами, молекулами и элементами простым и веселым способом.
Забронировать демо-класс
В чем разница между дыханием и дыханием?
В чем разница между эндокринной и экзокринной железой?
Забронируйте 60-минутный БЕСПЛАТНЫЙ урок сегодня! Зарегистрируйтесь сейчас
Откройте для себя новый способ обучения с TEL Gurus. 93% детей уже продемонстрировали невероятный прогресс в учебе и чувствуют себя более уверенно благодаря веселым и интерактивным онлайн-классам TEL Gurus.
93% детей уже продемонстрировали невероятный прогресс в учебе и чувствуют себя более уверенно благодаря веселым и интерактивным онлайн-классам TEL Gurus.
Забронировать демо-класс
Мир атомов. Ионы.
Мир атомов. Ионы.
1. Inside atoms and elements page 5
Ions If an atom gains or loses an electron, it bacomes an ion. Атом, который получает отрицательный электрон, становится отрицательным ионом. Если он теряет электрон, то становится положительным ионом.
Атом, который получает отрицательный электрон, становится отрицательным ионом. Если он теряет электрон, то становится положительным ионом.
Picture 1.8 Some atoms lose electrons and become positive ions. Другие получают электроны и становятся отрицательными ионами.
. 0122
0122 Атом лития имеет 3 протона и 3 электрона. Он может потерять один из своих электронов, превратившись в ион. Теперь у него больше положительных протонов, чем электронов, поэтому он имеет общий положительный заряд. Следовательно, это положительный ион . Атом фтора имеет тенденцию приобретать, а не терять электрон. Приобретая отрицательный электрон, он имеет общий отрицательный заряд. Он стал отрицательным ионом .
Склеивание Теперь положительный литий-ион и отрицательный фторид-ион будут притягиваться друг к другу. Они могут соединяться вместе или связывать с образованием фторида лития.
Примечание.
В чем разница между дыханием и дыханием?
В чем разница между эндокринной и экзокринной железой?
 93% детей уже продемонстрировали невероятный прогресс в учебе и чувствуют себя более уверенно благодаря веселым и интерактивным онлайн-классам TEL Gurus.
93% детей уже продемонстрировали невероятный прогресс в учебе и чувствуют себя более уверенно благодаря веселым и интерактивным онлайн-классам TEL Gurus.
| |||||
| Ions | ||
If an atom gains or loses an electron, it bacomes an ion. Атом, который получает отрицательный электрон, становится отрицательным ионом. Если он теряет электрон, то становится положительным ионом. Атом, который получает отрицательный электрон, становится отрицательным ионом. Если он теряет электрон, то становится положительным ионом. | ||
| ||
. 0122 0122 | Атом лития имеет 3 протона и 3 электрона. Он может потерять один из своих электронов, превратившись в ион. Теперь у него больше положительных протонов, чем электронов, поэтому он имеет общий положительный заряд. Следовательно, это положительный ион . Атом фтора имеет тенденцию приобретать, а не терять электрон. Приобретая отрицательный электрон, он имеет общий отрицательный заряд. Он стал отрицательным ионом . | |||
| Склеивание | ||
| Теперь положительный литий-ион и отрицательный фторид-ион будут притягиваться друг к другу. Они могут соединяться вместе или связывать с образованием фторида лития. | ||
|


 Цинк
Цинк Гадолиний
Гадолиний Берклий
Берклий ru/litiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
ru/litiy-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/