2. Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
ЛЕКЦИИ ПО ХИМИИ
Лекция 1. Основные понятия и законы химии
План
1. Предмет химии. Роль химии в развитии промышленности.
2. Основные понятия химии.
3. Основные законы химии.
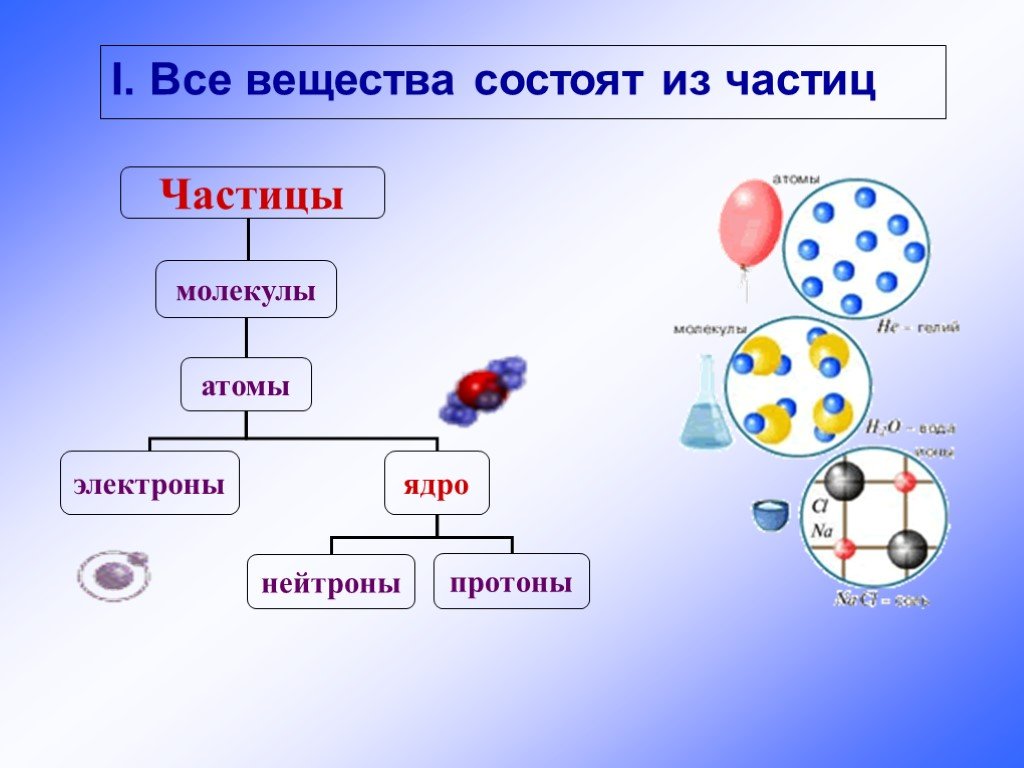
1. Химия – это наука о веществах, их строении, свойствах и превращении друг в друга. Химия относится к естественнонаучным дисциплинам и тесно связана с физикой, биологией, медициной и техникой.
В настоящее время химия подразделяется на ряд самостоятельных разделов – общую химию, неорганическую химия, органическую химию, аналитическую химию, физическую и коллоидную химию, биологическую химию.
Химия находит
широкое применение в различных отраслях
промышленности и сельском хозяйстве.
Вместе с тем, химия вносит большой вклад в дело защиты окружающей среды. Разрабатываются безотходные технологические процессы, создаются новые методы контроля за состоянием атмосферного воздуха, сточных вод и почвенного покрова.
Молекула – это наименьшая частица вещества, обладающая его химическими свойствами.
Относительная молекулярная масса – это масса молекулы, выраженная в атомных единицах массы.
Ион – электрически заряженная частица,
которая образуется при отдаче или
присоединении электронов атомами или
молекулами.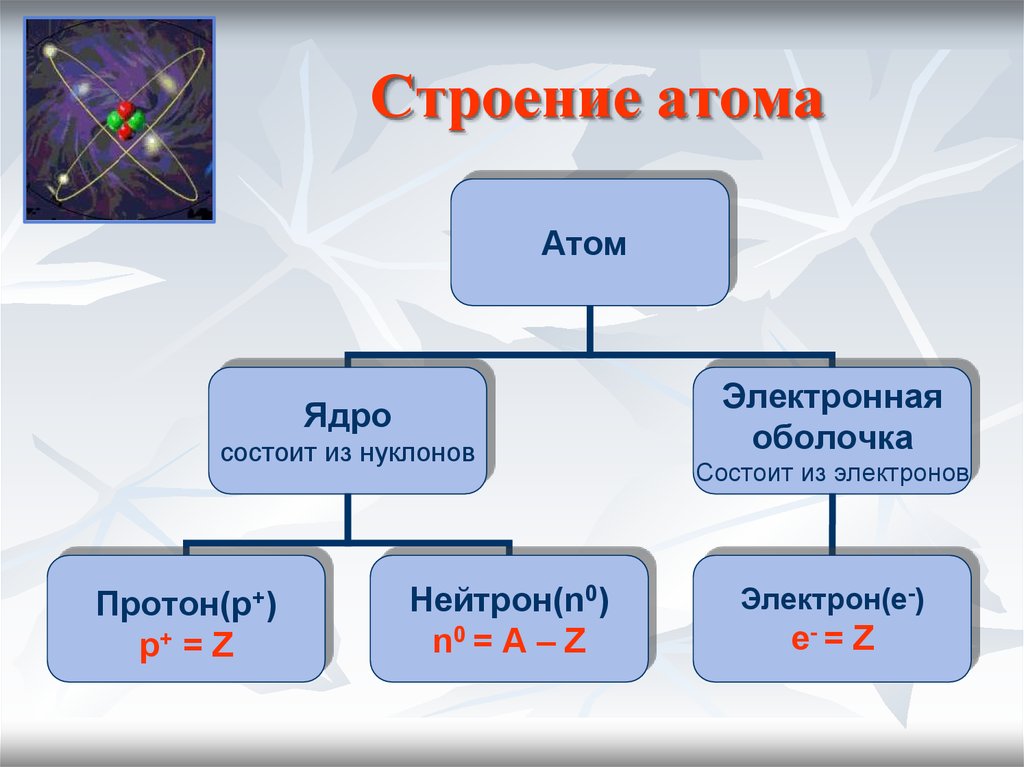
Вещество – любая совокупность атомов или молекул.
Аллотропия – существование химического элемента в форме нескольких простых веществ.
Валентность – способность атомов образовывать химические связи.
Химическая формула отражает состав или строение химического соединения или простого вещества.
Химическая реакция – это превращение веществ, сопровождающееся изменением их состава и (или) строения.
Химическое уравнение – запись химической реакции с помощью формул реагентов и продуктов реакции с указанием их относительных количеств.
3. Закон сохранения массы веществ (м.В. Ломоносов, 1748 г.).
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
Например: К2S + CuCI2 = CuS + 2KCI
Закон
эквивалентов (В. Рихтер, 1793 г.)
Рихтер, 1793 г.)
Вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам.
Закон постоянства состава (Ж.Л. Пруст, 1801).
Каждое чистое химическое соединение независимо от способа его получения всегда имеет один и тот же состав (например, О2 , СО2).
Закон кратных отношений (Дж. Дальтон, 1803 г.).
Если два элемента
образуют между собой несколько различных
соединений, то на одну и ту же массу
одного из них приходятся такие же массы
другого, которые относятся друг к другу
как простые целые числа (например,
массовые соотношения С:О в оксидах СО
Закон объемных отношений (Ж. Гей-Люссак, 1805 г.)
При одинаковых
условиях объемы вступающих в реакцию
газов, относятся друг к другу и к объемам
образовавшихся газообразных продуктов
реакции как небольшие целые числа. Эти
числа совпадают с коэффициентами в
уравнениях химических реакций (например,
2Н2
Эти
числа совпадают с коэффициентами в
уравнениях химических реакций (например,
2Н2
Закон Авогадро (А. Авогадро, 1811).
В равных объемах различных газов при одинаковых условиях (температуре, давлении) содержится одинаковое число молекул (например, в 1 л Н2 и в 1 л О2 содержится одинаковое число молекул – 6,02 · 1023 молекул).
Следствия из закона Авогадро:
1-е следствие – один моль любого газа при одинаковых условиях занимает один и тот же объем. Молярный объем любого газа при н.у. равен 22,4 л/моль.
2-е следствие используется для расчета относительных плотностей газов. Плотность вещества – это отношение массы этого вещества к его объему.
Плотность газов определяют по отношению к водороду и по отношению к воздуху.
Лекция 2. Строение атома
План
1. Модели строения
атома.
Модели строения
атома.
2. Атомная орбиталь.
3. Квантовые числа.
4. Распределение электронов в многоэлектронных атомах.
5. Ядро атома.
1. Гипотеза Дж. Томсона. Одна из первых моделей строения атома была предложена Дж. Томсоном в 1913 г. Атом представлялся как “сфера положительного электричества” одинаковой плотности по всему объему диаметром 0,1 нм. Электроны как бы плавают в этой сфере, нейтрализуя положительный заряд.
Планетарная модель Э. Резерфорда. Для проверки гипотезы Дж. Томсона, Э. Резерфорд провел серию опытов по рассеиванию α-частиц (ядра атома гелия). Суть планетарной модели Э. Резерфорда (1911) можно свести к следующим положениям:
1. в центре атома находится положительно заряженное ядро;
2. весь положительный заряд и почти вся масса атома сосредоточена в ядре;
3.
Строение атома по Н. Бору. В 1913 году Н. Бор основываясь на планетарной модели строения атома Э. Резерфорда и теории М. Планка предложил свою гипотезу строения атома, которую сформулировал в виде постулатов:
1. электрон может вращаться вокруг ядра не по произвольным, а по строго определенным (стационарным) круговым орбитам;
2. двигаясь по стационарной орбите электрон не излучает и не поглощает энергии;
3. излучение происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую.
Квантово-механическая модель строения атома.
2. Вероятность нахождения электрона в определенной области пространства вокруг ядра описывается волновой функцией (пси). В соответствии с определением орбиталью называется область околоядерного пространства, в котором наиболее вероятно нахождение электрона. Так как электрон несет отрицательный заряд, то его орбиталь представляет собой распределение заряда, которое получило название
3. Вся совокупность движений электрона в атоме описывается квантовыми числами: главным, орбитальным, магнитным и спиновым. Главное квантовое число (n) определяет общую энергию и размеры электронных орбиталей. Оно может принимать любые целые значения, начиная с единицы (n = 1, 2, 3… ). Орбитальное квантовое число
 Оно может принимать целые
значения от 0 до n-
1. Орбитали с l
= 0 называют s-орбитали,
l
= 1- р-орбитали, l
= 2 –d-орбитали,
l
= 3 – f-
орбитали. Магнитное
квантовое число (ml)
характеризует ориентацию орбитали в
пространстве. Оно может принимать целые
значения от – l
до + l,
включая 0. Спиновое квантовое число (ms)
характеризует собственный момент
импульса электрона, которому характерно
вращение вокруг собственной оси. Каждый
электрон может совершать такое вращение
в одном из двух противоположных
направлениях. Поэтому m
Оно может принимать целые
значения от 0 до n-
1. Орбитали с l
= 0 называют s-орбитали,
l
= 1- р-орбитали, l
= 2 –d-орбитали,
l
= 3 – f-
орбитали. Магнитное
квантовое число (ml)
характеризует ориентацию орбитали в
пространстве. Оно может принимать целые
значения от – l
до + l,
включая 0. Спиновое квантовое число (ms)
характеризует собственный момент
импульса электрона, которому характерно
вращение вокруг собственной оси. Каждый
электрон может совершать такое вращение
в одном из двух противоположных
направлениях. Поэтому m4. Распределение электронов в многоэлектронных атомах основано на следующих основных положениях: принципе минимума энергии, правиле В. Клечковского, принципе В. Паули и правиле Ф. Хунда.
Принцип
минимума энергии. Согласно этому принципу электроны в
основном состоянии заполняют орбитали
в порядке повышения уровня энергии
орбиталей. Первыми заполняются орбитали
с минимальными уровнями энергии.
Первыми заполняются орбитали
с минимальными уровнями энергии.
Правило В. Клечковского. Электрон обладает наинизшей энергией на той электронной подоболочке, где сумма квантовых числе n и l минимальна. Если сумма n + l одинакова для рассматриваемых электронных подоболочек, то используют второе правило В. Клечковского. Электрон обладает наинизшей энергией на подоболочке с наименьшим значением главного квантового числа.
Принцип В. Паули. Состоит в том, что в атоме не может быть двух электронов у которых все четыре квантовые числа были одинаковы. Отсюда следует, что на каждой орбитали может быть не более двух электронов, причем они должны иметь противоположные (антипараллельные) спины.
Правило Ф. Хунда. В наиболее устойчивом состоянии атома электроны размещаются в пределах элуктронной подоболочки так, чтобы их суммарный спин был максимален.
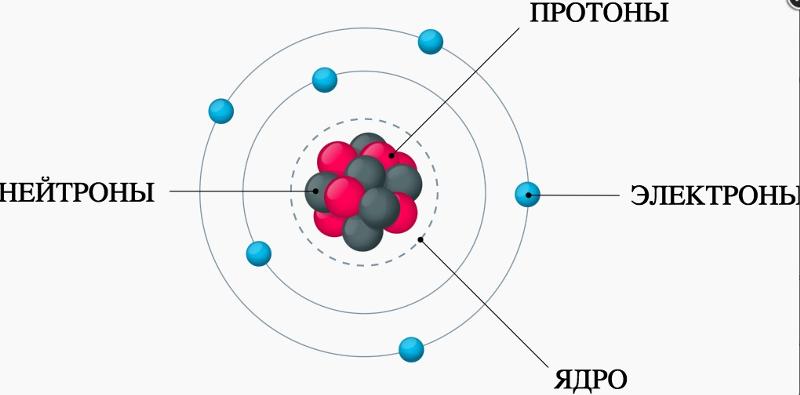
5. Ядро
атома – это положительно-заряженная
часть атома, в которой сосредоточена
почти вся масса атома.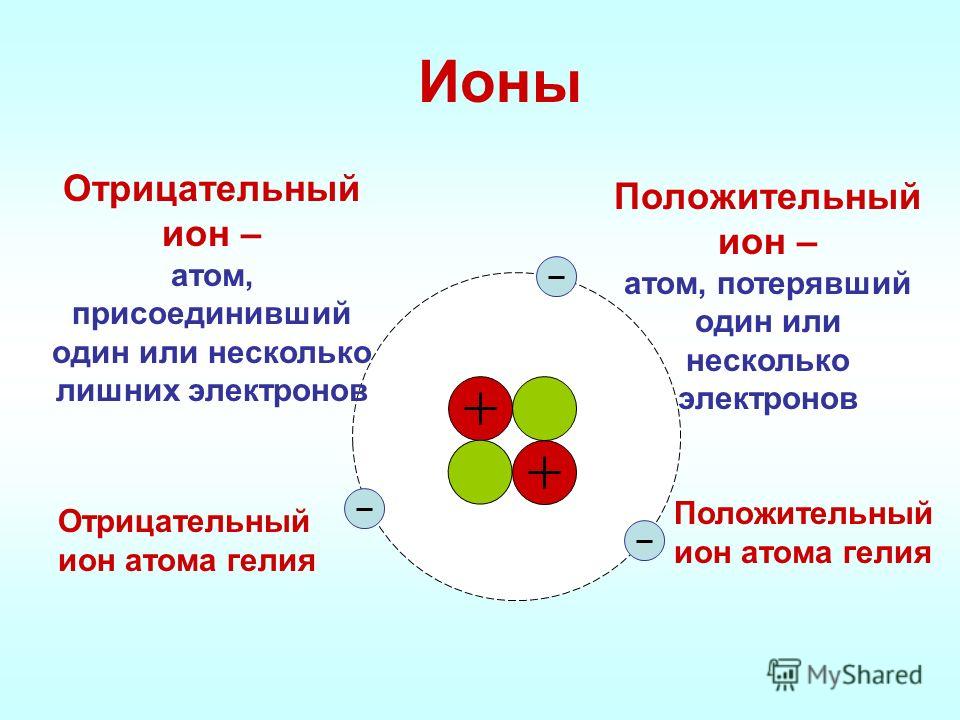 Радиус ядра
составляет 10-13 см. Ядро состоит из элементарных частиц
двух типов – протонов и нейтронов. Общее
их понятие – нуклоны. Сумма числа
протонов и числа нейтронов, содержащихся
в ядре атома называется массовым числом
атома (А). Заряд ядра равен порядковому
номеру химического элемента и числу
протонов. Разновидности атомов с
одинаковым зарядом ядра, но с разными
массовыми числами называют изотопами (например, кислород имеет три изотопа).
Радиус ядра
составляет 10-13 см. Ядро состоит из элементарных частиц
двух типов – протонов и нейтронов. Общее
их понятие – нуклоны. Сумма числа
протонов и числа нейтронов, содержащихся
в ядре атома называется массовым числом
атома (А). Заряд ядра равен порядковому
номеру химического элемента и числу
протонов. Разновидности атомов с
одинаковым зарядом ядра, но с разными
массовыми числами называют изотопами (например, кислород имеет три изотопа).
«Что такое атом?» — Яндекс Кью
Elena Kozicheva · ·
1,4 K
На Кью задали 1 похожий вопросВиктория Преподобная
диванный эксперт . меньше слов, больше информации · 28 июн 2017
Не знаю кто или что ответит на этот вопрос лучше Вики
Частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.

Атом состоит из атомного ядра и электронов. Если число электронов совпадает с числом протонов в ядре, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. В некоторых случаях под атомами понимают только электронейтральные системы, в которых заряд ядра равен суммарному заряду электронов, тем самым противопоставляя их электрически заряженным ионам.
Ядро, несущее почти всю (более чем 99,9 %) массу атома, состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Атомы классифицируются по количеству протонов и нейтронов в ядре: число протонов Z соответствует порядковому номеру атома в периодической системе Менделеева и определяет его принадлежность к некоторому химическому элементу, а число нейтронов N — определённому изотопу этого элемента. Единственный стабильный атом, не содержащий нейтронов в ядре — лёгкий водород (протий).Число Z также определяет суммарный положительный электрический заряд (Ze) атомного ядра и число электронов в нейтральном атоме, задающее его размер.
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
Нет оценок ·
265
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
Ответы на похожие вопросы
Что такое атом? — 5 ответов, заданУниверситет Детей
Университет детей рассказывает об окружающем мире… · 13 авг 2018 · udetey.ru
В ходе развития науки люди поняли, что все тела состоят из очень маленьких частиц. Вслед за древними греками их назвали атомами. И с помощью одной только этой идеи получилось объяснить много наблюдаемых явлений.
Но ещё больше получилось объяснить, когда оказалось, что атомы состоят из очень маленького ядра (оно в 100000 раз меньше самого атома) и совсем уж маленьких частиц — электронов. Мы точно не знаем их размер, но знаем, что они летают вокруг ядер и связывают их между собой в разнообразные тела, которые мы наблюдаем.
Чтобы объяснить, как ведут себя электроны, пришлось разрабатывать новые принципы устройства мироздания. Их назвали квантовыми принципами, и они в корне изменили представления людей об окружающем мире. Вполне возможно, это самые фундаментальные принципы нашей Вселенной.
Но люди на этом не остановились и узнали, что ядра атомов сами по себе состоят из еще меньших частиц, которые назвали протонами и нейтронами. Они отличаются тем, что протоны взаимодействуют электромагнитным образом в первом приближении, а нейтроны — нет. В остальном они очень сходны.
Но и это еще не все. Оказалось, что и протоны и нейтроны в свою очередь состоят из кварков — нового типа частиц, до этого неизвестного.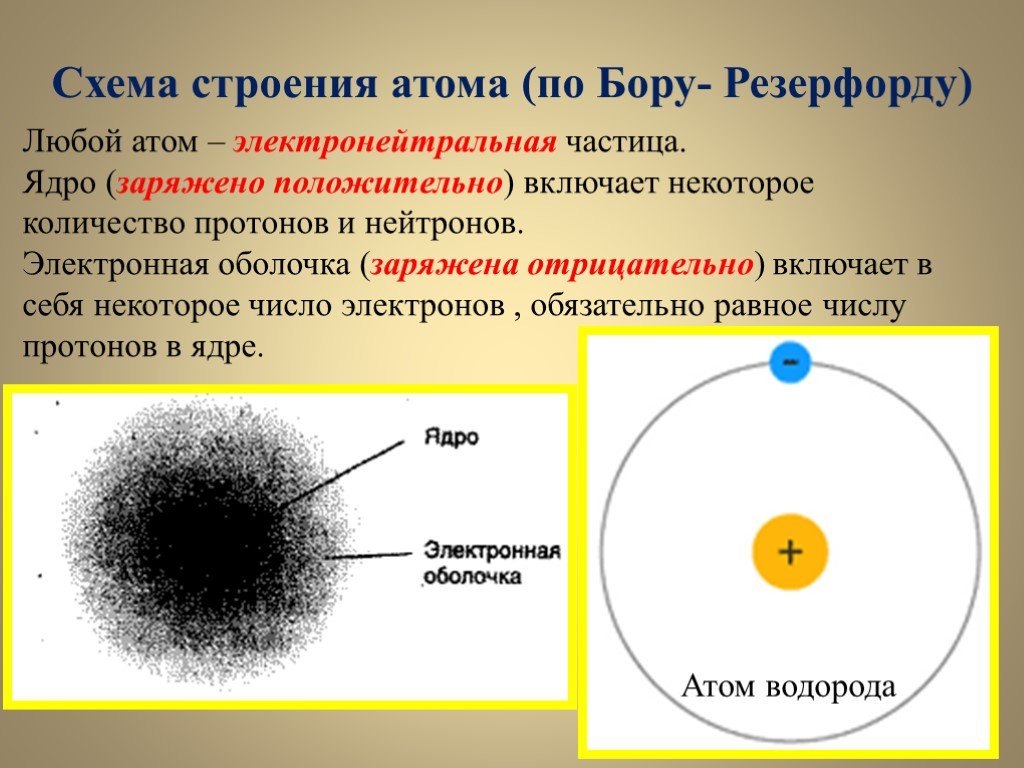 То, как кварки взаимодействуют между собой, образуя протоны и нейтроны (а вслед за ними и ядра атомов), до сих пор до конца не понято, хотя люди уже многого достигли, пытаясь разобраться в этом явлении. И по-видимому, кварки уже ни из чего не состоят.
То, как кварки взаимодействуют между собой, образуя протоны и нейтроны (а вслед за ними и ядра атомов), до сих пор до конца не понято, хотя люди уже многого достигли, пытаясь разобраться в этом явлении. И по-видимому, кварки уже ни из чего не состоят.
Понимание того, как атом устроен на самом фундаментальном уровне, потребовало от человечества создания квантовой теории поля. Это теория, которая является синтезом самых фундаментальных знаний о мире — квантовых принципов и принципа относительности, открытого Эйнштейном в 1905 году. Эта математическая конструкция оказалась настолько богата, что ее изучение продолжается и по сей день уже более полувека. И многое еще предстоит открыть.
·
8,0 K
Комментировать ответ…Комментировать…
Что такое атом? — 5 ответов, заданОлеся Н.
Мне интересны множество тем: от психологии до.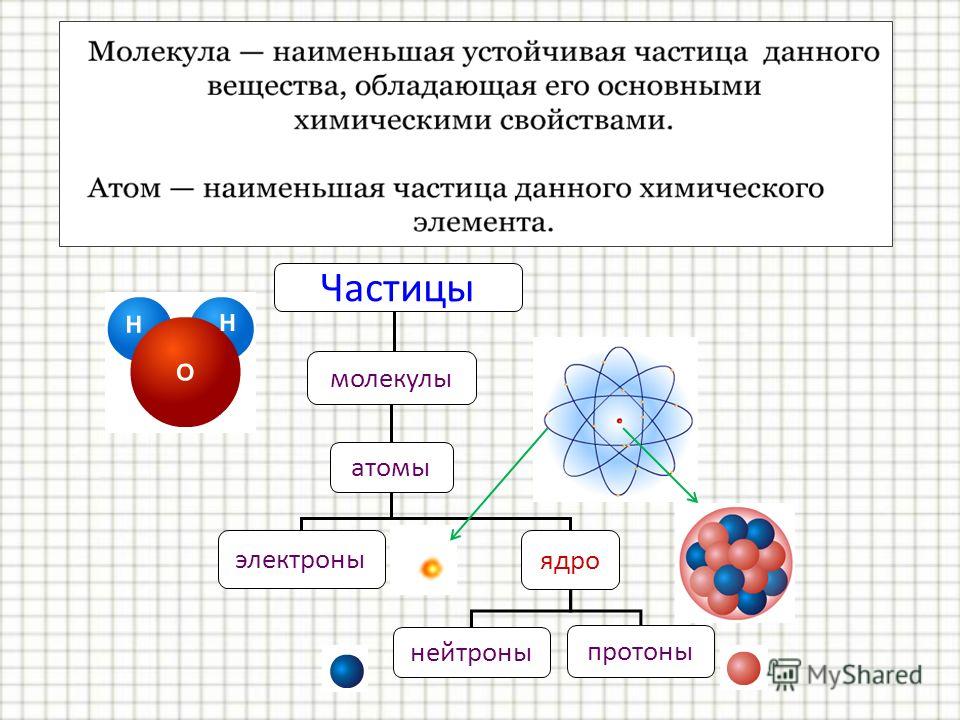 .. · 18 нояб 2018
.. · 18 нояб 2018
Слово атом происходит от греческого atomos- неделимый. Атомом называется мельчайшая частица вещества, которая сохраняет все его химические свойства.
Атом состоит из ядра, содержащего протоны (положительно заряженные частицы) и нейтроны (нейтральные частицы) и электронной оболочки (из отрицательно заряженных электронов).
12 оценили·
5,0 K
Комментировать ответ…Комментировать…
Что такое атом? — 5 ответов, заданОльга Борисова
Контент-редактор kontur.ru/partnership/online?p=f0… · 6 окт 2020
Добрый день. Атом — это мельчайшая частица вещества микроскопических размеров, наименьшая часть химического элемента, которая носит его свойства. Составляющие атома — протоны, нейтроны, электроны — этих свойств уже не имеют и образуют их в совокупности. Ковалентные атомы образуют молекулы.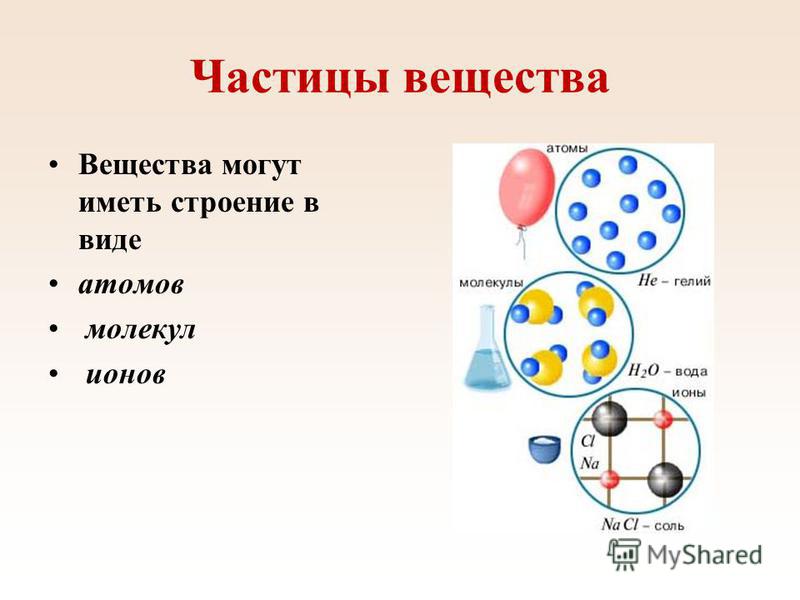
·
2,0 K
Комментировать ответ…Комментировать…
Исследования опровергают общепринятое представление об электрических свойствах нейтрона
Архив
17 сентября 2007 г.
Для двух поколений физиков было стандартным убеждение, что нейтрон, электрически нейтральная элементарная частица и первичный компонент атома, на самом деле несет положительный заряд в своем центре и компенсирующий отрицательный заряд. заряд на его внешнем краю.
Идея была впервые выдвинута в 1947 году Энрико Ферми, лауреатом Нобелевской премии, известным своей ролью в разработке первого ядерного реактора. Но новое исследование, проведенное физиком из Вашингтонского университета, показывает, что заряд нейтрона не так прост, как считал Ферми.
Используя точные данные, недавно собранные в трех разных лабораториях, и некоторые новые теоретические инструменты, Джеральд А. Миллер, профессор физики Университета Вашингтона, обнаружил, что нейтрон имеет отрицательный заряд как во внутреннем ядре, так и на внешнем краю, с положительным зарядом. заряд, зажатый между ними, чтобы сделать частицу электрически нейтральной.
Миллер, профессор физики Университета Вашингтона, обнаружил, что нейтрон имеет отрицательный заряд как во внутреннем ядре, так и на внешнем краю, с положительным зарядом. заряд, зажатый между ними, чтобы сделать частицу электрически нейтральной.
«Никто не понял, что это так, — сказал Миллер. «Это важно, потому что это явный факт природы, о котором мы раньше не знали. Теперь мы это знаем».
Открытие меняет научное понимание того, как нейтроны взаимодействуют с отрицательно заряженными электронами и положительно заряженными протонами. В частности, это имеет значение для понимания сильного взаимодействия, одного из четырех фундаментальных сил природы (другими являются слабое взаимодействие, электромагнетизм и гравитация).
Сильное взаимодействие связывает атомные ядра вместе, что позволяет атомам, строительным блокам всей материи, собираться в молекулы.
«Мы должны точно понять, как работает сильное взаимодействие, потому что это самое сильное взаимодействие, которое мы знаем во Вселенной», — сказал Миллер.
Выводы основаны на данных, собранных в Национальном ускорительном комплексе имени Томаса Джефферсона в Ньюпорт-Ньюс, штат Вирджиния, на линейном ускорителе Бейтса в Массачусетском технологическом институте и на Майнцском микротроне в Университете Иоганна Гутенберга в Германии.
Три лаборатории изучают различные аспекты свойств и поведения субатомных частиц, а Миллер изучает собранные ими данные о нейтронах. Его анализ был опубликован в Интернете 13 сентября в журнале Physical Review Letters. Работа частично финансировалась Министерством энергетики США.
Поскольку анализ основан на данных, полученных в результате прямых наблюдений, картина может еще больше измениться по мере сбора дополнительных данных, сказал Миллер.
«Частица может быть электрически нейтральной и при этом иметь свойства, связанные с зарядом. Мы давно знали, что нейтрон обладает этими свойствами, но теперь мы понимаем их более четко», — сказал он.
Он отметил, что самый важный аспект открытия подтверждает, что нейтрон несет отрицательный заряд на своем внешнем краю, что является ключевой частью первоначальной идеи Ферми.
Сильное взаимодействие, связывающее атомные ядра, связано с ядерной энергией и ядерным оружием, поэтому возможно, что исследования могут найти практическое применение в этих областях.
Это также может способствовать лучшему пониманию взаимодействий, происходящих в ядерной печи нашего Солнца, и более глубокому пониманию сильного взаимодействия в целом, сказал Миллер.
«Мы уже знаем, что без сильного взаимодействия у вас не было бы атомов — или всего, что следует из атомов», — сказал он.
###
За дополнительной информацией обращайтесь к Миллеру по телефону (206) 543-2995 или по электронной почте [email protected]
Немного истории нейтрино
Авторское право © Майкл Ричмонд. Эта работа находится под лицензией Creative Commons License. Давным-давно, на рубеже двадцатого века,
физики начали вглядываться в субатомные
область.
Их инструменты, наконец, становились все более изощренными.
достаточно, чтобы разбить на атомы и обнаружить отдельные
частицы.
Чтобы сильно упростить, ученые определили, что атомы были сделаны из более мелких частиц. Самые ранние идеи заключались в том, что эти частицы в двух разновидностях:
- положительно заряженные частицы (которые мы теперь называем протонами )
- отрицательно заряженных частицы (которые мы теперь называем электронами )
Они быстро поняли, что электроны менее массивны и менее массивны. легче манипулировать, чем протонами, так как положительные заряды были сгруппированы рядом с центром атомов в плотном шарике мы называем ядром.
Было обнаружено, что некоторые атомы самопроизвольно распадаются на новые формы — процесс под названием , радиоактивность . Один из видов радиоактивности, известный как бета-распад, участие в создании протона и электрона вместе, после чего электрон отлетел от атома с большой энергией и импульс. Например,
В исходном атоме было 6 протонов и 6 электронов, а
был электрически нейтрален. Дочерний атом имел 7 протонов и (кратко) 7 электронов,
и поэтому также был электрически нейтрален.
это сохранение электрического заряда был одним из наиболее тщательно проверенных и испытанных
принципы химии и физики, поэтому
облегчение видеть, что странный новый процесс
радиоактивность подчинялась правилу.
Дочерний атом имел 7 протонов и (кратко) 7 электронов,
и поэтому также был электрически нейтрален.
это сохранение электрического заряда был одним из наиболее тщательно проверенных и испытанных
принципы химии и физики, поэтому
облегчение видеть, что странный новый процесс
радиоактивность подчинялась правилу.
Однако… были и другие свойства, которые казались НЕ должны быть сохранены этим процессом. Например, электрон оторвался от атома. с высокой скоростью, забирая с собой энергию и импульс. Атом немного отпрянул, но тщательные измерения показали, что общая энергия (дочернего атома плюс электрон) была не такой большой, как энергия исходного атома; более того, импульс (дочерний атом-плюс-электрон) также не был равен к импульсу исходного атома. Оказалось, что бета-распад нарушается сохранение энергии и сохранение импульса . Это было плохо.
В 1930 году Вольфганг Паули предположил, что, возможно,
третья частица участвовала в бета-распаде.
Предположим, сказал он, что когда протон и электрон
создаются внутри атома, НЕЙТРАЛЬНОЙ частицы
также создается. Эта нейтральная частица унесла бы некоторое
небольшое количество энергии и импульса,
достаточно, чтобы привести окончательные значения
в балансе с исходными.
Эта нейтральная частица унесла бы некоторое
небольшое количество энергии и импульса,
достаточно, чтобы привести окончательные значения
в балансе с исходными.
В 1932 была обнаружена нейтральная частица, и получил название нейтрон . Увы, нужных свойств у него не было исправить проблемы с бета-распадом. Крысы.
Когда физики поняли, что нейтрон не может объяснить недостающую энергию и импульс, они постулировали, что другая нейтральная частица также должны существовать. Поскольку эта частица, казалось, имела небольшую массу, ему дали название нейтрино , итальянское уменьшительное, означающее «милая маленькая нейтральная частица». (Ну, может быть, без «милого»).
После многих лет поисков нейтрино
был окончательно обнаружен в 1956 г.
командой под руководством Клайда Коуэна и Фредерика Рейнса.
За этот потрясающий экспериментальный подвиг
Рейнесу была присуждена доля Нобелевской премии по физике.
в 1995 году;
Коуэн, к сожалению, умер в 1974 году и, таким образом,
не имеет права на получение своей доли Премии.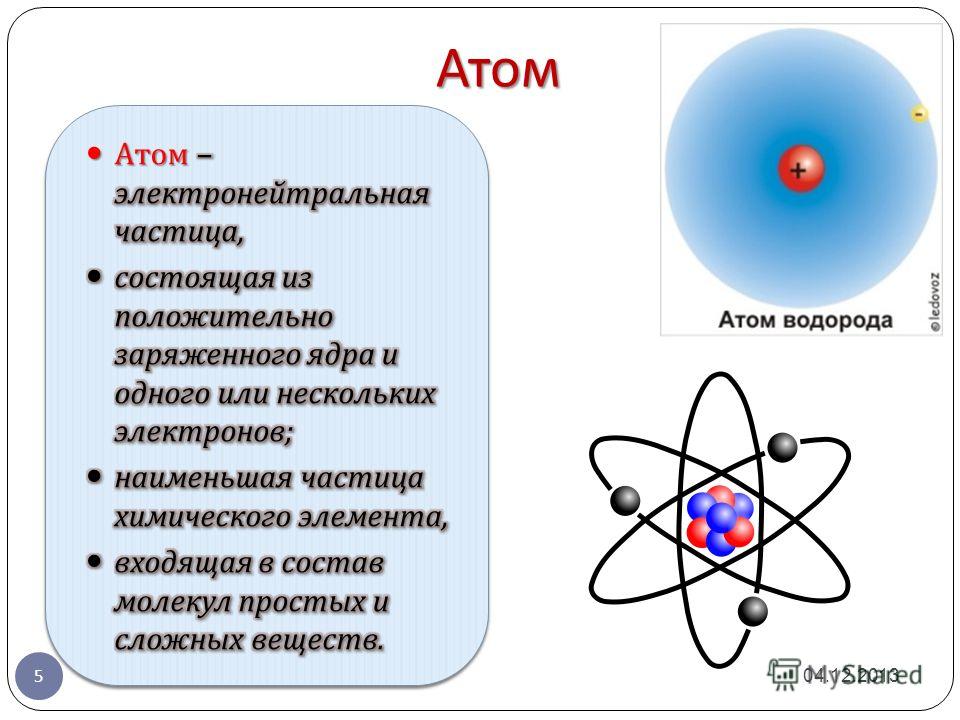
Почему нейтрино так трудно найти?
Почему ученым потребовалось так много времени, чтобы обнаружить эта частица? Одной из причин является отсутствие заряда: частицы с электрическим зарядом действуют с большими силами на другие частицы, и поэтому их легко заметить. Но оказалось, что нейтрино очень странная частица: он очень, очень, ОЧЕНЬ слабо взаимодействовал с материей, гораздо слабее, чем любая другая частица.
Как слабо? Что ж, давайте сравним его с другими товарами, произведенными процессами радиоактивного распада. Частицы, которые сильно взаимодействуют, будут сталкиваться атомы очень скоро после попадания в кусок материи, а те, которые взаимодействуют слабо, пройдут некоторое расстояние до столкновения с атомом.
| Имя | также известный как | можно остановить с помощью |
| альфа-луч | ядро гелия | лист бумаги, слой кожи |
| бета-луч | электрон | несколько листов алюминиевой фольги |
| гамма-излучение | фотон высокой энергии | свинцовые кирпичи |
Эти свойства показывают, что альфа-частицы сильно взаимодействуют с
вещество, тогда как гамма-лучи взаимодействуют относительно слабо.


 Число Z также определяет суммарный положительный электрический заряд (Ze) атомного ядра и число электронов в нейтральном атоме, задающее его размер.
Число Z также определяет суммарный положительный электрический заряд (Ze) атомного ядра и число электронов в нейтральном атоме, задающее его размер.